中国科学院微生物研究所,中国微生物学会,中国菌物学会
文章信息
- 汤芳, 陆承平. 2015
- Fang Tang, Chengping Lu. 2015
- 猪链球菌的烈性噬菌体和前噬菌体
- Lytic phages and prophages of Streptococcus suis-A review
- 微生物学报, 2015, 55(4): 389-394
- Acta Microbiologica Sinica, 2015, 55(4): 389-394
-
文章历史
- 收稿日期:2014-09-15
- 修回日期:2014-11-25
猪链球菌(Streptococcus suis,S.suis)是一种重要的人畜共患病病原,能引起猪的脑膜炎、败血症、心内膜炎、关节炎及肺炎,在人上主要引起脑膜炎和心内膜炎[1, 2],具有重要的公共卫生学意义。根据荚膜抗原的多样性,猪链球菌可分为33个血清型(1-31、33和1/2)[2, 3],其中2型在临床上分离最多、分布最广。噬菌体(Bacteriophage,phage)是感染细菌、支原体、螺旋体、放线菌及蓝细菌(蓝藻)的一类病毒,在自然界分布非常广,凡是有上述各类微生物的地方,都有相应种类的噬菌体存在[4]。根据噬菌体的生活周期不同,可将噬菌体分为烈性噬菌体(又称毒性噬菌体)和温和噬菌体(又称溶原性噬菌体)两大类。温和噬菌体可将自身的基因组整合到宿主的基因组中,并随宿主的基因组复制传代。这种带有噬菌体基因组的细菌称为溶原性细菌。而整合在宿主中的噬菌体称为前噬菌体。前噬菌体在细菌基因组中广泛分布,就目前已完成基因组测序的细菌中,大约65%的细菌基因组中都整合有前噬菌体,有些细菌携带前噬菌体序列将近整个细菌基因组容量的20%[5]。猪链球菌也携带有前噬菌体,但相关报道较少,全基因组测序的仅有1株烈性噬菌体和11株前噬菌体[6]。由于猪链球菌的噬菌体分离非常困难,目前为止,国内外仅有一个研究小组报道了一株猪链球菌的烈性噬菌体,其裂解谱较窄,仅能裂解少量猪链球菌2型菌株[7]。仅有5株猪链球菌的前噬菌体能从宿主菌中诱导出来,且均未发现它们对猪链球菌有裂解作用[6]。
1 猪链球菌的烈性噬菌体猪链球菌的烈性噬菌体分离率较低,据作者所知,国内外多家科研单位试图分离猪链球菌的烈性噬菌体,但均未果。迄今为止,仅有本课题组分离得一株猪链球菌的烈性噬菌体(命名为SMP)。
1.1 烈性噬菌体SMP的生物学特性噬菌体SMP为本实验室马玉玲2005年在上海健康巴马香猪的鼻拭子分离所得[7]。SMP为猪链球菌2型的烈性噬菌体,通过透射电镜观察,SMP头部呈正六边形,直径约50nm,尾部长约135nm,属于长尾噬菌体科(Siphoviridae family)(图1)。

|
| 图1. 猪链球菌噬菌体SMP透射电镜图(15000×) Figure 1. Transmission electron microscope photo of S. suis bacteriophage SMP (15000×). |
SMP的噬菌谱较窄,53株不同血清型的猪链球菌中,仅10株能被SMP裂解[8]。SMP已完成全基因组测序,其基因组为双股DNA,全长为36019bp,GC含量为41.6%,共编码48个基因[8]。
1.2 噬菌体SMP的裂解酶噬菌体的裂解酶和穿孔素在其感染过程中具有重要作用,受感染的细菌细胞晚期合成穿孔素(holin)和裂解酶(lysin)。穿孔素到达细胞膜形成一种同源低聚物损害膜或在细胞膜上形成“洞穴”,改变宿主菌细胞膜通透性,使裂解酶易于通过而攻击肽聚糖,干扰肽聚糖的合成,破坏胞壁质,裂解宿主细胞,结束感染周期[9]。
王琰等[10]将SMP的裂解酶LySMP进行了克隆和表达,发现裂解酶的噬菌谱较完整的噬菌体更广,几乎可以裂解所有的猪链球菌(除2型外,对猪链球菌7型和9型也有裂解作用)。史一博等[11]将SMP的穿孔素HolSMP在大肠杆菌内进行表达,发现它能提高细胞膜的渗透性,抑制细胞的生长速度,并且在裂解酶LySMP存在情况下具有显著的细胞裂解作用。他还将SMP的裂解酶LySMP和穿孔素HolSMP进行联合作用,发现两者联合作用后噬菌谱范围增加,不但可以裂解猪链球菌,还可裂解金黄色葡萄球菌和枯草芽胞杆菌[12]。孟祥朋等[13]发现大部分猪链球菌均具有不同程度形成生物被膜的能力,噬菌体SMP既不能有效杀灭被膜菌,也不能有效破坏生物被膜结构,但裂解酶LySMP可以在12h以内将SS2-4和SS2-H生物被膜菌几乎全部杀灭,并清除它们80%以上的生物被膜。由此看来,猪链球菌噬菌体的裂解酶较完整的噬菌体具有更好的抗菌效果,这可能与噬菌体的受体特异性相关,提示对噬菌体进行改造而提高其抗菌能力的可能。
1.3 末端酶大亚基的活性末端酶(terminase)是dsDNA病毒包装过程中的必要功能蛋白,其大亚基单位在包装过程中往往行使全酶的作用,一般具有ATP酶活性和限制性内切酶活性[14]。毛紫微[15]等将猪链球菌SMP末端酶大亚基单位基因(TlsSMP)在大肠杆菌中进行了表达,并对TlsSMP融合蛋白进行活性检测,发现末端酶大亚基单位在大肠杆菌中呈可溶性表达,具有ATP酶活性,在pH7、23℃和Mg2+存在的条件下,其活性最强,其他金属离子如Ca2+、Mn2+和Co2+都对其有不同程度的抑制作用。
2 猪链球菌的前噬菌体猪链球菌的前噬菌体有可诱导和不可诱导两种。
2.1 可诱导的前噬菌体Harel等[16]首次发现猪链球菌上存在前噬菌体,他们在猪链球菌2型菌株89-999上用丝裂霉素C诱导出前噬菌体,临床强毒株和弱毒株的差减杂交结果显示,许多强毒株特有的基因与前噬菌体的基因存在同源性,因此他们推测该前噬菌体与宿主细菌的毒力相关,但这株前噬菌体并没有进行全基因组测序。作者也试图在89-999上诱导该噬菌体,但没有成功,推测可能噬菌体的诱导受多种环境因素的影响,并非每次都能稳定的被诱导出来。
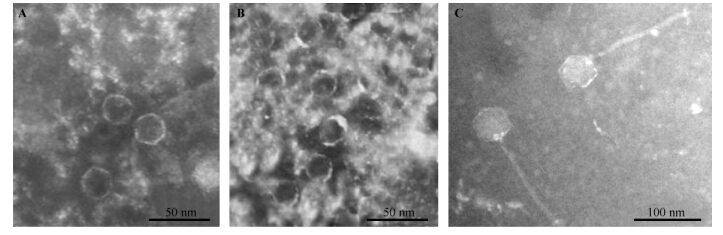
马玉玲[17]在猪链球菌2型致病株HA9801和ZY05719 中分别诱导出前噬菌体,命名为SS2-HA(图2-A)和SS2-ZY(图2-B),电镜观察,二者头部均呈正六边形,无尾部,其核酸类型为dsDNA,鉴定为复层噬菌体科(Tectiviridae)成员。作者对此观察结果存在疑义,由于此样本中杂质较多,电镜照片比较模糊,可能这两个噬菌体有长尾或短尾而未被观察到;而噬菌体负染样本的制备工序繁多,也有可能在这期间噬菌体的尾部被破坏,因此这两个噬菌体的形态还需制备更清晰的电镜照片才能确定。
作者在丹麦的猪链球菌9型菌株5218和中国的9型菌株NJ2中均诱导出前噬菌体,分别命名为phi5218和phiNJ2[18]。phiNJ2(图2-C)的透射电镜结果显示,其头部呈正六边形,有一个较长的尾部。经测量其头部的长度均为50nm,尾部长度约为180nm,此形态与烈性噬菌体SMP的形态相似。
2.2 不可诱导的前噬菌体Dan Claudio Palmieri[19]等在猪链球菌SsUD株上发现了一个不可诱导的前噬菌体样元件phiSsUD.1,它携带有四环素耐药基因,从而导致宿主细菌的耐药性,并且发现该耐药基因簇与化脓链球菌噬菌体Φm46.1高度同源,由此推测,这两个不同种属的前噬菌体之间可能存在着基因水平转移。
作者对不同来源的1、2、7、9型的猪链球菌基因组进行了预测,共预测出8个完整的前噬菌体基因组,分别为phi7917、phi20c、phi30c、phi891591、phiS10、phiSS12、phiST1以及phiD12。并对报道的所有的猪链球菌的噬菌体包括phi5218、phiNJ2、phi7917、phi20c、phi30c、phi891591、phiS10、phiSS12、phiST1、phiSsUD.1、phiD12及烈性噬菌体SMP进行了比较基因组学分析,发现这些噬菌体的基因组均可分为5个模块:溶原模块、复制模块、包装模块、形态模块和裂解模块(图3)。

|
| 图3. 猪链球菌(前)噬菌体的基因组比较[6] Figure 3. Comparative genome alignments of the twelve S. suis (pro)phages[6]. Modular organization of twelve S. suis (pro)phage genomes(phiSS12,phi20c,phi5218,phi7917,phi891591,phiNJ2,phiST1,phi30c,phiS10,SMP,phiD12,and phiSsUD.1). Genes are grouped into five functional modules associated with the phage life cycle: lysogeny,replication,packaging,morphogenesis and lysis. The likely functions of the genes are indicated by colorcoding. The bottom line provides a base pair scale of the genomes. |
许多病原菌的毒素由前噬菌体编码[20],如肉毒毒素、白喉毒素、霍乱毒素以及志贺毒素等[21]。除猪链球菌外,其他种属的链球菌如肺炎链球菌[22]、A 群链球菌[23]、化脓链球菌[24]和马链球菌[25]基因组中也含有前噬菌体,并且许多都与细菌毒力相关。而猪链球菌前噬菌体与宿主的毒力之间的关系尚处于推测阶段,仅在其前噬菌体中发现一些疑似的毒力因子,未经试验证实。
2.3 前噬菌体的裂解酶Daniel B. Gilmer[26]等将猪链球菌2型菌株89/1591基因组中的前噬菌体裂解酶基因PlySs2在大肠杆菌中克隆、表达并纯化,发现其具有很强的裂解能力,且噬菌谱非常广,不但能裂解猪链球菌,而且对耐药性金黄色葡萄球菌(MRSA)、万古霉素诱导的金黄色葡萄球菌(VISA)、拟葡萄球菌(Staphylococcus simulans)、李斯特菌(Listeria)、表皮葡萄球菌(Staphylococcus epidermidis)、马链球菌兽疫亚种(Streptococcus equi)、无乳链球菌(Streptococcus agalactiae)、化脓链球菌(S. pyogenes)、血链球菌(Streptococcus sanguinis)、G群链球菌(group G streptococci;GGS)、E群链球菌(group E streptococci,GES)及肺炎链球菌(Streptococcus pneumoniae)都有裂解能力。PlySs2在50℃能保持稳定30min,37℃保持稳定超过24h,4℃保持稳定超过15d,-80℃保持稳定超过7个月,在反复冻融10次后活力仍未减弱。动物实验表明PlySs2对耐药性金黄色葡萄球菌和化脓链球菌混合感染的小鼠具有92%的保护作用。这是迄今为止发现的裂解能力最强、裂解谱最广的猪链球菌的裂解酶,对今后相关研究具有参考价值。这表明猪链球菌的噬菌体虽然较难分离,但尚有可能利用前噬菌体的裂解酶作为生物防控的有效手段。
3 猪链球菌烈性噬菌体和溶原性噬菌体之间的相互转化噬菌体的两个生活周期可以相互转化。溶原型噬菌体在某些因素作用下,如丝裂霉素C 的诱导或紫外灯的照射下,可由溶原型生活周期向裂解型生活周期转变,此时噬菌体的基因组会从宿主染色体上掉下来,重新在宿主体内复制、装配出新的子代噬菌体并释放,同时宿主细菌也被裂解死亡。相反,烈性噬菌体在某些条件下,如不利的环境因素作用下,也可由裂解型生活周期向溶原型生活周期转化。噬菌体在感染宿主菌后,噬菌体的基因整合于宿主基因组中,形成溶原菌。作者将猪链球菌烈性噬菌体SMP的基因组整合到其宿主SS2-4的基因组上,构建了一株含有前噬菌体的溶原菌SS2-4(SMP)[8]。比较野生菌SS2-4和溶原菌SS2-4(SMP)的生物学特性,发现相对于野生菌SS2-4,溶原菌SS2-4(SMP)对斑马鱼的毒力有明显增强,生长速度显著加快,革兰氏染色显示链显著变短,对溶菌酶的敏感性也显著升高。表明噬菌体SMP一定程度上能增强宿主猪链球菌SS2-4的毒力。
4 猪链球菌基因组中的噬菌体相关基因除上述全基因组测序的噬菌体外,还有一些噬菌体相关基因的报道。如猪链球菌14型菌株基因组中存在一个特异性的前噬菌体片段[27]。3型猪链球菌ST3基因组中也发现了噬菌体相关基因[28]。
5 展望由于猪链球菌烈性噬菌体的分离存在一定难度,目前全世界仅发现一株猪链球菌2型的噬菌体SMP,故许多研究都围绕该噬菌体进行,主要集中于它的裂解酶和穿孔素蛋白。共有11株猪链球菌前噬菌体的相关报道,其中89/1591噬菌体的裂解酶具有较强的裂解能力,且噬菌谱非常广,能裂解猪链球菌及其他多种细菌,且对小鼠具有很好的保护力。目前报道的噬菌体裂解酶中,在裂解谱的广度、稳定性、对多种病原菌的防控效率上,尚无出其右者[26],提示猪链球菌噬菌体及其裂解酶在生物防控方面的潜力。链球菌属的化脓链球菌[29]、肺炎链球菌[22]的前噬菌体都与宿主毒力相关,而猪链球菌烈性噬菌体SMP整合入宿主基因组后,溶原菌株对斑马鱼的致病力也有所增强,但其具体机制尚不清楚,有待进一步的探索。
| [1] | Lun Z,Wang Q,Chen X,Li A,Zhu X. Streptococcus suis: an emerging zoonotic pathogen. The Lancet Infectious Diseases,2007,7(3) : 201-209. |
| [2] | Staats JJ, Feder I, Okwumabua O, Chengappa MM. Streptococcus suis: past and present. Veterinary Research Communications,1997,21(6) : 381-407. |
| [3] | Hill JE, Gottschalk M, Brousseau R, Harel J, Hemmingsen SM,Goh SH. Biochemical analysis,cpn60 and 16S rDNA sequence data indicate that Streptococcus suis serotypes 32 and 34, isolated from pigs, are Streptococcus orisratti. Veterinary Microbiology, 2005, 107(1-2) : 63-69. |
| [4] | 陆承平.兽医微生物学.第五版.北京:中国农业出版社,2013: 488. |
| [5] | Canchaya C, Fournous G, Brussow H. The impact of prophages on bacterial chromosomes. Molecular Microbiology,2004,53(1) : 9-18. |
| [6] | Tang F, Bossers A, Harders F, Lu C, Smith H. Comparative genomic analysis of twelve Streptococcus suis(pro) phages. Genomics,2013,101(6) : 336-344. |
| [7] | Ma Y, Lu C. Isolation and identification of a bacteriophage capable of infecting Streptococcus suis type 2 strains. Veterinary Microbiology,2008,132(3-4): 340- 347. |
| [8] | Tang F,Zhang W,Lu C. Lysogenic Streptococcus suis isolate SS2-4 containing prophage SMP showed increased mortality in zebra fish compared to the wild-type isolate. PloS One,2013,8(1) : e54227. |
| [9] | Barenboim M, Chang C, dib Hajj F, Young R. Characterization of the dual start motif of a class Ⅱ holin gene. Molecular Microbiology,1999,32(4) : 715-727. |
| [10] | Wang Y,Sun J,Lu C. Purified recombinant phage lysin LySMP: an extensive spectrum of lytic activity for swine streptococci. Current Microbiology,2009,58(6): 609- 615. |
| [11] | Shi Y,Yan Y,Ji W,Du B,Meng X,Wang H,Sun J. Characterization and determination of holin protein of Streptococcus suis bacteriophage SMP in heterologous host. Virology Journal,2012,9: 70. |
| [12] | Shi Y,Li N,Yan Y,Wang H,Li Y,Lu C,Sun J. Combined antibacterial activity of phage lytic proteins holin and lysin from Streptococcus suis bacteriophage SMP. Current Microbiology,2012,65(1) : 28-34. |
| [13] | 孟祥朋.猪链球菌生物被膜的生物学特性及噬菌体裂解酶对生物被膜的降解作用.上海交通大学的硕士论文,2011. |
| [14] | Sun S,Kondabagil K,Gentz PM,Rossmann MG,Rao VB. The structure of the ATPase that powers DNA packaging into bacteriophage T4 procapsids. Molecular Cell,2007,25(6) : 943-949. |
| [15] | Mao Z,Ji W,Du B,Zou Q,Yan Y,Sun J. Bioactivity of terminase large subunit encoded by Streptococcus suis phage. Journal of Shanghai Jiaotong University(Agricultural Science), 2013, 31(4): 70-75.(in Chinese)毛紫微,吉文汇,杜斌,邹绮,严亚贤,孙建和.猪链球菌噬菌体 SMP末端酶大亚基单位的活性研究.上海交通大学学报(农业科学版) ,2013,31(4) : 70-75. |
| [16] | Harel J,Martinez G,Nassar A,Dezfulian H,Labrie SJ, Brousseau R,Moineau S,Gottschalk M. Identification of an inducible bacteriophage in a virulent strain of Streptococcus suis serotype 2. Infection and Immunity, 2003,71(10) : 6104-6108. |
| [17] | Ma Y,Lu C,Fan H.[Isolation and identification of the temperate bacteriophage from isolated strains of Streptococcus suis serotype 2]. Acta Microbiologica Sinica, 2008,48(4) : 508-513.(in Chinese)马玉玲,陆承平,范红结.溶原性噬菌体在猪链球菌 2型分离株中的检出和鉴定.微生物学报,2008,48 (4) : 508-513. |
| [18] | Tang F, Bossers A, Harders F, Lu C, Smith H. Complete Genome Sequence of the Streptococcus suis Temperate Bacteriophage varphiNJ2. Genome Announcements,2013,1(1) :1-2. |
| [19] | Palmieri C,Princivalli MS,Brenciani A,Varaldo PE, Facinelli B. Different genetic elements carrying the tet(W) gene in two human clinical isolates of Streptococcus suis. Antimicrobial Agents and Chemotherapy,2011,55 (2) : 631-636. |
| [20] | Brussow H, Canchaya C, Hardt WD. Phages and the evolution of bacterial pathogens: from genomic rearrangements to lysogenic conversion. Microbiology and Molecular Biology Reviews: MMBR,2004,68 (3) : 560- 602,table of contents. |
| [21] | Beutin L, Kaulfuss S, Cheasty T, Brandenburg B, Zimmermann S, Gleier K, Willshaw GA, Smith HR. Characteristics and association with disease of two major subclones of Shiga toxin(Verocytotoxin)-producing strains of Escherichia coli(STEC) O157 that are present among isolates from patients in Germany. DiagnosticMicrobiology and Infectious Disease,2002,44 (4) : 337- 346. |
| [22] | Carrolo M,Frias MJ,Pinto FR,Melo-Cristino J,Ramirez M. Prophage spontaneous activation promotes DNA release enhancing biofilm formation in Streptococcus pneumoniae. PloS One,2010,5(12) : e15678. |
| [23] | Nagiec MJ,Lei B,Parker SK,Vasil ML,Matsumoto M, Ireland RM,Beres SB,Hoe NP,Musser JM. Analysis of a novel prophage-encoded group A Streptococcus extracellular phospholipase A(2). The Journal of Biological Chemistry,2004,279(44) : 45909-45918. |
| [24] | Dmitriev AV, McDowell EJ, Kappeler KV, Chaussee MA,Rieck LD, Chaussee MS. The Rgg regulator of Streptococcus pyogenes influences utilization of nonglucose carbohydrates,prophage induction,and expression of the NAD-glycohydrolase virulence operon. Journal of Bacteriology,2006,188(20) : 7230-7241. |
| [25] | Lindsay AM,Zhang M,Mitchell Z,Holden MT,Waller AS, Sutcliffe IC, Black GW. The Streptococcus equi prophage-encoded protein SEQ2045 is a hyaluronanspecific hyaluronate lyase that is produced during equine infection. Microbiology,2009,155( Pt 2) : 443-449. |
| [26] | Gilmer DB,Schmitz JE,Euler CW,Fischetti VA. Novel bacteriophage lysin with broad lytic activity protects against mixed infection by Streptococcus pyogenes and methicillin-resistant Staphylococcus aureus. Antimicrobial Agents and Chemotherapy,2013,57(6) : 2743-2750. |
| [27] | Hu P,Yang M,Zhang A,Wu J,Chen B,Hua Y,Yu J, Xiao J, Jin M. Complete genome sequence of Streptococcus suis serotype 14 strain JS14. Journal of Bacteriology,2011,193(9) : 2375-2376. |
| [28] | Hu P,Yang M,Zhang A,Wu J,Chen B,Hua Y,Yu J, Chen H,Xiao J,Jin M. Complete genome sequence of Streptococcus suis serotype 3 strain ST3. Journal of Bacteriology,2011,193(13) : 3428-3429. |
| [29] | Korczynska JE,Turkenburg JP,Taylor EJ. The structural characterization of a prophage-encoded extracellular DNase from Streptococcus pyogenes. Nucleic Acids Research,2012,40(2) : 928-938. |
 2015, Vol. 55
2015, Vol. 55