中国科学院微生物研究所,中国微生物学会,中国菌物学会
文章信息
- 高侃, 刘丽, 汪海峰. 2015
- Kan Gao, Li Liu, Haifeng Wang. 2015
- 微生物未甲基化CpG DNA 对动物肠道的免疫调节作用
- Advances in immunomodulation of microbial unmethylated CpG DNA on animal intestinal tract-A review
- 微生物学报, 201555(5): 543-550
- Acta Microbiologica Sinica, 201555(5): 543-550
-
文章历史
- 收稿日期:2014-08-16
- 修回日期:2014-12-01
微生物在初生动物肠道中定植逐步形成不同微生物区系,成年动物肠道中含有500多种不同种类细菌菌群。共生微生物粘附在动物肠道表面形成微生物屏障,抵御病原微生物的侵袭,介导肠道免疫应答,维持动物肠道稳态[1]。微生物通过微生物相关分子模式(Microorganism-associated molecular patterns,MAMPs)与肠道细胞生物膜表面的模式识别受体(Pattern recognition receptors,PRRs)结合激活下游级联反应,介导肠道免疫反应。微生物及其成分与肠道免疫细胞、上皮细胞的相互作用机制是目前肠道粘膜免疫的研究热点。研究报道表明,微生物成分包括脂多糖(Lipopolysaccharide,LPS)、磷壁酸(Teichoic acid,TA)、肽聚糖(Peptidoglycan,PGN)等微生物成分在动物肠道中发挥免疫调节作用,微生物中含有未甲基化胞嘧啶-鸟嘌呤二核苷酸(Cytosine-guanine,CpG)的DNA片段同样也能被机体免疫系统所识别,并介导动物肠道粘膜免疫[2, 3]。目前国内外最新研究表明,未甲基化CpG DNA作为一种潜在的免疫刺激因子,能够激活动物免疫系统并增强机体免疫应答能力,因此成为国内外免疫佐剂开发利用研究热点。本文综述了未甲基化CpG DNA的基本概念、受体TLR9的特征、调节动物肠道免疫作用及其信号机制,同时阐述了未甲基化CpG DNA作为免疫佐剂在实际中的应用,并对微生物未甲基化CpG DNA研究与开发利用前景进行了展望。
1 未甲基化CpG DNA微生物内未甲基化的CpG DNA具有免疫刺激作用,能够直接或间接激活肠道免疫系统,增强肠道免疫应答,从而维持肠道稳态。菌体DNA对哺乳动物免疫系统是否具有免疫刺激作用,取决于菌体DNA中未甲基化CpG二核苷酸的含量。哺乳动物DNA中多为甲基化CpG二核苷酸,所以哺乳动物DNA不具备免疫刺激效应[4]。动物肠道微生物菌群构成随动物生理状态(如年龄、健康状况等)不同而产生差异。不同肠道微生物菌群未甲基化CpG DNA对动物肠道免疫调节效果也不同。据报道,动物肠道中的肠球菌(Enterococcus faecalis)、干酪乳酸杆菌(Lactobacillus casei)、植物乳酸杆菌(Lactobacillus plantarum)、鼠李糖乳酸杆菌(Lactobacillus rhamnosus)、双歧杆菌(Bifidobacteria)、变形菌(Proteobacteria)、拟杆菌(Bacteroidetes)等细菌富含未甲基化CpG二核苷酸的DNA片段(表1),未甲基化CpG基序与肠道细胞特异性受体相互作用,调控动物肠道粘膜免疫功能,维持肠道免疫系统功能平衡[5]。
| Strains | GC/% | Mb | CpG motif/genome | CpG motif frequency/Mb |
| Enterococcus faecalisV583 | 37 | 3.2 | 225216 | 70380 |
| Lactobacillus caseiBL23 | 46 | 3.1 | 346378 | 111735 |
| Lactobacillus plantarumWCFS1 | 44 | 3.4 | 366552 | 108127 |
| Lactobacillus rhamnosusGG | 47 | 3.0 | 360288 | 119697 |
| BifidobacterialongumATCC 15697 | 59 | 2.8 | 604886 | 216031 |
| Pseudomonas aeruginosa PAO1 | 67 | 6.3 | 1526246 | 243809 |
| Parabacteroidesdistasonis ATCC 8503 | 45 | 4.8 | 581492 | 120892 |
人工合成的单链未甲基化CpG脱氧核糖寡核甘酸(Oligodeoxynucleotides,ODNs)能够模拟微生物菌体未甲基化CpG DNA的免疫刺激效应。根据特定序列组成和免疫功能,人工合成的CpG-ODN可被分为三大类,即A类、B类和C类,根据不同体外试验需要,用于替代菌体未甲基化CpG DNA。A类CpG-ODN主要由嵌合的硫代磷酸和磷酸二酯骨架构成,3′端或5′端含有至少一个未甲基化CpG二核苷酸的多聚鸟嘌呤回文结构,主要用于刺激树突细胞产生干扰素(Interferon,IFN)从而激活自然杀伤细胞(Natural killer cells,NK);B类CpG-ODN主要由硫代磷酸骨架构成,多个未甲基化CpG基序存在于骨架之间,主要用于刺激B细胞的增殖分化;而C类CpG-ODN的5'端具有六聚未甲基化CpG基序,3'端具有富含GC回文序列结构,功能上同时具备A类和B类ODN的特点[6]。
2 未甲基化CpG DNA受体微生物MAMP通过与机体肠道细胞表面的PRR结合,发挥调节效应。Toll样受体家族(Toll-like receptors,TLRs)是一类存在于动物肠道细胞生物膜表面的Ⅰ类跨膜蛋白,通过特异性识别并结合相对应微生物MAMP,引起机体细胞免疫应答,在介导机体肠道固有免疫中发挥着重要的作用[7]。研究报道已有10种特异性配体的TLR,如TLR2、TLR4、TLR5和TLR9分别能够特异性识别并结合磷壁酸LTA、脂多糖LPS、鞭毛和未甲基化CpG DNA等。本课题组先前已经对Toll样受体介导的肠道免疫调节相关研究进行了详细的综述[8, 9, 10]。TLR受体的激活取决于TLR受体的结构特性、不同细胞表面TLR受体的表达分布,以及特异性配体的结构特性等。本课题组研究发现鼠李糖乳酸杆菌Lactobacillus rhamnosus GG(LGG)通过调控TLR2、TLR4和TLR9受体表达,介导猪肠上皮细胞炎症免疫反应,发挥益生效应(未发表)。
TLR9受体不仅分布于肠道细胞膜表面[11],同样存在于动物肠道细胞胞浆的包涵体中,通过识别并结合菌体未甲基化CpG DNA激活下游信号通路[12]。TLR9作为未甲基化CpG DNA特异性识别受体,与其他TLR家族受体具有结构相似性。TLR9受体胞外结构域(Extracellular domain,ECD)由25个富含赖氨酸结构域(Leucine-rich repeats,LRRs)与1个富含半胱氨酸结构域组成,胞内结构域由α螺旋与β折叠构成,胞外结构域ECD通过跨膜结构域与胞内结构域连接。胞外结构域ECD识别未甲基化CpG DNA后,胞内结构域能够活化相关蛋白,激活细胞下游级联信号通路,从而产生相应免疫应答,如产生细胞因子、诱导细胞增殖或凋亡等[13, 14]。研究发现,TLR9通过胞外结构域ECD含有的LRR与CpG基序相结合,从而激活胞内相应信号激酶,LRR中LRR2、LRR5和LRR11对CpG基序具有较强的亲和力,尤其是LRR11[15]。同时研究发现,TLR9胞外结构域的C端和N端在结合激活TLR9受体过程中发挥重要作用,进一步研究发现C端的组氨酸His505、谷氨酰胺Gln510、组氨酸His530和丝氨酸Tyr554在TLR9受体激活中必不可少[16]。
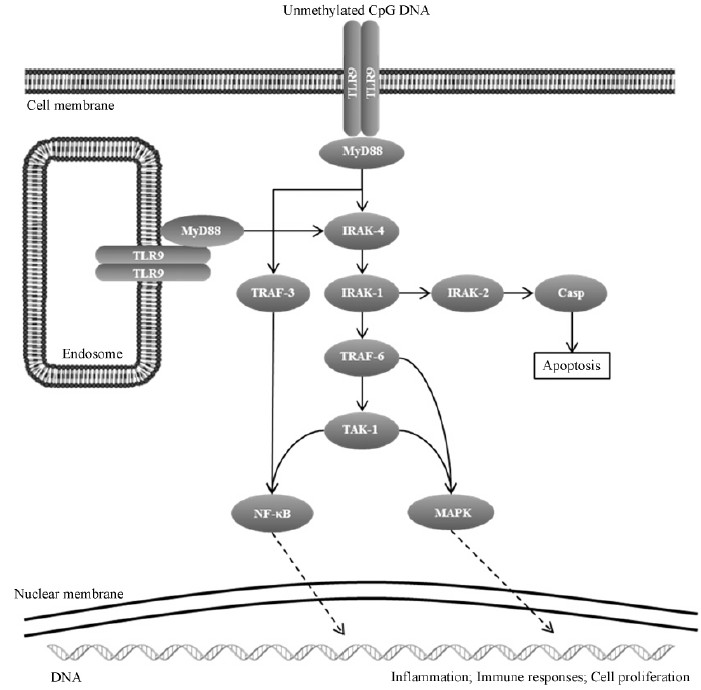
3 未甲基化CpG DNA经由TLR9介导的肠道免疫调节作用 3.1 未甲基化CpG免疫调节的信号通路肠道微生物富含未甲基化CpG的DNA片段随细菌的复制、凋亡等过程释放至肠道内环境中。由未甲基化CpG DNA与肠道TLR9结合,通过骨髓样分化因子88(Myeloiddifferentiationfactor88,MyD88)介导,激活下游的白介素受体相关激酶-1(Interleukin-1 receptor-associated kinase,IRAK-1)、肿瘤坏死因子相关因子6(Tumornecrosisfactor receptor-associated factor 6,TRAF6)与转化生长因子活化激酶1(Transforming growth factor -activated kinase 1,TAK1),从而激活核因子κB(Nuclear factor-kappa B,NF-κB)信号通路与丝裂原活化蛋白激酶(Mitogen-activated protein kinase,MAPK)信号通路。激活的MAPK信号通路包括p38MAPK信号通路、细胞外调节蛋白激酶1/2(Extracellular regulated protein kinases,ERK1/2)信号通路以及c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)信号通路,激活的信号分子通过进入胞核调控DNA的转录,引起肠道细胞产生细胞因子、介导免疫调控、促使细胞增殖或募集免疫细胞等[13, 14]。同时,在特定的外环境因子的刺激下,IRAK-4蛋白选择性激活含半胱氨酸的天冬氨酸蛋白水解酶(Cysteinyl aspartate specific proteinase,Caspase),介导细胞凋亡信号通路引起受感染肠道细胞程序性死亡(图1)。
|
| 图 1. 未甲基化CpG DNA/TLR9 MyD88依赖信号通路图[13] Figure 1. Schematic representation of unmethylatedCpG DNA/TLR9 MyD88-dependent signaling pathway[13] |
因此,未甲基化CpG DNA与肠道细胞TLR9识别后,通过NF-κB和MAPK信号通路增强细胞的免疫应答功能,在维持动物肠道稳态中发挥重要的作用[13]。未甲基化CpG DNA作用于人结肠癌细胞HT-29,通过TLR9介导的MyD88/NF-κB信号通路引起HT-29细胞中白介素-8(Interleukin-8,IL-8)的表达分泌增加[17]。与以上研究结果相一致,本课题组研究发现鼠李糖乳酸杆菌LGG的未甲基化CpG DNA能够被猪肠上皮细胞TLR9受体识别,并且激活下游NF-κB、p38MAPK和ERK1/2信号通路,引起细胞致炎性细胞因子表达升高,表明LGG的未甲基化CpG DNA介导TLR9激活炎性信号通路,在肠道粘膜免疫中发挥免疫刺激效应(未发表)。
3.2 未甲基化CpG DNA对肠道的免疫调节作用目前国内外主要采用人工合成的未甲基化CpG ODN代替肠道微生物未甲基化CpG DNA,用于研究动物肠道免疫应答。研究发现未甲基化CpG DNA不仅能够被机体肠道上皮细胞TLR9受体识别,引起肠道上皮细胞中致炎性细胞因子(肿瘤坏死因子-α(Tumor necrosis factor-alpha,TNF-α)、IFN-γ等)、CC类趋化因子(CCL2、CCL7等)以及CXC类趋化因子(CXCL1、CXCL10等)蛋白分泌上升[18],而且未甲基化CpG DNA作为一类肠道免疫刺激因子,还可促进动物肠道中树突状细胞(Dendritic cells,DC)和巨噬细胞等抗原提呈细胞(Antigen presenting cell,APC)大量增殖,分泌CC类趋化因子、单核细胞趋化蛋白-1(Monocyte chemoattractant protein-1,MCP-1)和巨噬细胞炎症蛋白(Macrophage inflammatory protein,MIP)[19]。未甲基化CpG DNA通过TLR9受体介导的信号通路增强肠道上皮细胞、APC细胞免疫应答反应,在调控机体肠道固有免疫应答中发挥重要作用,维持动物肠道稳态。
未甲基化CpG DNA不仅能够调控机体肠道固有免疫应答,而且能够通过肠道上皮细胞、APC细胞等间接介导机体肠道适应性免疫应答。未甲基化CpG DNA调节动物肠道适应性免疫应答的研究主要集中于小鼠肠道炎症的预防、治疗等方面。研究利用未甲基化CpG ODN饲喂新生小鼠和成年小鼠,未甲基化CpG ODN被小鼠肠道粘膜层APC细胞如DC细胞识别,诱导B淋巴细胞增殖分化分泌抗体,也促进辅助性T细胞Th1细胞因子IL-12p40和IFN-γ表达,增强小鼠肠道免疫细胞免疫应答反应[18],表明未甲基化CpG DNA能够通过激活APC细胞间接调控小鼠肠道适应性免疫应答反应。最新研究进一步发现,对患有肠道炎症的小鼠饲喂未甲基化CpG ODN后,小鼠肠道DC细胞TLR9受体特异性识别未甲基化CpG ODN,DC细胞激活后分泌相关细胞因子和趋化因子,从而活化小鼠肠道调节性B细胞(Regulatory B cell,Breg cell)分泌IL-10,进一步调节小鼠肠道适应性免疫反应,减轻小鼠肠道炎症反应[20]。研究利用未甲基化CpG ODN刺激患有慢性肠道炎症的小鼠试验中,未甲基化CpG ODN通过TLR9信号通路激活小鼠肠道免疫反应,刺激肠道B淋巴细胞活化,分泌大量免疫球蛋白A (Immunoglobulin A,IgA),从而缓解小鼠肠道炎症免疫反应[21]。另有研究报道未甲基化CpG ODN刺激小鼠肠道DC细胞分泌致炎性细胞因子,引起CD8+T淋巴细胞增殖;与此同时,未甲基化CpG ODN激活的DC细胞间接介导辅助性T细胞Th1和Th17免疫应答,诱导细胞毒性T淋巴细胞(Cytotoxic lymphocyte,CTL)活性[22]。以上研究均表明,未甲基化CpG DNA通过小鼠肠道APC细胞的递呈作用,活化免疫细胞功能,进而间接介导小鼠肠道的适应性免疫应答。基于未甲基化的CpG DNA调控小鼠肠道免疫应答的众多研究成果,未甲基化的CpG DNA调控猪肠免疫应答的研究亦取得进展。对新生仔猪鼻腔给予未甲基化CpG ODN刺激新生仔猪肠道免疫应答,发现未甲基化CpG ODN显著增强肠道淋巴结中辅助性T细胞Th1的免疫应答,致炎性细胞因子TNF-α的表达显著升高[23]。另有研究发现在预防由大肠杆菌引起的断奶仔猪肠道腹泻试验中,利用未甲基化CpG ODN饲喂断奶仔猪能够显著增加猪肠道B细胞免疫球蛋白M (Immunoglobulin M,IgM)和免疫球蛋白G (Immunoglobulin G,IgG)的分泌,同时显著增加辅助性T细胞Th1中TNF-α、IFN-γ、IL-12p40和IL-1β,以及Th2中IL-4、IL-6的表达[24]。以上未甲基化CpG DNA调节猪肠道免疫的研究表明,未甲基化CpG DNA通过激活猪肠道APC细胞、活化B细胞而引起大量抗体分泌,同时可以调控IgM的转变类别以及肠道辅助性T细胞Th1与Th2免疫应答平衡,在猪肠道免疫应答系统中发挥重要的调节功能。结合目前本课题组有关微生物未甲基化CpG DNA的研究,未甲基化CpG DNA通过被机体肠道上皮细胞、APC细胞TLR9受体识别,激活细胞分泌免疫因子,引起肠道固有免疫应答的同时,还可活化免疫细胞间接调节肠道适应性免疫应答。可见,未甲基化CpG DNA在介导动物肠道固有免疫和适应性免疫应答中发挥着重要的作用。
然而,未甲基化CpG DNA与机体免疫系统相互作用的机制并没有完全了解。使用高剂量未甲基化CpG ODN刺激小鼠浆细胞样树突细胞(plasmacytoid dendritic cells,pDCs),发现高剂量的未甲基化CpG ODN并没有激活pDC细胞免疫应答,反而呈现免疫耐受效应。通过进一步检测pDC细胞中细胞信号通路分子表达,发现高剂量未甲基化CpG ODN与pDC细胞TLR9识别后,通过TLR9-IRF3(Interferon regulatory factor 3,干扰素调节因子3)信号通路,而非TLR9-MyD88信号通路,激活下游转化生长因子β(Transforming growth factor-beta,TGF-β),从而引起pDC细胞免疫耐受效应[25]。因此,有必要在目前研究基础上,对未甲基化CpG DNA/TLR9介导的信号通路进行进一步的研究。
4 未甲基化CpG DNA在调节机体免疫中的应用人工合成的未甲基化CpG ODN代替肠道微生物未甲基化CpG DNA被广泛用于预防、治疗动物肠道疾病,具有重要的免疫佐剂作用。研究发现未甲基化CpG ODN通过激活人和小鼠APC细胞(pDC细胞)分泌表达细胞因子、趋化因子等,从而募集免疫B细胞增殖分化,在预防和治疗感染性疾病中发挥着重要的免疫佐剂功能[26]。研究显示肠道微生物菌群未甲基化CpG DNA能够通过增强辅助性T细胞Th1免疫应答,调节动物肠道自身免疫紊乱[5]。
未甲基化CpG DNA作为一类免疫刺激因子,具有免疫佐剂效应。最新研究发现,利用未甲基化CpG ODN处理鸡髓系树突状细胞(Bone marrowderived dendritic cells,BMDC),通过形态学、表型鉴定以及活性功能检测,发现未甲基化CpG ODN能够活化BMDC细胞,活化的BMDC细胞可进一步诱导鸡T淋巴细胞增殖分化并产生免疫应答反应[27]。对鸡饲喂未甲基化CpG ODN,未甲基化CpG ODN显著增强鸡肠道粘膜免疫应答,同时激活机体免疫系统功能,通过分泌大量IgA抵抗禽流感病毒H5N1侵袭,具有免疫佐剂效应[28]。未甲基化CpG ODN预处理的军曹鱼肠道被细菌感染后,与单独细菌感染的鱼类相比较,成活率升高,且无明显肠道组织损伤和炎症[29]。未甲基化CpG ODN在刺激南美对虾12 h后,能够显著提高南美对虾血液中TNF-α的表达量以及一氧化氮(NO)的含量,增强机体的免疫应答能力[30]。研究对新生仔猪鼻腔给予人工合成的未甲基化CpG ODN与先天免疫调节肽HH2(Innate defense regulator peptides-HH2,IDR-HH2)复合物(CpG-IDR-HH2 complex),发现仔猪肠道细胞因子、趋化因子mRNA表达量显著上升;同时对受致病性大肠杆菌感染的新生仔猪鼻腔给予未甲基化CpG ODN与IDR-HH2复合物,发现仔猪肠道致炎性细胞因子TNF-α的mRNA水平显著降低[23],研究结果表明未甲基化CpG DNA协同IDR增强猪肠道粘膜免疫抵抗病原微生物感染,同时对于肠道炎症有免疫治疗效果,在机体肠道中发挥重要的免疫佐剂作用。另有研究采用人工合成的未甲基化CpG ODN与IDR-HH2形成的免疫佐剂复合物饲喂新生仔猪,能够增加猪肠道免疫细胞的细胞因子IL-12、TNF-α和IFN-γ的表达,同时显著增强辅助性T细胞Th1(分泌IgG抗体)和Th2(分泌IgA抗体)的免疫应答,并可抵抗伪狂犬病毒感染[31],研究结果进一步佐证未甲基化CpG DNA与IDR-HH2协同介导机体肠道免疫功能;还有相关研究发现未甲基化CpG DNA/IL-6复合物佐剂在猪生产养殖中可有效地防止猪瘟的发生[32]。以上已有研究均表明,未甲基化CpG DNA作为一种肠道免疫佐剂,通过与其他物质构成复合物的形式,能够显著提高动物机体免疫功能,在实际动物生产中具有重要的应用价值。
5 展望动物肠道免疫系统是动物机体防御病原微生物侵袭的第一道免疫防线。以上综述表明,作为一类免疫刺激因子,微生物未甲基化CpG DNA可激活动物肠道免疫系统、增强机体免疫应答能力,从而抵御病原微生物的侵袭。未甲基化CpG DNA对动物具有免疫调节作用,能够直接或间接介导机体固有免疫和适应性免疫应答,是国内外免疫佐剂开发利用的热点。然而,目前未甲基化CpG DNA调节机体肠道免疫应答的机制尚未完全明晰,应用于实际生产的安全性尚未被完全阐明,需要进行更多研究来验证。因此,在目前国内外研究基础上,有必要进一步深入研究未甲基化CpG DNA在动物肠道免疫调节中的作用,阐明未甲基化CpG DNA/TLR9介导动物肠道粘膜免疫的机制,为开发和利用未甲基化CpG DNA作为肠道免疫佐剂提供理论基础,将对预防和治疗动物肠道疾病、提高动物免疫力、促进动物健康等具有重要意义。本课题组致力于乳酸杆菌肠道粘膜免疫调控效应及其机制研究,业已发现鼠李糖乳酸杆菌LGG的未甲基化CpG DNA具有肠道粘膜免疫调节效应,后续将进一步分析益生菌未甲基化CpG DNA肠道免疫调节效应及其详细分子信号机制,为更好开发利用益生菌提供理论基础。
| [1] | Buffie CG, Pamer EG. Microbiota-mediated colonization resistance against intestinal pathogens. Nature Reviews.Immunology, 2013, 13(11): 790-801. |
| [2] | Cinar MU, Islam MA, Proll M, Kocamis H, Tholen E, Tesfaye D, Looft C, Schellander K, Uddin MJ. Evaluation of suitable reference genes for gene expression studies in porcine PBMCs in response to LPS and LTA. BMC Research Notes, 2013, 6: 56. |
| [3] | Lemaitre B, Girardin SE. Translation inhibition and metabolic stress pathways in the host response to bacterial pathogens. Nature Reviews. Microbiology, 2013, 11(6): 365-369. |
| [4] | Patil V, Ward RL, Hesson LB. The evidence for functional non-CpG methylation in mammalian cells. Epigenetics : Official Journal of the DNA Methylation Society, 2014, 9(6). |
| [5] | Kant R, Vos WM, Palva A, Satokari R. Immunostimulatory CpG motifs in the genomes of gut bacteria and their role in human health and disease. Journal of Medical Microbiology, 2014, 63(Pt 2): 293-308. |
| [6] | Iliev DB, Hansen T, Jørgensen SM, Krasnov A, Jørgensen JB. CpG-and LPS-activated MAPK signaling inin vitrocultured salmon (Salmo salar) mononuclear phagocytes. Fish &Shellfish Immunology, 2013, 35(4): 1079-1085. |
| [7] | O’Neill LA, Golenbock D, Bowie AG. The history of Toll-like receptors - redefining innate immunity. Nature Reviews. Immunology, 2013, 13(6): 453-460. |
| [8] | Gao K, Wang H, Zhang W, Liu J. Functions of intestinal epithelial barriers modulated by probiotics and mechanisms. Chinese Journal of Animal Nutrition, 2013(09): 1936-1945.(in Chinese) 高侃, 汪海峰, 章文明, 刘建新. 益生菌调节肠道上皮屏障功能及作用机制. 动物营养学报, 2013(09): 1936-1945. |
| [9] | Wang H, Zhang W, Wang Y, Liu J. Cell surface components of lactobacilli: recentadvances on theiradherence mechanism of action in the gastrointestinal tract. Chinese Journal of Animal Nutrition, 2011(02): 179-186. (in Chinese) 汪海峰, 章文明, 汪以真, 刘建新. 乳酸杆菌与肠道黏附相关表面因子及其机制的研究进展. 动物营养学报, 2011(02): 179-186. |
| [10] | Zhang W, Wang H, Liu J. Mechanism of action of probiotic function of lactobacilli. Chinese Journal of Animal Nutrition, 2012(03): 389-396. (in Chinese) 章文明, 汪海峰, 刘建新. 乳酸杆菌益生作用机制的研究进展. 动物营养学报, 2012(03): 389-396. |
| [11] | Kivit S, Tobin MC, DeMeo MT, Fox S, Garrsen J, Forsyth CB, Keshavarzian A, Landay AL. In vitro evaluation of intestinal epithelial TLR activation in preventing food allergic responses. Clinical Immunology, 2014. |
| [12] | Kamdar K, Nguyen V, DePaolo RW. Toll-like receptor signaling and regulation of intestinal immunity. Virulence, 2013, 4(3): 207-212. |
| [13] | Hofmann C, Dunger N, Doser K, Lippert E, Siller S, Edinger M, Falk W, Obermeier F. Physiologic TLR9-CpG-DNA interaction is essential for the homeostasis of the intestinal immune system. Inflammatory Bowel Diseases, 2014, 20(1): 136-143. |
| [14] | Rose Ⅱ WA, Sakamoto K, Leifer CA. TLR9 is important for protection against intestinal damage and for intestinal repair. Scientific Reports, 2012, 2. |
| [15] | Pan X, Yue J, Ding G, Li B, Liu X, Zheng X, Yu M, Li J, Jiang W, Wu C. Leucine-rich repeat 11 of Toll-like receptor 9 can tightly bind to CpG-containing oligodeoxynucleotides, and the positively charged residues are critical for the high affinity. Journal of Biological Chemistry, 2012, 287(36): 30596-30609. |
| [16] | Suwarti S, Yamazaki T, Svetlana C, Hanagata N. Recognition of CpG oligodeoxynucleotides by human Toll-like receptor 9 and subsequent cytokine induction. Biochemical and Biophysical Research Communications, 2013, 430(4): 1234-1239. |
| [17] | Pedersen G, Andresen L, Matthiessen MW, Rask-Madsen J, Brynskov J. Expression of Toll-like receptor 9 and response to bacterial CpG oligodeoxynucleotides in human intestinal epithelium. Clinical and Experimental Immunology, 2005, 141(2): 298-306. |
| [18] | Lacroix-Lamande S, Rochereau N, Mancassola R, Barrier M, Clauzon A, Laurent F. Neonate intestinal immune response to CpG oligodeoxynucleotide stimulation. PloS One, 2009, 4(12): e8291. |
| [19] | Cheng Q, Xu C, Zhang L, Li J, Cao T, Zhang M. Administered CpG oligodeoxynucleotide induces mRNA expression of CXC and CC chemokines at the intestinal mucosa and PBMCs in piglets. International Immunopharmacology, 2010, 10(5): 611-618. |
| [20] | Nishida A, Lau C, Mizoguchi E, Mizoguchi A. Regulatory B cells in mouse models of intestinal inflammation. Methods in Molecular Biology, 2014, 1190: 227-241. |
| [21] | Blaas SH, Stieber-Gunckel M, Falk W, Obermeier F, Rogler G. CpG-oligodeoxynucleotides stimulate immunoglobulin A secretion in intestinal mucosal B cells. Clinical and Experimental Immunology, 2009, 155(3): 534-540. |
| [22] | Fujimoto K, Karuppuchamy T, Takemura N, Shimohigoshi M, Machida T, Haseda Y, Aoshi T, Ishii KJ, Akira S, Uematsu S. A new subset of CD103+CD8alpha+ dendritic cells in the small intestine expresses TLR3, TLR7, and TLR9 and induces Th1 response and CTL activity. Journal of Immunology, 2011, 186(11): 6287-6295. |
| [23] | Yang J, Mao M, Zhang S, Li H, Jiang Z, Cao G, Cao D, Wang X, Zhang L. Innate defense regulator peptide synergizes with CpG ODN for enhanced innate intestinal immune responses in neonate piglets. International Immunopharmacology, 2012, 12(2): 415-424. |
| [24] | Delisle B, Calinescu C, Mateescu MA, Fairbrother JM, Nadeau E. Oral immunization with F4 fimbriae and CpG formulated with carboxymethyl starch enhances F4-specific mucosal immune response and modulates Th1 and Th2 cytokines in weaned pigs. Journal of Pharmacy &Pharmaceutical Sciences : aPublication of the Canadian Society for Pharmaceutical Sciences, Societe Canadienne Des Sciences Pharmaceutiques, 2012, 15(5): 642-656. |
| [25] | Volpi C, Fallarino F, Pallotta MT, Bianchi R, Vacca C, Belladonna ML, Orabona C, De Luca A, Boon L, Romani L, Grohmann U, Puccetti P. High doses of CpG oligodeoxynucleotides stimulate a tolerogenic TLR9-TRIF pathway. Nature Communications, 2013, 4: 1852. |
| [26] | Gungor B, Yagci FC, Tincer G, Bayyurt B, Alpdundar E, Yildiz S, Ozcan M, Gursel I, Gursel M. CpG ODN nanorings induce IFNalpha from plasmacytoid dendritic cells and demonstrate potent vaccine adjuvant activity. Science Translational Medicine, 2014, 6(235): 235ra261. |
| [27] | Fu J, Liang J, Kang H, Lin J, Yu Q, Yang Q. The stimulatory effect of different CpG oligonucleotides on the maturation of chicken bone marrow-derived dendritic cells. Poultry Science, 2014, 93(1): 63-69. |
| [28] | Fu J, Liang J, Kang H, Lin J, Yu Q, Yang Q. Effects of different CpG oligodeoxynucleotides with inactivated avian H5N1 influenza virus on mucosal immunity of chickens. Poultry Science, 2013, 92(11): 2866-2875. |
| [29] | Byadgi O, Puteri D, Lee J, Chang T, Lee Y, Chu C, Cheng T. The Effect of TLR9 Agonist CpG Oligodeoxynucleotides on the Intestinal Immune Response of Cobia (Rachycentron canadum). Journal of Immunology Research, 2014, 2014: 273284. |
| [30] | Sun R, Wang M, Wang L, Yue F, Yi Q, Huang M, Liu R, Qiu L, Song L. The immune responses triggered by CpG ODNs in shrimp Litopenaeus vannamei are associated with LvTolls. Developmental and Comparative Immunology, 2014, 43(1): 15-22. |
| [31] | Cao D, Li H, Jiang Z, Cheng Q, Yang Z, Xu C, Cao G, Zhang L. CpG oligodeoxynucleotide synergizes innate defense regulator peptide for enhancing the systemic and mucosal immune responses to pseudorabies attenuated virus vaccine in piglets in vivo. International Immunopharmacology, 2011, 11(6): 748-754. |
| [32] | Li D, Chen J, Zhang H, Yang X, Wan X, Cheng C, Li Y, Wang Z, Lv X, Wang H, Wang H, Li J, Gao R. Improvement of the immunity of pig to Hog cholera vaccine by recombinant plasmid with porcine interleukin-6 gene and CpG motifs. Vaccine, 2011, 29(22): 3888-3894. |
 2015, Vol. 55
2015, Vol. 55