
中国科学院微生物研究所,中国微生物学会,中国菌物学会
文章信息
- 张化俊, 彭云, 张夙, 安新丽, 李祎, 郑伟, 郑天凌. 2015
- Huajun Zhang, Yun Peng, Su Zhang, Xinli An, Yi Li, Wei Zheng, Tianling Zheng. 2015
- 溶藻细菌BS01产二异丁氧基苯基对塔玛亚历山大藻生长的影响
- Algicidal effect of (2-isobutoxyphenyl) amine on Alexandrium tamarense
- 微生物学报, 2015,55(7): 834-842
- Acta Microbiologica Sinica, 2015,55(7): 834-842
-
文章历史
- 收稿日期:2014-11-27
- 修回日期:2015-01-15
随着人类活动的加剧,使得近岸海水中氮、磷营养元素大量增加,造成水体的富营养化,为浮游植物的大量繁殖提供了丰富的物质基础,而部分浮游植物的过度繁殖,可导致赤潮的爆发[1]。由富营养化所引发的赤潮已成为全球性海洋公害,有害赤潮能够通过产生毒素、造成物理损伤、改变水体理化特征等方式对人类健康、海洋生物和生态系统造成严重危害[2, 3]。据中国海洋灾害公报报道,我国2013年全海域共发现赤潮45次,波及面积达2620 km2,而且赤潮的发展趋势正向着高频率、大规模、危害日益增加的方向转变。
塔玛亚历山大藻( Alexandrium tamarense)广泛分布于我国沿海,且能够产生麻痹性贝毒(paralytic shellfish poisoning,PSP),是当前产生有害赤潮的主要 藻种之一。当塔玛亚历山大藻产生的PSP毒素被鱼虾贝类所摄食后,经过富集作用会对人类的健康造成严重的威胁[4, 5]。因此,研究有害赤潮藻的治理手段已经迫在眉睫。目前,藻类的控制技术可以归纳为:物理法、化学法、生物法,其中生物法中的微生物溶藻由于其技术成本低、菌质资源丰富,已经得到广泛关注[6, 7, 8]。海洋细菌在赤潮的生消中扮演着重要角色,影响着海洋生态系统物质和能量的运输及转换[9],而一些海洋细菌在赤潮爆发过程中,甚至能引起藻细胞的裂解死亡。早在1942年,Geitler就报道了一种寄生在刚毛藻上可使之死亡的粘细菌[10];至今为止已经有大量的溶藻细菌被分离获得,主要包括假交替单胞菌(Pseudoalteromonas)、 γ-变形菌门中的弧菌(Vibrio)、 噬纤维菌属(Cellulophaga)、 CFB类群中的黄杆菌属(Flavobacterium),以及低GC含量的芽孢杆菌属(Bacillus)[11, 12, 13];假交替单胞菌是报道较多的一种分泌胞外物质溶藻的细菌。而大多数溶藻细菌的溶藻作用都是通过分泌释放某种溶藻活性物质的方式达到的,这种方式就是细菌的间接溶藻作用。细菌分泌胞外具有溶藻活性的物质主要是蛋白质[14, 15]、多肽[16]、氨基酸[17]、 表面活性剂[18]和抗生素[19]等。然而,目前虽然已获得了丰富的溶藻菌株,但对于溶藻菌株的溶藻过程及机理 的报道却较少。本研究利用一株分离自厦门海域的细菌BS01[20]所分泌的杀藻化合物作用于赤潮塔玛亚历山大藻,并研究该杀藻化合物的杀藻过程及可能的机理。溶藻细菌BS01具有较强的溶藻活性,而从该菌中分离出的杀藻化合物同样能够高效的引起塔玛亚历山大藻的死亡,经过前期的研究该杀藻化合物已经纯化并鉴定,学名为(二异丁氧基苯基)胺,其结构式见图 1。
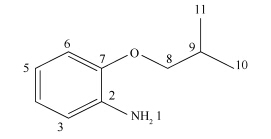
|
| 图 1. 杀藻活性物质(二异丁氧基苯基)胺的结构式 Figure 1. The structure of algicidal compound (2-isobutoxyphenyl)amine. |
杀藻化合物(二异丁氧基苯基)胺来源于溶藻细菌BS01,该菌株已经保藏于中国普通微生物菌种保藏管理中心(保藏号:CGMCC NO.6481)。
供试藻种为塔玛亚历山大藻(Alexandrium tamarense ATGD98-006),由暨南大学水生生态研究所提供。采用 f/2 培养基,于光强50 μE/(m2·s),温度( 20±1 )℃,昼夜比 L∶D=12 h∶12 h的条件下培养[4]。
杀藻谱所使用藻株均保藏于厦门大学金海海洋环境国家重点实验室。
1.2 杀藻化合物处理塔玛亚历山大藻将培养至指数生长期的无菌塔玛亚历山大藻转接到250 mL的三角瓶中,每瓶含有50 mL藻液,在光强50 μE/(m2·s),温度( 20±1 )℃,昼夜比 L∶D=12 h∶12 h的条件下适应培养一天。将杀藻化合物(二异丁氧基苯基)胺溶解于二甲基亚砜(DMSO)中按终浓度为10和20 μg/mL的浓度加入到藻的培养液中,处理4、8、12和24 h,每个处理做3个平行,并在不同的时间点收集藻细胞(离心条件: 3500×g,4℃,5 min),用于进一步实验,对照为加入相同体积的DMSO。
1.3 杀藻化合物的杀藻效果取1.2中不同时间点的藻液1 mL,用鲁哥氏碘液固定后,利用光学显微镜计算藻细胞个数,杀藻率按以下公式
(1)计算。
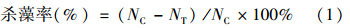
式中,NC为对照组塔玛亚历山大藻的藻细胞数(个/mL);NT为处理组塔玛亚历山大藻细胞数 (个/mL)。
1.4 光合色素和光合效率的测定取1.2中收集的藻细胞,利用95%乙醇提取藻细胞中的色素,锡箔纸封闭包裹,4℃过夜抽提。过夜抽提后,将萃取液8000×g离心10 min,取上清液在665、645和470 nm下测定不同波长的吸光值。叶绿素a(Chl a)的含量按以下公式(2)计算[21]。
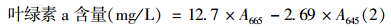
进行叶绿素荧光参数测定时,藻细胞按1.2中处理后,取5 mL藻液,在暗处避光进行暗适应 20 min,然后将藻液混匀后取3 mL于比色皿中,利用高级浮游植物荧光仪PHYTO-PAM测定叶绿素荧光。用可变荧光(Fv)与最大荧光(Fm)的比值Fv/Fm表示光合效率的大小。
1.5 藻细胞生理生化指标测定将1.2中收集的藻细胞,加入4℃预冷的0.05 mol/L pH7.5的磷酸缓冲液2 mL,冰浴中用超声波破碎(工作条件:80 W,工作5 s,间歇5s,40次),破碎液在4℃,12000×g离心10 min,取上清液用于酶活测定。测定试剂盒由南京建成生物工程公司生产的试剂盒进行蛋白含量、SOD、CAT、MDA的生理生化指标测定。
藻细胞内部活性氧(ROS)的测定利用荧光染料DCFH-DA进行[22]。取0.5 mL终浓度为10 μg/mL的DCFH-DA,加入到1.2收集的藻细胞中,置于37℃下避光共浴1 h,期间每隔5 min摇动混匀一次。之后用藻培养基f/2洗涤藻细胞3次,然后利用酶标仪测定藻细胞荧光强度,在485 nm下激发,525 nm下检测荧光强度。
1.6 藻细胞透射电镜形态观察将1.2中处理的藻细胞利用2.5%的戊二醛固定2 h,用0.1 mol/L PBS缓冲液洗涤3次后利用1%的锇酸进行后固定,经酒精脱水后,利用树脂进行包埋、切片。利用JEM2100HC(日本)的透射电镜进行藻细胞形态观察。
1.7 杀藻活性物质的杀藻谱针对杀藻活性物质(二异丁氧基苯基)胺,利用实验室的蓝藻门、绿藻门、甲藻门、金藻门、黄藻门和硅藻门的相关藻类进行杀藻谱试验。将22株供试藻株接入到新鲜的f/2培养液中,适应1 d后,将杀藻活性物质按照20 μg/mL的终浓度加入到藻液中,记录藻细胞的生长状况,对照为加入等体积的DMSO。
2 结果和分析 2.1 杀藻活性物质的杀藻效果杀藻活性物质的杀藻效果在一定浓度范围内,一般是与其浓度呈正相关的。由图 2可知,杀藻活性物质在短时间内就表现出了对塔玛亚历山大藻的杀藻效果,在处理4 h后,10 μg/mL的杀藻率约为14.6%,20 μg/mL的杀藻率为6.89%;而随着处理时间的延长,杀藻活性逐渐增强,但是低浓度的处理组在经过24 h后,杀藻效果明显低于 20 μg/mL的浓度。当藻细胞经过24 h的处理后,20 μg/mL处理组的杀藻率达到84.1%,而10 μg/mL处理组的杀藻率仅为58.9%。这也说明,该杀藻活性物质的杀藻效果具有一定的浓度依赖性,故为了获得更好的杀藻效果,此后的试验利用20 μg/mL的浓度展开。

|
| 图 2. 杀藻化合物的杀藻效果 Figure 2. Algicidal effect of algicidal compound on A. tamarense. |
叶绿素a是藻细胞内部重要的光合色素,与藻细胞的生物量密切相关,并且能反映杀藻物质对藻细胞生长状况的影响。由图 3可知,对照组塔玛亚历山大藻的叶绿素a含量在24 h内变化不大,处理组的叶绿素a含量在短时间内即12 h内,无论是10 μg/mL还是20 μg/mL的浓度,都无显著的下降。当处理时间达到24 h时,两个处理组的叶绿素a含量均低于对照组,其中20 μg/mL的处理组叶绿素a含量是对照的58.5%,且叶绿素a含量要低于低浓度处理组,表明杀藻物质在24 h时,对塔玛亚历山大藻叶绿素a含量具有较大影响。
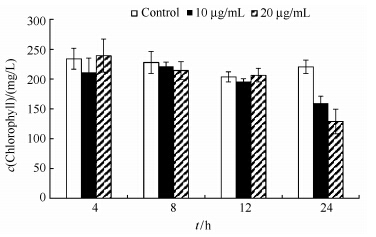
|
| 图 3. 杀藻化合物对叶绿素a含量的影响 Figure 3. Inhibitory effect of algicidal compound on chlorophyll a content. |
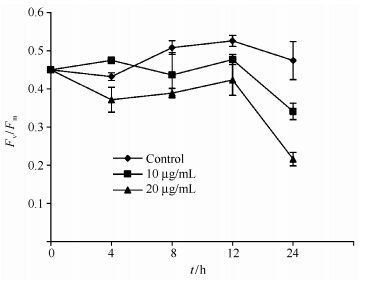
最大光化学效率(Fv/Fm)能够准确反映藻细胞光系统II(PSII)光合作用的状态,当藻细胞处在正常环境时,Fv/Fm的值不会有显著的变化;而当藻细胞的光合作用受到胁迫时,叶绿体的最大光化学效率会下降。因此,利用叶绿素荧光动力学可以快速、灵敏、无损伤地探测逆境对藻类光合作用的影响[23]。由图 4可知,对照组塔玛亚历山大藻的Fv/Fm值相对稳定,保持在正常范围内。而不同浓度的杀藻物质处理后,Fv/Fm值随着处理时间的延长,有着不同程度的下降,而且高浓度处理下降的更加明显。利用20 μg/mL的杀藻物质处理藻细胞,24 h后 Fv/Fm的值比对照降低了约55.5%,而10 μg/mL处理组则仅比对照的值低了28.1%。这些结果表明,杀藻物质对塔玛亚历山大藻的细胞最大光化学效率有显著影响,可降低PSII系统的活性,抑制藻类的光合系统,从而导致光合效率的降低。
|
| 图 4. 杀藻物质对藻细胞最大光化学效率的影响 Figure 4. Photosynthetic efficiency (Fv/Fm) of A. tamarense cells treated by algicidal compound. |
正常细胞内部的ROS在细胞信号传导方面有着重要的作用,而ROS同时也会对蛋白质、脂质、核酸等造成不可逆的损伤,并引起细胞的死亡[24]。在藻类细胞中,ROS的一个重要来源是在光合作用过程中,因此光合作用受到影响时,会导致大量ROS的产生。由图 5-A得知,在利用 20 μg/mL的杀藻物质处理藻细胞0.5 h后,藻细胞的ROS水平即出现第一次增高,荧光强度达到975,显著高于对照。而后,随着处理的时间延长,ROS的水平出现下降,这是由于清除ROS的酶活增强导致的。当处理时间达到6 h时,细胞内ROS的水平再次升高,而这个过程会加剧细胞内部的氧化损伤。

|
| 图 5. 杀藻物质对藻细胞活性氧水平(A)及丙二醛(MDA)含量的影响 Figure 5. Effects of algicidal compound on ROS (A) and MDA(B)contents of A. tamarense. |
丙二醛(MDA)是细胞内部脂质过氧化的产物,它能够准确的反映细胞内部脂质氧化损伤的状态[25],因此可以用MDA的含量来评估细胞内部受ROS氧化损伤的情况。由图 5-B可知,利用 20 μg/mL的杀藻物质处理4 h后,细胞内部MDA水平 的增加并不显著,而当处理8 h后,细胞内部MDA的含量是对照的1.63倍。随着处理时间的延长,MDA的含量并没有进一步增加,推测与细胞内部增强的酶活有关。MDA含量的增加表明细胞内部的生物大分子如脂质受到了氧化损伤,功能受到影响。
细胞内部的抗氧化酶系统包括SOD和CAT等,经过这些酶的催化,细胞内部的ROS可以转化成对细胞本身无毒害作用的水和氧气。因此,正常细胞所拥有的抗氧化酶系可以通过清除ROS来抵御ROS对细胞的伤害。
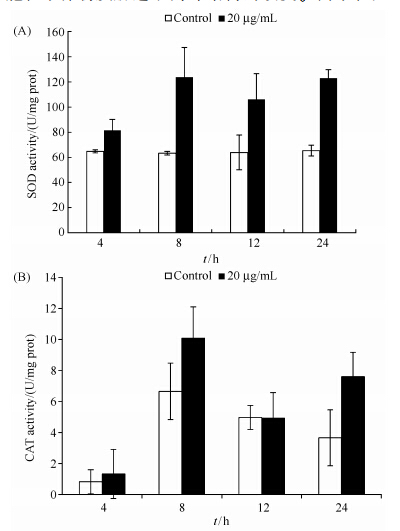
由图 6-A可知,经过20 μg/mL杀藻物质处理4 h后,SOD活力即开始升高,而当处理8 h后,细胞内SOD活力达到最大值,此时SOD的活力是对照的1.96倍。随着处理时间的延长,细胞内部的SOD活力依然维持在较高的水平,而持续对细胞内部的ROS起着清除作用。CAT是细胞内部另外一种可以清除ROS的重要酶。由图 6-B可知,CAT酶活的变化与SOD的活性变化有着相似的趋势,在处理后第8 h达到最大值,此时CAT的酶活是对照的1.51倍。随后CAT活力下降,但是在处理后24 h,CAT活力再次增高。SOD与CAT活力的增高有助于清除细胞内部的ROS,但当细胞内的ROS超出了抗氧化酶的清除能力时,依然会导致细胞死亡。
|
| 图 6. 杀藻物质对藻细胞内部SOD(A)和CAT(B)酶活力的影响 Figure 6. Effects of algicidal compound on SOD (A) and CAT (B) contents of A. tamarense. |
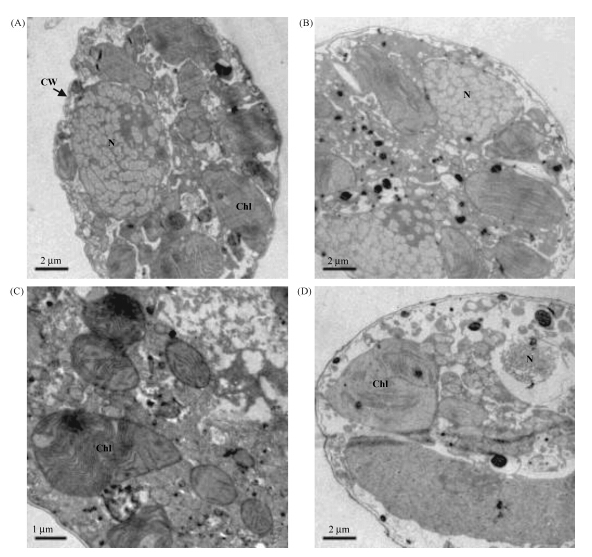
利用透射电镜(TEM)可以直观地观察到藻细胞在杀藻物质胁迫下内部结构的改变。由于在 处理4 h时杀藻率并不高,故在利用TEM观察细胞内部结构改变时从杀藻率升高的起始点8 h开始。图 7显示了藻细胞在杀藻物质胁迫下内部结构变化的过程,图 7-A是对照组细胞,图 7中的B、C、D分别是8、12、24 h处理的细胞。从图中得知,对照组细胞内部结构致密,细胞核形态正常,细胞结构完整,且叶绿体内部结构规则完整(图 7-A);经过8 h处理后,细胞内部开始出现空泡,结构变得疏松,细胞核浓缩变小(图 7-B);处理12 h后,细胞内部结构进一步疏松,且叶绿体内部结构变得紊乱,使得叶绿体的功能逐渐丧失(图 7-C);处理24 h后,细胞核结构已经严重浓缩并降解,且细胞内部空泡化明显,部分细胞器解体。因此,在处理24 h后,细胞内部结构已经遭到严重破坏,使得藻细胞逐渐裂解死亡。
|
| 图 7. 杀藻物质对藻细胞亚显微结构的影响 Figure 7. Ultrastructure of A. tamarense after exposure to algicidal compound with the concentration of 20 μg/mL. A: Control cell; B: 8 h treatment; C: 12 h treatment; D: 24 h treatment. N: Nucleus,Chl: Chloroplast,CW: Cell wall. |
为了确定杀藻化合物(二异丁氧基苯基)胺的杀藻种属特异性,选取了来自5个门类22种藻类。杀藻种属特异性的确定可以为该杀藻化合物的生物安全性提供一定的支持。由表 1可知,在供试的22株藻中,杀藻化合物只对硅藻门中的扁面角毛藻 Chaetoceros comperssus和假微型海链藻 Thalassiosira pseudonana 以及甲藻门中的链状亚历山大藻 Alexandrium catenella DH01(ACDH01)和塔玛亚历山大藻A. tamarense 2个门类的4个藻株具有一定的杀藻效果,而对绿藻门、黄藻门和金藻门的藻株没有杀藻效果。因此,杀藻化合物(二异丁氧基苯基)胺的杀藻范围较窄,可做为一种潜在的杀藻化合物用于赤潮藻类的控制。
| Algae species | Algicidal activity |
| +:Algcidal compound showed algicidal effect on this algae species; -:Algcidal compound did not showe algicidal effect on this algae species. | |
| Platymonas helgolandica | - |
| Prasinophyceae | - |
| Dunaliella salina | - |
| Chlorella autotrophica | - |
| Chlorella | - |
| Chaetoceros comperssus | + |
| Pmphiprora alata | - |
| Thalassiosira weissflogii | - |
| Thalassiosira pseudonana | + |
| Phaeodactylum tricornutum | - |
| Asterionella japonica | - |
| Alexandrium mimutum TW01 | - |
| Prorocentrum donghaiense | - |
| Alexandrium catenella DH01 | + |
| Scrippsiella trochoidea XM01 | - |
| Alexandrium tamarense | + |
| Chattonella marina | - |
| Heterosigma akashiwo | - |
| Phaeocystis globosa | - |
| Isochrysis galbana | - |
| Nannochloropsis | - |
| Dicrateria inornata | - |
杀藻化合物(二异丁氧基苯基)胺是我们从杀藻细菌BS01中分离获得,目前还没有该化合物杀藻的报道,但已有许多其它杀藻化合物引起藻类死亡的报道。在正常的细胞中,细胞内部ROS的产生和清除处于一个平衡的状态。ROS的形成是机体许多反应过程中不可避免的副产物。在植物细胞中,ROS的来源主要是叶绿体和线粒体,而在藻细胞中ROS的主要来源是叶绿体。当ROS产生过多或抗氧化防御能力减弱,ROS对组织的损伤就会发生,例如脂质过氧化,DNA降解,从而使得细胞正常功能丧失或病变。体内的抗氧化酶系主要包括氧化酶如超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和过氧化物酶(POD)等,这些酶在细胞内负责清除活性氧,平衡机体的正常生理代谢功能。其中,SOD可以催化细胞内氧自由基发生歧化反应,生成H2O2和O2;CAT催化H2O2生成H2O和O2[26, 27]。
研究表明,杀藻化合物(二异丁氧基苯基)胺作用于塔玛亚历山大藻后,藻细胞的叶绿素a含量下降并且伴随着藻细胞最大光化学效率的降低,这表明藻细胞光合作用的过程受到了抑制。在藻细胞中光合作用受到抑制后,极易导致大量ROS的产生,我们检测到在杀藻化合物处理0.5 h后,藻细胞内部的ROS水平即明显上升。MDA作为脂质过氧化程度的指标,其在细胞内的浓度可反映细胞所受氧化损伤的程度。结果表明,在处理4 h后MDA的含量即上升,到8 h达到峰值,故此时藻细胞内部处于严重的氧化损伤状态。在细胞内部ROS的刺激下,抗氧化酶系SOD和CAT的活力都表现出不同程度的增加,但是增加的酶活并未能有效的清除细胞内部的ROS,使得藻细胞受到了持续的氧化损伤。透射电镜的观察结果也进一步证实细胞内部叶绿体等结构的破坏导致细胞的供能遭到抑制,这也最终导致了细胞的死亡。
以上结果表明,杀藻化合物(二异丁氧基苯基)胺能够通过引起藻细胞内部氧化损伤的方式引起藻细胞的死亡,同时该化合物仅针对少数几种藻类具有杀藻效果,因此该杀藻化合物在赤潮的治理方面具有较好的应用前景。
| [1] | Anderson DM, Cembella AD, Hallegraeff GM. Progress in understanding harmful algal blooms: paradigm shifts and new technologies for research, monitoring, and management. Annual Review Marine Science, 2012, 4: 143-176. |
| [2] | Sekula-Wood E, Schnetzer A, Benitez-Nelson CR, Anderson C, Berelson WM, Brzezinski MA, Burns JM, Caron DA, Cetinic I, Ferry JL. Rapid downward transport of the neurotoxin domoic acid in coastal waters. Nature Geoscience, 2009, 2(4): 272-275. |
| [3] | Zheng T, Lv J, Zhou Y, Su J, Yang X, Zhang J, Tian Y, Xiong X, Zhang J, Cai M. Advance in study on microbial control of harmful algae blooms-exploitation and research on marine algicidal bacteria. Journal of Xiamen University (Natural Science), 2011, 50(2):445-454.(in Chinese) 郑天凌, 吕静琳, 周艳艳, 苏建强, 杨小茹, 张金龙, 田蕴, 熊小京, 章军, 蔡明刚. 海洋有害赤潮调控功能菌的发现与研究. 厦门大学学报: 自然科学版, 2011, 50(2): 445-454. |
| [4] | Li D, An X, Fu L, Lin Y, Zheng T. Effects of algicidal bacterium BS03 ( Microbulbifer sp.) on the growth and antioxidant systems of Alexandrium tamarense. Acta Microbiologica Sinica, 2013, 33(1):44-52. (in Chinese) 李东, 安新丽, 傅丽君, 林毅, 郑天凌. 溶藻细菌 BS03 分离, 鉴定及其对塔玛亚历山大藻生长的影响. 环境科学学报, 2013, 33(1): 44-52. |
| [5] | Qi Y, Qian F. Taxonomic studies on red tide causative dinoflagellates in dapeng bay, south china sea. Oceanologia et Limnologia Sinica, 1994, 25(2):206-210. (in Chinese) 齐雨藻, 钱锋. 大鹏湾几种赤潮甲藻的分类学研究. 海洋与湖沼, 1994, 25(2): 206-210. |
| [6] | Li Y, Zhu H, Zhang H, Chen Z, Tian Y, Xu H, Zheng T, Zheng W. Toxicity of algicidal extracts from Mangrovimonas yunxiaonensis strain LY01 on a HAB causing Alexandrium tamarense. Journal of Hazardous Materials, 2014, 278: 372-381. |
| [7] | Sakata T, Yoshikawa T, Nishitarumizu S. Algicidal activity and identification of an algicidal substance produced by marine Pseudomonas sp. C55a-2. Fisheries Science, 2011, 77(3): 397-402. |
| [8] | Zhang H, Lv J, Peng Y, Zhang S, An X, Xu H, Zhang J, Tian Y, Zheng W, Zheng T. Cell death in a harmful algal bloom causing species Alexandrium tamarense upon an algicidal bacterium induction. Applied Microbiology and Biotechnology, 2014, 98(18): 7949-7958. |
| [9] | Wang X, Zhou Y, Zheng T. Recent advances in marine bacterial ecology-A review. Acta Microbiologica Sinica, 2010, 50(3): 291-297. (in Chinese) 王新, 周艳艳, 郑天凌. 海洋细菌生态学的若干前沿课题及其研究新进展. 微生物学报, 2010, 50(3):291-297. |
| [10] | Zhao Y, Liu Y. Possible microbial control on the adverse impacts of algae-current information about the relationship between algae and microbes. Acta Hydrobiologica Sinica, 1996, 20(2): 173-181. (in Chinese) 赵以军, 刘永定. 有害藻类及其微生物防治的基础—藻菌关系的研究动态. 水生生物学报, 1996, 20(2): 173-181. |
| [11] | Lovejoy C, Bowman JP, Hallegraeff GM. Algicidal effects of a novel marine Pseudoalteromonas isolate (class Proteobacteria, gamma subdivision) on harmful algal bloom species of the genera Chattonella, Gymnodinium, and Heterosigma. Applied and Environmental Microbiology, 1998, 64(8): 2806. |
| [12] | Su J, Yang X, Zhou Y, Zheng T. Marine bacteria antagonistic to the harmful algal bloom species Alexandrium tamarense (Dinophyceae). Biological Control, 2011, 56(2): 132-138. |
| [13] | Yoshinaga I, Kawai T, Ishida Y. Analysis of algicidal ranges of the bacteria killing the marine dinoflagellate Gymnodinium mikimotoi isolated from Tanabe Bay, Wakayama Pref., Japan. Fisheries Science: FS, 1997, 63(1): 94-98. |
| [14] | Lee S, Kato J, Takiguchi N, Kuroda A, Ikeda T, Mitsutani A, Ohtake H. Involvement of an extracellular protease in algicidal activity of the marine bacterium Pseudoalteromonas sp. strain A28. Applied and Environmental Microbiology, 2000, 66(10): 4334. |
| [15] | Paul C, Pohnert G. Interactions of the algicidal bacterium kordia algicida with diatoms: regulated protease excretion for specific algal lysis. PLoS One, 2011, 6(6): e21032. |
| [16] | Evens T, Park S-C, Lee J-K, Kim SW, Park Y. Selective Algicidal action of peptides against harmful algal bloom species. PLoS One, 2011, 6(10): e26733. |
| [17] | Yoshikawa K, Adachi K, Miyuki N, Tamaki S, Harada K, Mochida K, Sano H. β-cyanoalanine production by marine bacteria on cyanide-free medium and its specific inhibitory activity toward cyanobacteria. Applied and Environmental Microbiology, 2000, 66(2): 718. |
| [18] | Wang X, Gong L, Liang S, Han X, Zhu C, Li Y. Algicidal activity of rhamnolipid biosurfactants produced by Pseudomonas aeruginosa. Harmful Algae, 2005, 4(2): 433-443. |
| [19] | Zheng X, Zhang B, Zhang J, Huang L, Lin J, Li X, Zhou Y, Wang H, Yang X, Su J. A marine algicidal actinomycete and its active substance against the harmful algal bloom species Phaeocystis globosa. Applied Microbiology and Biotechnology, 2012, 97(20): 9207-9215. |
| [20] | Bai SJ, Huang LP, Su JQ, Tian Y, Zheng TL. Algicidal effects of a novel marine actinomycete on the toxic dinoflagellate Alexandrium tamarense. Current Microbiology, 2011, 62(6): 1774-1781. |
| [21] | Zhang H, An X, Zhou Y, Zhang B, Zhang S, Li D, Chen Z, Li Y, Bai S, Lv J, Zheng W, Tian Y, Zheng T. Effect of oxidative stress induced by Brevibacterium sp. BS01 on a HAB causing species-Alexandrium tamarense. PLoS One, 2013, 8(5): e63018. |
| [22] | Yin L, Huang J, Huang W, Li D, Wang G, Liu Y. Microcystin-RR-induced accumulation of reactive oxygen species and alteration of antioxidant systems in tobacco BY-2 cells. Toxicon, 2005, 46(5): 507-512. |
| [23] | Drábková M, Admiraal W, Marálek B. Combined exposure to hydrogen peroxide and light selective effects on Cyanobacteria, Green Algae, and Diatoms. Environmental Science & Technology, 2007, 41(1): 309-314. |
| [24] | Apel K, Hirt H. Reactive oxygen species: metabolism, oxidative stress, and signal transduction. Annual Review Plant Biology, 2004, 55: 373-399. |
| [25] | Qian H, Chen W, Sheng GD, Xu X, Liu W, Fu Z. Effects of glufosinate on antioxidant enzymes, subcellular structure, and gene expression in the unicellular green alga Chlorella vulgaris. Aquatic Toxicology, 2008, 88(4): 301-307. |
| [26] | Valentine JS, Wertz DL, Lyons TJ, Liou LL, Goto JJ, Gralla EB. The dark side of dioxygen biochemistry. Current Opinion in Chemical Biology, 1998, 2(2): 253-262. |
| [27] | Zamocky M, Furtmüller PG, Obinger C. Evolution of catalases from bacteria to humans. Antioxidants & Redox Signaling, 2008, 10(9): 1527-1548. |
 2015, Vol. 55
2015, Vol. 55




