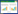中国科学院微生物研究所,中国微生物学会,中国菌物学会
文章信息
- 刘子凌 , 彭杰丽 , 李友国 . 2016
- Liu Ziling, Peng Jieli, Li Youguo . 2016
- 华癸根瘤菌7653R中一个RND型药物外排泵的功能表型及调控鉴定
- Characterization of phenotype and expression regulation of an RND-type multidrug efflux pump in Mesorhizobium huakuii 7653R
- 微生物学报, 2016, 56(12): 1876-1882
- Acta Microbiologica Sinica, 2016, 56(12): 1876-1882
-
文章历史
- 收稿日期:2016-03-13
- 修回日期:2016-04-08
- 网络出版日期:2016-04-18
豆科植物与根瘤菌之间的相互作用是一个非常复杂的过程,涉及到大量的信号物质交换,其中,当植物氮饥渴时释放的类黄酮物质和根瘤菌合成的结瘤因子对形成共生关系起到关键性的作用[1]。类黄酮在植物中有多种功能,调节生长素运输、花粉育种和抵御病原菌入侵等[2-3]。
细菌多重耐药性的机制是通过多药外排泵(multidrug resistance efflux pumps)将药物排出体外[4],外排泵有5个家族,分别是ABC转运家族(ATP-binding cassette),主要易化子超家族(major facilitator superfamily),防御结瘤分裂家族(resistance nodulation cell division,RND),小型多药防御家族(small multidrug resistance)以及多药有毒化合物排出家族(multidrug and toxic compound extrusion)[5]。RND泵是一个三组分系统,外排泵定位在内膜上,一个属于外膜因子(outer membrane factor)家族的外膜通道,和一个属于膜融合蛋白(membrane fusion protein)家族的周质接合蛋白[6-8]。
植物病原菌必须把植物分泌的抑菌物质排出体外,才能成功的入侵植物,破坏欧文氏菌(Erwinia amylovora)和丁香假单胞菌(Pseudomonas syringae)的RND外排泵,可以减少对宿主植物的损害[9-10]。外排泵促进病原性的作用比较清楚,在与植物共生的根瘤菌中外排泵的存在也比较普遍。在日本大豆慢生根瘤菌(Bradyrhizobium japonicum)中破坏了RND家族的RdeAB外排泵会影响固氮能力和药物敏感性[11]。在苜蓿根瘤菌(Sinorhizobium meliloti 1021)中当RND泵SmeAB被破坏后竞争结瘤能力会受到影响[12]。
喹诺酮是一种广谱抗菌剂,第一代喹诺酮是萘啶酸[13]。在肠杆菌科中很多基因编码药物转运蛋白,但只有AcrAB/TolC超表达显示出外排喹诺酮[14]。这个射流泵属于RND超家族,由3部分组成,acrA和acrB共转录于同一个操纵子,AcrA蛋白是一个膜融和蛋白,AcrB是一个锚定在内膜的转运蛋白。第3个部件TolC是一个外膜蛋白[15]。acrAB被4个转录因子调控,Rob、MarA和SoxS是转录激活因子,作用于acrAB操纵子的上游;而acrR是该射流泵的局部抑制因子,定位于acrA基因上游[16-17]。
本课题组前期工作,通过RNA-seq和Microarry差异表达基因情况及共生固氮子网hub基因的类别分析,挑选出感兴趣的2个基因MCHK_0866、MCHK_0867进行研究,构建了这2个基因同时缺失的突变菌株DoublemutKm,该突变株接种宿主植物后会形成白色无效根瘤[18]。这2个基因所编码的蛋白质共同组成一个属于RND家族的膜运输结构。本研究通过对该外排泵基因结构的分析,缺失该泵后对自生生长的影响及药物敏感性的变化来研究该外排泵的功能表型,同时初步鉴定该外排泵所受的调控作用。
1 材料和方法 1.1 菌株华癸中慢生根瘤菌7653R为华中农业大学农业微生物学国家重点实验室生物固氮室所保存,大肠杆菌DH5α购自TaKaRa公司,组氨酸尿嘧啶合成缺陷菌株USO购自Addgene。双基因突变菌株Doublemutkm由华中农业大学博士研究生彭杰丽构建。
1.2 主要试剂及质粒Ex-Taq酶、克隆基因载体pMD18-T购自TaKaRa公司。转录因子表达载体pB1H2W5和报告载体pH3U3购自Addgene。Gel Extraction Kit购自OMEGA公司。
1.3 敏感性实验将抑菌药物配置成母液,无菌操作将倍比稀释后不同浓度的抑菌药物溶液分别加到灭菌的96孔聚苯乙烯板中,第一至十一孔加药液,第十二孔不加药液的培养基作为阳性生长对照,密封后-20 ℃保存备用。待试菌株培养至对数期,经TY1∶1000稀释后,往每个孔加入100 μL,密封后孵育。结果判断,以在小孔内完全抑制细菌生长的最低药物浓度为最小抑菌浓度(MIC),当阳性对照孔内细菌明显生长实验才有意义。
1.4 根瘤菌总RNA的抽提菌株活化培养至对数期,接入三角瓶中TY培养基28 ℃振荡培养48 h。1.5 mL离心管收集菌体,DEPC水洗。每管加入1 mL Trizol,待其溶解澄清后4 ℃、12000 r/min离心10 min。取上清液转入另一离心管,加入0.2 mL氯仿,充分混匀后4 ℃、12000 r/min离心10 min。取上清加入等体积异丙醇,冰上放置10 min后4 ℃、12000 r/min离心10 min。倒去上清,加入75%乙醇4 ℃、12000 r/min离心10 min。倒去上清,空气中干燥至乙醇挥发干净,加入DEPC水溶解。加入DNaseⅠ消解DNA,-80 ℃保存备用。
1.5 荧光定量PCRRNA反转录为cDNA后,调节至适宜浓度,进行荧光定量PCR检测。信号检测使用SYBR GREEN购自Roche公司,分析相对表达量采用ΔΔCt方法,使用管家基因rnpB作为对照。
1.6 细菌单杂交本工作采用的细菌单杂交系统由3个元件构成:转录因子表达载体(pB1H2W5)、报告载体(pH3U3)、筛选菌株USO均购自Addgene。筛选培养基配方及具体实验操作方法参考文献[19]中报道。
2 结果和分析 2.1 目的基因结构分析为了了解MCHK_0866、MCHK_0867两个基因的功能,我们首先调查了他们的基因结构如图 1。同时进行功能预测如表 1,发现MCHK_0866编码384个氨基酸的膜融和蛋白,MCHK_0867编码1058个氨基酸的运输蛋白,这2个蛋白组装在一起构成RND运输系统的核心结构。同时在这2个基因下游存在一个类似TetR家族的转录调控因子MCHK_0869。
|
| 图 1. MCHK_0866和MCHK_0867区域基因结构 Figure 1. Genetic organization of the MCHK_0866 and MCHK_0867 region. |
| Gene id | Size/aa | Putative function |
| MCHK_0866 | 384 | Efflux transporter, RND family, MFP subunit |
| MCHK_0867 | 1058 | RND transporter |
| MCHK_0869 | 175 | Bacterial regulatory, tetR family protein |
2.2 缺失MCHK_0866、MCHK_0867对根瘤菌自身生长的影响
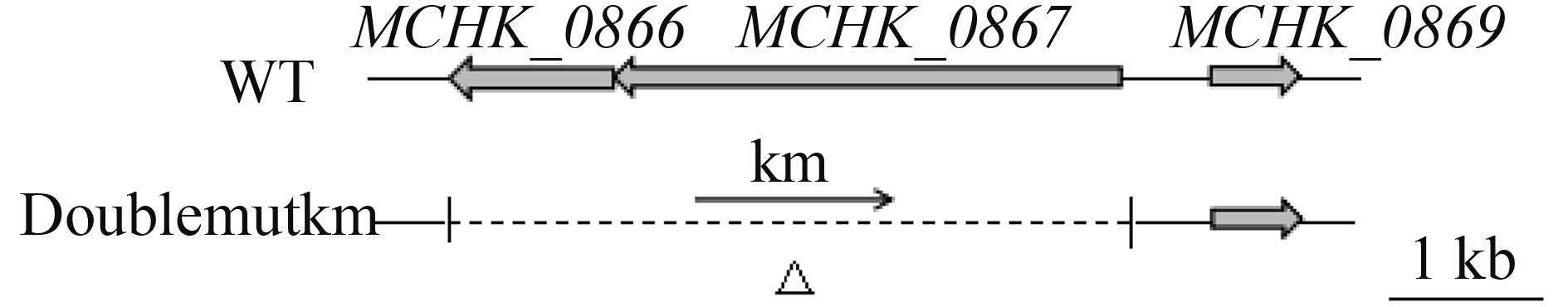
分别将7653R和Doublemutkm活化并培养至对数期后,按1%接种量接种于5 mL TY液体培养基,置于28 ℃摇床振荡培养,每隔6 h取样测OD600。如图 2,系列1和系列2分别是7653R和Doublemutkm,测定结果可以看出在自身条件下,细菌生长周期的稳定期Doublemutkm相对7653R OD600较低。
|
| 图 2. 野生型7653R和突变菌株Doublemutkm在TY培养基上的生长曲线 Figure 2. Growth curve of wild-type (circles) and Doublemukm (squares) strains in TY medium. |
2.3 抑菌物质的敏感性
在其它根瘤菌中,破坏多组分射流系统后会影响对毒素的敏感性。我们选取了几类抑菌性物质按梯度浓度加入96孔聚苯乙烯板中,将7653R与Doublemutkm培养至对数期,稀释后加入孔中,密封后孵育。培养2 d后观察结果,以在小孔内完全抑制细菌的生长的最低药物浓度为MIC,当阳性对照孔内细菌明显生长实验才有意义。
如表 2所示,Doublemutkm对萘啶酸的敏感性增加了但是对四环素和SDS的敏感性降低了。
| Antimicrobial | MIC/(μg/mL) | |
| 7653R (WT) | Doublemutkm | |
| Gentamicin | 16 | 16 |
| Tetracycline | 2 | 32 |
| Tobramycin | 4 | 4 |
| Nalidixic acid | 128 | 16 |
| Deoxycholic | 3200 | 3200 |
| Zinc sulfate | 400 | 400 |
| Silver nitrate | 6.25 | 6.25 |
| SDS | 400 | 6400 |
2.4 敏感性药物对基因表达的影响
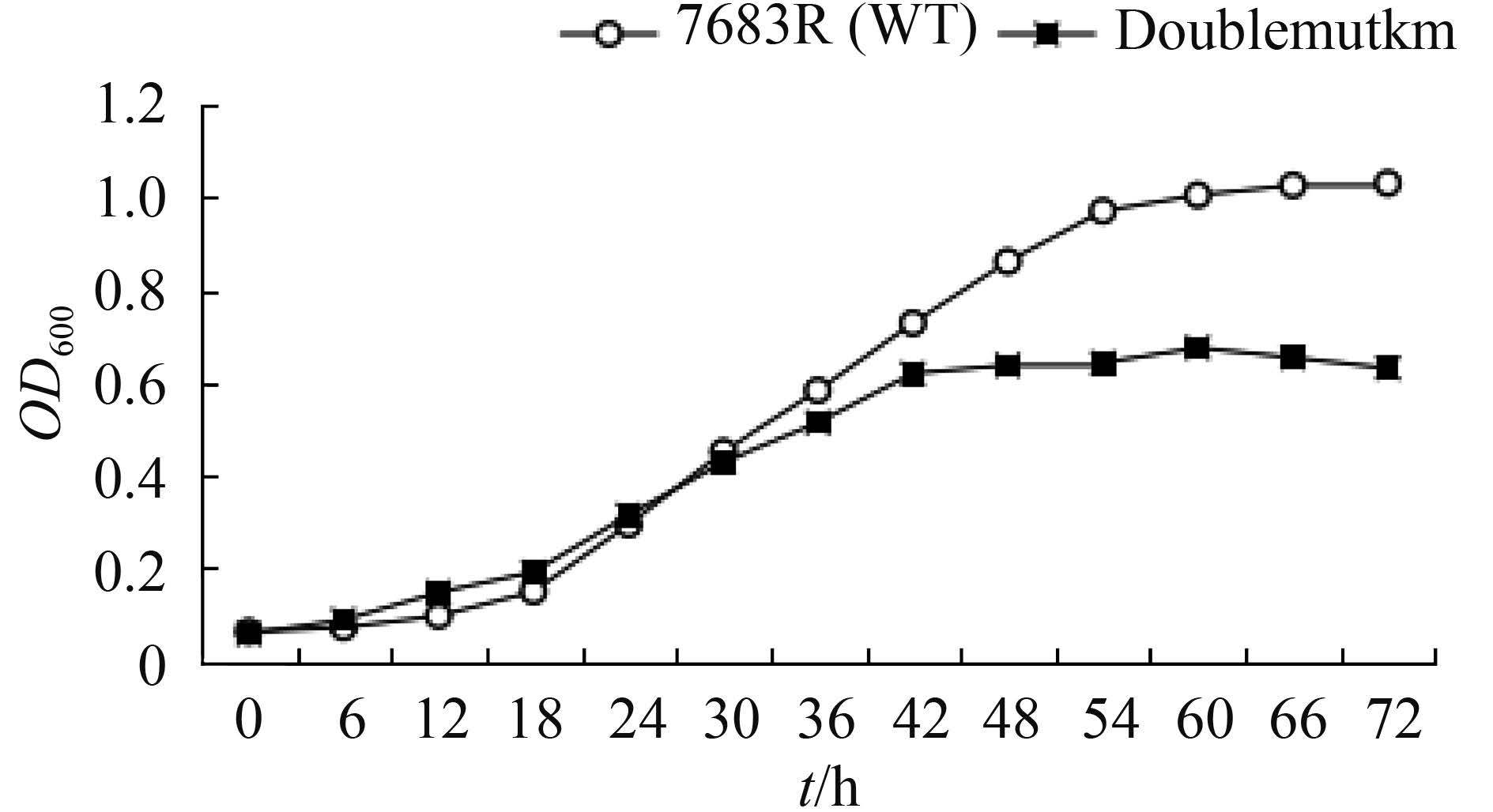
由于Doublemutkm对萘啶酸、四环素和SDS的敏感性相对野生型有变化,我们用这几个物质处理7653R后检测MCHK_0866、MCHK_0867表达量的差异,设计荧光定量PCR实验,同一种药物用了2种不同的浓度处理7653R。
测定结果如图 3,用萘啶酸处理后2个基因都明显上调表达,四环素和SDS处理后没有明显差异。
|
| 图 3. 7653R经萘啶酸、四环素和十二烷基磺酸钠处理后MCHK_0866和MCHK_0867的相对表达量 Figure 3. Relative transcript level of MCHK_0866 and MCHK_0867 in 7653R after treatment with nalidix acid, tetracycline and SDS. WT: wild-type 7653R. N32: nalidixic acid 32 μg/mL. N64: nalidixic acid 64 μg/mL. T0.5: tetracycline 0.5 μg/mL. T1: tetracycline 1 μg/mL. S50: SDS 50 μg/mL. S100: SDS 100 μg/mL. Error bars: standard deviations from three independent experiments. Statistical significance was analyzed by SPSS. *: P<0.05; **: P<0.01. NS: not significant. |
2.5 MCHK_0866、MCHK_0867转录调控的初步检测
在基因组上位于MCHK_0866和MCHK_0867下游有一个TetR家族的转录因子MCHK_0869,通过MCHK_0866和MCHK_0867同源比对,发现在其它根瘤菌中也有同样的情况。所以我们设计了细菌单杂交实验来鉴定MCHK_0869能不能与该射流系统的启动子区域相互作用。
该单杂交系统正对照设置为:pB1H2W5-zif268和pH3U3-zif268,负对照设置为:pB1H2W5-mutodd和pH3U3-zif268。因为MCHK_0867和MCHK_0869转录方向相反,中间间隔500 bp左右,所以我们选取MCHK_0867和MCHK_0869起始位点中间的片段克隆于报告载体(pH3U3-p),MCHK_0869克隆于表达载体(pB1H2W5-69),为实验组。自激活设置为:pBIH2W5-69和pH3U3;pB1H2W5和pH3U3-p。NSSM为非筛选平板,DSSM为筛选平板,如果转录因子和启动子区域相互作用就可以激活下游报告基因表达,就能在DSSM选择培养基上生长。
如图 4,NSSM平板点板验证结果和DSSM平板点板验证结果,由上到下分别为正对照、负对照、实验组和自激活。从图中可看出,实验组在DSSM选择培养基上生长,因而判断MCHK_0869的表达产物可以结合在MCHK_0867的启动子区域。

|
| 图 4. 非筛选平板和筛选平板点板验证 Figure 4. Validation on nonselective and dual selective screening medium, MCHK_0869 and promoter (69-p), self-activation detection (SA1, SA2). |
3 讨论
细菌多药物转运子是细胞自我保护的关键因素,这种转运子主要的特点就是它能运输较大范围的药物和有毒物质。在病原菌中多药物转运子研究的较多,特别是属于RND家族的AcrAB-TolC系统,其结构和作用机制以及基因的调控表达都研究的非常多,为其它外排泵的研究起到了指导性作用。根瘤菌入侵宿主和病原菌入侵宿主有一定的相似性,但是在根瘤菌中外排泵研究的较少。Takeshima等在日本大豆根瘤菌中发现一个经染料木黄酮处理后大量表达的外排泵,失活该外排泵后导致根瘤重量和固氮酶活减少,但是增加了每株植物的结瘤数,同时在外排泵下游有一个TetR家族转录因子。作者最后表示,该外排泵在共生过程的早期阶段,在平衡染料木黄酮既诱导nod基因的表达又是有毒物质的双重功能时,起着关键性作用[20]。
MCHK_0866、MCHK_0867是本研究室前期转录组分析,在共生时期表达量较高的基因,同时突变这2个基因后会严重影响固氮酶活。本研究通过对这2个基因的功能预测发现它们的表达产物共同组成一个属于RND家族的外排泵,MCHK_0867表达出一个外排转运蛋白,MCHK_0866表达出一个膜融合蛋白,这2个蛋白构成外排泵的主要部分。同时在这2个基因下游有一个属于TetR家族的转录因子基因MCHK_0869。缺失该外排泵的菌株Doublemutkm测定其生长曲线,发现相对野生型菌株,在经过稳定期和对数期后,OD600值明显降低,可能是外排泵被破坏后,某些有害的代谢产物不能顺利排出体外导致细菌生长受到影响。通过药物敏感性实验,从结果看出Doublemutkm对萘啶酸、四环素和SDS的敏感性相对野生型发生了变化。通过RT-PCR进一步研究这些物质对基因表达量的影响,发现经萘啶酸处理后,MCHK_0866和MCHK_0867都明显上调表达,可能该外排泵与萘啶酸的运输有关系[21]。通过细菌单杂交实验可以初步判断MCHK_0869的表达产物会作用于MCHK_0867的启动子区域,TetR家族转录因子作为一种负调控因子抑制外排泵的表达多次被报道[22]。
外排泵作为细菌自我保护系统的重要组成,在细菌面对外界不利环境的情况下发挥着重要作用,但根瘤菌外排泵如何影响共生关系的机理还需要进一步研究,特别是宿主植物所分泌的对诱导根瘤菌入侵有利、同时具有抑菌能力的信号物质有待进一步提取和分析鉴定。此外,在今后的研究中还需要更精确的实验来鉴定外排泵的转录调控作用,不仅是局部的阻遏因子作用,还有全局的转录激活作用。
| [1] | JanczarekM, RachwałK, MarzecA, GrządzielJ, Palusińska-SzyszM. Signal molecules and cell-surface components involved in early stages of the legume-rhizobium interactions. Applied Soil Ecology , 2015, 85 : 94–113. |
| [2] | Subramanian S, Stacey G, Yu O. Distinct,crucial roles of flavonoids during legume nodulation. Trends in Plant Science , 2007, 12 (7) : 282–285 DOI:10.1016/j.tplants.2007.06.006 . |
| [3] | Cooper JE. Early interactions between legumes and rhizobia:disclosing complexity in a molecular dialogue. Journal of Applied Microbiology , 2007, 103 (5) : 1355–1365 DOI:10.1111/j.1365-2672.2007.03366.x . |
| [4] | Alekshun MN, Levy SB. Molecular mechanisms of antibacterial multidrug resistance. Cell , 2007, 128 (6) : 1037–1050 DOI:10.1016/j.cell.2007.03.004 . |
| [5] | Saier MH Jr, Paulsen IT. Phylogeny of multidrug transporters. Seminars in Cell & Developmental Biology , 2001, 12 (3) : 205–213 . |
| [6] | Nikaido H.Structure and mechanism of RND-type multidrug efflux pumps//Toone EJ.Advances in enzymology and related areas of molecular biology.Hoboken,NJ:John Wiley & Sons Inc,2011,77:1-60. |
| [7] | Paulsen IT, Park JH, Choi PS, Saier MH Jr. A family of gram-negative bacterial outer membrane factors that function in the export of proteins,carbohydrates,drugs and heavy metals from gram-negative bacteria. FEMS Microbiology Letters , 1997, 156 (1) : 1–8 DOI:10.1016/S0378-1097(97)00379-0 . |
| [8] | Dinh T, Paulsen IT, Saier MH Jr. A family of extracytoplasmic proteins that allow transport of large molecules across the outer membranes of gram-negative bacteria. Journal of Bacteriology , 1994, 176 (13) : 3825–3831 DOI:10.1128/jb.176.13.3825-3831.1994 . |
| [9] | Burse A, Weingart H, Ullrich MS. The phytoalexin-inducible multidrug efflux pump AcrAB contributes to virulence in the fire blight pathogen,Erwinia amylovora. Molecular Plant-Microbe Interactions , 2004, 17 (1) : 43–54 DOI:10.1094/MPMI.2004.17.1.43 . |
| [10] | Stoitsova SO, Braun Y, Ullrich MS, Weingart H. Characterization of the RND-type multidrug efflux pump MexAB-OprM of the plant pathogen Pseudomonas syringae. Applied and Environmental Microbiology , 2008, 74 (11) : 3387–3393 DOI:10.1128/AEM.02866-07 . |
| [11] | Lindemann A, Koch M, Pessi G, Müller AJ, Balsiger S, Hennecke H, Fischer HM. Host-specific symbiotic requirement of BdeAB,a RegR-controlled RND-type efflux system in Bradyrhizobium japonicum. FEMS Microbiology Letters , 2010, 312 (2) : 184–191 DOI:10.1111/fml.2010.312.issue-2 . |
| [12] | Eda S, Mitsui H, Minamisawa K. Involvement of the smeAB multidrug efflux pump in resistance to plant antimicrobials and contribution to nodulation competitiveness in Sinorhizobium meliloti. Applied and Environmental Microbiology , 2011, 77 (9) : 2855–2862 DOI:10.1128/AEM.02858-10 . |
| [13] | Fàbrega A, Madurga S, Giralt E, Vila J. Mechanism of action and resistance to quinolones. Microbial Biotechnology , 2009, 2 (1) : 40–61 DOI:10.1111/mbt.2009.2.issue-1 . |
| [14] | Chen S, Cui SH, McDermott PF, Zhao SH, White DG, Paulsen I, Meng J. Contribution of target gene mutations and efflux to decreased susceptibility of Salmonella enterica serovar Typhimurium to fluoroquinolones and other antimicrobials. Antimicrobial Agents and Chemotherapy , 2007, 51 (2) : 535–542 DOI:10.1128/AAC.00600-06 . |
| [15] | Fàbrega A, Sánchez-Céspedes J, Soto S, Vila J. Quinolone resistance in the food chain. International Journal of Antimicrobial Agents , 2008, 31 (4) : 307–315 DOI:10.1016/j.ijantimicag.2007.12.010 . |
| [16] | Martin RG, Rosner JL. Genomics of the marA/soxS/rob regulon of Escherichia coli:identification of directly activated promoters by application of molecular genetics and informatics to microarray data. Molecular Microbiology , 2002, 44 (6) : 1611–1624 DOI:10.1046/j.1365-2958.2002.02985.x . |
| [17] | Olliver A, Vallé M, Chaslus-Dancla E, Cloeckaert A. Role of an acrR mutation in multidrug resistance of in vitro-selected fluoroquinolone-resistant mutants of Salmonella enterica serovar Typhimurium. FEMS Microbiology Letters , 2004, 238 (1) : 267–272 . |
| [18] | Peng JL.Study Mesorhizobium Huakuii 7653R bacteroids differentiation and nitrogen fixation mechanism based on global transcriptome analysis.Wuhan:Doctoral Dissertation of Doctoral Dissertation of Huazhong Agricultural University,2014.(in Chinese) 彭杰丽.基于全局转录组分析研究华癸中慢生根瘤菌7653R类菌体分化和固氮机理.华中农业大学博士学位论文,2014. http://cdmd.cnki.com.cn/Article/CDMD-10504-1014213509.htm |
| [19] | Feng H.Construction of a new bacterial one-hybrid system reporter vector and the application in detecting transcription factors.Wuhan:Master's Thesis of Huazhong Agricultural University,2007.(in Chinese) 冯辉.一个新型细菌单杂交系统报告载体的构建及其在转录因子发现中的应用.华中农业大学硕士学位论文,2007. http://cdmd.cnki.com.cn/Article/CDMD-10504-2007209710.htm |
| [20] | Takeshima K, Hidaka T, Wei M, Yokoyama T, Minamisawa K, Mitsui H, Itakura M, Kaneko T, Tabata S, Saeki K, Oomori H, Tajima S, Uchiumi T, Abe M, Tokuji Y, Ohwada T. Involvement of a novel genistein-inducible multidrug efflux pump of Bradyrhizobium japonicum early in the interaction with glycine max (L.) Merr. Microbes and Environments , 2013, 28 (4) : 414–421 DOI:10.1264/jsme2.ME13057 . |
| [21] | Hasdemir UO, Chevalier J, Nordmann P, Pagès JM. Detection and prevalence of active drug efflux mechanism in various multidrug-resistant Klebsiella pneumoniae strains from Turkey. Journal of Clinical Microbiology , 2004, 42 (6) : 2701–2706 DOI:10.1128/JCM.42.6.2701-2706.2004 . |
| [22] | Hernández A, Maté MJ, Sánchez-Díaz PC, Romero A, Rojo F, Martínez JL. Structural and functional analysis of SmeT,the repressor of the Stenotrophomonas maltophilia multidrug efflux pump SmeDEF. The Journal of Biological Chemistry , 2009, 284 (21) : 14428–14438 DOI:10.1074/jbc.M809221200 . |
 2016, Vol. 56
2016, Vol. 56