中国科学院微生物研究所,中国微生物学会,中国菌物学会
文章信息
- 范学锋 , 张河山 , 杨文香 . 2016
- Xuefeng Fan, Heshan Zhang, Wenxiang Yang . 2016
- 植物专性寄生菌吸器功能研究现状
- Advances in haustoria function of plants obligate parasite-A review
- 微生物学报, 2016, 56(8): 1222-1233
- Acta Microbiologica Sinica, 2016, 56(8): 1222-1233
-
文章历史
- 收稿日期:2015-11-02
- 修回日期:2016-01-27
- 网络出版日期:2016-04-07
吸器是植物专性寄生真菌和卵菌唯一位于寄主细胞内并可从中获取养分的器官,吸器形成是植物专性寄生菌成功侵染的标志。自1853年von Mohl第1次描述吸器以来,植物病理学家们对此产生了浓厚的兴趣。1863年,de Bary提出吸器可能具有吸收营养物质的作用。但由于专性寄生菌不能进行离体培养,人们对其了解不深入。20世纪60年代,开展了小麦秆锈菌(Puccinia graminis f. sp. tritici)与寄主互作的超微结构研究,确定了胞间菌丝、吸器母细胞和吸器的基本形态。70年代,由于显微技术和制片技术的进步,掀起了对小麦锈病、亚麻锈病、菜豆锈病、梨锈病和桧柏锈病侵染过程中寄主与病原超微结构的变化研究。90年代应用微分干涉技术、生物电镜技术和荧光标记技术对吸器的形成过程、超微结构、信息交流和细胞生理生化做了深入的研究[1]。1991年Kurt Mendgen和Dietrich-Eckhardt Lesemann出版了《ELECTRON MICROSCOPY OF PLANT PATHOGENS》,对于吸器的产生、结构及其功能做了一定的阐述,但由于研究技术的限制,仍不能非常清晰地揭示吸器的功能。Hahn和Mendgen[2]开发了吸器的分离方法,Rampitsch等[3]利用抗原-抗体法进一步对吸器进行了特异性富集提纯。李芳芳等[4]用蚕豆单胞锈菌(Uromyces fabae)吸器的提取方法对小麦条锈菌(P. striiformis f. sp. tritici)的吸器进行了分离。分离技术的发展使人们对专性寄生菌吸器的部分功能有了深入的了解。进入21世纪后,各专性寄生菌的基因组或转录组测序相继完成,在高通量、大数据实验技术的支持下,加快了对专性寄生菌在互作过程中吸器功能的研究,特别集中于效应蛋白的相关研究。
1 吸器的形成及结构不同病原物的吸器形成过程和结构组成基本相同,均有吸器体(Haustorium)、吸器外间质(Extrahaustorial matrix)和吸器外质膜(Extrahaustorial membrane,EHM) 3部分组成。吸器是由胞间菌丝特化产生的,病原菌侵入后,在寄主细胞间隙形成胞间菌丝,胞间菌丝顶端与寄主细胞壁接触后被诱导分化,进而形成吸器母细胞[5-6]。小麦叶锈菌(P. triticina)接种8 h后就可以形成椭圆、长圆或是烧瓶形的气孔下囊;气孔下囊分化形成初生侵染丝并向周围的叶肉细胞延伸,接触到叶肉细胞后被诱导分化产生隔膜,形成初生吸器母细胞,吸器母细胞在与寄主细胞接触部位细胞壁第五层增厚成凸镜状,形成两层壁的入侵栓。入侵栓侵入叶肉细胞形成初生吸器。入侵栓穿透寄主细胞壁后,延伸形成吸器的颈部,吸器颈部停止延伸后,顶端部位开始膨大,形成幼小的吸器,建立寄生关系。吸器母细胞中原生质和细胞器渐渐流入吸器,使其逐渐趋于成熟[7-8]。初生吸器的后侧产生分支状的次生侵染丝,在其顶端形成次生吸器母细胞以及次生吸器。由于寄主植物的不同,吸器的形态存在差异。大多数霜霉菌产生丝状吸器,但向日葵霜霉菌(Plasmopara halstedii)产生的吸器呈球状,并且没有颈部[9]。白锈菌产生球状吸器,白粉菌产生掌状吸器,锈菌则产生指状吸器。
随着吸器体的膨大,寄主的细胞膜不断下陷。在颈部,吸器外质膜紧贴颈的外壁;在颈部与吸器体的过渡部位,吸器外质膜渐渐远离吸器体壁;在其他的部位吸器外质膜和吸器体壁之间始终保持一定的距离,吸器外质膜呈折叠的波浪状分布,造成吸器外间质的宽窄变化比较大[7-8]。吸器外质膜,吸器外间质和吸器体组成寄主和病原重要的互作交界面,由于在植物表皮细胞中中央液泡占据很大的细胞空间,因此,吸器外质膜与液泡膜(Tonoplast)相邻很近[10-11]。不同种属菌间的吸器中细胞核数目具有差异,多数锈菌的吸器为双核,P. striiformis多核现象比较普遍,P. triticina吸器成熟前含有双核,成熟后只能观察到具有双核仁的单细胞核,可能是由双核的融合所致,成熟的燕麦冠锈菌(P. coronate)吸器中也含有单核。吸器体内的原生质成分与吸器母细胞基本一致,含有丰富的线粒体、内质网以及大量电子密度颗粒。Enkerli等[12]观察到卵菌的吸器外膜与其他的细胞质膜不同,膜质较厚且被高度糖基化。
2 吸器功能研究 2.1 吸器具有特殊的代谢机制Hahn和Mendgen[13]开展的U. fabae吸器基因表达谱研究显示,在U. fabae侵染过程中形成的吸器中,有一些寄主诱导表达的基因(in Planta-Induced Genes, PIGs)被激活,如己糖转运子基因(hexose transporter, hxt1),氨基酸次生转运子基因(Amino acid transporter,aat) aat1、aat2和aat3。其中转运子蛋白HXT1p和AAT2p位于吸器质膜上,AAT1p和AAT3p是质子依赖型的转运子。Sohn等[14]进一步发现这其中的2个基因(Thiamine, thi) thi1 (原命名为pig1)和thi2 (pig4)高表达,它们的转录量之和超过了吸器中总mRNA的5%。利用硫胺素营养缺陷thi3和thi2突变体互补试验证明了这2个基因在硫胺素生物合成中的作用。THI1p可能参与合成硫胺素的嘧啶部分,THI2p可能参与合成硫胺素的噻唑基部分。与其它真菌受硫胺素完全抑制的硫胺素生物合成相关基因相比,thi1和thi2不受植物体内外锈菌菌丝中所含的硫胺素的影响。Western blot分析显示,在休眠孢子、萌发孢子的提取液中和体外生长的侵染结构中的thi1基因量明显比吸器中少。用免疫荧光显微镜观察被锈菌感染的叶片,在吸器中观察到高浓度的THI1p,而在胞间菌丝和夏孢子中只发现了少量的THI1p。硫胺素经过磷酸化过程形成其辅酶形式焦磷酸硫胺素(Thiamine pyrophosphate,TPP),TPP参与转醛基反应,是丙酮酸脱氢酶、丙酮酸脱羧酶、α-酮戊二酸脱羧酶和转酮酶的辅因子[14]。但不同的专性寄生菌的吸器在代谢功能上存在特异性。Godfrey等[15]分离出大麦白粉菌(Blumeria graminis f. sp. Hordei, Bgh)的吸器,从蛋白质组的角度对204个吸器蛋白进行了分析,结果表明大多数蛋白在代谢途径和生物能源产生等方面起作用,但没有发现丙酮酸脱羧酶,表明白粉菌的代谢途径可能与植物和其它真菌不同。这些结果表明,吸器是专性寄生菌菌丝体中生物合成代谢物的一个必要的结构。
随着近年来新一代测序技术的应用,专性寄生菌的DNA测序和mRNA测序得以迅速地发展。P. graminis、P. striiformis和亚麻锈菌(Melampsora lini)[16-19]的基因组学研究发现,这些基因组均缺少同化硝酸盐和硫关键酶的编码基因,说明这些锈菌病原物不能从植物中有效获取硝酸盐和硫。通过基因和蛋白质的关联分析,预测了许多锈菌的吸器中的转运体,但是,到目前发现的锈菌糖吸收转运体只有HXT1p。大多数锈菌的氨基酸转运体属于氨基酸/聚氨/胆碱超家族(Amino acid polyamine choline, APC),其具有12个跨膜结构域组成的拓扑结构,是氨基酸和H+质子共转运体,包括4个不同的亚族YAT family (Yeast amino acid transporter)、LAT family (L-type amino acid transporter)、ACT family (Amino acid/choline transporter)和AAAP superfamily(Amino acid/auxin permease)[20]。
2.2 吸器具有营养吸收的功能早在1863年,de Bary就提出了吸器是专性活体营养菌吸收寄主营养物质结构的假设。1978-1982年间Martin和Ellingboe,Mendgen、Manners和Gay分别利用32P、14CO2标记物对豌豆白粉菌(Erysiphe pisi),利用3H标记的氨基酸对U. phaseoli进行了研究,间接地证明了吸器在营养吸收方面的作用。吸器对氨基酸和糖分的吸收过程为次级主动运输,转运的能量来源于H+-ATP酶形成的质子梯度。专性寄生菌对氨基酸的吸收依赖于吸器和胞间菌丝,而对糖分的吸收仅仅依赖于吸器[1]。锈菌中HXT1的转录和其编码的HXT1p只在吸器中能检测到,巢式PCR和基因组Southern杂交分析表明,锈菌的各个发育阶段均没有发现其它的己糖转运蛋白存在。HXT1p分布于单核吸器的尖端或双核吸器的吸器体周围[21]。转基因酵母和爪蟾卵母细胞异源表达表明HXT1p是D-葡萄糖和D-果糖特异的质子共转运体,并且HXT1p对葡萄糖和果糖的转运效率相似,它依靠质子驱动力将葡萄糖和果糖从植物细胞转运到吸器中[21]。Bgh的吸器能够直接吸取寄主细胞的葡萄糖,而蔗糖、D-半乳糖和D-果糖在被运输到吸器之前需要经过一定程度的代谢过程才能被吸器吸收。首先,从植物中释放出来的蔗糖,穿过吸器外质膜,进入吸器外间质;蔗糖在酶的作用下裂解为葡萄糖和果糖,植物中的纤维二糖也可能在酶的作用下裂解为葡萄糖;然后,在吸器质膜内外H+浓度梯度的驱动下葡萄糖和果糖通过HXT1转运体进入到吸器体内。吸器对氨基酸的吸收与对糖的吸收相类似,即氨基酸从植物细胞中释放出来,穿过吸器外质膜进入到吸器外间质,随后通过吸器质膜上的氨基酸转运体进入到吸器体内,在吸器吸收糖和氨基酸的过程中,吸器质膜上的H+-ATP酶同HXT1转运体和氨基酸转运体一样,也起着重要的作用,它们负责将共转运进入吸器体的H+再转运回吸器外间质中,调节吸器外间质和吸器体中的H+浓度,使吸器质膜内外产生H+浓度梯度,以使糖和氨基酸更好的进入到吸器中去[11]。
吸器质膜上的H+-ATP酶和特异转运蛋白决定着病原真菌吸收寄主植物代谢产物的能力,虽然专性寄生菌的大部分寄生菌丝为胞间菌丝,但吸器的超微结构和其所处的位置表明了其具有特殊的营养作用。与其它结构相比,病原菌吸器中的H+-ATP酶的活性更高[21-22]。目前已发现60种锈菌氨基酸转运蛋白,其中P. graminis含有21种,P. triticina含有14种,M. lini含有4种,M. larici-populina含有16种,蕨类锈菌(Mixia osmundae)含有5种,但关于这些转运体的具体转运机制有待于深入研究。已经确定了编码氨基酸次生转运蛋白的基因AAT,AAT1p (PIG27)表现出其特异地转运L-组氨酸和L-赖氨酸的氨基酸转运蛋白特性[23],AAT3p表现出其特异地转运L-亮氨酸及含硫氨基酸L-甲硫氨酸和L-半胱氨酸的特性[24]。这些发现再次确定了吸器在营养吸收方面的潜在作用。虽然研究发现AAT2p(PIG2p)只出现在吸器中,但还没有检测到其具有转运活性[18]。aat1和aat3在吸器和胞间菌丝中都有表达,表明吸器具有吸收植物体氨基酸的作用。
2.3 吸器是碳水化合物代谢及其转化为多元醇的主要场所吸器是营养吸收的主要部位,也是营养物质代谢及利用碳水化合物产生多元醇的主要场所。多元醇是孢子中化合物储存的主要形式。多元醇在吸器中产生后会通过菌丝体转运到夏孢子中,并在夏孢子中沉积下来。不同专性寄生菌利用多元醇的情况差异很大。
葡萄糖和果糖进入吸器后经过严格的调控会在吸器中进入糖酵解和磷酸戊糖途径。在U. fabae吸器中,发现了葡萄糖激酶1 (Glucokinase, GLK1p)、甘露醇脱氢酶1 (Mannitol dehydrogenase, MAD1p)和D-阿拉伯糖醇脱氢酶1 (D-Arabia sugar alcohol dehydrogenase, ARD1p)等。RT-PCR分析和免疫定位分析发现GLK1p的编码基因GLK1只在或者优先在吸器中进行表达。GLK1p作用于葡萄糖,当ATP存在时使葡萄糖发生磷酸化反应,生成6-磷酸葡萄糖。MAD1p的编码基因mad1的转录只在吸器中进行,MAD1p位于吸器内腔和夏孢子。MAD1p作用于果糖或甘露醇,催化果糖和甘露醇的相互转变,以NADP+/H为辅酶。MAD1p虽然称之为甘露醇脱氢酶,但它更多的表现为D-果糖还原酶的活性,即以NADPH为还原剂催化D-果糖还原为甘露醇。由于MAD1p的存在,经过吸器质膜上的HXT1p转运到吸器内腔的果糖可以被锈菌利用。虽然一些植物能够合成甘露醇,但大部分植物并不能利用它,而甘露醇可以在菌丝体中自由扩散。因此甘露醇是植物病原真菌中碳水化合物储存的理想形式。ARD1p位于吸器内腔,作用于D-核酮糖、D-木酮糖和D-阿拉伯糖醇,以NADP+/H为辅酶。D-阿拉伯糖醇也是U. fabae中碳水化合物的储存形式。在U. fabae吸器中,ARD1p以NADPH为还原剂催化磷酸戊糖途径中产生的D-核酮糖和D-木酮糖还原为D-阿拉伯糖醇[1](图 1)。但是,并不是所有专性寄生菌都积累D-阿拉伯糖醇,在U. fabae中积累甘露醇与D-阿拉伯糖醇,而在P. graminis中积累的却是甘露醇与D-山梨糖醇。Yin等[25]通过比较转录组学在P. gra-minis中发现了将近1200个在吸器中特异富集表达的基因,经病毒诱导的基因沉默(virus-induced gene silencing,VIGS)和寄主诱导的基因沉默(host-induced gene silencing,HIGS)功能验证,证明其涉及糖酵解酶、糖代谢相关分泌蛋白和膜转运蛋白,这些基因的沉默阻碍了菌丝的扩展。
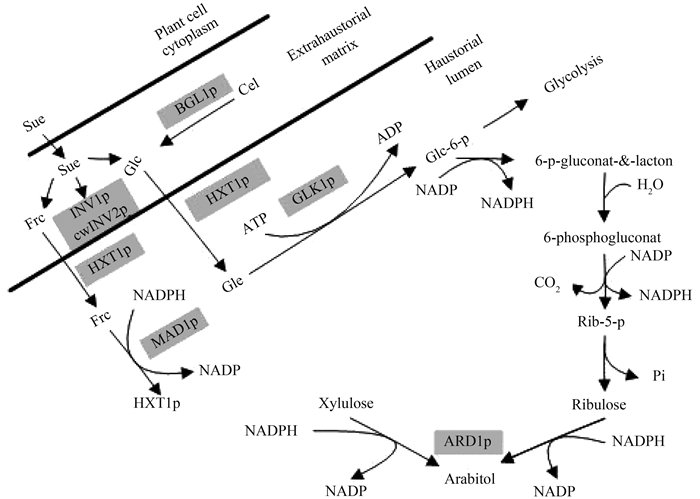
|
| 图 1. U. fabae吸器中己糖的吸收、代谢和转化[1] Figure 1. Mobilization, uptake, and utilization of hexoses in haustoria of U. fabae. Sucrose (Suc) is released from the infected plant cell either actively or passively. The disaccharide is cleaved by the fungal invertase INV1p and possibly the action of plant enzymes. The resulting monosaccharides, D-glucose (Glc) and D-fructose (Frc), are taken up via the hexose transporter HXT1p. Glc might also be provided through the breakdown of cellobiose (Cel) by the action of BGL1p. Glc is funneled into glycolysis and the pentose phosphate pathway (PPP) by phosphorylation through GLK1p. D-fructose on the other hand is converted into mannitol by the action of MAD1p. At the bottom of the PPP, the novel enzyme ARD1p is generating D-arabitol[1]. |
2.4 吸器产生效应子并将之转运到寄主细胞中
目前的很多研究证明吸器是活体营养真菌和卵菌效应子产生的主要场所,并起着将效应子转运到寄主植物中的作用。目前,已经从M. lini鉴定出30余个无毒基因,从P. graminis、P. striiformis和P. triticina中鉴定出近50个无毒基因[18, 26]。通过基因组学研究和转录组学研究,已经从吸器中获得了大量的(500-1500个)候选效应蛋白。本课题组从P. triticina的吸器产生阶段筛选到300余个候选效应蛋白,经过分析发现,这些效应蛋白不具有保守的氨基酸保守结构,多态性非常强。杜冬冬[27]对2个不同致病力小麦叶锈菌株的150个候选分泌蛋白进一步进行Pfam分析,结果得到注释的分泌蛋白仅有36个。剩余的114个分泌蛋白使用MEME软件进行de novo结构筛选和预测,结果在15个分泌蛋白中预测到3个保守结构域,分别是motif 1(YxxxxNKxDC)、motif 2(Y [N/A] Y [T/D] [H/A] [C/A] [S/H] [T/Q] [S/N] [S/G] [N/C]T [N/A] W)和motif 3([S/K] M [H/A] R [R/M] R [P/A] [W/Q])。剩余的99个P. triticina的分泌蛋白含有新的功能motif。Godfrey等[28]通过构建Bgh的cDNA文库发现了白粉菌分泌蛋白的保守结构域Y/F/WxC。根据此保守结构进行EST文库比较,在P. striiformis和U. maydis中都发现了有此结构的分泌蛋白。本课题组在研究P. triticina中发现,在大量的候选分泌蛋白中也存在着Y/F/WxC的保守结构域,而其他不产生吸器的真菌和卵菌中没有此结构,说明这类分泌蛋白只特异的在有吸器的真菌中表达。这些效应蛋白的产生均证明吸器是产生效应子的重要场所。
锈菌吸器中无毒蛋白(Avirulence, Avr)的表达以及伴随吸器产生而导致寄主过敏性坏死反应(Hypersensitive response, HR)发生,这种现象说明吸器在将效应蛋白转入寄主细胞中起着至关重要的作用。Kemen等[29]在研究U. fabae中发现在侵染寄主时效应蛋白Uf-RTP1进入寄主细胞,且发现Uf-RTP1锚定于寄主的细胞核,推测在病原物侵染寄主过程中该效应因子影响到寄主的表达或调控。然而,在研究其他豆类锈菌时却仅仅在吸器外膜区域能够检测到吸器的分泌蛋白,说明吸器产生的分泌蛋白只有一部分转移到寄主细胞中去[29],这表明蛋白的转运机制具有选择性。
吸器与寄主互作交界面可能更利于分泌蛋白进入寄主细胞。虽然吸器外质膜与寄主的质膜紧密相邻,但其理化特性与寄主和锈菌的不同。吸器外质膜把寄主与吸器明显分隔开,推测可能与病原物的专性寄生特性有关[22, 30]。吸器外间质通过颈环,把寄主非原质体与吸器外间质完全分开,具有密封吸器外间质的作用。锈菌和白粉病菌形成颈环,但在卵菌中除了白锈菌形成类似于颈环的结构外不曾发现形成颈环[30-31]。但在几种卵菌中,在侵入细胞所在位置经常出现颈领或乳突,该结构起到与真菌的吸器颈环相同或相似的作用。推测该结构的存在更利于控制寄主和病原菌间信号和营养的交换。此外,在某些锈菌中发现,吸器外间质外膜向外延伸出一个管状结构与寄主的细胞质,包括内质网(endoplasmic reticulum, ER)和高尔基体(Golgi membranes, GM)接触,表明其与吸器外间质膜和寄主的细胞膜间存在着物质交换。Mims等[32]发现在黄花菜柄锈菌(P. hemerocallidis)侵染黄花菜叶片过程中吸器外间质区域中电子致密沉淀物延伸至管状结构中,且出现在顶端的囊泡状结构中。他们同时发现这些管状延伸物与寄主植物的扁平囊泡接触,进而与ER接触,为分泌蛋白进入寄主细胞提供了途径。Bgh侵染拟南芥的超微结构的观察也发现在寄主与吸器作用层面存在活跃的小囊泡,但是这种延伸非常小。拟南芥的RPP1A蛋白通过N端疏水性肽与ER和/或GM接触[33],因此,抗病蛋白很可能拦截了通过内膜系统进入寄主细胞的Avr同源蛋白。在卵菌中无毒蛋白有N端信号肽,能够指导其ER分泌途径。
寄主与吸器形成的互作交界面可能利于蛋白的转运,但同时锈菌的效应蛋白也可能存在某种固有的跨膜转运机制。利用锈菌的包含信号肽序列的全长无毒基因在寄主中表达,同样可以产生HR反应[34-35]。这就说明,由于信号肽异常或低效的加工使得Avr在细胞之中少量积累。但是,添加内质网对AvrM的拦截信号,可以阻止HR反应的发生[35]。当没有病原菌存在时,很可能这些蛋白成功进入寄主植物的分泌途径,从而能够从非质体或者内膜分泌系统,如高尔基体或者运输小泡(transport vesicles),进入寄主的细胞质。此外,分泌蛋白的正确折叠也影响转运效率。
在研究转运机制中发现除了上述转运机制外,还存在内吞作用,如小麦褐斑病的PtrToxA毒素蛋白的转运[36],通过修饰的受体内吞作用(receptormediated endocytosis,RME),进入寄主细胞。植物上的RME研究并不十分的清楚,然而,质膜蛋白和细胞壁成分的循环再利用已经证明是通过内吞作用,非蛋白类的激发子也已证明通过内吞作用进入寄主细胞[37]。致病疫霉(Phytophthora infestans)通过调节寄主植物与病原菌互作交界的植物的内吞系统进入寄主原生质[38]。已经有研究证明分泌蛋白保守的N端motifs小片段序列能够完成效应蛋白进入植物细胞[39-41],例如在卵菌效应子蛋白家族中已经发现LXLFLAK motifs和RXLR motifs[42]。虽然一些真菌效应蛋白的N端区域是进入植物细胞所必需的,包括来自M. lini的AvrL567和AvrM,但是至今没有发现保守的转入信号序列。
2.5 吸器干扰正常生理过程和寄主防御反应效应子是病原菌在侵染寄主植物时产生的兼具毒性和无毒功能的调节分子,其毒性功能表现为干扰正常生理过程和寄主防御反应,帮助病原菌侵染、繁殖,无毒功能是被植物抗病蛋白特异识别,激发防御反应[43-44]。
目前的研究发现了一些具有毒性功能的蛋白。在吸器中,由D-果糖产生的甘露醇是一种自由基清除剂,它可以清除植物产生和释放的活性氧自由基,可能会抑制寄主的防御反应[22]。B. graminis候选效应子BEC1011和BEC1054,通过HIGS证明与致病相关,通过功能互补实验证明两者在植物细胞内起作用,BEC1011能抑制白粉菌诱导的植物细胞死亡[45]。候选效应子BEC4和ADP核糖基化因子-GTP酶激活蛋白(ARF-GAP)相互作用,阻碍与寄主防卫相关的囊泡运输[46]。U. maydis在侵入初期分泌效应蛋白Pep1并在质外体空间内积累,缺失pep1基因的突变体在侵入玉米细胞的初期被阻遏,菌丝细胞间的信号通路被阻断,并诱发强烈的防卫反应[47]。分泌蛋白Pep1通过阻碍寄主的Pox12来抑制植物的防卫反应。Pox12是一种被分泌的玉米过氧化物酶,是植物活性氧产生体系的保守配合物[48]。U. maydis的分泌效应蛋白Pit2也与致病力相关,pit2突变体能够侵入但是成瘤能力严重减弱。PIT2蛋白在质外体空间内直接阻碍一系列玉米半胱氨酸蛋白酶。玉米半胱氨酸蛋白酶的激活能够促进水杨酸相关的防卫反应[49]。U. maydis分泌大量的分支酸歧化酶Cmu1来中和水杨酸(salicylic acid,SA)诱导的免疫反应。同时Cmu1可以转运进入邻近的植物细胞,为扩散侵染做铺垫[50]。
不同病原菌的吸器具有其独特的结构,这些结构会影响到其寄主植物。燕麦被P. graminis侵染后,吸器外质膜上会出现短管状的延伸,而被冠柄锈菌(P. coronata)侵染后,吸器外质膜上出现长而窄的延伸。锈菌吸器与寄主细胞交界处的精细结构受锈菌产生的物种特异性信号控制,这些信号包括抑制因子,抑制因子能够维持病原菌与其寄主间的相容性,能够抑制寄主的防御反应,使寄主植物表现出对病原菌的易感性。Fernandez和Heath发现感染了豇豆锈菌(U. vignae)的菜豆组织会受到一些非寄主病原的侵染。此外,植物病原菌可以通过分泌一些蛋白和效应子来调节寄主植物的防御反应,使其能够在寄主植物上定殖。在U. fabae吸器中特异性表达的小分子分泌蛋白RTP1具有影响寄主防御基因表达、维持蚕豆单胞锈菌吸器结构及其在寄主上活体营养的作用[51]。进一步的研究表明RTP1同系物广泛存在于锈菌目,与专性寄生有密切的联系。
2.6 吸器产生的效应蛋白可能决定着对寄主的专化性无毒基因具有高度的多态性,而且在信号选择上也具有多样性,特别表现在植物防御系统的协同进化上。例如,M. Lini,暴露在AvrL567蛋白表面的正向选择多态残基负责免疫受体特异性差异的识别,这种现象解释了基因家族在分子基础上通过多样化选择,从而避开被寄主的识别。同样,AvrM通过直接与M抗性蛋白表面的残基互作被识别,而且识别的差异性取决于表面暴露的残基多态性[52]。效应子可能通过毒性功能的不同选择适合的寄主蛋白靶标或者是新的毒力靶标。通过对多个锈菌效应子的比较分析发现,一些保守的、决定某种酶活性的蛋白可能具有常规的毒性作用,例如一些细胞壁降解酶。当然,很多的候选效应子在属内或种内并不保守,而且即使是一个种的不同的分离物间也存在着很高的多样性[34]。本研究组对10个毒性不同的中国小麦叶锈菌致病类型进行侵染阶段的转录组分析,发现不同的致病类型间存在的效应蛋白的特异性比较丰富,总计在10个致病菌中获得侵染阶段的候选效应蛋白754个,而在2个不同毒力菌株之间存在的差异表达分泌蛋白在10至100余个之间。杜冬冬[35]对2个P. triticina Tc284-2和Tc361-1的吸器阶段表达进行分析,确定差异表达的分泌蛋白共150个。其中相对于Tc284-2, Tc361-1上调表达的分泌蛋白有92个,下调表达的有58个。在Tc284-2中特异表达的分泌蛋白为Unigene11683-Tc15-2、Unigene11935-Tc15-2,在Tc361-1中特异表达分泌蛋白分别是CL4323.sContig1-Tc15-2、CL5606.Contig1-Tc15-2和Unigene26432-Tc15-2,充分证明效应蛋白对寄主的专化性选择。
3 待解决的问题及展望随着科学技术,尤其是分子生物学的发展,人们对吸器功能将会有更深入的了解。利用快速发展的吸器基因组学能够进一步揭示病原菌的活体营养吸收的特性。然而,至今我们的了解仅限于在不同的阶段高表达程度不同的转运体基因,需要进一步研究揭示有关营养吸收的转运体的详细作用,包括涉及到营养信号因子和氨基酸吸收与调节表达的效应蛋白的转运机制等。这些有助于我们更好地了解病原菌适应其寄主的机制。此外,通过比较不同专性寄生菌的氨基酸转运子来更详细地开展专性寄生菌的生理和分子基础的研究,得到了转运蛋白的序列和种类及结构,但转运体在不同菌间、不同属间、甚至不同的种间都存在着差异,转运体千差万别,这些现象可以解释为什么植物专性寄生菌有很强的寄主专化性,但这些机制均有待于澄清。此外,在吸器的某些营养代谢途径上也有待于深入研究。例如U. fabae硫胺素的合成不受高浓度硫氨酸的抑制,其原因是其缺乏抑制子还是缺乏相应的转运子目前并不清楚。硫胺素磷酸化形成辅酶因子焦磷酸及其以后的代谢过程已经明确,但是硫胺素的前体化合物是什么需要确定。
近几年,EST分析、吸器cDNA文库构建、全基因组测序、基因沉默等不同方法的应用,在专性寄生菌吸器的功能及效应子的研究方面做了大量的工作,并取得了一定的进展,发现了大量吸器中相关候选效应子。信号识别是专性寄生菌与寄主植物互作的关键,但病原菌吸器与寄主细胞交接界面的分子互作在很大程度上仍然未知。在病原物活体营养阶段和寄主的互作中分泌蛋白研究迅速,这些成果给专性寄生菌分泌蛋白的研究提供了很强的指导作用,但是不同专性寄生菌的分泌蛋白仍然具有其特异性,因此给研究带来一定的困难。吸器中产生的效应蛋白可以利用寄主的分泌系统进入寄主细胞,也可以通过病原菌的分泌系统进入,还可以通过自身的信号肽进入但转运肽在氨基酸的种类、长度和序列上变化多样,没有发现保守序列[53]。病原菌效应蛋白中多存在模拟寄主蛋白的序列,这可能有利于在寄主膜系统上的转运[54]。虽然效应蛋白的转运方式研究比较缺乏,但是其作用方式的研究方法已经比较成熟。在本氏烟上的瞬时表达和亚细胞定位分析确定其植物中的作用靶标蛋白。最近,Sperschneider等[55]开发了新的高效、精确的寻找候选效应蛋白的方法,为以后的研究提供了基础。至今为止,候选效应蛋白的具体作用机制仍然是待解决的关键问题。随着人们对专性寄生菌吸器的研究的不断深入,人们将更全面的认识专性寄生菌,更好的控制其引起的植物病害。
| [1] | Voegele RT, Mendgen KW. Nutrient uptake in rust fungi: how sweet is parasitic life?. Euphytica , 2011, 179 (1) : 41–55 . |
| [2] | Hahn M, Mendgen K. Isolation by ConA binding of haustoria from different rust fungi and comparison of their surface qualities. Protoplasma , 1992, 170 (3/4) : 95–103 . |
| [3] | Rampitsch C, Günel A, Beimcik E, Mauthe W. Proteome of monoclonal antibody-purified haustoria from Puccinia triticina Race-1. Proteomics , 2015, 15 (7) : 1307–1315 . |
| [4] | 李芳芳.小麦条锈菌吸器提取体系建立及PsBpp1基因的克隆及功能分析.西北农林科技大学硕士学位论文, 2012. |
| [5] | Kang ZS, Li ZQ, Chong J, Rohringer R. Ultrastructure and cytochemistry of haustorium of wheat stripe rust. Acta Mycologica Sinica , 1994, 13 (l) : 52–57 (in Chinese) . 康振生, 李振岐, 庄约兰J, 罗林格R. 小麦条锈菌吸器超微结构和细胞化学的研究. 真菌学报 , 1994, 13 (l) : 52–57. |
| [6] | Tian CM, Liang YM, Kang ZS, Li ZQ, Zhao YX. Ultrastructure of poplar leaf infected by rust fungus (Melampsora larici-populina Kleb). Acta Phytopathologica Sinica , 2002, 32 (1) : 71–78 (in Chinese) . 田呈明, 梁英梅, 康振生, 李振岐, 赵彦修. 青杨叶锈病菌(Melampsora larici-populina Kleb.)染过程的超微结构研究. 植物病理学报 , 2002, 32 (1) : 71–78. |
| [7] | Huang GH, Kang ZS, Zhu ZY, Li ZQ. Histopathological and ultrastructural studies on development of Puccinia recondita f. sp. tritici in a susceptible wheat cultivar. Acta Phytopathologica Sinica , 2003, 33 (1) : 52–56 (in Chinese) . 黄国红, 康振生, 朱之堉, 李振歧. 小麦叶锈菌在感病寄主上发育的组织病理学和超微结构研究. 植物病理学报 , 2003, 33 (1) : 52–56. |
| [8] | Bai ZY, Wang DM, Hou CY, Liu N, Han SF, Ma LH. Microstructure and ultrastructure infected by wheat rust fungus. Chinese Journal of Cell Biology , 2003, 25 (6) : 393–397 (in Chinese) . 白志英, 王冬梅, 侯春燕, 刘娜, 韩胜芬, 马利华. 小麦叶锈菌侵染过程的显微和超微结构. 细胞生物学杂志 , 2003, 25 (6) : 393–397. |
| [9] | Kang ZS, Hu DW, Shang HS. Electron microscopy observation of development of haustorium and sporangiophore in sunflower downy mildew. Journal of Northwest A & F University , 1993, 21 (S2) : 41–45 (in Chinese) . 康振生, 胡东维, 商鸿生. 向日葵霜霉菌吸器和孢囊梗发育的电镜观察. 西北农林科技大学学报 , 1993, 21 (S2) : 41–45. |
| [10] | Bozkurt TO, Schornack S, Banfield MJ, Kamoun S. Oomycetes, effectors, and all that jazz. Current Opinion in Plant Biology , 2012, 15 (4) : 483–492 . |
| [11] | Caillaud MC, Piquerez SJM, Fabro G, Steinbrenner J, Ishaque N, Beynon J, Jones JDG. Subcellular localization of the Hpa RxLR effector repertoire identifies a tonoplast-associated protein HaRxL17 that confers enhanced plant susceptibility. The Plant Journal , 2012, 69 (2) : 252–265 . |
| [12] | Enkerli K, Mims CW, Hahn MG. Ultrastructure of compatible and incompatible interactions of soybean roots infected with the plant pathogenic oomycete Phytophthora sojae. Canadian Journal of Botany , 1997, 75 (9) : 1493–1508 . |
| [13] | Hahn M, Mendgen K. Characterization of in planta-induced rust genes isolated from a haustorium-specific cDNA library. Molecular Plant-Microbe Interactions , 1997, 10 (4) : 427–437 . |
| [14] | Sohn J, Voegele RT, Mendgen K, Hahn M. High level activation of vitamin B1 biosynthesis genes in haustoria of the rust fungus Uromyces fabae. Molecular Plant-Microbe Interactions , 2000, 13 (6) : 629–636 . |
| [15] | Godfrey D, Zhang ZG, Saalbach G, Thordal-Christensen H. A proteomics study of barley powdery mildew haustoria. Proteomics , 2009, 9 (12) : 3222–3232 . |
| [16] | Cantu D, Govindarajulu M, Kozik A, Wang MN, Chen XM, Kojima KK, Jurka J, Michelmore RW, Dubcovsky J. Next generation sequencing provides rapid access to the genome of Puccinia striiformis f. sp. tritici, the causal agent of wheat stripe rust. PLoS One , 2011, 8 (6) : e24230 . |
| [17] | Duplessis S, Cuomo CA, Lin YC, Aerts A, Tisserant E, Veneault-Fourrey C, Joly DL, Hacquard S, Amselem J, Cantarel BL, Chiu R, Coutinho PM, Feau N, Field M, Frey P, Gelhaye E, Goldberg J, Grabherr MG, Kodira CD, Kohler A, Kües U, Lindquist EA, Lucas SM, Mago R, Mauceli E, Morin E, Murat C, Pangilinan JL, Park R, Pearson M, Quesneville H, Rouhier N, Sakthikumar S, Salamov AA, Schmutz J, Selles B, Shapiro H, Tanguay P, Tuskan GA, Henrissat B, Van de Peer Y, Rouzé P, Ellis JG, Dodds PN, Schein JE, Zhong SB, Hamelin RC, Grigoriev IV, Szabo LJ, Martin F. Obligate biotrophy features unraveled by the genomic analysis of rust fungi. Proceedings of the National Academy of Sciences of the United States of America , 2011, 108 (22) : 9166–9171 . |
| [18] | Zheng WM, Huang LL, Huang JQ, Wang XJ, Chen XM, Zhao J, Guo J, Zhuang H, Qiu CZ, Liu J, Liu HQ, Huang XL, Pei GL, Zhan GM, Tang CL, Cheng YL, Liu MJ, Zhang JS, Zhao ZT, Zhang SJ, Han QM, Han DJ, Zhang HC, Zhao J, Gao XN, Wang JF, Ni PX, Dong W, Yang LF, Yang HM, Xu JR, Zhang GY, Kang ZS. Erratum: high genome heterozygosity and endemic genetic recombination in the wheat stripe rust fungus. Nature Communication , 2014, 5 (4) : 2673–2683 . |
| [19] | Nemri A, Saunders DGO, Anderson C, Upadhyaya NM, Win J, Lawrence GJ, Jones DA, Kamoun S, Ellis JG, Dodds PN. The genome sequence and effector complement of the flax rust pathogen Melampsora lini. Frontiers in Plant Science , 2014, 5 : 98–102 . |
| [20] | Struck C. Amino acid uptake in rust fungi. Frontiers in Plant Science , 2015, 6 : 40 . |
| [21] | Voegele RT, Struck C, Hahn M, Mendgen K. The role of haustoria in sugar supply during infection of broad bean by the rust fungus Uromyces fabae. Proceedings of the National Academy of Sciences of the United States of America , 2001, 98 (14) : 8133–8138 . |
| [22] | Voegele RT, Mendgen K. Rust haustoria: nutrient uptake and beyond. New Phytologist , 2003, 159 (1) : 93–100 . |
| [23] | Struck C, Ernst M, Hahn M. Characterization of a developmentally regulated amino acid transporter (AAT1p) of the rust fungus Uromyces fabae. Molecular Plant Pathology , 2002, 3 (1) : 23–30 . |
| [24] | Struck C, Muller E, Martin H, Lohaus G. The Uromyces fabae UfAAT3 gene encodes a general amino acid permease that prefers uptake of in planta scarce amino acids. Molecular Plant Pathology , 2004, 5 (3) : 183–189 . |
| [25] | Yin CT, Downey SI, Klages-Mundt NL, Ramachandran S, Chen XM, Szabo LJ, Pumphrey M, Hulbert SH. Identification of promising host-induced silencing targets among genes preferentially transcribed in haustoria of Puccinia. BMC Genomics , 2015, 16 (1) : 579–592 . |
| [26] | Bruce M, Neugebauer KA, Joly DL, Migeon P, Cuomo CA, Wang S, Akhunov E, Bakkeren G, Kolmer JA, Fellers JP. Using transcription of six Puccinia triticina races to identify the effective secretome during infection of wheat. Frontiers in Plant Science , 2014, 4 : 520 . |
| [27] | 杜冬冬.两个不同致病类型小麦叶锈菌株差异表达分析及其分泌蛋白的筛选.河北农业大学硕士学位论文, 2015. |
| [28] | Godfrey D, B hlenius H, Pedersen C, Zhang ZG, Emmersen J, Thordal-Christensen H. Powdery mildew fungal effector candidates share N-terminal Y/F/WxC-motif. BMC Genomics , 2010, 11 (1) : 317–330 . |
| [29] | Kemen E, Kemen AC, Rafiqi M, Hempel U, Mendgen K, Hahn M, Voegele RT. Identification of a protein from rust fungi transferred from haustoria into infected plant cells. Molecular Plant Microbe Interactions , 2005, 18 (11) : 1130–1139 . |
| [30] | Perfect SE, Green JR. Infection structures of biotrophic and hemibiotrophic fungal plant pathogens. Molecular Plant Pathology , 2001, 2 (2) : 101–108 . |
| [31] | Soylu S. Ultrastructural characterisation of the host-pathogen interface in white blister-infected Arabidopsis leaves. Mycopathologia , 2004, 158 (4) : 457–464 . |
| [32] | Mims CW, Rodriguez-Lother C, Richardson EA. Ultrastructure of the host-pathogen interface in daylily leaves infected by the rust fungus Puccinia hemerocallidis. Protoplasma , 2002, 219 (3/4) : 221–226 . |
| [33] | Weaver LM, Swiderski MR, Li Y, Jones JDG. The Arabidopsis thaliana TIR-NB-LRR R-protein, RPP1A; protein localization and constitutive activation of defence by truncated alleles in tobacco and Arabidopsis. The Plant Journal , 2006, 47 (6) : 829–840 . |
| [34] | Dodds PN, Lawrence GJ, Catanzariti AM, Ayliffe MA, Ellis JG. The Melampsora lini AvrL567 avirulence genes are expressed in haustoria and their products are recognized inside plant cells. The Plant Cell , 2004, 16 (3) : 755–768 . |
| [35] | Catanzariti AM, Dodds PN, Lawrence GJ, Ayliffe MA, Ellis JG. Haustorially expressed secreted proteins from flax rust are highly enriched for avirulence elicitors. The Plant Cell , 2006, 18 (1) : 243–256 . |
| [36] | Manning VA, Ciuffetti LM. Localization of Ptr ToxA produced by Pyrenophora tritici-repentis reveals protein import into wheat mesophyll cells. The Plant Cell , 2005, 17 (11) : 3203–3212 . |
| [37] | Samaj J, Baluska F, Voigt B, Schlicht M, Volkmann D, Menzel D. Endocytosis, actin cytoskeleton, and signaling. Plant Physiology , 2004, 135 (3) : 1150–1161 . |
| [38] | Bozkurt TO, Belhaj K, Dagdas YF, Chaparro-Garcia A, Wu CH, Cano LM, Kamoun S. Rerouting of plant late endocytic trafficking toward a pathogen interface. Traffic , 2015, 16 (2) : 204–226 . |
| [39] | Whisson SC, Boevink PC, Moleleki L, Avrova AO, Morales JG, Gilroy EM, Armstrong MR, Grouffaud S, van West P, Chapman S, Hein I, Toth IK, Pritchard L, Birch PRJ. A translocation signal for delivery of oomycete effector proteins into host plant cells. Nature , 2007, 450 (7166) : 115–118 . |
| [40] | Dou DL, Kale SD, Wang X, Jiang RHY, Bruce NA, Arredondo FD, Zhang XM, Tyler BM. RXLR-mediated entry of Phytophthora sojae effector Avr1b into soybean cells does not require pathogen-encoded machinery. The Plant Cell , 2008, 20 (7) : 1930–1947 . |
| [41] | Schornack S, van Damme M, Bozkurt TO, Cano LM, Smoker M, Thines M, Gaulin E, Kamoun S, Huitema E. Ancient class of translocated oomycete effectors targets the host nucleus. Proceedings of the National Academy of Sciences of the United States of America , 2010, 107 (40) : 17421–17426 . |
| [42] | Haas BJ, Kamoun S, Zody MC, Jiang RHY, Handsaker RE, Cano LM, Grabherr M, Kodira CD, Raffaele S, Torto-Alalibo T, Bozkurt TO, Ah-Fong, A MV, Alvarado L, Anderson VL, Armstrong MR, Avrova A, Baxter L, Beynon J, Boevink PC, Bollmann SR, Bos JIB, Bulone V, Cai GH, Cakir C, Carrington JC, Chawner M, Conti L, Costanzo S, Ewan R, Fahlgren N, Fischbach MA, Fugelstad J, Gilroy EM, Gnerre S, Green PJ, Grenville-Briggs LJ, Griffith J, Grünwald NJ, Horn K, Horner NR, Hu CH, Huitema E, Jeong DH, Jones AME, Jones JDG, Jones RW, Karlsson EK, Kunjeti SG, Lamour K, Liu ZY, Ma LJ, Maclean D, Chibucos MC, McDonald H, McWalters J, Meijer HJG, Morgan W, Morris PF, Munro CA, O'Neill K, Ospina-Giraldo, M, Pinzón A, Pritchard L, Ramsahoye B, Ren QH, Restrepo S, Roy S, Sadanandom A, Savidor A, Schornack S, Schwartz DC, Schumann UD, Schwessinger B, Seyer L, Sharpe T, Silvar C, Song J, Studholme DJ, Sykes S, Thines M, van de Vondervoort PJI, Phuntumart V, Wawra S, Weide R, Win J, Young C, Zhou SG, Fry W, Meyers BC, van West P, Ristaino J, Govers F, Birch PRJ, Whisson SC, Judelson HS, Nusbaum C. Genome sequence and analysis of the Irish potato famine pathogen Phytophthora infestans. Nature , 2009, 461 (7262) : 393–398 . |
| [43] | Tyler BM. Entering and breaking: virulence effector proteins of oomycete plant pathogens. Cellular Microbiology , 2009, 11 (1) : 13–20 . |
| [44] | Dodds PN, Rathjen JP. Plant immunity: towards an integrated view of plant-pathogen interactions. Nature Reviews Microbiology , 2010, 11 (8) : 539–548 . |
| [45] | Pliego C, Nowara D, Bonciani G, Gheorghe DM, Xu R, Surana P, Whigham E, Nettleton D, Bogdanove AJ, Wise RP, Schweizer P, Bindschedler LV, Spanu PD. Host-induced gene silencing in barley powdery mildew reveals a class of ribonuclease-like effectors. Molecular Plant Pathology , 2013, 26 (6) : 633–642 . |
| [46] | Schmidt SM, Kuhn H, Micali C, Liller C, Kwaaitaal M, Panstruga R. Interaction of a Blumeria graminis ff. sp. hordei effector candidate with a barley ARF-GAP suggests that host vesicle trafficking is a fungal pathogenicity target. Molecular Plant-Microbe Interactions , 2014, 15 (6) : 535–549 . |
| [47] | Doehlemann G, van der Linde K, A mann D, Schwammbach D, Hof A, Mohanty A, Jackson D, Kahmann R. Pep1, a secreted effector protein of Ustilago maydis, is required for successful invasion of plant cells. PLoS Pathogens , 2009, 5 (2) : e1000290 . |
| [48] | Hemetsberger C, Herrberger C, Zechmann B, Hillmer M, Doehlemann G. The Ustilago maydis effector Pep1 suppresses plant immunity by inhibition of host peroxidase activity. PLoS Pathogens , 2012, 8 (5) : e1002684 . |
| [49] | Mueller AN, Ziemann S, Treitschke S, A mann D, Doehlemann G. Compatibility in the Ustilago maydis-maize interaction requires inhibition of host cysteine proteases by the fungal effector Pit2. PLoS Pathogens , 2013, 9 (2) : e1003177 . |
| [50] | Djamei A, Schipper K, Rabe F, Ghosh A, Vincon V, Kahnt J, Osorio S, Tohge T, Fernie AR, Feussner I, Feussner K, Meinicke P, Stierhof YD, Schwarz H, Macek B, Mann M, Kahmann R. Metabolic priming by a secreted fungal effector. Nature , 2011, 478 (7369) : 395–398 . |
| [51] | Kemen E, Kemen A, Ehlers A, Voegele R, Mendgen K. A novel structural effector from rust fungi is capable of fibril formation. The Plant Journal , 2013, 75 (5) : 767–780 . |
| [52] | Ve T, Williams SJ, Catanzariti AM, Rafiqi M, Rahman M, Ellis JG, Hardham AR, Jones DA, Anderson PA, Dodds PN, Kobe B. Structures of the flax-rust effector AvrM reveal insights into the molecular basis of plant-cell entry and effector-triggered immunity. Proceedings of the National Academy of Sciences of the United States of America , 2013, 110 (43) : 17594–17599 . |
| [53] | Demarsy E, Lakshmanan AM, Kessler F. Border control: selectivity of chloroplast protein import and regulation at the TOC-complex. Frontiers in Plant Science , 2014, 5 : 483 . |
| [54] | Hicks SW, Galán JE. Exploitation of eukaryotic subcellular targeting mechanisms by bacterial effectors. Nature Reviews Microbiology , 2013, 11 (5) : 316–326 . |
| [55] | Sperschneider J, Gardiner DM, Dodds PN, Tini F, Covarelli L, Singh KB, Manners JM, Taylor JM. EffectorP: predicting fungal effector proteins from secretomes using machine learning. New Phytologist , 2015 . DOI:10.1111/nph.13794 |
 2016, Vol. 56
2016, Vol. 56