
中国科学院微生物研究所,中国微生物学会,中国菌物学会
文章信息
- 张长风 , 余利岩 , 张玉琴 . 2017
- Zhang Changfeng, Yu Liyan, Zhang Yuqin . 2017
- 小月菌属放线菌的研究进展
- Research progress on the genus Microlunatus
- 微生物学报, 2017, 57(2): 179-187
-
文章历史
- 收稿日期:2016-05-25
- 修回日期:2016-07-29
- 网络出版日期:2016-08-17
由细菌、原生动物和藻类等微生物群体及它们所依附的有机物质和无机物质组成的活性污泥(active sludge),广泛应用于生活与工业的废水处理。早期研究方法的局限性,使得人们对于活性污泥中微生物组成及其具体功能的认知少之又少。随着以高通量测序为主要研究手段来揭示原核生物多样性的研究方法的不断发展与广泛应用,研究人员发现,活性污泥中实际存在的微生物类群远比纯培养所获得的微生物种类丰富[1],除了厌氧、好氧的革兰氏阴性细菌,还包括许多革兰氏阳性球菌类群,小月菌属便是其中的一类。
小月菌属(Microlunatus)菌株是一类革兰氏阳性、化能有机异养的好氧微生物,隶属于细菌域-放线菌门(Actinobacteria)-放线菌纲(Actinobacteria)- 丙酸杆菌目(Propionibacterineae)-丙酸杆菌科(Propionibacteriaceae),包括7个有效描述种,积磷小月菌(Microlunatus phosphovorus)为其模式种。
小月菌属的成员不仅栖息环境多样,而且还表现出多种生理活性,例如,Microlunatus phosphovorus具有磷酸盐代谢能力,以及可以大量产生聚羟基脂肪酸酯(PHA);Microlunatus aurantiacus能够降解磷酸盐[2];Microlunatus panaciterrae产生的β-半乳糖苷酶,能够分解人参皂苷[3]。因此,小月菌属菌株在生物除磷、污水治理和环境修复等方面呈现出巨大的研究价值和开发潜力,使之成为一类珍贵的新型资源微生物。
1 小月菌属的建立及研究现状 1.1 小月菌属的建立1990年,Nakamura等从富含磷酸盐的活性污泥中分离获得43个含有异染粒的单菌落,并从中挑选出磷酸盐代谢能力较强的12株菌进行深入研究。以积聚磷酸盐能力最强的菌株NM-1作为模式生物,探究了其积聚磷酸盐作用的机制[4]。1995年,Nakamura等从形态、化学分类学和系统发育学的角度对菌株NM-1的分类学地位做出了综合分析与讨论。16S rRNA基因信息比较结果显示,菌株NM-1与丙酸杆菌科(Propionibacteriaceae)内成员的系统进化关系最为密切,最相近的属是黄球菌属(Luteococcus)。在细胞化学组成上,菌株NM-1具有与黄球菌属相同的特征性细胞壁肽聚糖LL-二氨基庚二酸(LL-DAP)及优势甲基萘醌[MK-9(H4)]组分;同时,菌株NM-1又具有区别于黄球菌属的化学分类特征,如NM-1的优势脂肪酸组分为含支链的饱和脂肪酸(anteiso-C15:0、iso-C15:0和iso-C16:0),而非不饱和脂肪酸。生物学特性方面,菌株NM-1显示出较强的硝酸盐还原及积聚磷酸盐能力,是严格好氧微生物。综合其基因型与表型特征,以菌株NM-1为模式生物,建立了1个新的菌属——小月菌属(Microlunatus)[5]。
1.2 小月菌属及其近缘属丙酸杆菌科(Propionibacteriaceae)最初由Delwiche于1957年建立,1997年,Stackebrandt等依据16S rRNA特征核苷酸分析结果,对其做了重新修订[6]。目前,丙酸杆菌科囊括了丙酸杆菌属(Propionibacterium)、小月菌属、黄球菌属、产丙酸菌属(Propionibacterium)、四球菌属(Tessaracoccus)等15个属,丙酸杆菌属为其模式属。在基于丙酸杆菌科相关菌株的16S rRNA基因序列构建的系统进化树中,小月菌属与以下各属关系较近:弗莱德门菌属(Friedmanniella)、Naumannella、微白霜菌属(Micropruina)和产丙酸单胞菌属(Propionicimonas) (图 1)。其中,小月菌属与1997年建立的弗莱德门菌属在形态和化学分类特征上最为相近,例如,细胞形态同为球形,特征性细胞壁肽聚糖二氨基庚二酸组分均为LL-DAP,胞壁类型都是A3γ型,主要的甲基萘醌都是MK-9(H4),优势脂肪酸组分为anteiso-C15:0和iso-C15:0,特征性极性脂组分均包括双磷脂酰甘油(DPG)和磷脂酰甘油(PG)[7-10]。小月菌属与其他近缘属的分类学特征的比较结果详见表 1。
| Characteristic | Microlunatus | Friedmanniella | AuraticoccusAuraticoccus | Naumannella | Propionicicella | Propionicimonas | Micropruina |
| Cell | cocci/ rod-shaped | cocci in packets | cocci | cocci | rod-shaped | irregular rods | coccoid |
| pH | 5.0-9.0 | 5.5-8.5 | 6.5-9.0 | 6.0-8.0 | 4.5-8.5 | 4.5-7.5 | 5.0-9.0 |
| Temperature range/°C | 20-30 | 5-37 | 15-30 | 15-37 | 15-37 | 10-40 | 20-35 |
| NaCl tolerance/(%,w/v) | 0-5 | 0-4 | 0-5 | 0-10 | ND | 0-2 | 0-3 |
| Colour ofcolony | yellow/cream | orange | golden orange | pale yellow | white | white | white |
| Diagnostic diamino acid | LL-DAP | LL-DAP | LL-DAP | LL-DAP | meso-DAP | meso-DAP | meso-DAP |
| Respiratory quinones | MK-9(H4) | MK-9(H4) | MK-8(H2)MK-9(H2)MK-9(H4)MK-9 | MK-8(H4)MK-9(H4). | MK-9 | MK-9(H4)MK-10(H4) | MK-9(H4) |
| Cellular fattyacid | anteiso-C15:0iso-C15:0iso-C16:0 | anteiso-C15:0iso-C15:0iso-C14:0 | anteiso-C15:0anteiso-C15:1iso-C15:0 | anteiso-C15:0 | anteiso-C15:0C15:0iso-C16:0 | anteiso-C15:0iso-C15:0iso-C14:0 | anteiso-C15:0,iso-C14:0iso-C16:0 C16:0 |
| Polar lipids | PG,DPG | PI,PG,DPG,PL,(GL) | PG,DPG,PGL,PL,GL, | PG,DPG | ND | ND | ND |
| DNA G+Ccontent/(mol%) | 65.10-70.90 | 69.00-74.00 | 73.50 | 67.70 | 69.90 | 67.40-68.70 | 70.50 |
| ND: no Data; PG: phosphatidylglycerol; DPG: diphosphatidylglycerol; PI: phosphatidylinositol; GL: unknown glycolipids; PL: unknown phospholipid; PGL: unknown phosphoglycolipid. | |||||||
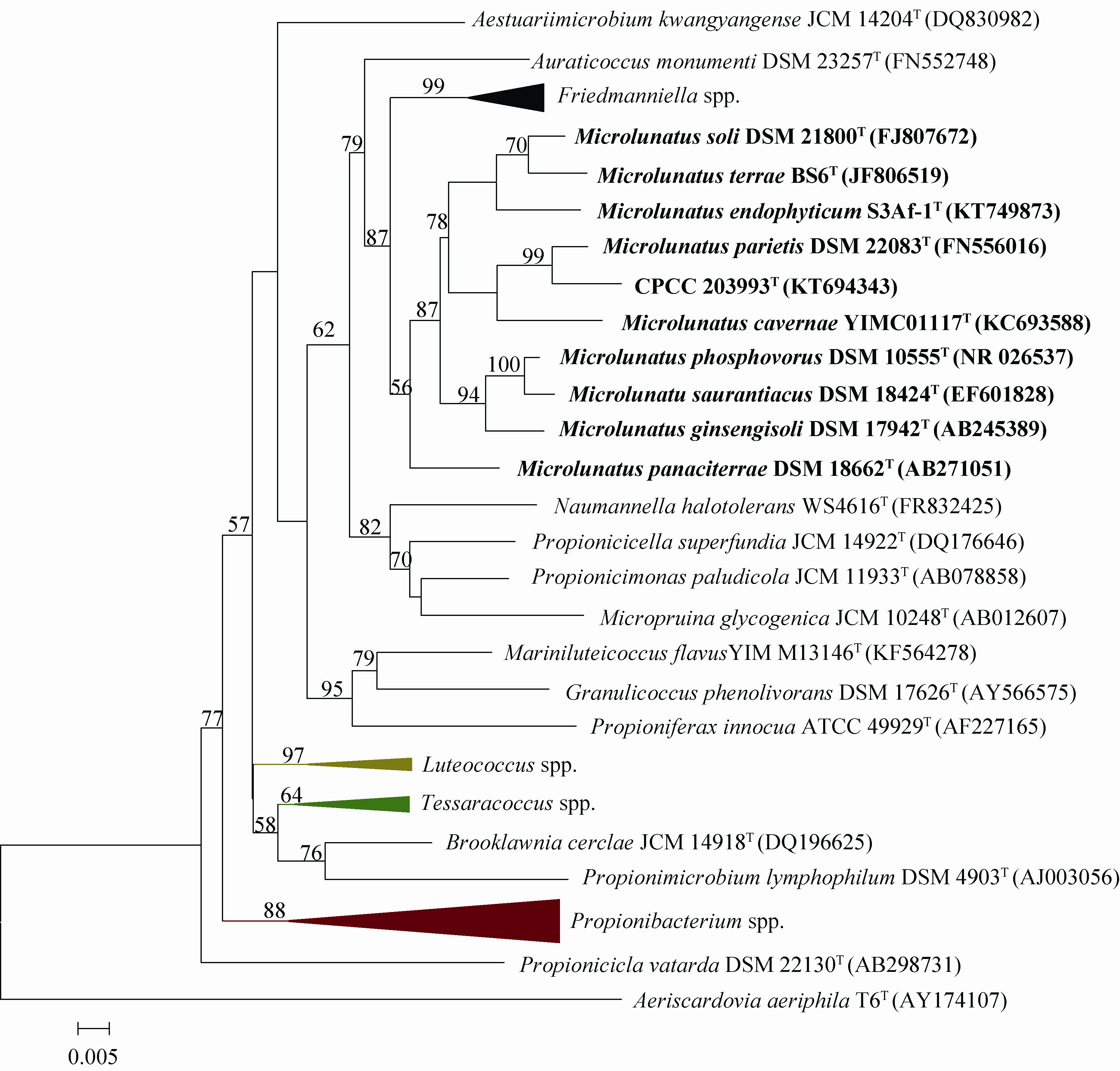
|
| 图 1. 基于丙酸杆菌科各属代表菌株的16S rRNA基因序列构建的N-J系统进化树 Figure 1. Neighbour-joining phylogenetic tree based on 16S rRNA gene sequences of the representative members of the genera of the family Propionibacteriaceae. Bar,05% sequence divergence. |
1.3 小月菌属的分类学特征 1.3.1 形态和生理生化特征: 小月菌属菌株细胞形态多为球形,单一、成对或成簇排列,个别菌株细胞呈短棒状或不规则棒状。处于生长静止期的细胞在中间部位常具有细胞壁结构,细胞生长至2-4 d时,球形细胞直径大小为0.5-2.0 μm。细胞无运动能力,不形成孢子,菌落为圆形凸起、表面光滑无光泽,革兰氏染色反应阳性。 该属菌株为化能有机异养的严格好氧菌,过氧化氢酶反应阳性,不产生H2S气体,不耐酸,适宜生长的pH值范围:pH 5-9,生长温度:20-30 °C;可利用糖和糖醇等多种有机物作为唯一碳源和能量来源,生长速率较缓慢。目前发现的菌株中,多数氧化酶反应呈阴性,只有M. soli、M. panaciterrae和M. endophyticus种内菌株氧化酶反应呈阳性;M. phosphovorus、M. aurantiacus、M. soli和M. parietis种内菌株硝酸盐还原反应呈阳性。 1.3.2 化学分类学特征: 小月菌属成员的细胞壁肽聚糖都含有LL-DAP、丙氨酸、甘氨酸和谷氨酸,胞壁肽聚糖类型为A3γ型,并且菌株M. phosphovorus和M. soli的肽桥只包含1个甘氨酸;优势甲基萘醌组分多为MK-9(H4),部分菌株含有少量MK-9(H8)、MK-9、MK-8(H4)、MK-8(H2)和MK-8等,此外,菌株M. endophyticus主要甲基萘醌为MK-9(H6);全细胞水解物糖组分包括阿拉伯糖、半乳糖、鼠李糖和葡萄糖;主要磷酸类脂组分为双磷脂酰甘油(DPG)和磷脂酰甘油(PG),部分菌株还含有磷脂酰肌醇(PI)、磷脂酰乙醇胺(PE)、未知磷脂(PL)、未知甘油酯(GL)或糖基磷脂;优势脂肪酸组分为anteiso-C15:0、iso-C15:0和iso-C16:0,属于FA2c类型,菌株Microlunatus ginsengsoli和Microlunatus panaciterrae还含有不饱和脂肪酸C18:1ω7c组分。 Busse等研究了包括小月菌属在内的10个属共26 株菌的多胺类型:其中类诺卡氏属以及与其近缘的气微菌属含有尸胺,小月菌属、黄球菌属等4个属的模式菌株含有精胺和亚精胺,间孢囊菌属等3个属的特征多胺为腐胺[11]。因此,多胺可作为区分细胞壁肽聚糖中含LL-DAP的放线菌各类群的一项参考分类指标。 1.3.3 分子分类特征:小月菌属菌株隶属于丙酸杆菌科,丙酸杆菌科的16S rRNA的特征性核苷酸位点包括:688:699(G-C)、701(C)、823:877(G-C)和1060:1197(U-A)[12]。在基于丙酸杆菌科相关菌株16S rRNA基因序列构建的系统进 化树中,小月菌属各成员聚在一起且形成一个稳定的分支,并与弗莱德门菌属(Friedmanniella)、Naumannella、微白霜菌属(Micro pruina)和产丙酸单胞菌属(Propionicimonas)成员为邻。小月菌属成员的基因组DNA (G+C) mol%含量为65.1%-70.9%。 1.4 小月菌属的研究现状
自1995年Nakamura等以积磷小月菌为模式种建立小月菌属以来,在之后的十多年间,一直没有新的成员被报道。最近几年,随着原核微生物分离、培养和分类方法的发展,小月菌属的新成员也陆续从各种不同环境中被分离得到。到 目前为止,该属已涵盖了7个有效描述种:Microlunatus aurantiacus[2]、Microlunatus endophyticus[13]、Microlunatus ginsengisoli[14]、Microlunatus panaciterrae[3]、Microlunatus parietis[15]、Microlunatus phosphovorus [5]和Microlunatus soli[16]。另外,Lee和Journal of Microbiology上描述的2个新物种Microlunatus terrae和Microlunatus cavernae尚待“List of Prokaryotic names with Standing in Nomenclature”的进一步确认[17-18]。
小月菌属的成员分离自不同的生态环境,其中,以土壤环境为其主要来源,包括活性污泥、高丽参根际土、红豆杉根际土、树木腐殖土和岩洞土壤等。也有部分成员分离自其他生态环境,例如食用蘑菇的菌丝、室内的墙体、从人体面部采拭的样品以及蚂蚁体内环境等。
本实验室在对不同环境中放线菌多样性的研究过程中,分别从采集自青海省玉树藏族自治州可可西里沙土样品和黑龙江省黑龙山蒿子根际土样品中分离得到2株小月菌属菌株CPCC 203993和CPCC 100076。菌株CPCC 100076和CPCC 203993的16S rRNA基因序列相似性为99.8%,2菌株在形态学和生理生化特性上也呈现出高度相似的特征,二者的基因组DNA-DNA杂交值为87%,高于界定原核生物物种的界限值(70%)。因此,我们认为菌株CPCC 203993和CPCC 100076为同一个基因种的成员。随后,以CPCC 203993为代表菌株,对其进行了多相分类研究,结果概述如下。菌株CPCC 203993是化能异养好氧菌,革兰氏染色反应呈阳性。球形细胞,不具运动性,不产生内生孢子。能够在pH 6.0-8.0、0-3.0%的NaCl浓度范围、4-42 °C的温度范围内生长;最适生长条件是pH 8.0、NaCl浓度为1%-3%、20-28 °C。能够在ISP (国际链霉菌研究计划)系列培养基上生长。能够发酵以下碳源产酸:甘油、D-阿拉伯糖、L-阿拉伯糖、核糖、D-木糖、L-木糖、β-甲基-D-木糖甙、葡萄糖、山梨糖、鼠李糖、肌醇、α-甲基-D-甘露糖甙、α-甲基-D-葡萄糖甙、熊果甙、柳醇、纤维二糖、麦芽糖、乳糖、蜜二糖、蔗糖、海藻糖、木糖醇、龙胆二糖、D-松二糖、D-来苏糖、D-塔格糖、D-岩糖、L-岩糖、D-阿拉伯糖醇、L-阿拉伯糖醇、葡萄糖酸盐及2-酮基-葡萄糖酸盐。具有碱磷酶、类脂酯酶、白氨酸芳胺酶、缬氨酸芳胺酶、胱氨酸芳胺酶、胰蛋白酶、胰凝乳蛋白酶、酸性磷酸酶、α-半乳糖甙酶、β-半乳糖甙酶、α-葡萄糖甙酶、β-葡萄糖甙酶、N-乙酰-葡萄糖胺酶、β-岩藻糖甙酶、酯酶和类脂酶活性,但不具有β-糖醛酸甙酶和萘酚-磷酸水解酶活性。七叶苷水解、硫化氢产生、淀粉水解、明胶液化、氧化酶(API)、VP实验和甲基红实验呈阴性,而硝酸盐还原、过氧化氢酶和尿素水解反应为阳性。细胞壁含LL-DAP,全细胞水解物含有葡萄糖和阿拉伯糖,主要脂肪酸组分为antesio-C15:0、iso-C16:0和iso-C15:0,优势甲基萘醌是MK-9(H4),磷酸类脂包括磷脂酰甘油(PG)、二磷脂酰甘油(DPG)、磷脂酰肌醇(PI)和少量的未知糖脂(GL),基因组DNA的(G+C)含量为64.0 mol%。菌株CPCC 203993的16Sr RNA基因序列与Microlunatus parietis DSM 22083T相似性最高(97.8%),并且与小月菌属内其它菌株的相似性均低于97%。在基于丙酸杆菌科相关菌株16Sr RNA基因序列构建的系统进化树中,菌株CPCC 203993落在了小月菌属内,并与菌株Microlunatus parietis DSM 22083T形成一个亚分支。菌株CPCC 203993和Microlunatus parietis DSM 22083T的基因组DNA- DNA杂交值(31%)明显低于70% (界定原核生物物种的界限值)。因此,综合其基因型和表型特征,菌株CPCC 203993代表了小月菌属的一个新物种。由于菌株CPCC 203993的分离基物采集自黑龙江省的黑龙山,根据双命名法原则,我们把菌株CPCC 203993所代表的新物种命名为黑龙小月菌(Microlunatus nigridraconis sp. nov.)。
2 小月菌属的应用研究 2.1 小月菌属的生物除磷作用随着水体富营养化的加剧,水体生态治理的紧迫性也日益凸显,其中磷元素的循环引起了许多学者的广泛关注。活性污泥法一直是常规的污水处理方法,活性污泥中的微生物种类丰富,具有生物除磷作用的小月菌属菌株在活性污泥中起着关键作用[19]。因此,对小月菌属成员的生物除磷过程及作用机制进行深入研究,对于治理生活、工农业中磷元素导致的水质污染具有十分重要的意义。
强化生物除磷(EBPR)是指活性污泥中的优势微生物类群在有氧和无氧交替条件下进行磷酸盐代谢的过程,该过程由多种微生物共同作用,不易控制[20]。目前,研究人员已探明,M. phosphovorus是生物除磷过程中的主要微生物之一。
最初,Santos等通过在供氧和厌氧交替的环境条件下培养菌株M. phosphovorus,研究其代谢过程中磷元素和碳元素的变化,结果显示,在厌氧条件下胞内物质和谷氨酸盐得以累积,而在好氧的条件下被消耗。此项研究为进一步探究废水中的生物除磷作用奠定了基础[21]。2003年,Tanaka等发现M. phosphovorus中存在可利用多聚磷酸盐且不依赖ATP的葡萄糖激酶,即polyP-GK,这是首次发现严格意义上的polyP-GK,为研究polyP-GK和ATP/polyp-GK的长期进化过程提供了科学依据[22]。2012年,Begum等学者采用荧光原位杂交技术(FISH)证明,小月菌属是强化生物除磷(EBPR)过程中的主要聚磷微生物(PAO)之 一[23]。同年, Kawakoshi等研究者从分子生物学的角度,对M. phosphovorus的基因组进行了研究,发现M. phosphovorus基因组中用于编码多聚磷酸盐代谢酶的基因拷贝数,多于其他参与生物除磷过程的放线菌,间接证明了菌株M. phosphovorus NM-1T具有更为强大的磷酸盐代谢能力[24]。此外,另有研究报道,小月菌属的另一成员M. aurantiacus YIM 45721T同样具有一定的磷酸盐降解作用[2]。
2.2 小月菌可产生聚羟基脂肪酸酯(PHA)菌株M. PhosphovorusDSM 10555T除了具有较强的磷酸盐降解能力,还能够产生大量的聚羟基脂肪酸酯(PHA)和少量的发酵副产物,可作为生产PHA的工业菌种,应用于大规模工业化生产[25]。PHA是许多微生物合成的一种胞内聚酯,在生物体内主要是作为碳源和能源的贮藏性物质而存在[26]。PHA的物理性能类似于传统的合成塑料,同时具备合成塑料所没有的生物可降解性、生物相容性、光学活性、压电性、气体相隔性等诸多优秀性能,因此可作为传统的化学合成塑料的替代材料,被用于制造一次性环保塑料制品[27]、医用植入材料[28]、药物缓释材料以及化学药品合成的结构元件等[29],从而减轻日益严重的“白色污染”问题,并且在医学、医药、精细化工、光学工业中呈现出巨大的应用价值[3]。
2.3 小月菌属的其他应用小月菌属成员M. panaciterrae的发现,源于人参皂苷代谢的研究。该菌含有β-半乳糖苷酶,能够分解人参皂苷[1]。2014年,研究人员从北冰洋楚科奇海陆架区的沉积物中分离得到1株具有抗枯草芽孢杆菌活性的小月菌y400,它含有编码多种次级代谢产物生物合成关键酶的基因,如编码Ⅰ型聚酮合酶(PKSⅠ)、dTDP-葡萄糖-4,6-脱氧-酮基酶(dTGD)、卤化酶(Halo)以及细胞色素P450羟化酶(CYP)的基因,从而为菌株y400产生有效的次级代谢产物的进一步研究提供理论依据[30]。
3 展望目前,有关小月菌属成员M. phosphovorus在磷酸盐代谢方面的研究较为深入,但是对该属其他菌株磷酸盐代谢能力的探究相对较少,甚至仍未开展任何相关研究。因此,进一步扩大研究菌株的范围,有利于筛选到更好的功能菌株。此外,在EBPR中,分离获得聚磷菌纯培养物仍是一项艰巨任务,并且在实验室建立的磷酸盐代谢模型中,具体的代谢途径以及如何在实际应用中优化培养条件等,也有待于进一步探索。
随着现代分子生物学技术的快速发展,一系列基于免培养的技术方法,如PCR技术、电泳技术、克隆文库技术、荧光原位杂交技术(FISH)、流式细胞技术(FCM)和组学技术,正在成为研究微生物群落结构及多样性的主要手段。越来越多的、广泛存在但依靠传统检测方法未能发现的、难培养的微生物将会被不断地从各种生态环境中发掘出来。小月菌属菌株的时空分布特征、生态功能及应用也将从微生物组学信息中得到更为全面的阐释。
| [1] | Maszenan AM, Seviour RJ, Patel BKC, Schumann P, Burghardt J, Tokiwa Y, Stratton HM. Three isolates of novel polyphosphate-accumulating gram-positive cocci, obtained from activated sludge, belong to a new genus, Tetrasphaera gen. International Journal of Systematic and Evolutionary Microbiology , 2000, 50 (2) : 593–603 DOI:10.1099/00207713-50-2-593 . |
| [2] | Wang YX, Cai M, Zhi XY, Zhang YQ, Tang SK, Xu LH, Cui XL, Li WJ. Microlunatus aurantiacus sp. International Journal of Systematic and Evolutionary Microbiology , 2008, 58 (8) : 1873–1877 DOI:10.1099/ijs.0.65518-0 . |
| [3] | An DS, Im WT, Yoon MH. Microlunatus panaciterrae sp. International Journal of Systematic and Evolutionary Microbiology , 2008, 58 (12) : 2734–2738 DOI:10.1099/ijs.0.65004-0 . |
| [4] | Nakamura K, Masuda K, Mikami E. Isolation of a new type of polyphosphate accumulating bacterium and its phosphate removal characteristics. Journal of Fermentation and Bioengineering , 1991, 71 (4) : 258–263 DOI:10.1016/0922-338X(91)90278-O . |
| [5] | Nakamura K, Hiraishi A, Yoshimi Y, Kawaharasaki M, Masuda K, Kamagata Y. Microlunatus phosphovorus gen. International Journal of Systematic Microbiology , 1995, 45 (1) : 17–22 . |
| [6] | Stackebrandt E, Rainey FA, Ward-Rainey NL. Proposal for a new hierarchic classification system, Actinobacteria classis nov. International Journal of Systematic Bacteriology , 1997, 47 (2) : 479–491 DOI:10.1099/00207713-47-2-479 . |
| [7] | Iwai K, Aisaka K, Suzuki M. Friedmanniella luteola sp. International Journal of Systematic and Evolutionary Microbiology , 2010, 60 (1) : 113–120 DOI:10.1099/ijs.0.007815-0 . |
| [8] | Maszenan AM, Seviour RJ, Patel BKC, Schumann P, Burghardt J, Webb RI, Soddell JA, Rees GN. Friedmanniella spumicola sp. International Journal of Systematic Bacteriology , 1999, 49 (Pt4) : 1667–1680 . |
| [9] | Schumann P, Prauser H, Rainey FA, Stackebrandt E, Hirsch P. Friedmanniella antarctica gen. International Journal of Systematic Bacteriology , 1997, 47 (2) : 278–283 DOI:10.1099/00207713-47-2-278 . |
| [10] | Zhang X, Zhang J, Zhang Y, Xin Y, He H. Friedmanniella flava sp. International Journal of Systematic and Evolutionary Microbiology , 2013, 63 (Pt5) : 1771–1775 . |
| [11] | Busse HJ, Schumann P. Polyamine profiles within genera of the class Actinobacteria with LL-diaminopimelic acid in the peptidoglycan. International Journal of Systematic Bacteriology , 1999, 49 (1) : 179–184 DOI:10.1099/00207713-49-1-179 . |
| [12] | Zhi XY, Li WJ, Stackebrandt E. An update of the structure and 16S rRNA gene sequence-based definition of higher ranks of the class Actinobacteria, with the proposal of two new suborders and four new families and emended descriptions of the existing higher taxa. International Journal of Systematic and Evolutionary Microbiology , 2009, 59 (3) : 589–608 DOI:10.1099/ijs.0.65780-0 . |
| [13] | Tuo L, Li J, Liu SW, Liu Y, Hu L, Chen L, Jiang MG, Sun CH. Microlunatus endophyticus sp. International Journal of Systematic and Evolutionary Microbiology , 2016, 66 (1) : 481–486 DOI:10.1099/ijsem.0.000779 . |
| [14] | Cui YS, Im WT, Yin CR, Yang DC, Lee ST. Microlunatus ginsengisoli sp. International Journal of Systematic and Evolutionary Microbiology , 2007, 57 (4) : 713–716 DOI:10.1099/ijs.0.64395-0 . |
| [15] | Kämpfer P, Schäfer J, Lodders N, Martin K. Microlunatus parietis sp. International Journal of Systematic and Evolutionary Microbiology , 2010, 60 (10) : 2420–2423 DOI:10.1099/ijs.0.020115-0 . |
| [16] | Kämpfer P, Young CC, Busse HJ, Chu JN, Schumann P, Arun AB, Shen FT, Rekha PD. Microlunatus soli sp. International Journal of Systematic and Evolutionary Microbiology , 2010, 60 (4) : 824–827 DOI:10.1099/ijs.0.013540-0 . |
| [17] | Lee JJ, Kim MK. Microlunatus terrae sp. Journal of Microbiology , 2012, 50 (3) : 547–552 DOI:10.1007/s12275-012-1623-6 . |
| [18] | Cheng J, Chen W, Huo-Zhang B, Nimaichand S, Zhou EM, Lu XH, Klenk HP, Li WJ. Microlunatus cavernae sp. Antonie van Leeuwenhoek , 2013, 104 (1) : 95–101 DOI:10.1007/s10482-013-9929-x . |
| [19] | Mudaly DD, Atkinson BW, Bux F. 16S rRNA in situ probing for the determination of the family level community structure implicated in enhanced biological nutrient removal. Water Science and Technology , 2001, 43 (1) : 91–98 . |
| [20] | Shintani T, Liu WT, Hanada S, Kamagata Y, Miyaoka S, Suzuki T, Nakamura K. Micropruina glycogenica gen. International Journal of Systematic and Evolutionary Microbiology , 2000, 20 (1) : 201–207 . |
| [21] | Santos MM, Lemos PC, Reis MA, Santos H. Glucose metabolism and kinetics of phosphorus removal by the fermentative bacterium Microlunatus phosphovorus. Applied and Environmental Microbiology , 1999, 65 (9) : 3920–3928 . |
| [22] | Tanaka S, Lee SO, Hamaoka K, Kato J, Takiguchi N, Nakamura K, Ohtake H, Kuroda A. Strictly polyphosphate-dependent glucokinase in a polyphosphate-accumulating bacterium, Microlunatus phosphovorus. Journal of Bacteriology , 2003, 185 (18) : 5654–5656 DOI:10.1128/JB.185.18.5654-5656.2003 . |
| [23] | Begum SA, Batista JR. Microbial selection on enhanced biological phosphorus removal systems fed exclusively with glucose. World Journal of Microbiology & Biotechnology , 2012, 28 (5) : 2181–2193 . |
| [24] | Kawakoshi A, Nakazawa H, Fukada J, Sasagawa M, Katano Y, Nakamura S, Hosoyama A, Sasaki H, Ichikawa N, Hanada S, Kamagata Y, Nakamura K, Yamazaki S, Fujita N. Deciphering the genome of polyphosphate accumulating actinobacterium Microlunatus phosphovorus. DNA Research , 2012, 19 (5) : 383–394 DOI:10.1093/dnares/dss020 . |
| [25] | Akar A, Akkaya EU, Yesiladali SK, Çelikyilmaz G, Çokgor EU, Tamerler C, Orhon D, Çakar ZP. Accumulation of polyhydroxyalkanoates by Microlunatus phosphovorus under various growth conditions. Journal of Industrial Microbiology & Biotechnology , 2006, 33 (3) : 215–220 . |
| [26] | Canetti M, Urso M, Sadocco P. Influence of the morphology and of the supermolecular structure on the enzymatic degradation of bacterial poly(3-hydroxybutyrate). Polymer , 1999, 40 (10) : 2587–2594 DOI:10.1016/S0032-3861(98)00503-5 . |
| [27] | Chen GQ, Wu Q, Xi JZ, Yu HP. Microbial production of biopoly esters-polyhydroxyalkanoates. Progress in Natural Science , 2000, 10 (11) : 843–850 . |
| [28] | Williams SF, Martin DP, Horowitz DM, Peoples OP. PHA applications:addressing the price performance issue:I. International Journal of Biological Macromolecules , 1999, 25 (1/3) : 111–121 . |
| [29] | Chen GQ, Wu Q. Microbial production and applications of chiral hydroxyalkanoates. Applied Microbiology & Biotechnology , 2005, 67 (5) : 592–599 . |
| [30] | Yuan M, Yu Y, Li HR, Dong N, Zhang XH. Phylogenetic diversity and biological activity of actinobacteria isolated from the Chukchi Shelf marine sediments in the Arctic Ocean. Marine Drugs , 2014, 12 (3) : 1281–1297 DOI:10.3390/md12031281 . |
 2017, Vol. 57
2017, Vol. 57




