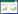中国科学院微生物研究所,中国微生物学会,中国菌物学会
文章信息
- 吴玉珍, 洪亚天, 刘全力, 徐海津, 白艳玲, 张秀明, 乔明强. 2018
- Yuzhen Wu, Yatian Hong, Quanli Liu, Haijin Xu, Yanling Bai, Xiuming Zhang, Mingqiang Qiao. 2018
- 双孢蘑菇酪氨酸酶基因在酿酒酵母中的异源表达及其酶学特性
- Expression and characterization of tyrosinase from Agaricus bisporus in Saccharomyces cerevisiae
- 微生物学报, 58(3): 423-431
- Acta Microbiologica Sinica, 58(3): 423-431
-
文章历史
- 收稿日期:2017-04-23
- 修回日期:2017-06-10
- 网络出版日期:2017-08-04
2. 南开大学分子微生物学与技术教育部重点实验室, 天津 300071;
3. 济南市中心医院, 山东 济南 250013
2. Key Laboratory of Molecular Microbiology and Technology, Ministry of Education, Nankai University, Tianjin 300071, China;
3. Jinan Central Hospital, Jinan 250013, Shandong Province, China
酪氨酸酶是普遍存在于微生物、植物、无脊椎动物及哺乳动物中的一种多酚氧化酶[1]。在氧气的参与下,酪氨酸酶能将单酚类化合物(如酪氨酸)氧化为多酚类化合物(如L-多巴)及醌类化合物进而形成肉眼可见的黑色素[2]。酪氨酸酶属于三型铜蛋白,其酶活性中心含有一个双核的铜原子位点[3-4],铜原子与分子氧形成侧面桥连,从而发挥催化活性。因此酪氨酸酶发挥催化活性需要铜离子的参与。
目前来源于假单胞菌[5]、曲霉菌[6]、木霉菌[7]、漏斗棱孔菌[8]等微生物的酪氨酸酶基因均已被分离鉴定。其中双孢蘑菇来源的酪氨酸酶是真菌中最早被研究的[9]。酪氨酸酶在食品药品生产、医学、美容、生物传感器[10]及废水处理等多个领域中都发挥着重要作用。来源于双孢蘑菇的酪氨酸酶是目前唯一商品化的酪氨酸酶,但由于提取纯化的技术限制,商品化酪氨酸酶的价格昂贵且纯度不高。已有文献报道,商品酪氨酸酶中含有杂蛋白、碳水化合物、酚类化合物及漆酶等可能会干扰酪氨酸酶活性鉴定的杂质[11],因此对于获得低成本、高纯度、相对安全的异源酪氨酸酶的研究具有重要的意义。
酿酒酵母作为真核模式生物,且为非致病菌,用于表达双孢蘑菇来源的酪氨酸酶具有天然的优势,是进行微生物发酵生产黑色素的合适宿主。除此之外,针对酿酒酵母中酪氨酸产量测定方法的缺陷,酪氨酸酶在酿酒酵母中的表达亦可作为酪氨酸产量的生物传感器,为高通量筛选高产酪氨酸菌株提供了可能[12-13]。
本文在酿酒酵母中异源表达了双孢蘑菇来源的酪氨酸酶基因PPO2,对酪氨酸酶蛋白进行了分离纯化和鉴定,并对其在体外的催化条件进行了探索,特别对酪氨酸酶在酿酒酵母胞内的酶学特性进行了探究,为其在酿酒酵母中作为酪氨酸产量的生物传感器提供了实验依据。
1 材料和方法 1.1 材料 1.1.1 菌株和质粒: 本研究中用到的菌株和质粒如表 1所示。| Strains or plasmids | Characteristics | Source |
| BY4741 | MATa, his3Δ1, leu2Δ0, ura3Δ0, met15Δ0 | EUROSCARF |
| SC-pSP-G1 | BY4741 containing pSP-G1 plasmid | This study |
| SC-PPO2 | BY4741 containing pSP-G1-PPO2 | This study |
| pSP-G1 | Shuttle vector, Ampr, URA3 | EUROSCARF |
| pSP-G1-PPO2 | PPO2 expression vector | This study |
| DH5α | Host strain to amplify plasmid DNA and the mazF source | Laboratory stock |
| pGEM-T Easy | Cloning vector for the PCR products, Ampr | Promega |
1.1.2 培养基和生长条件: YPD培养基(g/L):葡萄糖20,蛋白胨20,酵母粉10。营养缺陷培养基SC-ura (g/L):葡萄糖20,硫酸铵5,无氨基酵母氮源1.7,无尿嘧啶氨基酸混合物1.3。LB培养基(g/L):胰蛋白胨10,酵母粉5,氯化钠10。氨苄青霉素的使用浓度为100 μg/mL。固体培养基加入20 g/L琼脂粉。BY4741的培养条件为30 ℃、200 r/min;大肠杆菌培养条件为37 ℃、200 r/min。 1.1.3 主要试剂: 实验所用PCR相关试剂、限制性内切酶、RNAiso Plus试剂盒、PrimeScript 1st Strand cDNA Synthesis Kit试剂盒购于大连宝生物工程有限公司;Super-Bradford Protein Assay Kit试剂盒、大肠杆菌感受态DH5α购自康为世纪生物科技有限公司;质粒快速小提试剂盒购于天根生物科技公司。 1.1.4 主要仪器设备: PCR热循环仪、DNA凝胶电泳仪、冷冻离心机、蛋白质半干转膜仪、752紫外可见分光光度计、凝胶成像仪、915型Accument pH计。 1.2 酪氨酸酶基因表达载体的构建
按照TaKaRa公司的RNAiso Plus及PrimeScript 1st Strand cDNA Synthesis Kit试剂盒说明书提取双孢蘑菇的总RNA并合成第一链cDNA,利用引物对PPO2-F (ATAACTAGTATGTCGCTGATTGC TACTGT)和PPO2-R (ATAAGATCTTCAATGGTG ATGGTGATGATGACCACCGTTAATAACATGCACCGCGA)进行PCR扩增克隆得到PPO2基因,并连接至pGEM-T Easy载体,转化大肠杆菌DH5α。测序验证序列正确的质粒与表达载体pSP-G1均通过Bgl Ⅱ、Spe Ⅰ双酶切后回收并连接,转化大肠杆菌,通过酶切验证后命名为pSP-G1-PPO2并保存菌种。
1.3 酪氨酸酶在酿酒酵母中的表达及纯化将质粒pSP-G1-PPO2转化至酿酒酵母BY4741中,利用营养缺陷标记URA3进行筛选,涂布至SC-ura培养基平板。通过菌落PCR验证正确的转化子命名为SC-PPO2。分别接种SC-PPO2与对照SC-pSP-G1菌株至5 mL SC-ura液体培养基中,培养至OD600为1.5–1.7时收集菌体,加入100 μL裂解液和50 mg玻璃珠振荡破碎10 min,4 ℃离心收集上清。取100 μL上清液,加入25 μL上样缓冲液,加热变性10 min后,进行SDS-PAGE凝胶电泳,银染显色及Western blot蛋白杂交。当凝胶电泳蛋白条带与预期一致后进行扩大培养,按照上述方法,同样进行细胞破碎,收集上清液,进行Ni-NTA柱纯化蛋白并脱盐处理。根据康为世纪Super-Bradford Protein Assay Kit试剂盒说明绘制BSA标准曲线,计算纯化样品中的蛋白浓度,纯化后的蛋白于–80 ℃保存。
1.4 酪氨酸酶活力的测定酪氨酸酶活力的测定参照文献[14]中的方法,以L-酪氨酸和L-多巴为底物,在酶促作用下生成产物黑色素,利用黑色素最大光吸收波长为475 nm,通过分光光度计测定黑色素光吸收值来测定酪氨酸酶的活力。
1.5 酪氨酸酶的体外酶学特性 1.5.1 底物浓度与酪氨酸酶活力的关系: L-酪氨酸浓度设置为0.1、0.2、0.5、1.0、2.0 mmol/L;L-多巴浓度设置为1、2、5、10、15、30 mmol/L。取100 μL酶液与2.9 mL分别含有底物L-酪氨酸或L-多巴的磷酸盐缓冲液(pH 7.0)充分混匀后测定反应体系的起始OD475,分别于常温条件下反应60 min与15 min,反应结束后测定终止OD475。 1.5.2 温度与酪氨酸酶活力的关系: L-酪氨酸浓度2 mmol/L,L-多巴浓度15 mmol/L,同样取100 μL酶液与2.9 mL含有底物的磷酸盐缓冲液(pH 7.0)混匀后测定初始OD475,分别置于20、30、37、45、55、65、75 ℃充分反应,L-酪氨酸与L-多巴反应体系分别于60 min和15 min后测定终止OD475。 1.5.3 pH与酪氨酸酶活力的关系: 分别配置含2 mmol/L L-酪氨酸,15 mmol/L L-多巴的磷酸盐缓冲液,分别将pH调节至4.0、5.0、6.0、7.0、8.0、9.0、10.0。同样取100 μL酶液与2.9 mL含有底物的磷酸盐缓冲液混匀后测定初始OD475,分别于常温条件下反应60 min与15 min,反应结束后测定终止OD475。 1.6 酪氨酸酶在酿酒酵母中的酶学特性测定 1.6.1 pH与酪氨酸酶活力的关系: 挑取酿酒酵母SC-PPO2单菌落于5 mL SC-ura液体培养基,30 ℃、220 r/min过夜培养,取250 μL培养物转接至5 mL SC-ura培养基,培养至OD600为3.5–4.0,补加酪氨酸至其终浓度为5 mg/mL,加入CuSO4至终浓度为1 mmol/L。加入NaOH分别调节pH至5.0、6.0、7.0、8.0、9.0、10.0。30 ℃继续培养24 h后,观察颜色变化,取出1 mL培养物,离心取上清测定OD475。 1.6.2 底物浓度与酪氨酸酶活力的关系: 同1.6.1所述培养菌体至OD600 3.5–4.0,加入NaOH调节pH至9.0,加入CuSO4至终浓度为1 mmol/L。补加L-酪氨酸至终浓度分别为0、0.1、0.5、1.0、2.5、5.0 mg/mL,30 ℃继续培养24 h后,观察颜色变化,取出1 mL培养物,离心取上清测定OD475。 1.6.3 铜离子浓度与酪氨酸酶活力的关系: 同1.6.1所述培养菌体至OD600为3.5–4.0,补加酪氨酸至其终浓度为2.5 mg/mL,加入NaOH调节pH至9.0,分别加入CuSO4至终浓度为0、0.1、0.2、0.5、1.0 mmol/L。30 ℃继续培养24 h后,观察颜色变化,取出1 mL培养物,离心取上清测定OD475。 2 结果和分析 2.1 酪氨酸酶基因表达载体的构建处理新鲜双孢蘑菇提取总RNA,结果如图 1-A所示。利用引物对PPO2-F/R克隆基因PPO2,其中下游引物引入his-TAG。反转录克隆到的基因PPO2如图 1-B所示。条带大小为1.7 kb,符合预期。连接pGEM-T Easy载体后验证正确的质粒与表达载体pSP-G1双酶切后纯化并连接。质粒通过Bgl Ⅱ、Spe Ⅰ双酶切,如图 1-C所示,得到7.3 kb与1.7 kb两条条带,符合预期,并进行测序将序列正确的转化子用于下一步实验。
|
| 图 1 酪氨酸酶基因表达载体的构建 Figure 1 Construction of expression vector of tyrosinase-coding gene PPO2. A: total RNA of Agaricus bisporus. B: clone of tyrosinase-coding gene PPO2 by RT-PCR. C: enzyme digestion analysis using Spe Ⅰ and Bgl Ⅱ. M: marker. |
2.2 酪氨酸酶在酿酒酵母中的表达及纯化
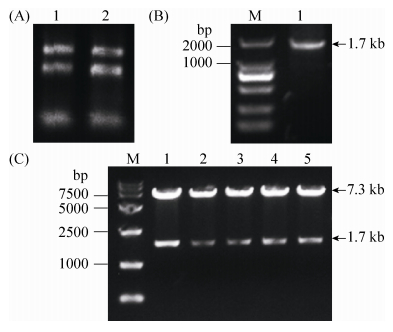
菌株SC-PPO2与对照SC-pSP-G1过夜培养,添加外源酪氨酸继续培养24 h,肉眼可见菌株SC-PPO2培养物变黑,如图 2-A中2号试管所示。1号试管为空白对照,无黑色素产生。表明PPO2基因在酿酒酵母中正确表达且具生物活性,能够将底物酪氨酸催化为黑色素。蛋白杂交检测结果如图 2-B所示,SC-PPO2菌株正确表达65 kDa大小的酪氨酸酶,泳道1空白对照中无此条带。
|
| 图 2 酪氨酸酶蛋白的表达、Western blot检测及纯化分析 Figure 2 The enzyme activity analysis, Western blot analysis and purification of recombinant tyrosinase. A: enzyme activity analysis of tyrosinase in Saccharomyces cerevisiae. Lane 1: control SC-pSP-G1; lane 2: recombinant SC-PPO2. B: Western blot analysis of recombinant tyrosinase. M: protein marker; lane 1: control SC-pSP-G1; lane 2: recombinant SC-PPO2. C: SDS-PAGE analysis of purified tyrosinase. M: protein marker; lane 1: recombinant strain SC-PPO2; lane 2: purified protein tyrosinase. |
酶液经过镍柱纯化且进行脱盐处理后,通过SDS-PAGE检测蛋白纯化结果。如图 2-C所示,纯化后条带单一,大小正确,表明纯化结果较好,可用于酪氨酸酶的活性检测。蛋白质定量采用牛血清蛋白BSA作为标准品,由标准曲线计算蛋白含量约为0.604 mg/mL。
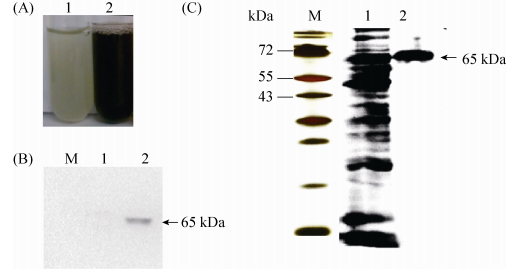
2.3 重组酪氨酸酶的体外酶学特性 2.3.1 底物浓度与酪氨酸酶活力的关系: 酪氨酸酶同时具有单酚氧化酶与多酚氧化酶的活性[15],因此我们选用L-酪氨酸与L-多巴分别作为底物表征酪氨酸酶的两种酶活性。酪氨酸酶活力与L-酪氨酸浓度的关系如图 3-A所示,可见当酪氨酸浓度低于2 mmol/L时,酶催化速率随底物浓度增加而升高,高于2 mmol/L时反应速率没有明显变化,表明此时底物已饱和;酪氨酸酶活力与L-多巴浓度的关系如图 3-B所示,当L-多巴浓度低于10 mmol/L时,酶催化速率也随底物浓度增加而升高,高于10 mmol/L后酶催化速率保持不变。根据Linewear-Burk方程1/V=(Km/Vmax)×1/[S]+1/Vmax,计算可得以酪氨酸为底物时Km=0.12 mmol/L,Vmax=97 U/min;以L-多巴为底物时,Km=1.86 mmol/L,Vmax=132 U/min。其中Km是酶催化反应的重要常数,表征酶与底物的亲和力,Km越小,酶与底物之间的亲和力越高。
|
| 图 3 底物浓度对酪氨酸酶活性的影响 Figure 3 Effect of substrate concentration on tyrosinase activity. Values represent results of three independent operations. The average and standard error were calculated. |
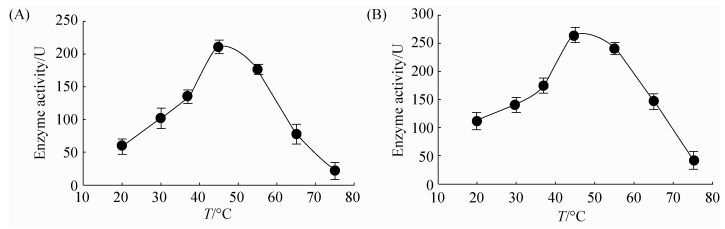
2.3.2 温度与酪氨酸酶活力的关系: 图 4显示的是酪氨酸酶活性受温度的影响,可见在45 ℃时酶活力达到最高,30–65 ℃酪氨酸酶均表现出较高的酶活力。
|
| 图 4 温度对酪氨酸酶活性的影响 Figure 4 Effect of temperature on tyrosinase activity. A: L-tyrosine as substrate; B: L-DOPA as substrate. Values represent results of three independent operations. The average and standard error were calculated. |
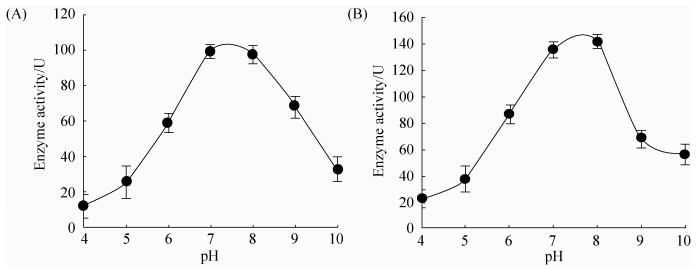
2.3.3 pH与酪氨酸酶活力的关系: 酪氨酸酶活力与pH关系如图 5所示,以L-酪氨酸为底物时最适pH约为7.0,以L-多巴为底物时最适pH约为8.0,表明酪氨酸酶发挥单酚氧化酶与多酚氧化酶的最适pH有所差别,但总体相近。
|
| 图 5 pH对酪氨酸酶活性的影响 Figure 5 Effect of pH on tyrosinase activity. A: L-tyrosine as substrate; B: L-DOPA as substrate. Values represent results of three independent operations. The average and standard error were calculated. |
2.4 酪氨酸酶在酿酒酵母中的酶学特性 2.4.1 pH与酪氨酸酶活力的关系: 将生长至稳定期的SC-PPO2培养体系分别调节pH至5.0–10.0,继续培养24 h后,培养体系的颜色变化如图 6所示。测得上清OD475的结果见表 2,与肉眼观察结果较为一致。将生长至稳定期的培养体系pH调为9.0时,培养24 h后,培养液中的pH值降为7.7,黑色素积累量最高。

|
| 图 6 pH对酿酒酵母胞内酪氨酸酶活性的影响 Figure 6 Effect of pH on tyrosinase activity in Saccharomyces cerevisiae. 1–6: pH: 5.0, 6.0, 7.0, 8.0, 9.0 and 10.0. |
| pH | OD475 |
| 5.0 | 0.443 |
| 6.0 | 0.596 |
| 7.0 | 1.395 |
| 8.0 | 2.081 |
| 9.0 | 3.249 |
| 10.0 | 2.794 |
2.4.2 底物浓度与酪氨酸酶活力的关系: 通过在培养体系中外源添加不同浓度的酪氨酸,颜色变化如图 7所示,上清OD475结果如表 3,可见酪氨酸浓度低于2.5 mg/mL时,黑色素随底物浓度增加而积累,高于2.5 mg/mL时,黑色素积累量保持稳定,底物达到饱和。

|
| 图 7 底物浓度对酿酒酵母胞内酪氨酸酶活性的影响 Figure 7 Effect of substrate concentration on tyrosinase activity in Saccharomyces cerevisiae. 1–6: tyrosine concentration: 0, 0.1, 0.5, 1.0, 2.5, 5.0 mg/mL. |
| c (Tyrosine)/(mg/mL) | OD475 |
| 0 | 0.147 |
| 0.1 | 0.415 |
| 0.5 | 1.296 |
| 1.0 | 2.285 |
| 2.5 | 3.445 |
| 5.0 | 3.549 |
2.4.3 铜离子浓度与酪氨酸酶活力的关系: Cu2+对酪氨酸酶发挥酶活性起着重要作用,添加不同浓度的CuSO4对酪氨酸酶活性的影响如图 8所示,上清OD475结果如表 4,可见Cu2+浓度不低于0.2 mmol/L时,酪氨酸酶可以发挥较高的催化活性。

|
| 图 8 Cu2+浓度对酿酒酵母胞内酪氨酸酶活性的影响 Figure 8 Effect of CuSO4 concentration on tyrosinase activity in Saccharomyces cerevisiae. 1–5: CuSO4 concentration: 0, 0.1, 0.2, 0.5, 1.0 mmol/L. |
| c (CuSO4)/(mmol/L) | OD475 |
| 0 | 0.003 |
| 0.1 | 0.576 |
| 0.2 | 2.879 |
| 0.5 | 2.993 |
| 1.0 | 3.012 |
3 讨论
酪氨酸酶在微生物及动植物中普遍存在,并发挥着重要的生理功能。近年来,由于酪氨酸酶在食品、药品及环境领域有潜在用途,酪氨酸酶受到广泛的关注。但是从生物体中直接分离纯化酪氨酸酶的工艺复杂、产量较低[16],致使商品化酪氨酸酶的价格昂贵且纯度不高,制约了酪氨酸酶在各领域的应用,因此酪氨酸酶的异源表达成为了研究热点。Wichers等在大肠杆菌中成功克隆了酪氨酸酶基因PPO2的cDNA[17],但是表达出的蛋白并没有表现出酪氨酸酶活性。酿酒酵母作为真核模式生物,在表达双孢蘑菇来源的酪氨酸酶上具有天然的优势。
本研究在酿酒酵母中异源表达了双孢蘑菇的酪氨酸酶,并鉴定了其相关酶学特性。在体外实验中发现,酪氨酸酶发挥催化作用的最适温度为45 ℃,以酪氨酸为底物时酪氨酸酶Km=0.12 mmol/L,最适pH为7.0;L-多巴作为底物时,Km=1.86 mmol/L,最适pH为8.0,表明相较于L-多巴,酪氨酸酶对酪氨酸的亲和力更高。当酪氨酸浓度低于2 mmol/L时,酶催化速率随底物浓度增加而升高,高于2 mmol/L时底物饱和;底物L-多巴浓度高于10 mmol/L后酶催化速率保持不变,底物达到饱和。同时,在酿酒酵母中测定了酪氨酸酶在胞内的相关特性,在适合酿酒酵母生长的30 ℃条件下,酪氨酸酶发挥催化活性需要不低于0.2 mmol/L的Cu2+。培养物生长至稳定期后将pH调节为9.0时,24 h后黑色素积累量最高。该培养条件偏碱性,推测与酿酒酵母胞内产酸相关。在底物酪氨酸浓度低于2.5 mg/mL时,黑色素的产量与底物酪氨酸的浓度呈正相关性。
酪氨酸酶通过催化酪氨酸生成肉眼可见的黑色素,且在一定范围内黑色素的产量与酪氨酸浓度呈正相关性,可将酪氨酸酶作为酿酒酵母细胞酪氨酸产量的传感器,为高通量筛选酪氨酸高产菌株提供了思路。但是酿酒酵母的培养条件偏酸性,需要人工调节培养体系的pH,这可能成为影响最终结果的因素,是下一步工作需要解决的问题。
| [1] | Cabrera-Valladares N, Martínez A, Piñero S, Lagunas-Muñoz VH, Tinoco R, de Anda R, Vázquez-Duhalt R, Bolívar F, Gosset G. Expression of the melA gene from Rhizobium etli CFN42 in Escherichia coli and characterization of the encoded tyrosinase. Enzyme and Microbial Technology, 2006, 38(6): 772-779. DOI:10.1016/j.enzmictec.2005.08.004 |
| [2] | Jang JH, Moon KD. Inhibition of polyphenol oxidase and peroxidase activities on fresh-cut apple by simultaneous treatment of ultrasound and ascorbic acid. Food Chemistry, 2011, 124(2): 444-449. DOI:10.1016/j.foodchem.2010.06.052 |
| [3] | Gerdemann C, Eicken C, Krebs B. The crystal structure of catechol oxidase:new insight into the function of type-3 copper proteins. Accounts of Chemical Research, 2002, 35(3): 183-191. DOI:10.1021/ar990019a |
| [4] | Inlow JK. Homology models of four Agaricus bisporus tyrosinases. International Journal of Biological Macromolecules, 2012, 50(1): 283-293. DOI:10.1016/j.ijbiomac.2011.11.010 |
| [5] | McMahon AM, Doyle EM, Brooks S, O'Connor KE. Biochemical characterisation of the coexisting tyrosinase and laccase in the soil bacterium Pseudomonas putida F6. Enzyme and Microbial Technology, 2007, 40(5): 1435-1441. DOI:10.1016/j.enzmictec.2006.10.020 |
| [6] | Abdel-Raheem A, Shearer CA. Extracellular enzyme production by freshwater ascomycetes. Fungal Diversity, 2002, 11: 1-19. |
| [7] | Selinheimo E, Saloheimo M, Ahola E, Westerholm-Parvinen A, Kalkkinen N, Buchert J, Kruus K. Production and characterization of a secreted, C-terminally processed tyrosinase from the filamentous fungus Trichoderma reesei. The FEBS Journal, 2006, 273(18): 4322-4335. DOI:10.1111/ejb.2006.273.issue-18 |
| [8] | Marková E, Kotik M, Křenková A, Man P, Haudecoeur R, Boumendjel A, Hardré R, Mekmouche Y, Courvoisier-Dezord E, Réglier M, Martínková L. Recombinant tyrosinase from Polyporus arcularius:overproduction in Escherichia coli, characterization, and use in a study of aurones as tyrosinase effectors. Journal of Agricultural and Food Chemistry, 2016, 64(14): 2925-2931. DOI:10.1021/acs.jafc.6b00286 |
| [9] | Lezzi C, Bleve G, Spagnolo S, Perrotta C, Grieco F. Production of recombinant Agaricus bisporus tyrosinase in Saccharomyces cerevisiae cells. Journal of Industrial Microbiology & Biotechnology, 2012, 39(12): 1875-1880. |
| [10] | DeLoache WC, Russ ZN, Narcross L, Gonzales AM, Martin VJJ, Dueber JE. An enzyme-coupled biosensor enables (S)-reticuline production in yeast from glucose. Nature Chemical Biology, 2015, 11(7): 465-471. DOI:10.1038/nchembio.1816 |
| [11] | Flurkey A, Cooksey J, Reddy A, Spoonmore K, Rescigno A, Inlow J, Flurkey HW. Enzyme, protein, carbohydrate, and phenolic contaminants in commercial tyrosinase preparations:potential problems affecting tyrosinase activity and inhibition studies. Journal of Agricultural and Food Chemistry, 2008, 56(12): 4760-4768. DOI:10.1021/jf800109a |
| [12] | Mustafi N, Grünberger A, Kohlheyer D, Bott M, Frunzke J. The development and application of a single-cell biosensor for the detection of L-methionine and branched-chain amino acids. Metabolic Engineering, 2012, 14(4): 449-457. DOI:10.1016/j.ymben.2012.02.002 |
| [13] | Santos CNS, Stephanopoulos G. Melanin-based high-throughput screen for L-tyrosine production in Escherichia coli. Applied and Environmental Microbiology, 2008, 74(4): 1190-1197. DOI:10.1128/AEM.02448-07 |
| [14] |
Jiang MM, Tian CR, Wang XJ. Characteristics of Agaricus bisporus tyrosinase. Jiangsu Journal of Agricultural Sciences, 2008, 24(2): 194-198.
(in Chinese) 蒋萌蒙, 田呈瑞, 王向军. 双孢蘑菇中酪氨酸酶的特性. 江苏农业学报, 2008, 24(2): 194-198. |
| [15] | Faccio G, Kruus K, Saloheimo M, Thöny-Meyer L. Bacterial tyrosinases and their applications. Process Biochemistry, 2012, 47(12): 1749-1760. DOI:10.1016/j.procbio.2012.08.018 |
| [16] |
Liao HJ, Li RJ, Tao M, Bai YJ, Tang J, Tang YM. Isolation, purification and partial characterization of tyrosinase from Yunnan-grown lettuce tip. Food Science, 2017, 38(8): 30-36.
(in Chinese) 廖海君, 李蕊伽, 陶敏, 白亚娟, 唐菁, 唐云明. 云南莴笋尖酪氨酸酶分离纯化及酶学性质. 食品科学, 2017, 38(8): 30-36. DOI:10.7506/spkx1002-6630-201708006 |
| [17] | Wichers HJ, Recourt K, Hendriks M, Ebbelaar CEM, Biancone G, Hoeberichts FA, Mooibroek H, Soler-Rivas C. Cloning, expression and characterisation of two tyrosinase cdnas from Agaricus bisporus. Applied Microbiology and Biotechnology, 2003, 61(4): 336-341. DOI:10.1007/s00253-002-1194-2 |
 2018, Vol. 58
2018, Vol. 58