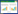中国科学院微生物研究所,中国微生物学会,中国菌物学会
文章信息
- 沈金红, 王倩, 夏晓峰, 尤民生. 2018
- Jinhong Shen, Qian Wang, Xiaofeng Xia, Minsheng You. 2018
- 抗生素和肠道细菌对小菜蛾适合度的影响
- Effect of antibiotics and gut bacteria on fitness of diamondback moth Plutella xylostella (L.)
- 微生物学报, 58(6): 1025-1035
- Acta Microbiologica Sinica, 58(6): 1025-1035
-
文章历史
- 收稿日期:2017-07-16
- 修回日期:2017-11-04
- 网络出版日期:2017-12-28
2. 农业部闽台作物有害生物综合治理重点实验室, 福建农林大学, 福建 福州 350002;
3. 害虫绿色防控福建省高等学校重点实验室, 福建农林大学, 福建 福州 350002;
4. 闽台作物有害生物生态防控协同创新中心, 福建农林大学, 福建 福州 350002
2. Key Laboratory of Integrated Pest Management for Fujian-Taiwan Crops, Ministry of Agriculture, Fuzhou 350002, Fujian Province, China;
3. Key Laboratory of Green Control of Insect Pests(Fujian Agriculture and Forestry University), Fujian Province University, Fuzhou 350002, Fujian Province, China;
4. Fujian-Taiwan Joint Centre for Ecological Control of Crop Pests, Fujian Agriculture and Forestry University, Fuzhou 350002, Fujian Province, China
Minsheng You, E-mail:msyou@iae.fjau.edu.cn
小菜蛾Plutella xylostella属鳞翅目菜蛾科(Lepidoptera: Plutellidae),是一种世界性的迁飞害虫,主要危害十字花科蔬菜。小菜蛾发育周期短、繁殖速度快、世代重叠严重,最新统计显示每年由小菜蛾造成的损害以及用于防治的费用高达40亿至50亿美元[1]。到目前为止,小菜蛾对有机磷、氨基甲酸酯、阿维菌素、拟除虫菊酯以及苏云金芽胞杆菌Bacillus thuringiensis (Bt)等多种杀虫剂均已产生了抗性[2],几乎涉及到所有化学防治方法中使用的杀虫剂,这使小菜蛾的防治变得愈加困难,因此寻找好的生物防治方法成为未来发展的一个趋势。
肠道作为昆虫重要的食物消化和营养吸收的“器官”,其中栖息着数量庞大的微生物。近年来的研究发现昆虫肠道微生物与宿主相互依赖,互惠共生[3-4]。肠道微生物在宿主的营养吸收、发育繁殖、抵御病原菌、增强免疫力、代谢解毒以及抗药性等方面均起到重要作用[5]。研究昆虫肠道微生物对于益虫的保护以及害虫的综合治理具有重要的意义。昆虫肠道微生物处于一个相对稳定的内环境中,打乱肠道微生物的组成会导致宿主适合度的降低。例如,在白蚁Reticulitermes flavipes的研究中发现,抗生素利福平Rifampin不仅打乱了白蚁肠道微生物多样性,而且导致了白蚁寿命、产卵量以及体重的下降[6];研究发现玉米根叶甲(Diabrotica virgifera virgifera LeConte)的肠道微生物能够介导其适应非寄主植物大豆(Glycine max),用抗生素抑制其肠道菌后,显著降低了其对大豆的植食性[7];咖啡螟虫Hypothenemus hampei的研究发现,用抗生素清除其肠道微生物后,导致了咖啡螟虫不能代谢咖啡因,从而造成其产卵量显著降低[8];果蝇Drosophila melanogaster肠道微生物的研究发现其肠道细菌与交配选择有关,用抗生素清除肠道细菌后会阻断这种交配选择[9]。由此可见,用抗生素处理来清除肠道细菌是评价肠道微生物功能的一个重要手段。但近年来针对抗生素处理所导致的适合度改变是由于共生菌的清除引起还是抗生素自身的毒性引起的争论日益增多。前期在蚜虫的研究中发现抗生素处理并没有影响蚜虫线粒体和蛋白质的合成、氨基酸的吸收、渗透压调节以及取食,虫体发生的不适主要是因为共生菌的缺失所致[10]。但也有研究表明抗生素利福平能够影响烟粉虱防御基因的表达,且影响的程度与利福平的浓度相关[11]。因此,利用抗生素处理昆虫来评价肠道微生物对宿主适合度的影响,必须充分考虑抗生素对宿主的直接效应。
基于小菜蛾的高抗药性以及昆虫肠道微生物对宿主的重要作用,近年来不少学者开始关注小菜蛾肠道微生物的组成和功能。Indiragandhi等通过传统培养法从小菜蛾肠道中分离到了多种细菌[12]。本课题组利用宏基因组技术分析了小菜蛾肠道微生物的组成,并对其功能进行了预测[13],同时还发现了小菜蛾抗药性与肠道微生物之间的潜在关联[14]。Lin等利用抗生素处理影响了小菜蛾生长发育,导致了小菜蛾高死亡率和预蛹畸形[15],然而该研究并不能判断宿主适合度的变化是由于肠道细菌的改变引起还是抗生素的直接毒性作用导致。为了进一步研究肠道细菌对小菜蛾的功能,本课题在前人研究的基础上,利用抗生素对含肠道细菌的小菜蛾和无肠道菌的小菜蛾同时进行多代处理,采用多个适合度参数进行分析,评价“抗生素-肠道细菌-宿主适合度”三者之间的关系,明确抗生素对小菜蛾的直接毒性效应,阐明肠道细菌对小菜蛾适合度的影响,为后续深入研究小菜蛾肠道细菌的功能提供理论依据和新的思路。
1 材料和方法 1.1 小菜蛾的饲养萝卜苗敏感(FZss)品系小菜蛾于2004年7月采集自福建省福州市郊区新店(26.08° N, 119.28° E),并长期在实验室内饲养。幼虫饲养在萝卜苗上,成虫用10%的蜂蜜水饲喂。饲养条件为:温度(25±2) ℃,湿度70%–80%,光照周期16L:8D。饲料敏感(SLss)品系小菜蛾从河南省济源白云实业有限公司(http://www.keyunnpv.cn)购买得到,并饲养在实验室养虫室内。幼虫用人工饲料饲养,成虫用10%蜂蜜水饲喂,饲养环境同FZss品系小菜蛾。人工饲料的配制:麦胚粉37.5 g;蔗糖10.0 g;尼泊金0.5 g;山梨酸1.0 g;混合维生素0.25 g;维生素C 1.0 g;菜叶粉3.0 g;菜籽油1 mL;亚油酸1-2滴;酵母粉20.0 g;琼脂6.0 g;去离子水250 mL。配制人工饲料时,先将不含琼脂和去离子水的其他成分进行充分混合,再加入50 mL去离子水搅拌均匀;另外200 mL去离子水中加入琼脂,加热充分溶解后再冷却到70 ℃左右,倒入之前的50 mL混合液中,充分搅拌均匀后再分装。含抗生素人工饲料(TR100)的配制:在普通人工饲料凝固之前加入相应体积的抗生素溶液,使其终浓度为10.0 μg/mg盐酸左氧氟沙星、10.0 μg/mg盐酸环丙沙星、20.0 μg/mg甲硝唑,将配好的人工饲料用无菌保鲜膜包好,于4 ℃冰箱保存备用。
1.2 小菜蛾肠道细菌的培养取10头4龄幼虫,用无菌水清洗体表,转移到75%的酒精中浸泡10 s,再用无菌水清洗虫体表面残留的酒精,于超净工作台下进行解剖,肠道内容物溶于1 mL无菌水中,充分搅拌混匀后备用。FZss品系小菜蛾肠道内容物的原液稀释100倍后取25 μL涂LB平板(LB培养基:NaCl 10.0 g/L,酵母提取物5.0 g/L,蛋白胨10.0 g/L,2%琼脂粉);SLss品系小菜蛾肠道内容物取原液50 μL涂布LB平板,37 ℃培养24 h后拍照记录肠道细菌的生长情况。
1.3 抗生素处理萝卜苗敏感品系小菜蛾(FZss)对其适合度的影响前期研究发现单种抗生素很难完全清除小菜蛾的肠道细菌[15]。为了有效清除小菜蛾肠道菌群,本研究选择抗菌谱广且抗菌作用强的盐酸左氧氟沙星(1 mg/mL)、盐酸环丙沙星(1 mg/mL)[16]和对厌氧菌有很强杀菌作用的甲硝唑(2 mg/mL)[17]配制抗生素溶液,加入1%吐温-80。用该溶液浸泡萝卜苗菜叶,10 min后取出叶片晾干,再用湿棉花包住叶片底部,放置于垫有滤纸的培养皿(d=9 cm)中备用。记录小菜蛾生理指标的变化,包括卵期、幼虫期、蛹期、雌雄成虫寿命、4龄幼虫虫重、蛹重、孵化率、化蛹率、羽化率、单雌产卵量、雌雄比。具体实验步骤如下:(1)将100对成虫放置在干净的指形管中,棉花塞住指形管口,每管1对,每管取产卵第1–3天的卵用于实验,记录每管产卵日期及卵的数目,待孵化后记录孵化日期及数目,计算孵化率和卵期。(2)用小毛笔将同一天孵化的1龄幼虫挑至对应溶液浸泡过的萝卜苗菜叶上,每天更换菜叶。(3)对处于暴食期且体重高峰期的4龄幼虫进行单头称重,计算平均4龄幼虫虫重。(4)记录幼虫化蛹时间及化蛹数目,计算幼虫的平均发育历期。(5)取化蛹第2天的蛹进行单头称重,并记录羽化时间及雌雄数量,计算蛹重、蛹期及成虫的雌雄比。(6)将羽化的成虫进行配对,记录成虫存活情况,计算雌雄成虫存活时间及单雌产卵量。(7)将有产卵的指形管用于下一代实验。(8)重复步骤(2)–(7),直至第四代成虫全部死亡,以取食不含抗生素的萝卜苗菜叶的小菜蛾作为对照(CK)。使用SPSS(Statistical Product and Service Solutions)19.0软件进行数据分析,两组小菜蛾的试验数据使用独立样本t检验进行分析。
1.4 抗生素处理饲料敏感品系小菜蛾(SLss)对其适合度的影响用含抗生素的人工饲料(TR100)饲养SLss品系小菜蛾一代,记录小菜蛾生理指标的变化,包括卵期、幼虫期、蛹期、雌雄成虫寿命、4龄幼虫虫重、蛹重、孵化率、化蛹率、羽化率、单雌产卵量、雌雄比。具体操作方法参考1.3中的实验步骤,仅把菜叶换成人工饲料,以取食不含抗生素的人工饲料的小菜蛾作为对照(CK0)。使用SPSS(Statistical Product and Service Solutions)19.0软件进行数据分析,两组小菜蛾的试验数据使用独立样本t检验进行分析。
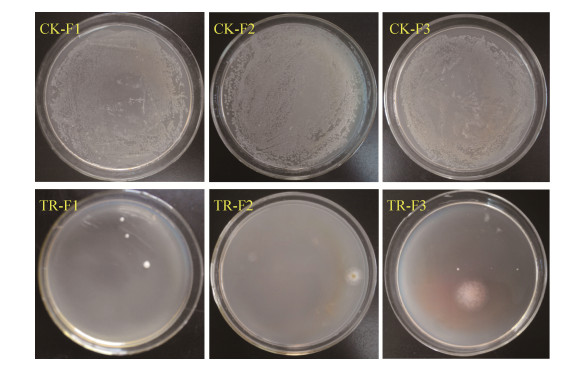
2 结果和分析 2.1 抗生素对小菜蛾肠道细菌的清除效果将小菜蛾4龄幼虫的肠道内容物涂布LB平板,各代小菜蛾(FZss)对照组均含有高丰度的肠道细菌,与对照相比,抗生素基本清除了FZss品系小菜蛾肠道可培养细菌(图 1)。此外,经抗生素处理后,SLss品系小菜蛾肠道可培养细菌完全被抑制,且SLss品系对照组中肠道可培养细菌也非常少(图 2),这可能跟本实验中使用无菌人工饲料饲养小菜蛾有关,因此在本研究中我们把含菌量极低的SLss品系小菜蛾定义为无肠道细菌小菜蛾,用抗生素处理SLss品系小菜蛾,可以评估抗生素对小菜蛾的直接毒性效应。
|
| 图 1 抗生素对F1-F3代小菜蛾(FZss)肠道可培养细菌的影响 Figure 1 Effect of antibiotic treatment on the culturable gut bacteria of P. xylostella (FZss) among different generations (F1–F3). CK: The P. xylostella reared with normal radish plant; TR: The P. xylostella reared with radish plant that contains antibiotics; F: Generation. |
|
| 图 2 抗生素对小菜蛾(SLss)肠道可培养细菌的影响 Figure 2 Effect of antibiotic treatment on the culturable gut bacteria of P. xylostella (SLss). CK0: The P. xylostella reared with normal artificial diet; TR100: The P. xylostella reared with artificial diet that contains antibiotics. |
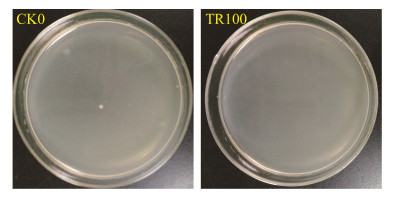
2.2 抗生素处理对小菜蛾生长发育的影响 2.2.1 抗生素处理对小菜蛾发育历期的影响: 将连续3代(F1–F3)萝卜苗饲养品系小菜蛾(FZss)的抗生素处理组和对照组的卵期、幼虫期、蛹期进行比较分析,F1–F3代处理组与对照组相比,小菜蛾的卵期差异均不显著(图 3-A),F2代和F3代抗生素处理组幼虫期均显著延长(图 3-B)。各代(F1–F3)抗生素处理组蛹期也显著长于对照组(图 3-C)。结果表明,抗生素处理小菜蛾(FZss)导致了小菜蛾发育历期(幼虫期和蛹期)的延长。将连续3代(F1–F3)抗生素处理组和对照组的成虫寿命进行比较分析,F3代雌成虫寿命显著降低,但是抗生素对F1和F2代小菜蛾雌成虫寿命并无显著影响(图 3-D)。雄成虫寿命分析发现抗生素处理并不影响F1代的寿命,但是F2代和F3代雄成虫寿命均显著缩短(图 3-E)。结果表明,抗生素处理会导致小菜蛾成虫寿命的缩减,随着处理代时的增加,影响逐渐显著。
|
| 图 3 抗生素对小菜蛾(FZss)发育历期的影响 Figure 3 Impact of antibiotic treatment on the development time of P. xylostella (FZss). A: Impact of antibiotic treatment on the egg development time of P. xylostella; B: Impact of antibiotic treatment on the larval development time of P. xylostella; C: Impact of antibiotic treatment on the pupal development time of P. xylostella; D: Impact of antibiotic treatment on the female adult life-pan of P. xylostella; E: Impact of antibiotic treatment on the male adult life-pan of P. xylostella. (*P < 0.05; **P < 0.01). CK: The P. xylostella reared with normal radish plant; Antibiotic: The P. xylostella reared with radish plant that contains antibiotics. Bars in the figure are means±SE, abscissa represents the generation number of P. xylostella. |
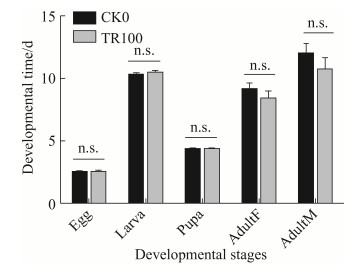
基于饲料品系小菜蛾(SLss)肠道几乎处于无菌状态,因此可以利用SLss品系小菜蛾来评估抗生素对小菜蛾的毒性效应以及间接分析肠道细菌对小菜蛾的生理作用。实验结果表明对照组CK0与抗生素处理组TR100的卵期差异不显著(图 4),这与FZss品系的研究结果一致(图 3-A),此外CK0与TR100的幼虫期和蛹期差异均不显著(图 4),这与FZss品系小菜蛾幼虫和蛹的发育历期显著延长不同(图 3-B, 3-C)。成虫寿命分析显示CK0与TR100雌雄成虫的寿命差异均不显著(图 4),对FZss品系小菜蛾的研究也显示抗生素处理对F1代FZss品系小菜蛾成虫寿命的影响不显著(图 3-D, 3-E)。
|
| 图 4 抗生素处理对小菜蛾(SLss)发育历期的影响 Figure 4 Impact of antibiotic treatment on the development time of P. xylostella (SLss). CK0: The P. xylostella reared with normal artificial diet; TR100: The P. xylostella reared with artificial diet containing antibiotics. Bars in the figure are means±SE, n.s. indicates no significant difference from the control. Abscissa represents the developmental stages of P. xylostella. AdultF: female adult; AdultM: male adult. |
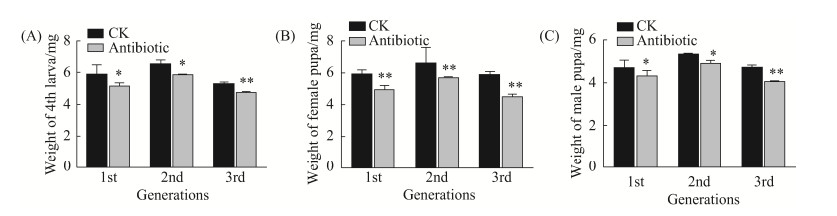
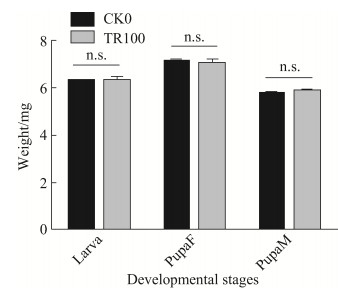
2.2.2 抗生素处理对小菜蛾幼虫虫重和蛹重的影响: 对F1–F3代(FZss)抗生素处理组与对照组的4龄幼虫、雌蛹和雄蛹进行称重,结果表明F1–F3代处理组的4龄幼虫虫重、雌蛹重和雄蛹重均显著低于对照组(图 5)。而SLss品系小菜蛾的虫重和蛹重分析结果表明:CK0与TR100的4龄幼虫虫重、雌蛹重和雄蛹重差异均不显著(图 6),与FZss品系小菜蛾的实验结果不同。
|
| 图 5 抗生素处理对小菜蛾(FZss)虫重和蛹重的影响 Figure 5 Impact of antibiotic treatment on the larval and pupal weight of P. xylostella (FZss). A: Impact of antibiotic treatment on the 4th larval weight of P. xylostella; B: Impact of antibiotic treatment on the female pupal weight of P. xylostella; C: Impact of antibiotic treatment on the male pupal weight of P. xylostella. (*P < 0.05; **P < 0.01). Bars in the figure are means±SE, and abscissa represents the generation number of P. xylostella. |
|
| 图 6 抗生素处理对小菜蛾(SLss)虫重和蛹重的影响 Figure 6 Impact of antibiotic treatment on the larval and pupal weight of P. xylostella (SLss). CK0: The P. xylostella reared with normal artificial diet; TR100: The P. xylostella reared with artificial diet containing antibiotics. Bars in the figure are means±SE, n.s. indicates no significant difference from the control. Abscissa represents the developmental stages of P. xylostella. PupaF: female pupa; PupaM: male pupa. |
2.3 抗生素处理对小菜蛾生殖的影响
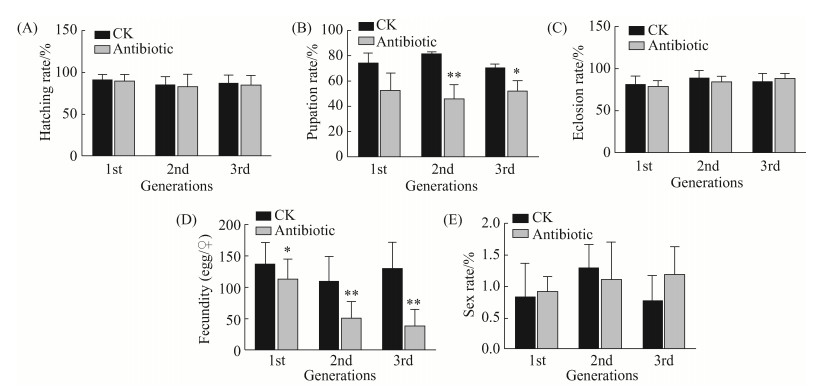
抗生素处理小菜蛾(FZss) 3代后,分别统计F1–F3代小菜蛾的孵化率、化蛹率、羽化率、单雌产卵量和雌雄比,分析抗生素对小菜蛾生殖的影响。实验结果表明抗生素清除肠道细菌对孵化率、羽化率和雌雄比没有显著的影响(图 7-A,7-C,7-E)。但从F2代开始,抗生素处理组的化蛹率均显著低于对照组(图 7-B),此外F1–F3代抗生素处理组的单雌产卵量均显著低于对照组,且呈逐代递减的趋势(图 7-D),表明抗生素对小菜蛾(FZss)的生殖具有强烈的抑制作用。
|
| 图 7 抗生素处理对小菜蛾(FZss)生殖的影响 Figure 7 Impact of antibiotic treatment on the reproduction of P. xylostella (FZss). A: Impact of antibiotic treatment on the egg hatching rate of P. xylostella; B: Impact of antibiotic treatment on the pupation rate of P. xylostella; C: Impact of antibiotic treatment on the eclosion rate of P. xylostella; D: Impact of antibiotic treatment on the fecuntity of P. xylostella; E: Impact of antibiotic treatment on the sex rate of P. xylostella. (*P < 0.05; **P < 0.01). Bars in the figure are means±SE, abscissa represents the generation number of P. xylostella. |
对SLss品系小菜蛾在抗生素处理后孵化率、化蛹率、羽化率、单雌产卵量、雌雄比的观察结果表明:CK0与TR100相比,其孵化率和雌雄比差异均不显著(图 8-A,8-E),但是化蛹率和单雌产卵量均显著降低(图 8-B,8-D),这与FZss品系小菜蛾的研究结果一致(图 7),相反地是TR100的羽化率高于CK0 (图 8-C)。

|
| 图 8 抗生素处理对小菜蛾(SLss)生殖的影响 Figure 8 Impact of antibiotic treatment on the reproduction of P. xylostella (SLss). A: Impact of antibiotic treatment on the egg hatching rate of P. xylostella; B: Impact of antibiotic treatment on the pupation rate of P. xylostella; C: Impact of antibiotic treatment on the eclosion rate of P. xylostella; D: Impact of antibiotic treatment on the fecuntity of P. xylostella; E: Impact of antibiotic treatment on the sex rate of P. xylostella. (*P < 0.05; **P < 0.01). CK0: The P. xylostella reared with normal artificial diet; TR100: The P. xylostella reared with artificial diet containing antibiotics. Bars in the figure are means±SE, n.s. indicates no significant difference from the control. |
3 讨论
肠道微生物对宿主的生长繁殖和生理活动具有重要的作用,健康的肠道菌群结构可以促进宿主的适合度,提高宿主的存活率[18]。FZss品系小菜蛾取食菜叶,富含肠道细菌,抗生素处理FZss品系小菜蛾可以揭示抗生素和肠道细菌对宿主的生理功能,而SLss品系小菜蛾肠道细菌非常少,传统分离培养结果表明对照组SLss品系小菜蛾肠道细菌的数量甚至低于经抗生素处理过的FZss品系小菜蛾(图 1,2),因此用抗生素处理SLss品系小菜蛾可以验证抗生素的直接毒性效应,所以FZss和SLss品系小菜蛾适合度之间的差异能够体现出肠道细菌的功能。本文通过抗生素连续处理FZss品系小菜蛾3代,综合评估长期抗生素压力下小菜蛾生长发育与繁殖受影响的程度;其次用抗生素处理SLss品系小菜蛾,探讨抗生素对小菜蛾的直接毒性效应。结果表明,抗生素处理FZss品系小菜蛾幼虫不仅清除了幼虫的肠道菌群,也对小菜蛾的生长、发育和繁殖产生不利的影响,而且随着处理代数的增加影响越显著,研究结果表明小菜蛾在用抗生素连续处理四代之后便不能继续繁殖,由于第四代的虫子量很少,用于统计分析误差太大,因而文中没有列出第四代的数据。抗生素处理后小菜蛾的适合度劣势主要表现为:发育历期延长,而化蛹率、4龄幼虫虫重、蛹重、产卵量和成虫寿命均降低。SLss品系小菜蛾经抗生素处理后,其化蛹率和产卵量均大幅度地降低;相反,发育历期、4龄幼虫虫重、蛹重和成虫寿命则并未受到影响。该结果提示小菜蛾化蛹率和产卵量这两个指标可能是由抗生素的直接毒性效应所致。而4龄幼虫虫重、蛹重和发育历期等参数则可能与小菜蛾的肠道细菌相关。前期很多研究均表明肠道细菌有利于提高宿主的适合度[5, 19]。Lin等利用不同浓度的多种抗生素处理甘蓝饲养的小菜蛾,并观察了其幼虫死亡率、蛹重、预蛹畸形、蛹死亡率以及雌雄比等参数,发现抗生素处理导致了当代小菜蛾幼虫和蛹死亡率的增加以及蛹重的降低,这与我们的实验结果是一致的。但是在雌雄比方面,我们的研究发现不管是FZss品系还是SLss品系小菜蛾的雌雄比差异均不显著,而Lin等的研究则发现不同类型的抗生素对宿主雌雄比的影响具有很大的不同[15],表明抗生素的类型对宿主具有不同的效应。此外,我们的工作拓展了前期的研究,通过对小菜蛾进行更多代时的培养以及观察更多的适合度指标来综合评价抗生素对宿主的直接和间接效应,能够为后续精确研究肠道细菌及其对应的功能提供更加明确的方向。
SLss品系小菜蛾缺乏肠道细菌,但仍然可以在人工饲料上很好地完成世代更迭,说明SLss品系小菜蛾在用饲料饲养时并不需要依靠肠道细菌也可以保持良好的生理状态,其原因可能是人工饲料营养丰富、容易吸收,不需要肠道细菌帮助其进行消化和降解,所以抗生素的处理不影响其正常的取食以及体重的发育。相反,FZss品系小菜蛾取食植物时会遇到很多问题,从而影响其生长发育,其可能的机制主要为以下三个方面:(1)肠道细菌能够帮助宿主应对植物防御物质。当植物被昆虫取食时会释放防御物质来应对害虫的侵袭[20-21],因此宿主必须进化出一套应对植物防御物质的机制。肠道微生物在这个过程中往往发挥着重要的作用,如存在于苹果实蝇Rhagoletis pomonella中的肠杆菌属细菌Enterobacter agglomerans可以降解对R. pomonella有毒的植物化合物[22];咖啡螟虫H. hampei肠道细菌中的假单孢菌属Pseudomonas可以降解有毒咖啡因[8];我们前期基于FZss品系小菜蛾肠道微生物宏基因组的研究也发现小菜蛾肠道细菌具有很多降解植物次生代谢物的基因,并且体外实验也表明肠道细菌能够高效降解许多次生代谢物的前体物质苯酚[13]。(2)肠道细菌的定殖抗性能够帮助宿主抵御病原微生物的侵染。由于植物和环境往往携带一些病原菌,当这些病原菌进入小菜蛾肠道后,可能会对宿主造成危害,引发宿主的免疫防御,产生适合度代价,昆虫肠道微生物的定殖抗性可以有效抑制外源病原菌在宿主体内的增殖。在沙漠蝗虫Schistocerca gregaria的研究中,Dillon等发现肠道细菌可以通过产生抗菌的酚类物质来抵御绿僵菌的侵染[23]。(3)肠道细菌能够帮助宿主降解木质纤维素,促进宿主的消化和营养吸收。由于植物富含纤维素等难降解物质,宿主本身并不能降解这类物质,需要肠道细菌帮助其消化和利用植物的营养物质。在白蚁Reticulitermes flaviceps的研究中发现白蚁的肠道微生物可以帮助宿主降解木质纤维素[24],我们前期的研究也发现FZss品系小菜蛾肠道细菌含有降解纤维素的完整基因,体外实验也表明小菜蛾肠道分离菌能够降解纤维素、木聚糖和果胶[13]。因此用抗生素去除FZss品系小菜蛾的肠道细菌后干扰了其对食物的取食、降解和消化,从而影响其生长发育。该结果也提示我们,在用人工饲料来饲养小菜蛾、评价小菜蛾肠道微生物的功能时,需要更加谨慎。
由抗生素导致的适合度降低主要是作用于雌虫还是雄虫是一个非常有意思的课题。Shan等用抗生素利福平处理烟粉虱Bemisia tabaci,发现宿主的不适主要存在于雌性昆虫[25]。而我们的研究发现,经抗生素处理后,小菜蛾的雌雄蛹重以及成虫寿命均显著受到影响,且雌雄比无显著差异,说明抗生素在体重以及寿命这些参数上对小菜蛾雌雄宿主的影响并没有选择性。此外,抗生素对产卵量具有非常大的影响,表明抗生素会导致宿主昆虫生殖系统的破坏,但其产卵量降低主要是由雄虫生殖系统破坏引起还是雌虫生殖系统引起,或者是两者共同引起仍需要以后进一步的深入研究。
本文进一步明确了抗生素和肠道细菌对宿主适合度的效应,特别是肠道细菌对宿主生长发育的影响,为后续研究小菜蛾肠道细菌的种群、结构及其对应的功能(如定殖抗性、次生代谢物降解、协助宿主进行食物消化以及为宿主供给氨基酸和维生素等营养物质的相关机制)奠定了基础。
| [1] | Furlong MJ, Wright DJ, Dosdall LM. Diamondback moth ecology and management:problems, progress, and prospects. Annual Review of Entomology, 2013, 58: 517-541. DOI:10.1146/annurev-ento-120811-153605 |
| [2] | Sun JY, Liang P, Gao XW. Cross-resistance patterns and fitness in fufenozide-resistant diamondback moth, Plutella xylostella (Lepidoptera:Plutellidae). Pest Management Science, 2012, 68(2): 285-289. DOI:10.1002/ps.v68.2 |
| [3] | Dale C, Moran NA. Molecular interactions between bacterial symbionts and their hosts. Cell, 2006, 126(3): 453-465. DOI:10.1016/j.cell.2006.07.014 |
| [4] | Shao YQ, Chen BS, Sun C, Ishida K, Hertweck C, Boland W. Symbiont-derived antimicrobials contribute to the control of the lepidopteran gut microbiota. Cell Chemical Biology, 2017, 24(1): 66-75. DOI:10.1016/j.chembiol.2016.11.015 |
| [5] | Engel P, Moran NA. The gut microbiota of insects-diversity in structure and function. FEMS Microbiology Reviews, 2013, 37(5): 699-735. DOI:10.1111/1574-6976.12025 |
| [6] | Rosengaus RB, Zecher CN, Schultheis KF, Brucker RM, Bordenstein SR. Disruption of the termite gut microbiota and its prolonged consequences for fitness. Applied and Environmental Microbiology, 2011, 77(13): 4303-4312. DOI:10.1128/AEM.01886-10 |
| [7] | Chu CC, Spencer JL, Curzi MJ, Zavala JA, Seufferheld MJ. Gut bacteria facilitate adaptation to crop rotation in the western corn rootworm. Proceedings of the National Academy of Sciences of the United States of America, 2013, 110(29): 11917-11922. DOI:10.1073/pnas.1301886110 |
| [8] | Ceja-Navarro JA, Vega FE, Karaoz U, Hao Z, Jenkins S, Lim HC, Kosina P, Infante F, Northen TR, Brodie EL. Gut microbiota mediate caffeine detoxification in the primary insect pest of coffee. Nature Communications, 2015, 6: 7618. DOI:10.1038/ncomms8618 |
| [9] | Sharon G, Segal D, Ringo JM, Hefetz A, Zilber-Rosenberg I, Rosenberg E. Commensal bacteria play a role in mating preference of Drosophila melanogaster. Proceedings of the National Academy of Sciences of the United States of America, 2010, 107(46): 20051-20056. DOI:10.1073/pnas.1009906107 |
| [10] | Wilkinson TL. The elimination of intracellular microorganisms from insects:an analysis of antibiotic-treatment in the pea aphid (Acyrthosiphon pisum). Comparative Biochemistry and Physiology Part A:Molecular & Integrative Physiology, 1998, 119(4): 871-881. |
| [11] |
Liu LY, Su Q, Fang YW, Zhang YJ, Chu D. Effects of antibiotic rifampicin on the expression of the defense genes in Bemisia tabaci Q. Journal of Environmental Entomology, 2015, 37(5): 962-969.
(in Chinese) 刘凌云, 苏奇, 方艺伟, 张友军, 褚栋. 抗生素利福平对Q烟粉虱防御基因表达水平的影响. 环境昆虫学报, 2015, 37(5): 962-969. |
| [12] | Indiragandhi P, Anandham R, Madhaiyan M, Poonguzhali S, Kim GH, Saravanan VS, Sa TM. Cultivable bacteria associated with larval gut of prothiofos-resistant, prothiofos-susceptible and field-caught populations of diamondback moth, Plutella xylostella and their potential for, antagonism towards entomopathogenic fungi and host insect nutrition. Journal of Applied Microbiology, 2007, 103(6): 2664-2675. DOI:10.1111/jam.2007.103.issue-6 |
| [13] | Xia XF, Gurr GM, Vasseur L, Zheng DD, Zhong HZ, Qin BC, Lin JH, Wang Y, Song FQ, Li Y, Lin HL, You MS. Metagenomic sequencing of diamondback moth gut microbiome unveils key holobiont adaptations for herbivory. Frontiers in Microbiology, 2017, 8: 663. DOI:10.3389/fmicb.2017.00663 |
| [14] | Xia XF, Zheng DD, Zhong HZ, Qin BC, Gurr GM, Vasseur L, Lin HL, Bai JL, He WY, You MS. DNA sequencing reveals the midgut microbiota of diamondback moth, Plutella xylostella (L.) and a possible relationship with insecticide resistance. PLoS One, 2013, 8(7): e68852. DOI:10.1371/journal.pone.0068852 |
| [15] | Lin XL, Kang ZW, Pan QJ, Liu TX. Evaluation of five antibiotics on larval gut bacterial diversity of Plutella xylostella (Lepidoptera:Plutellidae). Insect Science, 2015, 22(5): 619-628. DOI:10.1111/ins.2015.22.issue-5 |
| [16] | Drlica K, Zhao XL. DNA gyrase, topoisomerase Ⅳ, and the 4-quinolones. Microbiology and Molecular Biology Reviews, 1997, 61(3): 377-392. |
| [17] | Löfmark S, Edlund C, Nord CE. Metronidazole is still the drug of choice for treatment of anaerobic infections. Clinical Infectious Diseases, 2010, 50(S1): S16-S23. DOI:10.1086/648687 |
| [18] | Shin SC, Kim SH, You HJ, Kim B, Kim AC, Lee KA, Yoon JH, Ryu JH, Lee WJ. Drosophila microbiome modulates host developmental and metabolic homeostasis via insulin signaling. Science, 2011, 334(6056): 670-674. DOI:10.1126/science.1212782 |
| [19] | Hosokawa T, Kikuchi Y, Nikoh N, Shimada M, Fukatsu T. Strict host-symbiont cospeciation and reductive genome evolution in insect gut bacteria. PLoS Biology, 2006, 4(10): e337. DOI:10.1371/journal.pbio.0040337 |
| [20] | D'Alessandro M, Turlings TCJ. Advances and challenges in the identification of volatiles that mediate interactions among plants and arthropods. Analyst, 2006, 131(1): 24-32. DOI:10.1039/B507589K |
| [21] | Mithöfer A, Boland W. Plant defense against herbivores:chemical aspects. Annual Review of Plant Biology, 2012, 63: 431-450. DOI:10.1146/annurev-arplant-042110-103854 |
| [22] | Lauzon CR, Potter SE, Prokopy RJ. Degradation and detoxification of the dihydrochalcone phloridzin by Enterobacter agglomerans, a bacterium associated with the apple pest, Rhagoletis pomonella (Walsh) (Diptera:Tephritidae). Environmental Entomology, 2003, 32(5): 953-962. DOI:10.1603/0046-225X-32.5.953 |
| [23] | Dillon RJ, Vennard CT, Buckling A, Charnley AK. Diversity of locust gut bacteria protects against pathogen invasion. Ecology Letters, 2005, 8(12): 1291-1298. DOI:10.1111/ele.2005.8.issue-12 |
| [24] | Mo JC, Yang TC, Song XG, Cheng JA. Cellulase activity in five species of important termites in China. Applied Entomology and Zoology, 2004, 39(4): 635-641. DOI:10.1303/aez.2004.635 |
| [25] | Shan HW, Zhang CR, Yan TT, Tang HQ, Wang XW, Liu SS, Liu YQ. Temporal changes of symbiont density and host fitness after rifampicin treatment in a whitefly of the Bemisia tabaci species complex. Insect Science, 2016, 23(2): 200-214. DOI:10.1111/ins.2016.23.issue-2 |
 2018, Vol. 58
2018, Vol. 58