中国科学院微生物研究所,中国微生物学会,中国菌物学会
文章信息
- 张利坤, 肖延铭, 钱敏帆, 严燕兵, 李敬亚. 2018
- Likun Zhang, Yanming Xiao, Minfan Qian, Yanbing Yan, Jingya Li. 2018
- 固定化细胞拆分(R, S)-α-乙基-2-氧-1-吡咯烷乙酸甲酯的研究
- Resolution of rac-α-ethyl-2-oxo-pyrrolidineacetic acid methyl ester by immobilized cell
- 微生物学报, 58(9): 1672-1682
- Acta Microbiologica Sinica, 58(9): 1672-1682
-
文章历史
- 收稿日期:2017-12-20
- 修回日期:2018-03-23
- 网络出版日期:2018-05-29
2. 郑州大学化学与分子工程学院, 河南 郑州 450001
2. College of Chemistry and Molecular Engineering, Zhengzhou University, Zhengzhou 450001, Henan Province, China
随着手性化学技术在制药、农药以及非生物等领域不断进步,在生物活性方面获得至少含有一个手性中心化合物的方法受到人们越来越多的关注[1]。生物催化与化学反应相比,具有反应条件温和、催化效率高、副反应少[2]的特点,是代替传统化学拆分反应的最佳选择[3]。由于酯酶具有高催化活性和优良区域选择性,无需辅助因子参与,该类酶应用于光学纯化合物的制备已经成为生产手性化合物的一种重要方法[4]。
目前制备固定化细胞的方法主要有吸附法、共价结合法、交联法、包埋法等,固定化方法还可以联用以实现优势互补,提高细胞的活性与稳定性,如吸附交联法、包埋-交联法、包埋-吸附法、包埋-共价结合法等[5]。
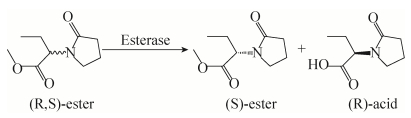
左乙拉西坦(Levetiracetam)化学名称为(S)-α-乙基-2-氧合-1-乙酰胺吡咯烷,是一种乙酰吡咯烷类化合物的新型抗癫痫药物[6]。该药治疗指数很高,药动学理想,口服吸收快且安全,生物利用度可达100%,是一种高效、毒副作用小的广谱抗癫痫药,具有极高的开发价值[7-8]。(R, S)-α-乙基-2-氧-1-吡咯烷乙酸甲酯是生产左乙拉西坦的重要中间体,一条有效途径是通过对(R, S)-α-乙基-2-氧-1-吡咯烷乙酸甲酯进行生物拆分,获得高光学纯度的(S)-α-乙基-2-氧-1-吡咯烷乙酸甲酯,如图 1。王普等[9]使用产酯酶耐酪氨酸冢村氏菌选择性水解(S)-α-乙基-2-氧-1-吡咯烷乙酸乙酯,制备(S)-α-乙基- 2-氧-1-吡咯烷乙酸,底物浓度12 g/L,反应24 h,产率和ee值分别为48%和99%;宣磊等[10]使用产酯酶蜡状芽孢杆菌选择性水解(R)-α-乙基-2-氧-1-吡咯烷乙酸甲酯,制备(S)-α-乙基-2-氧-1-吡咯烷乙酸甲酯,底物浓度20 g/L,反应13 h,转化率54.04%,ees值达到99.9%。上述工艺中底物投量较低,难以实现工业化,此类工艺要达到具有产业化价值的要求,需寻找催化活性高、拆分效果好的新型酯酶。
|
| 图 1 生物催化拆分(R, S)-α-乙基-2-氧-1-吡咯烷乙酸甲酯 Figure 1 Enatioelective hydrolysis of rac-α-ethyl-2- oxo-pyrrolidineacetic acid methyl ester catalyzed by biocatalysts. |
本文利用以(R, S)-α-乙基-2-氧-1-吡咯烷乙酸甲酯为产酯酶诱导剂的培养基从土壤、污泥等样品中筛选能选择性水解(R, S)-α-乙基-2-氧-1-吡咯烷乙酸甲酯的菌种,并进行菌种鉴定。在此基础上,优化了固定化细胞工艺条件,并对游离细胞和固定化细胞催化性质进行研究,最后利用固定化细胞水解(R, S)-α-乙基-2-氧-1-吡咯烷乙酸甲酯,考察了其操作稳定性。
1 材料和方法 1.1 土样及试剂浙江台州华海药业川南一分厂、川南二分厂污水处理池、生产车间周边等35份样本。聚乙烯醇(PVA) (1750±50),中国医药集团上海化学试剂公司;海藻酸钠,国药集团化学试剂有限公司;50%聚乙烯亚胺水溶液(分子量70000),上海阿拉丁生化科技股份有限公司;硅藻土(粒径19.6 μm),上海阿拉丁生化科技股份有限公司;25%戊二醛溶液,国药集团化学试剂有限公司;(R, S)-α-乙基-2-氧-1-吡咯烷乙酸甲酯,华海药业川南二分厂技术中心;其他常规试剂均为市售分析纯。
1.2 培养基 1.2.1 富集培养基(g/L): K2HPO4 2.1,KH2PO4 0.4,NaCl 0.1,MgSO4·7H2O 0.2,CaCl2 0.025,NH4NO3 0.5,酵母粉1.0,蛋白胨2.0,(R, S)-α-乙基-2-氧-1-吡咯烷乙酸甲酯1.0。 1.2.2 罗丹明B初筛培养基(g/L): K2HPO4 2.1,KH2PO4 0.4,NaCl 0.1,MgSO4·7H2O 0.2,CaCl2 0.025,NH4NO3 0.5,酵母粉1.0,蛋白胨2.0,琼脂20,121 ℃灭菌20 min。待培养基冷却至50 ℃加入10 mL过滤除菌后罗丹明(1 mg/mL)和12 mL PVA乳化液,摇匀后倒平板。PVA底物乳化液的制备:(1)聚乙烯醇(PVA)溶液:2.0 g PVA加去离子水800 mL加热溶解,冷却,用0.2 mol/L NaOH溶液滴定至pH 7.5后过滤,再定容至1000 mL,制成2%的PVA水溶液。(2)量取制得的PVA水溶液450 mL,再加入(R, S)-α-乙基-2-氧-1-吡咯烷乙酸甲酯150 mL,用高速匀浆机充分搅拌,取出备用(现配现用)。 1.2.3 复筛固体培养基(g/L): K2HPO4 2.1,KH2PO4 0.4,NaCl 0.1,MgSO4·7H2O 0.2,CaCl2 0.025,NH4NO3 0.5,酵母粉1.0,蛋白胨2.0,琼脂20。 1.2.4 复筛摇瓶培养基(g/L): K2HPO4 2.1,KH2PO4 0.4,NaCl 0.1,MgSO4·7H2O 0.2,CaCl2 0.025,NH4NO3 0.5,酵母粉1.0,蛋白胨2.0,(R, S)-α-乙基-2-氧-1-吡咯烷乙酸甲酯1.0。 1.3 催化拆分(R, S)-α-乙基-2-氧-1-吡咯烷乙酸甲酯菌株的筛选富集培养:称取2 g土样加入30 mL灭菌后的生理盐水中,30 ℃、180 r/min摇床振荡30 min,吸取2 mL悬液加入到富集培养基中,30 ℃、180 r/min摇床培养3–4 d,然后吸取2 mL再次转接到新鲜富集培养基中,如此重复富集培养5次。
平板筛选:无菌生理盐水稀释富集培养液,稀释梯度为10–7、10–9、10–11、10–13,取0.1 mL菌悬液涂布在初筛平板培养基上,30 ℃培养3–5 d,365 nm紫外灯下观察平板上菌体生长状况,在平板上挑取形成荧光圈的菌株,划线纯化至纯种,保存在斜面试管复筛培养基上。
复筛:将分离纯化后的菌株接入复筛摇瓶培养基,30 ℃、180 r/min摇床培养3–4 d。取发酵液,通过HPLC检测,选取拆分效果理想的菌株。
1.4 产酯酶菌株Methylopila sp. cxzy-L013固定化细胞的制备采用硅藻土-戊二醛吸附交联法制备固定化细胞:称取0.6 g硅藻土与一定量菌体用Tris-HCl缓冲液(100 mmol/L,pH 8.0)悬浮定容至100 mL,加入聚乙烯亚胺使其终浓度为0.1% (V/V),交联1 h,再加入戊二醛使其终浓度为0.2% (V/V),继续交联1 h,抽滤水洗备用。
1.5 固定化细胞催化水解(R, S)-α-乙基-2-氧-1-吡咯烷乙酸甲酯300 mL催化反应体系:500 mL的转化瓶中,(R, S)-α-乙基-2-氧-1-吡咯烷乙酸甲酯终浓度200 g/L,以水为反应介质,固定化酶投量1.5% (M/V),200 r/min机械搅拌,反应温度40 ℃,用20% (M/V) Na2CO3溶液维持pH 8.5左右。
1.6 分析方法 1.6.1 (R, S)-α-乙基-2-氧-1-吡咯烷乙酸甲酯及其水解产物的HPLC分析: 取一定量水解反应液加HCl至pH为4.0左右,乙酸乙酯萃取,取一定量有机相,氮气吹干,加入流动相溶解。流动相中正己烷:异丙醇:三氟乙酸=80:20:0.2,流速0.8 mL/min,检测波长210 nm,柱温30 ℃,进样量20 μL,大赛璐(Daicel) CHIRALPAK AS-H 250 mm× 4.6 mm色谱柱。保留底物对映体过量值(ees)和收率C按公式(1–2)计算。
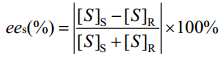
|
公式(1) |
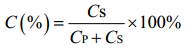
|
公式(2) |
式中,[S]S和[S]R分别为样品中S和R型甲酯的含量,ees为(S)-α-乙基-2-氧-1-吡咯烷乙酸甲酯的对映体过量值,CP为产物的摩尔浓度,Cs为保留底物的摩尔浓度。
1.6.2 酶活力测定: 取0.5 g菌体或含有相同菌泥量固定化细胞,加入含1% (M/V)的(R, S)-α-乙基-2-氧-1-吡咯烷乙酸甲酯Tris-HCl缓冲液(100 mmol/L,pH 8.0),反应体系20 mL,37 ℃反应10 min,强酸终止反应,液相检测产物生成量。以游离细胞的活力为100%,计算固定化细胞的活力收率。在上述条件下,1 min产生1 μmol (R)-α-乙基-2-氧-1-吡咯烷乙酸所需的酶量为一个酶活力单位(U)。比酶活即1 g固定化细胞所具有的酶活力单位。 2 结果和分析 2.1 菌种的筛选和鉴定 2.1.1 菌种的筛选: 脂肪酶/酯酶能够分解油脂,加入罗丹明B的阳离子会与脂肪酶水解得到的脂肪酸发生络合作用,在365 nm紫外灯下产生荧光,可利用该方法对产酯酶/脂肪酶的菌株进行快速筛选,结果如图 2。经过罗丹明B平板初筛,挑取有荧光圈菌株接种到复筛摇瓶培养基,30 ℃培养3 d,取菌液进行HPLC分析,成功获得了一株能不对称水解(R, S)-α-乙基-2-氧-1-吡咯烷乙酸甲酯的菌株,该菌株主要水解R-甲酯,保留构型为S-甲酯,S-甲酯对映体过量值ees > 99%,将该菌株初步命名为cxzy-L013。
|
| 图 2 罗丹明B平板 Figure 2 Rhodamine B medium. Using rac-α-ethyl- 2-oxo-pyrrolidineacetic acid methyl ester as the inducer and Rhodamine B as the indicator. |
2.1.2 菌种形态和生理生化鉴定: 将菌株cxzy-L013划线于LB固体培养基,30 ℃培养3–5 d,挑取菌落进行革兰氏染色,在显微镜下观察,菌体呈短圆杆状,单个分散排列,大小为(0.3–0.4) μm× (1.0–1.2) μm,为革兰氏阴性菌。菌株在LB平板上菌落呈规则状圆形,边缘整齐,直径0.5–1.0 mm,表面隆起,湿润,有光泽,乳白色。在以葡萄糖、甘油为碳源的培养基上生长缓慢,以甲醇、甲胺盐酸盐、甲酸铵为碳源时生长较快。该菌株生理生化鉴定在本实验室完成,部分生理生化特征结果如表 1。该菌株种生理生化特征与已报道Methylopila菌株JZL-4T [11]较为相似。
| Characteristics | Results |
| Lysine decarboxylase | – |
| Arginine decarboxylase | – |
| Ornithine decarboxylase | – |
| O-nitrophenyl-β-D- | – |
| galactopyranoside (ONPG) | |
| Oxidase | + |
| Catalase | + |
| Voges-Proskauer (V-P) | – |
| Urea | + |
| Methyl red (MR) | – |
| Starch | + |
| Gelatin | – |
| Casein | + |
| Sucrose | + |
| Glucose | + |
| Raffinose | + |
| Xylose | + |
| Maltose | – |
| Citrate | – |
| Esculin | – |
| H2S production | – |
| D-sorbitol | + |
| Dichloromethane | – |
| Methanol | + |
| Gelatin | – |
| +: growth or positive; –: not growth or negative. | |
2.1.3 16S rRNA分子生物学鉴定: 以菌株cxzy-L013基因组为模板,采用通用引物27F和1492R进行PCR扩增,将扩增序列交由生工生物工程(上海)股份有限公司进行测序,16S rDNA序列长度为1411 bp,将该序列在NCBI网站上用BLAST检索GenBank中相关菌株的16S rDNA序列,并进行核苷酸同源性比对,发现它与Methylopila oligotropha strain 2395A、Methylopila musalis strain MUSA、Methylopila jiangsuensis strain JZL-4有98%的相似性,该菌株16S rRNA基因序列的系统进化树如图 3。菌株与Methylopila oligotropha strain 2395A系统发育关系较为密切,结合菌株形态和生理生化特征,鉴定cxzy-L013为甲基球状菌属(Methylopila),将其命名为Methylopila sp. cxzy-L013.

|
| 图 3 菌株cxzy-L013的16S rDNA系统发育树 Figure 3 16S rDNA phylogenetic tree of strain cxzy-L013. The numbers on branches indicate bootstrap values. The tree rooted was constructed by Kimura-2-Parameter model and N-J method with bootstrap values calculated from 1000 resampling. The numbers at each node that indicate the percentage of bootstrap supporting. Numbers in parentheses represent the sequences accession number in GenBank. Bar=0.5% sequence divergence. |
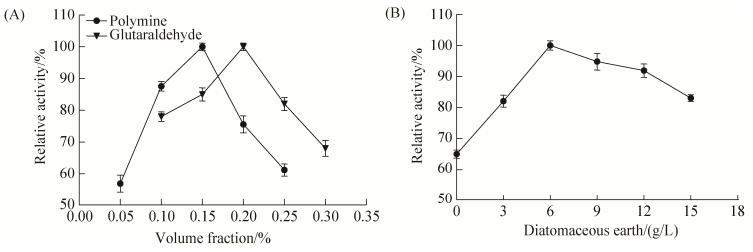
2.2 固定化细胞制备条件的优化 2.2.1 固定化试剂添加量的确定: 聚乙烯亚胺与戊二醛联用较单一使用戊二醛固定化效果好。聚乙烯亚胺与戊二醛通过交联能够在细胞表面形成一层聚合物膜[12],提高固定化细胞稳定性。固定化体系中其他因素不变,分别考察不同体积分数聚乙烯亚胺以及戊二醛对固定化细胞酶活影响,以最高酶活为100%,结果如图 4-A。当聚乙烯亚胺浓度为0.15% (V/V),固定化细胞酶活力达到最高,高浓度的聚乙烯亚胺与戊二醛交联较为彻底,减弱了戊二醛与细胞蛋白交联作用,导致酶活回收率下降。当戊二醛浓度为0.2% (V/V)时,固定化细胞酶活力达到最高,随后又大幅下降,可能是因为醛基与蛋白分子上的氨基发生多点结合,导致酶蛋白构象发生变化,使部分蛋白变性。固定化体系中其他因素不变,考察硅藻土添加量对固定化细胞酶活影响,以最高酶活为100%,结果如图 4-B。加入硅藻土比未加硅藻土制备的固定化细胞酶活有明显提高,当硅藻土加量为6 g/L,酶活力达到最大,随后有所降低。
|
| 图 4 固定化试剂添加量对固定化酶活的影响 Figure 4 Effect of immobilized reagent concentration on activity of immobilized cells. A: polymine and glutaraldehyde; B: diatomaceous earth. |
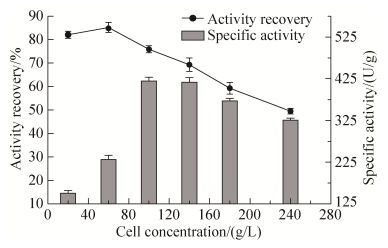
2.2.2 菌体细胞添加量的确定: 固定化体系中其他因素不变,固定化相同体积不同浓度的菌悬液,测定固定化细胞酶活回收率和比酶活,结果如图 5。随着菌体浓度提高,酶活回收率整体呈下降趋势。当菌体浓度为100 g/L时,比酶活达到最大419.5 U/g,此时酶活回收率为75.9%,细胞浓度过高,可能硅藻土颗粒覆盖细胞较多,增加传质阻力。
|
| 图 5 菌体加量对固定化酶活的影响 Figure 5 Effect of cell addition on activity of immobilized cells. |
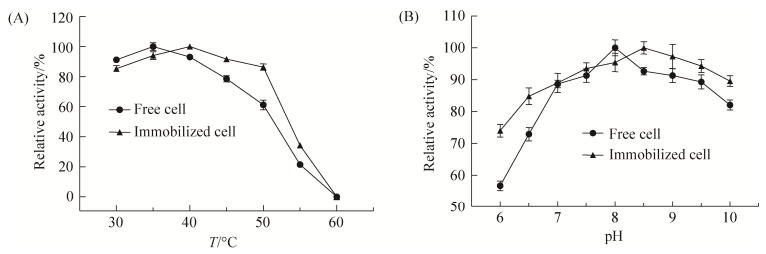
2.3 固定化细胞的催化性质 2.3.1 温度和pH对酶活力影响: 在不同的温度下,分别测定游离细胞与固定化细胞酯酶的酶活,以最高酶活为100%,结果如图 6-A。游离细胞的最适温度为35 ℃,而固定化细胞为40 ℃。固定化细胞在50 ℃仍保留80%以上酶活,较游离细胞温度适应范围变宽。不同pH下,分别测定游离细胞与固定化细胞酯酶的酶活,以最高酶活为100%,结果如图 6-B。游离细胞的最适pH为8.0,而固定化细胞为8.5,向碱性方向偏移了0.5个单位,固定化细胞对不同pH的适应能力明显强于游离细胞。将游离细胞与固定化细胞分别在不同温度下保温6 h,酶活的稳定性如图 7-A。在30–45 ℃范围内固定化细胞仍保留90%以上的初始酶活,在50 ℃时游离细胞保留45.6%的初始酶活,而固定化细胞仍保留83.8%的初始酶活,较游离细胞的温度稳定性好。在4 ℃下将游离细胞与固定化细胞分别在不同pH下保温24 h,pH稳定性如图 7-B。在pH 6.0–7.0范围内,固定化细胞剩余酶活明显高于游离细胞,在pH 7.0–10.0范围内,固定化细胞剩余酶活仍保留初始时的90%以上,表明固定化细胞pH适应范围较游离细胞更宽。
|
| 图 6 温度(A)和pH (B)对酶活力的影响 Figure 6 Effect of temperature (A) and pH (B) on enzyme activity. |

|
| 图 7 温度(A)和pH (B)对酶稳定性的影响 Figure 7 Effect of temperature (A) and pH (B) on enzyme's stability. |
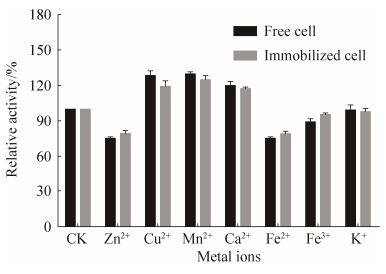
2.3.2 金属离子对酶活影响: 分别测定加入10 mmol/L不同金属离子后游离细胞与固定化细胞的酶活,以不加金属离子时的酶活(CK)为100%,结果如图 8。金属离子对固定化细胞和游离细胞影响相差不大,Cu2+、Mn2+、Ca2+能促进酶活,Zn2+、Fe2+对酶活有一定的抑制,其他金属离子对酶活的影响较小。
|
| 图 8 金属离子对酶活的影响 Figure 8 Effect of various metal ions (10 mmol/L) on enzyme's activity. |
2.3.3 有机溶剂对酶活影响: 测定加入不同有机溶剂对酶活的影响,以未加入有机溶剂为对照(CK),分别测定不同有机溶液及浓度下游离细胞与固定化细胞反应1 h的转化率,反应结果如表 2。10%的甲醇对酶活力有抑制作用,10%的异丙醇、甲苯、正己烷对酶活有明显促进作用。30%甲苯和正己烷对酶活有明显抑制作用,但相比游离细胞,对固定化细胞影响较弱,表明固定化细胞对有机溶剂耐受性有所提高。不同有机溶剂对游离细胞和固定化细胞的选择性没有明显的影响,(S)-α-乙基-2-氧-1-吡咯烷乙酸甲酯的对映体过量值ees均大于99%。
| Organic solvent | Solvent concentration/% (V/V) | Conversion of free cells/% | Conversion of immobilized cells/% |
| CK | 0 | 21.8 | 16.9 |
| Methanol | 10 | 14.9 | 13.8 |
| Isopropanol | 10 | 27.9 | 21.6 |
| Tert-butyl methyl ether | 10 | 22.4 | 18.5 |
| 30 | 12.5 | 14.8 | |
| Toluene | 10 | 29.6 | 27.3 |
| 30 | 6.9 | 14.7 | |
| n-hexane | 10 | 25.4 | 21.6 |
| 30 | 3.8 | 11.9 |
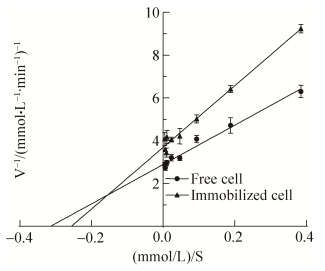
2.3.4 酶动力学测定: 测定了不同底物浓度下游离细胞与固定化细胞的酶反应速度,用Lineweaver- Burk双倒数作图法进行曲线拟合,如图 9。游离细胞与固定化细胞米氏常数Km分别为3.59 mmol/L和3.85 mmol/L,Vmax为0.35 mmol/(min·L)和0.27 mmol/(min·L)。相较于游离酶,固定化细胞的Km值变大,可能是由于固定化细胞传质阻力增加,使底物与酶的亲和力减弱。
|
| 图 9 酶反应速率和底物浓度的双倒数图 Figure 9 Double reciprocal of enzyme reaction rate and substrate concentration. |
2.4 固定化细胞催化水解(R, S)-α-乙基-2-氧-1-吡咯烷乙酸甲酯
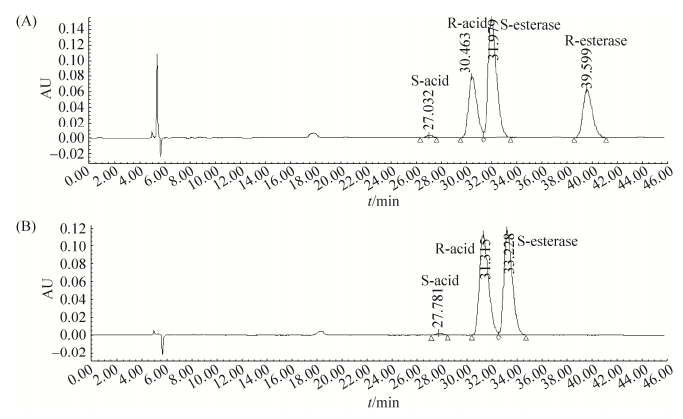
(R, S)-α-乙基-2-氧-1-吡咯烷乙酸甲酯经固定化细胞催化20 h,(R)-α-乙基-2-氧-1-吡咯烷乙酸甲酯已经被完全水解为酸,保留构型为(S)-α-乙基-2-氧-1-吡咯烷乙酸甲酯,得率为47.8%,对映体过量值ees为99.4%。利用HPLC分析了水解6 h和20 h的情况,如图 10。
|
| 图 10 固定化细胞水解外消旋甲酯反应6 h和20 h的HPLC图 Figure 10 HPLC graphs in the course of hydrolysis of racemic methyl ester catalyzed by immobilized cells. A: reaction 6 h; B: reaction 20 h. |
2.5 固定化细胞操作稳定性
将固定化细胞按文中1.5转化工艺反应20 h后,抽滤水洗用于下次催化反应,考察固定化细胞操作稳定性,结果如图 11。固定化细胞连续使用12次后仍可保留初始酶活的80%以上,且连续使用6次后酶活有小幅上升,可能是由于连续使用过程中交联度降低及细胞通透性增加,减少底物传质阻力。该固定化细胞具有良好的操作稳定性。

|
| 图 11 固定化细胞操作稳定性 Figure 11 Recycling experiment for immobilized cells. |
3 结论
获得高光学纯度的(S)-α-乙基-2-氧-1-吡咯烷乙酸甲酯是制备左已拉西坦的关键,目前国内外仍采用化学法合成左已拉西坦,苯乙胺是生产左乙拉西坦的重要拆分剂,其对环境污染较严重,导致化工厂污水治理费用较高,而寻求生物拆分剂是左已拉西坦生产工艺转型的一条重要途径。本文从土样中筛选到一株可以选择性拆分(R, S)-α-乙基-2-氧-1-吡咯烷乙酸甲酯菌种,通过其形态、生理生化特征及16S rDNA序列分析,鉴定为甲基球状菌属(Methylopila),将该菌种命名为Methylopila sp. cxzy-L013。
在对菌株cxzy-L013选用硅藻土-戊二醛吸附交联法固定化条件优化研究中发现聚乙烯亚胺添加0.15% (V/V)、戊二醛0.2% (V/V)、硅藻土6 g/L、菌体质量浓度100 g/L的条件下制备的固定化细胞比酶活达到最大419.5 U/g,酶活回收率为75.9%。与游离细胞相比,固定化细胞催化性质发生改变,最适pH由8.0变为8.5,最适温度由35 ℃变为40 ℃,pH稳定性和温度稳定性都有所提高。金属离子对固定化细胞和游离细胞影响相差不大,Cu2+、Mn2+、Ca2+能促进酶活,Zn2+、Fe2+对酶活有一定的抑制作用。相较于水相反应体系,10%的异丙醇、甲苯、正己烷对酶活有明显促进作用,10%的甲醇、30%甲苯和正己烷对酶活有明显抑制作用,固定化细胞的有机溶剂耐受性较游离细胞有所提高。游离细胞与固定化细胞米氏常数Km分别为3.59 mmol/L和3.85 mmol/L,Vmax为0.35 mmol/(min·L)和0.27 mmol/(min·L),固定化细胞与底物的亲和力较游离细胞要小。
利用固定化细胞水解(R, S)-α-乙基-2-氧-1-吡咯烷乙酸甲酯,底物浓度200 g/L,反应20 h,保留构型为S型,得率47.8%,对映体过量值ees为99.4%,重复使用12次后仍可保留初始酶活的80%以上。目前笔者已利用该固定化细胞进行5批次的1500 L中试转化验证,前两批转化符合预期,后三批所需反应时间逐渐延长,最后一批反应30 h将(R)-α-乙基-2-氧-1-吡咯烷乙酸甲酯水解完全,由于固定化细胞在每次转化后需进行压滤以备下次使用,该操作会损失部分固定化细胞,可以在后续反应批次中补加一定量固定化细胞,以达到与前两批转化相同的效果。如加大转化体系投酶量,底物添加量仍有进一步提高的可能。该工艺具有一定的工业化应用潜力。
| [1] | Garrison AW. Issues on the enantioselectivity of chiral agrochemicals. Chimica Oggi, 2002, 20(10): 28-32. |
| [2] | Carrea G. Biocatalysis in water-organic solvent two-phase systems. Trends in Biotechnology, 1984, 2(4): 102-106. DOI:10.1016/S0167-7799(84)80006-2 |
| [3] | Bornscheuer UT. Microbial carboxyl esterases:classification, properties and application in biocatalysis. FEMS Microbiology Reviews, 2002, 26(1): 73-81. DOI:10.1111/j.1574-6976.2002.tb00599.x |
| [4] | Barros MD, Macedo GA. Biochemical characterization of esterase from soybean (Glycine max L.). Food Science and Biotechnology, 2011, 20(5): 1195-1201. DOI:10.1007/s10068-011-0165-8 |
| [5] |
Qu WX, Yue XF. Progress in cell immobilizationtechniques and its application. Shaanxi Journal of Agricultural Sciences, 2007(6): 121-123.
(in Chinese) 渠文霞, 岳宣峰. 细胞固定化技术及其研究进展. 陕西农业科学, 2007(6): 121-123. DOI:10.3969/j.issn.0488-5368.2007.06.045 |
| [6] | Sander JW, Mitchell TN. Levetiracetam:a new antiepileptic drug for the adjunctive therapy of chronic epilepsy. Drugs of Today, 2001, 37(10): 665-673. DOI:10.1358/dot.2001.37.10.704215 |
| [7] | Genton P, van Vleymen B. Piracetam and levetiracetam:close structural similarities but different pharmacological and clinical profiles. Epileptic Disorders, 2000, 2(2): 99-105. |
| [8] | Löscher W, Richter A. Piracetam and levetiracetam, two pyrrolidone derivatives, exert antidystonic activity in a hamster model of paroxysmal dystonia. European Journal of Pharmacology, 2000, 391(3): 251-254. DOI:10.1016/S0014-2999(00)00105-9 |
| [9] |
Wang P, Yan R, Huang J, He JY. Preparation of (S)-alpha-ethyl-2-oxo-1-pyrrolidineacetic acid by microbial resolution. Journal of Zhejiang University of Technology, 2014, 42(6): 640-645.
(in Chinese) 王普, 严人, 黄金, 何军邀. 生物拆分制备(S)-α-乙基-2-氧-1-吡咯烷乙酸工艺研究. 浙江工业大学学报, 2014, 42(6): 640-645. DOI:10.3969/j.issn.1006-4303.2014.06.011 |
| [10] |
Xuan L. Study on microbial enzymatic synthesis of the chiral intermediate of levetiracetam. Master Dissertation of Zhejiang University of Technology, 2013. (in Chinese) 宣磊. 微生物酶法合成左乙拉西坦手性中间体的研究. 浙江工业大学硕士学位论文, 2013. |
| [11] | Li L, Zheng JW, Hang BJ, Doronina NV, Trotsenko YA, He J, Li SP. Methylopila jiangsuensis sp. nov., an aerobic, facultatively methylotrophic bacterium. International Journal of Systematic and Evolutionary Microbiology, 2011, 61(7): 1561-1566. DOI:10.1099/ijs.0.020925-0 |
| [12] | Chen J, Zheng YG, Shen YC. Biosynthesis of p-methoxyphenylacetic acid from p-methoxyphenylacetonitrile by immobilized Bacillus subtilis ZJB-063. Process Biochemistry, 2008, 43(9): 978-983. DOI:10.1016/j.procbio.2008.05.002 |
 2018, Vol. 58
2018, Vol. 58