
中国科学院微生物研究所,中国微生物学会,中国菌物学会
文章信息
- 李晴晴, 徐松, 赵维, 杨榕, 赵思崎, 黄志勇, 王敬敬. 2019
- Qingqing Li, Song Xu, Wei Zhao, Rong Yang, Siqi Zhao, Zhiyong Huang, Jingjing Wang. 2019
- 根际微生物组介导的解淀粉芽孢杆菌FH-1对水稻的促生机制
- Rhizosphere microbiome mediated growth-promoting mechanisms of Bacillus amyloliquefaciens FH-1 on rice
- 微生物学报, 59(12): 2410-2426
- Acta Microbiologica Sinica, 59(12): 2410-2426
-
文章历史
- 收稿日期:2019-02-20
- 修回日期:2019-05-08
- 网络出版日期:2019-05-31
近年来为了促进农作物的增产,我国大量施用化肥和农药,农作物亩均化肥和农药施用量均已是世界平均水平的2倍以上[1]。这不仅造成了一系列的生态环境污染,而且严重危害农业和社会的可持续化发展。目前,微生物促生菌剂的应用已成为促进植物生长的一种生态友好、可持续的途径,其具有增加土壤肥力、减少化肥使用、净化和修复土壤、降低植物病害、提高食品安全等特点[2-3]。
水稻是我国三大粮食作物之一,在中国有65%以上的人以稻米为主食,2018年全国水稻播种面积达到了2.927×107 hm2。水稻种植过程中化肥和农药的过量施用,不仅可造成土壤污染退化、作物病害频发而且严重危害人类健康[4]。近年来针对水稻已经研发了很多微生物接种剂,如Pham等[5]在温室条件下利用盆栽实验发现接种斯氏假单胞菌(Pseudomonas stutzeri)A15可以显著促进水稻苗的干重以及根的干重。Salamone等[6]发现荧光假单胞菌(Pseudomonas fluorescens)和巴西固氮螺菌(Azospirillum brasilense)的联合使用在大田条件下对水稻(Supremo 13)的收获指数、水稻产量均有显著促进作用,分别提高了16%、20.2%。
接种微生物菌剂可以促进水稻生长,但是长期以来由于技术手段的限制,微生物菌剂在大田土壤生态系统中如何促进水稻生长,并不十分清楚。微生物菌剂接种到大田后:(1)可能通过固氮、解磷、解钾、分泌植物激素等改良作物根际养分和生长环境,直接促进植物的生长发育[7-8];(2)也可能通过改变土壤微生物组,定向富集某些有益微生物类群,从而间接促进植物生长发育[9]。
土壤微生物组是土壤中所有微生物及其栖息环境的总称。土壤微生物是陆地生态系统植物多样性和生产力的重要驱动者[10-11]。根际微生物组是土壤微生物组的重要组成部分,且与植物生长发育、健康状况等密切相关[12]。根际微生物能帮助植物吸收养分,防治病害,增强植物对非生物和生物胁迫的耐受性,提高植物的免疫力[13-14],从而提高植物的生产力。微生物菌剂对根际微生物组的影响已引起了人们的极大兴趣。如Kunal等[15]利用DGGE和PLFA的研究方法发现在水稻田接种Calothrix elenkinii可以提高土壤微生物的数量,但是会降低革兰氏阳性细菌、革兰氏阴性细菌、放线菌门的一些丰度。由于研究水稻根际微生物群落结构和多样性的方法多为DGGE、PLFA、CLPPs[15-16]等,导致这些研究在一定程度上有局限性,使得微生物菌剂对根际微生物组影响的研究、报道等不够深入、全面。
解淀粉芽孢杆菌(Bacillus amyloliquefaciens)是一种常用的生防菌剂,已广泛用于辣椒、西瓜、花生等作物,用于防治根腐病、枯萎病等农作物真菌病害[17]。然而在大田土壤生态系统中解淀粉芽孢杆菌对水稻的促生机制尚未有较深入的报道。本文拟以前期筛选到的一株可在盆栽实验中明显促进水稻生长的解淀粉芽孢杆菌FH-1为研究对象,利用大田实验验证其对水稻的促生效果,同时采用高通量测序技术和生化技术深入研究其对根际土壤微生物组和土壤理化特性的影响,以期初步探明解淀粉芽孢杆菌FH-1在水稻大田生态系统中的促生机制,并为微生物肥料的研制和应用提供理论指导。
1 材料和方法 1.1 培养基、主要试剂和仪器Luria-Bertani(LB)培养基(g/L):蛋白胨10.0 g,酵母提取物5.0 g,氯化钠10.0 g,调整pH至7.0,1×105 Pa灭菌30 min。
酵母粉和蛋白胨,其他无机化学试剂等(分析纯,国药),SYBR Select Master Mix(2×)(Applied Biosystem,Foster City,CA,USA),Powersoil DNA提取试剂盒(MOBIO Laboratories,Carlsbad,CA,USA)。
NanoDrop 2.0(Thermo Scientific,USA),PCR仪、变性梯度凝胶电泳仪(伯乐公司),ABI 7500 FAST实时荧光定量PCR仪(ABI Life Technologies,Singapore,USA),贝朗70 L发酵罐(Sartorius,德国)。
1.2 解淀粉芽孢杆菌FH-1理化特性测定土壤样品来源为安徽省黄山市徽州区西溪南镇茶树的根际土壤。在90 mL无菌水中加入10 g土壤样品,高速振荡10 min,静置30 s,得到上清液;将该上清液置于100 ℃沸水中加热10 min,自然冷却,得到土壤悬液(此时稀释度记为10-1)。吸取1 mL土壤悬液加入盛有9 mL无菌水的试管中充分混匀(此时稀释度为10-2),然后从此试管中吸取1 mL加入到另一盛有9 mL无菌水的试管中混合均匀,制成稀释液(稀释度为10-3)。将稀释液均匀涂布在LB固体培养基上,30 ℃培养3 d。将在LB固体培养基上可以生长的菌落进行菌种纯化,筛选到了一株细菌命名为细菌FH-1。经过16S rRNA序列同源性分析,最终确定细菌FH-1为解淀粉芽孢杆菌FH-1。
将保藏-80 ℃冰箱的解淀粉芽孢杆菌FH-1菌株按照10%的比例接种到LB液体培养基中,在30 ℃摇床、180 r/min培养24 h。
用移液枪将5 μL培养的解淀粉芽孢杆菌FH-1菌液分别接种到阿须贝固氮培养基、有机磷固体培养基、无机磷固体培养基、解钾培养基、CAS平板上,观察解淀粉芽孢杆菌FH-1菌株是否有固氮、解有机磷、解无机磷、解钾以及产生铁载体的能力[18-19]。
用移液枪取3 mL解淀粉芽孢杆菌FH-1菌液12000 r/min离心15 min,取2 mL的上清液加入2 mL的Salkowski’s比色液中,混匀,在暗处反应30 min后,测定其OD530值(以未接菌的LB液体培养基与等体积Salkowski’s比色液的混合液为对照)[20]。
利用ADF培养基培养解淀粉芽孢杆菌FH-1,参照Bradford法测定细菌细胞提取液中总蛋白质含量。以牛血清白蛋白为标准物,制作标准曲线。参照Saleh等的方法测定ACC脱氨酶活力[21-22]。
用移液枪吸取5 μL培养的解淀粉芽孢杆菌FH-1菌液,利用平板对峙法在PDA平板上分别检测解淀粉芽孢杆菌FH-1菌株对3种植物病原菌(立枯丝核菌、尖孢镰刀菌、禾谷镰刀菌)是否有拮抗作用。
1.3 解淀粉芽孢杆菌FH-1菌液培养及大田地点与实验设计 1.3.1 解淀粉芽孢杆菌FH-1菌液培养:将保藏在-80 ℃冰箱的解淀粉芽孢杆菌FH-1菌株按照1%的比例接种到100 mL LB液体培养基中,在30 ℃摇床180 r/min活化培养48 h。按照5%的接种量在LB液体培养基中扩大培养。使用价格低廉、配方简单的工业酵母粉、蛋白胨配制工业LB液体培养基。按照5%的比例,将活化菌种在装有70 L工业LB液体培养基的发酵罐中培养(温度30 ℃,转速150 r/min,通气量3 m3/h,罐压0.05 MPa) 24 h后,获得所需菌液。
1.3.2 大田地点与实验设计:实验地点为浙江省湖州市,该地点为水稻种植区,一年2-3季。该地区气候潮湿,属亚热带季风气候,年平均气温16 ℃。年平均降雨量约为1200 mm。实验设置两个处理:(1)空白对照(CK):水稻插秧期撒施尿素75 kg/hm2、氯化钾105-120 kg/hm2、有机肥1200 kg/hm2;水稻中期撒施有机肥1200 kg/hm2;水稻抽穗期撒施有机肥1200 kg/hm2。(2)菌剂FH-1处理(FH):水稻插秧期撒施尿素75 kg/hm2、氯化钾105-120 kg/hm2、有机肥1200 kg/hm2,并冲施FH-1菌液30 L/hm2;水稻中期撒施有机肥1200 kg/hm2,并喷施FH-1菌液30 L/hm2;水稻抽穗期撒施有机肥1200 kg/hm2,并喷施FH-1菌液30 L/hm2。每个处理5个重复,共10个小区,每个处理小区130 m2,采用随机设计布置实验区块。各处理施肥、浇水等管理措施均按照当地农民的习惯进行,栽培作物为水稻,品种为甬优1540水稻。
1.4 样品的采集在水稻成熟期,根据“S”采样方法在每个小区中采集5株甬优1540水稻植株,利用铁锹将水稻从土壤中移出,将附着在水稻根上的土壤抖落下来,放入到标好序号的收集袋中,放置到盛有冰袋的收集盒中,迅速送至实验室并将根际土壤储存在-80 ℃的冰箱中。利用尺子测量水稻的株高、根长和穗长,并统计水稻的穗数、单穗粒数、千粒重。
1.5 土壤理化性质土壤pH采用国际标准(ISO 10390 2005)按照水与土的体积比为5:1放置在三角瓶中,在摇床上振荡60 min,然后放在桌面上静置60 min,用pH计(S20K型号)测其pH。有机质(OM)采用有机质光度法、总氮(TN)采用凯氏定氮法、总磷(TP)采用钼锑抗比色法、总钾(TK)采用火焰分光光度法、有效氮(AN)采用扩散法、有效磷(AP)采用钼锑抗比色法和有效钾(AK)采用火焰光度法在苏州科铭生物技术有限公司进行测定。
1.6 土壤基因组的提取按照PowerSoil DNA提取试剂盒说明书对10个土壤样品进行DNA提取。提取的基因组进行电泳鉴定,并用NanoDrop 2.0测定基因组的含量和质量。
1.7 细菌的定量PCR运用测序阳性克隆质粒配制细菌定量PCR的标准曲线对两个处理组的10个样品进行细菌的绝对定量。细菌16S rRNA基因定量PCR引物338F 5'-ACTCCTACGGGAGGCAGCAG-3'和518R 5'-ATTACCGCGGCTGCTGG-3'[23]。20 μL的PCR反应体系包括:2×SYBR select Master Mix 10 μL,上下游引物(0.25 μmol/L)各1 μL,DNA模板1 μL,ddH2O 7 μL。反应程序为两步法:95 ℃预孵育10 min;95 ℃ 15 s,60 ℃ 1 min,40个循环。
1.8 16S rRNA基因高通量测序以10个土壤样品基因组DNA为模板,采用Illumina MiSeq测序平台检测16S rRNA的V3-V4区。细菌通用引物序列为515F 5'-GTGCCAGCMG CCGCGGTAA-3'和915R 5'-CCGYCAATTYMTT TRAGTTT-3'。利用QIIME 1.9处理和分析16S rRNA基因序列。首先短于200 bp的序列,包含未解析的核苷酸,低于25平均质量评分的序列,在正向引物中具有长于3 bp的错配的序列,或者具有长于6 bp的均聚物,用split_libraries.py命令去除。以核糖体数据库(RDP)作为参考数据集,使用UCHIME去除嵌合序列(identify_chimeric_seqs.py)。利用命令pick_de_novo_otus.py在3%(种水平)的遗传差异下进行操作分类单元(OTU)的测定。采用命令filter_taxa_from_otu_table.py和filter_otus_ from_otu_table.py去除单体、叶绿体、非分类OTUs和外源域OTUs。我们在每个样本中随机选取了6500个序列利用core_diversity.py命令计算样本间的多样性和距离。统计各个样品之间的群落组成,组间群落差异分析,LEfSe采用Huttenhower实验室开发的galaxy网站进行分析。使用python collapse_table.py命令通过功能注释原核分类群(FAPROTAX)预测微生物群落功能,利用table_L6. from_biom_function.txt文件在HemI 1.0软件中绘制成Heatmap。
1.9 数据统计分析所有数据为均值±标准差(n=5)。通过独立样本t检验分析两个处理组间的水稻各个性质、群落组成、群落功能预测、土壤群落多样性等的差异显著性(P < 0.05)。使用Pearson相关分析检验水稻各个性质与微生物α多样性、富集微生物的相关性。所有统计分析均使用IBM SPSS statistic(Version 21.0)进行。所有作图都使用Origin 2016完成。
2 结果和分析 2.1 解淀粉芽孢杆菌FH-1的生理生化特性如图 1所示解淀粉芽孢杆菌FH-1具有固氮、解无机磷、解钾、产生铁载体和ACC脱氨酶的能力,并且对立枯丝核菌、尖孢镰刀菌、禾谷镰刀菌这三株病原菌均有拮抗作用,但是该菌不具有解有机磷和产生吲哚乙酸的能力(表 1)。
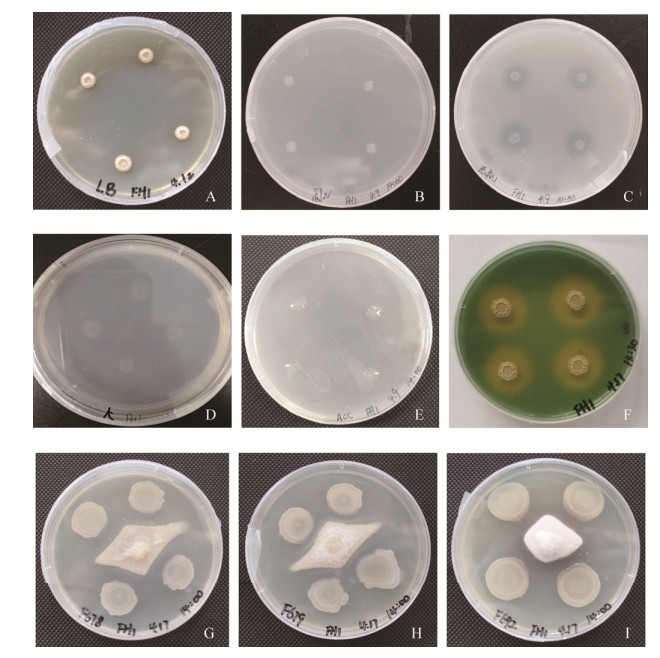
|
| 图 1 解淀粉芽孢杆菌FH-1在LB平板(A)、固氮平板(B)、解无机磷平板(C)、解钾平板(D)、ADF平板(E)、CAS平板(F)和PDA平板(G:尖孢镰刀菌、H:禾谷镰刀菌、I:立枯丝核菌)上生长情况 Figure 1 Bacillus amyloliquefaciens FH-1 grew on LB plate (A), Nitrogen fixation plate (B), Inorganic phosphorus solution plate (C), Potassium solution plate (D), ADF plate (E), CAS plate (F) and PDA plate (G: Fusarium oxysporum, H: Fusarium graminearum, I: Rhizoctonia solani). |
| The growth-promoting characteristic of FH-1 | Results |
| Nitrogen fixing ability | + |
| Inorganic phosphate solubilizing ability (D/d) | 2.00 |
| Organic phosphate solubilizing ability (D/d) | - |
| Potassium solubilizing ability | + |
| Siderophore (D/d) | 2.30 |
| Indole acetic acid producing ability/(g/L) | - |
| Activity of ACC deaminase/(U/mg) | 0.42 |
| Antagonistic ability against Rhizoctonia solani (d/D) | 0.47 |
| Antagonistic ability against Fusarium oxysporum (d/D) | 0.41 |
| Antagonistic ability against Fusarium graminearum (d/D) | 0.43 |
| FH-1, Bacillus amyloliquefaciens FH-1; +, means having the ability; -, means having no the ability; D, diameter of solubilizing zone; d, diameter of bacterial colony; d, diameter of fungal colony with antagonistic bacteria; D, diameter of fungal colony without antagonistic bacteria. | |
2.2 菌剂FH-1对水稻的影响
菌剂FH-1处理(FH)水稻的根长、株高、穗长、单株穗数、单穗粒数、千粒重显著高于空白对照(CK)(P < 0.05)(表 2)。菌剂FH-1处理(FH)水稻的根长、单穗粒数约为空白对照(CK)的1.5倍,单株穗数约为空白对照(CK)的2倍。菌剂FH-1处理(FH)水稻的株高、穗长、千粒重较空白对照(CK)分别提高了14.90%、35.90%、12.68%。说明菌剂FH-1可显著促进水稻生长,提高水稻产量。
| Various properties of rice | CK | FH |
| Root length/cm | 10.48±0.72b | 16.38±2.22a |
| Plant height/cm | 113.16±3.96b | 130.02±2.51a |
| Spike length/cm | 17.16±0.26b | 23.32±1.64a |
| Panicles per plant | 12.20±1.79b | 23.00±5.24a |
| Grain number per spike | 199.40±41.25b | 309.00±23.23a |
| Thousand-grain weight/g | 19.72±1.52b | 22.22±1.01a |
| Data followed by the different lowercase letters are significantly different due to various properties of rice of different treatments at P < 0.05. | ||
2.3 菌剂FH-1对土壤基本理化性质的影响
菌剂FH-1处理(FH)与空白对照(CK)的土壤理化性质无显著性差异(表 3)。但是菌剂FH-1处理(FH)土壤中的全氮、全磷、有效氮、有效磷均低于空白对照(CK),全钾、有效钾均高于空白对照(CK)。说明菌剂FH-1可能促进了水稻对氮和磷养分的吸收。
| Soil physical and chemical properties | CK | FH |
| pH | 5.87±0.23a | 6.14±0.20a |
| Organic matter/(g/kg) | 36.87±3.97a | 38.80±6.06a |
| Total nitrogen/(g/kg) | 2.40±0.04a | 1.93±0.43a |
| Total phosphorus/(g/kg) | 0.27±0.05a | 0.23±0.02a |
| Total potassium/(g/kg) | 18.54±1.54a | 20.60±3.66a |
| Available nitrogen/(mg/kg) | 86.10±21.38a | 76.30±24.67a |
| Available phosphorou/(mg/kg) | 3.04±0.42a | 2.69±0.39a |
| Available potassium/(mg/kg) | 55.30±8.97a | 58.28±10.13a |
| Data followed by the different lowercase letters are significantly different due to various properties of rice of different treatments at P < 0.05. | ||
2.4 菌剂FH-1对根际土壤微生物群落组成的影响
利用Illumina Hiseq 2500测序平台对10个根际土壤样品的微生物多样性进行检测,总共获得429002个序列,每个样本平均42900条序列(38173-60712)。将每个样本序列随机抽取38000条序列进行标准化分析后,发现优势物种为α-变形菌纲、β-变形菌纲、δ-变形菌纲、γ-变形菌纲、绿弯菌门、酸杆菌门、硝化螺旋菌门、放线菌门、疣微菌门、拟杆菌门、浮霉菌门、蓝藻、绿菌门、芽单胞菌门、厚壁菌门(> 1%)(图 2)。菌剂FH-1处理(FH)土壤中的γ-变形菌纲、绿弯菌门显著高于空白对照(CK),β-变形菌纲、疣微菌门显著低于空白对照(CK)(P < 0.05)。菌剂FH-1处理(FH)土壤中的γ-变形菌纲的含量提高了25.19%,β-变形菌纲的含量较空白对照(CK)降低了27.49%。
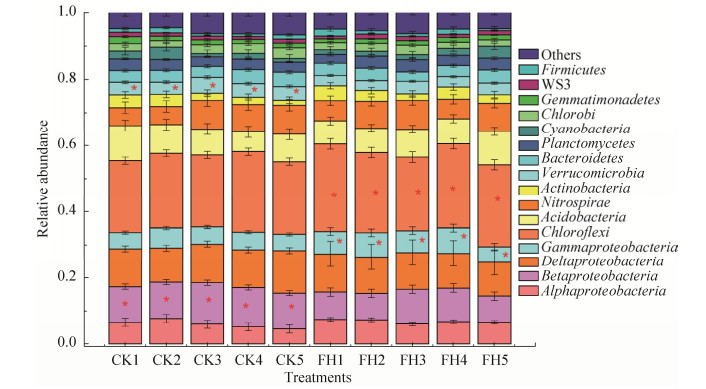
|
| 图 2 菌剂FH-1处理(FH)与空白对照(CK)的土壤细菌门(纲)水平物种组成 Figure 2 Soil bacterial phylum(class) level species composition of the inoculant FH-1 treatment(FH) and blank control (CK). *, Significantly correlated at the 0.05 level (both sides). |
LEfSe分析显示菌剂FH-1处理(FH)土壤中富集的微生物有19个,主要包括绿弯菌门及厌氧绳菌纲中的A31、H39、S0208纲,PAUC34f,酸杆菌门的S035纲,酸杆菌门索利氏菌纲索利氏菌目的AKIW659科,迷踪菌门的4-29,厚壁菌门的芽孢杆菌纲及芽孢杆菌目,浮霉菌门的浮霉菌纲及Gemmatales目,硝化螺旋菌门硝化螺旋菌纲硝化螺旋菌目的0319-6A21科,α-变形菌纲的红螺菌目及红螺菌科,α-变形菌纲根瘤菌目的生丝微菌科,β-变形菌纲A21b目的EB1003科,γ-变形菌纲的HOC36目,γ-变形菌纲交替单胞菌目交替单胞菌科的HB2-32-21属。空白对照(CK)土壤中富集的微生物(即FH-1处理(FH)土壤中显著减少的物种)主要包括TPD-58,疣微菌门,OP11门的OP11-3纲,GN04门的GN15纲,酸杆菌门的OS-K纲,绿弯菌门厌氧绳菌纲的厌氧绳菌目及厌氧绳菌科,β-变形菌纲及其中的嗜甲基菌目,红环菌目和红环菌科,δ-变形菌纲的脱硫杆菌目及其中脱硫杆菌科和脱硫球菌属,δ-变形菌纲互营杆菌目的互营杆菌科,α-变形菌纲红螺菌目的醋杆菌科,α-变形菌纲鞘脂单胞菌目鞘脂单胞菌科的新鞘脂菌属,螺旋体门螺旋体钢螺旋体目螺旋体科的螺旋体属(图 3)。
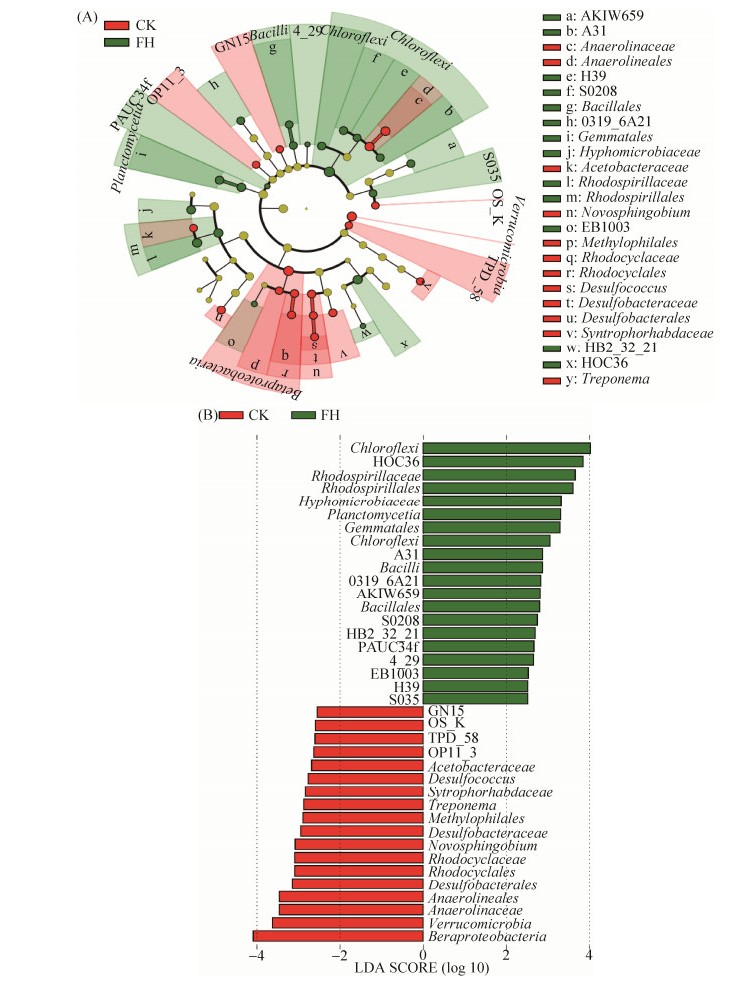
|
| 图 3 菌剂FH-1处理(FH)与空白对照(CK)土壤细菌微生物LEfSe分析的进化分支图(A)和LDA值(B)(LDA值> 2.5) Figure 3 Evolutionary branching diagram (A) and LDA value (B) (LDA value > 2.5) of soil bacterial LEfSe analysis of the inoculant FH-1 treatment(FH) and blank control (CK). |
2.5 菌剂FH-1对根际土壤细菌数量及α多样性的影响
菌剂FH-1处理(FH)与空白对照(CK)的细菌DNA拷贝数无显著性差异(P < 0.05)(表 4)。菌剂FH-1处理(FH)的细菌DNA拷贝数(1.063×1010 g/dry soil)略低于空白对照(CK)的细菌DNA拷贝数(1.078×1010 g/dry soil)。推测施加菌剂FH-1后,可能会提高某些对水稻生长有益的物种数量,同时减少某些对水稻生长发育不利或无关的物种数量,从而造成两个处理组细菌数量无显著性差异。
| DNA numbers and alpha diversity | CK | FH |
| Log 16S rRNA copies per g dry soil | 10.78±0.09a | 10.63±0.13a |
| Chao1 | 14074.06±138.99a | 13270.06±737.11b |
| PD-whole tree | 476.48±8.90a | 460.47±10.80b |
| Observed OTUs | 7558.96±191.50a | 7157.28±330.63b |
| Data followed by the different lowercase letters are different due to soil bacterial alpha diversity of different treatments at P < 0.05. | ||
微生物α多样性分析结果显示,菌剂FH-1处理(FH)土壤中的微生物多样性均显著低于空白对照(CK)(P < 0.05)(表 4)。菌剂FH-1处理(FH)土壤中的微生物丰富度指数(chao1)、谱系多样性(PD-whole tree)和观测到的OTUs数目(observed OTUs)较空白对照(CK)分别降低了6.06%、3.48%、5.61%。这可能与菌剂FH-1处理(FH)降低β-变形菌纲和疣微菌门有关。
2.6 菌剂FH-1对根际土壤微生物β多样性的影响将菌剂FH-1处理(FH)与空白对照(CK)土壤中的微生物群落结构进行PCoA分析发现,菌剂FH-1处理(FH)与空白对照(CK)土壤中的微生物群落可以显著分开(图 4),表明两个处理组间的菌群群落结构整体差异较大。ANOSIM分析显示菌剂FH-1处理(FH)是影响群落组成的重要因素(R=0.452,P=0.023),相应地,ADONIS分析显示菌剂FH-1处理(FH)对群落差异的贡献率为78.2%(R2= 0.21848,P=0.024)。总体来说,群落组成主要受菌剂FH-1处理(FH)影响。
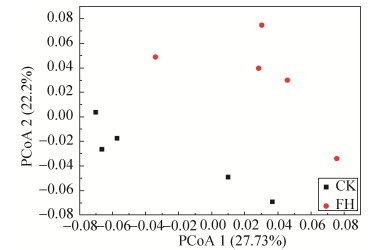
|
| 图 4 菌剂FH-1处理(FH)与空白对照(CK)的土壤细菌群落PCoA分析(Weighted Unifrac) Figure 4 PCoA analysis of soil bacterial community of the inoculant FH-1 treatment(FH) and blank control(CK) (Weighted Unifrac). |
2.7 菌剂FH-1对根际土壤微生物群落功能的影响
FAPROTAX分析显示,至少有30.26%的数据可以与数据库匹配。功能分析的结果显示,菌剂FH-1处理(FH)与空白对照(CK)土壤中的微生物群落功能主要有硝化(nitrification)、好氧亚硝酸氧化(aerobic nitrite oxidation)、化能异养(chemoheterotrophy)、有氧化能异养(aerobic chemoheterotrophy)、暗硫化物氧化(dark sulfide oxidation)、硫化合物的暗氧化(dark oxidation of sulfur compounds)、硫化合物的呼吸作用(respiration of sulfur compounds)、硫酸呼吸(sulfate_respiration)、光合营养(phototrophy)、光能自养(photoautotrophy)、铁呼吸(iron_respiration)、硝酸还原(nitrate_reduction)、硝酸呼吸(nitrate_respiration)、氮呼吸(nitrogen_respiration)、光合异养(photoheterotrophy)、亚硝酸呼吸(nitrite_respiration)、光合自养硫氧化(anoxygenic_photoautotrophy_S_oxidizing)、光能自养(anoxygenic_photoautotrophy)、硝酸异化还原(nitrate_denitrification)、亚硝酸异化还原(nitrite_denitrification)、一氧化二氮还原(nitrous_oxide_denitrification)、有氧光能自养(oxygenic_photoautotrophy)(丰度 > 1%)。Heatmap分析结果显示菌剂FH-1处理(FH)与空白对照(CK)土壤中的微生物群落功能较为不同(图 5)。菌剂FH-1处理(FH)土壤中微生物群落的亚硝酸呼吸(nitrite_respiration)、光合自养硫氧化(anoxygenic_photoautotrophy_S_oxidizing)、光能自养(anoxygenic_photoautotrophy)、硝酸异化还原(nitrate_denitrification)、亚硝酸异化还原(nitrite_denitrification)、一氧化二氮还原(nitrous_oxide_denitrification)、锰氧化作用(manganese_oxidation)等功能显著高于空白对照(CK)(P < 0.05)。两个处理组间其他功能无显著差异,但是菌剂FH-1处理(FH)的硝化作用、好氧亚硝酸氧化、硝酸还原作用、硝酸呼吸作用、氮呼吸作用、光合营养以及光合自养高于空白对照(CK),说明可能菌剂FH-1处理(FH)中的氮循环、光合自养功能增强,从而促进作物对氮养分的吸收。
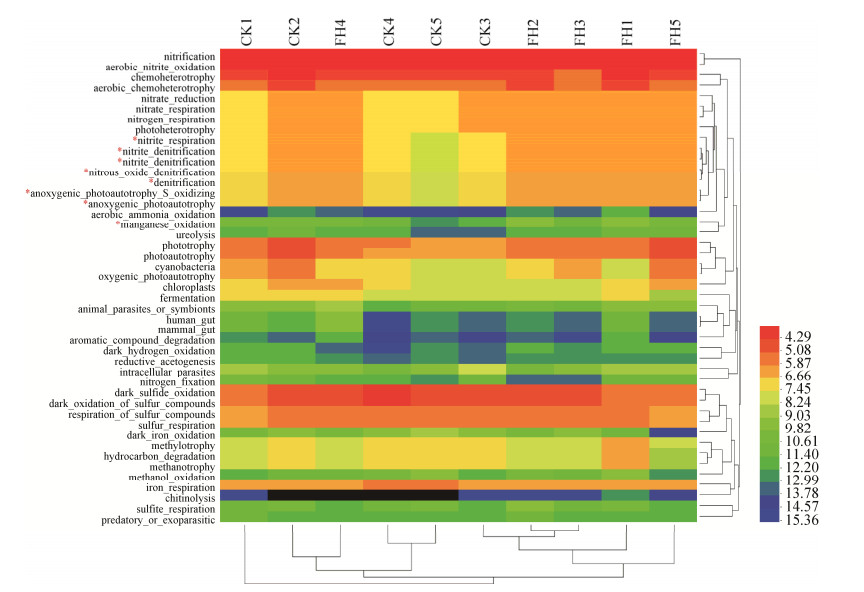
|
| 图 5 菌剂FH-1处理(FH)与空白对照(CK)的土壤细菌群落功能Heatmap图 Figure 5 Heatmap diagram of soil bacterial community function of the inoculants FH-1 treatment (FH) and blank control (CK). *, Significantly correlated at the 0.05 level (both sides). |
2.8 微生物-植物-土壤间的相关性
Pearson相关性分析结果显示,芽孢杆菌属与水稻的株高、单株穗数呈显著正相关。菌剂FH-1处理(FH)富集物种与株高、根长、穗长、单株穗数、单穗粒数、千粒重呈正相关,其中绿弯菌门、PAUC34f、S035、4-29、芽孢杆菌纲、浮霉菌纲、A31、H39、芽孢杆菌目、Gemmatales、红螺菌目、AKIW659、0319-6A21、生丝微菌科、红螺菌科、EB1003和HB2-32-21具有显著性。Chao1与穗长呈显著负相关,细菌DNA拷贝数与株高、根长、单株穗数呈显著负相关(P < 0.05)。这表明施加菌剂FH-1及其富集的相关物种在促进水稻生长发育的过程中发挥着重要作用。芽孢杆菌属与有效氮(AN)呈显著负相关,PAUC34f、S035、芽孢杆菌纲、芽孢杆菌目与有效氮(AN)呈显著负相关,S0280与有效氮(AP)呈显著负相关(P < 0.05)。这表明施加菌剂FH-1及其富集的相关物种可能在土壤养分循环和作物养分吸收中同样发挥着重要作用,推测菌剂FH-1及其富集的物种可能会促进植物对氮、磷等养分的吸收(表 5)。
| Correlation | Pht | RL | SL | PPt | GNS | TGW | AN | AP | AK |
| AN | -0.248 | -0.051 | -0.101 | -0.264 | -0.073 | -0.430 | 1 | ||
| AP | -0.191 | -0.158 | -0.407 | -0.046 | -0.386 | -0.053 | -0.231 | 1 | |
| AK | 0.169 | -0.010 | 0.203 | 0.127 | 0.147 | 0.183 | -0.328 | -0.047 | 1 |
| Chao1 | -0.622 | -0.482 | -0.663* | -0.469 | -0.585 | -0.607 | 0.589 | 0.260 | -0.365 |
| PD_whole_tree | -0.561 | -0.507 | -0.617 | -0.448 | -0.550 | -0.467 | 0.349 | 0.536 | -0.073 |
| Observed_otus | -0.548 | -0.444 | -0.600 | -0.412 | -0.538 | -0.421 | 0.330 | 0.563 | -0.220 |
| Log 16S rRNA copies per g dry soil | -0.640* | -0.806** | -0.540 | -0.739* | -0.528 | -0.350 | -0.065 | 0.029 | 0.417 |
| Bacteria|Firmicutes|Bacilli|Bacillales| Bacillaceae|Bacillus | 0.672* | 0.528 | 0.438 | 0.741* | 0.481 | 0.581 | -0.704* | 0.060 | 0.332 |
| Bacteria|Chloroflexi | 0.661* | 0.607 | 0.649* | 0.603 | 0.615 | 0.483 | -0.415 | -0.284 | -0.001 |
| Bacteria|PAUC34f | 0.656* | 0.577 | 0.549 | 0.691* | 0.596 | 0.758* | -0.789** | -0.041 | 0.111 |
| Bacteria|Acidobacteria|S035 | 0.698* | 0.544 | 0.720* | 0.566 | 0.651* | 0.802** | -0.682* | -0.129 | 0.465 |
| Bacteria|Elusimicrobia|4-29 | 0.677* | 0.619 | 0.587 | 0.719* | 0.592 | 0.492 | -0.315 | -0.530 | 0.168 |
| Bacteria|Firmicutes|Bacilli | 0.682* | 0.517 | 0.543 | 0.685* | 0.558 | 0.620 | -0.733* | -0.144 | 0.414 |
| Bacteria|Planctomycetes|Planctomycetia | 0.660* | 0.593 | 0.544 | 0.646* | 0.497 | 0.418 | -0.094 | -0.013 | 0.077 |
| Bacteria|Chloroflexi|Anaerolineae|A31 | 0.787** | 0.602 | 0.767** | 0.672* | 0.670* | 0.606 | -0.573 | -0.459 | 0.398 |
| Bacteria|Chloroflexi|Anaerolineae|H39 | 0.827** | 0.708* | 0.782** | 0.620 | 0.736* | 0.664* | -0.168 | -0.336 | -0.006 |
| Bacteria|Chloroflexi|Anaerolineae|S0208 | 0.432 | 0.367 | 0.545 | 0.392 | 0.547 | 0.491 | -0.483 | -0.679* | 0.253 |
| Bacteria|Firmicutes|Bacilli|Bacillales | 0.727* | 0.604 | 0.520 | 0.808** | 0.564 | 0.621 | -0.687* | -0.078 | 0.306 |
| Bacteria|Planctomycetes|Planctomycetia|Gemmatales | 0.684* | 0.633* | 0.530 | 0.754* | 0.521 | 0.452 | -0.241 | -0.209 | 0.066 |
| Bacteria|Proteobacteria| AlPhaProteobacteria|RhodosPirillales | 0.705* | 0.500 | 0.577 | 0.577 | 0.423 | 0.467 | -0.485 | -0.183 | 0.055 |
| Bacteria|Proteobacteria| GammaProteobacteria|HOC36 | 0.612 | 0.569 | 0.543 | 0.605 | 0.503 | 0.323 | -0.116 | -0.606 | -0.138 |
| Bacteria|Acidobacteria|Solibacteres| Solibacterales|AKIW659 | 0.730* | 0.750* | 0.745* | 0.670* | 0.692* | 0.708* | -0.054 | 0.013 | 0.398 |
| Bacteria|NitrosPirae|NitrosPira| NitrosPirales|0319-6A21 | 0.632 | 0.541 | 0.735* | 0.395 | 0.575 | 0.634* | -0.183 | -0.095 | 0.220 |
| Bacteria|Proteobacteria|AlPhaProteobacteria| Rhizobiales|HyPhomicrobiaceae | 0.738* | 0.485 | 0.571 | 0.615 | 0.547 | 0.444 | -0.429 | -0.243 | 0.136 |
| Bacteria|Proteobacteria|AlPhaProteobacteria| RhodosPirillales|RhodosPirillaceae | 0.738* | 0.557 | 0.632* | 0.602 | 0.482 | 0.523 | -0.452 | -0.215 | 0.036 |
| Bacteria|Proteobacteria| BetaProteobacteria|A21b|EB1003 | 0.818* | 0.838** | 0.821** | 0.762* | 0.757* | 0.596 | -0.198 | -0.490 | -0.141 |
| Bacteria|Proteobacteria|GammaProteobacteria|Alteromonadales|Alteromonadaceae|HB2-32-21 | 0.634* | 0.779** | 0.446 | 0.886** | 0.625 | 0.617 | -0.332 | 0.070 | -0.198 |
| Pht, Plant height; RL, Root length; SL, Spike length; PPt, Panicles per plant; GNS, Grain number per spike; TGW, Thousand-grain weight; AN, Available nitrogen; AP, Available phosphorus; AK, Available potassium. *, Significantly correlated at the 0.05 level (both sides); **, Significantly correlated at the 0.01 level (both sides). | |||||||||
3 讨论
土壤微生物组是维系陆地生态系统地上-地下相互作用的纽带,参与了植物获得养分和土壤养分循环两个过程[24]。微生物组的重要性近年来得到了广泛的认识,对植物的健康起着至关重要的作用。然而关于微生物菌剂在田间条件下接种对根际存在的土著微生物群落的认识仍然有限。本文较为系统地研究了施加菌剂FH-1对大田水稻土壤微生物群落的影响。
在已有的文献报道中,施加微生物菌剂可以提高细菌数量,如Cai等[25]发现在番茄连续五季盆栽试验中,大量化肥施用处理的土壤导致细菌数量降低,而富含木霉的有机肥处理的土壤细菌数量增加。而本研究结果表明菌剂FH-1处理(FH)与空白对照(CK)的细菌DNA拷贝数无显著性差异。但是亦有文献支持我们发现的规律,如Camilla等[26]发现在土壤中添加AM真菌,在豌豆开花前期,并不影响细菌的数量。这表明施加菌剂并不一定会显著改变细菌总量,它可能在一定范围内富集对植物生长有益的微生物物种,同时减少不利于植物生长的微生物物种。
在大部分的文献报道中,添加微生物菌剂会提高土壤中微生物的多样性,如Hann等[27]发现在黄瓜盆栽实验中添加解淀粉芽孢杆菌(Bacillus amyloliquefaciens)B1408会显著促进根际土壤细菌多样性的提高,并促进植株生长。张云霞等[28]研究发现盆栽实验中高效解磷枯草芽孢杆菌(Bacillus subtilis)JY-1可显著提高小麦土壤的微生物多样性。本实验研究结果表明菌剂FH-1处理(FH)土壤中的微生物α多样性均显著低于空白对照(CK)(P < 0.05)。但是亦有文献支持我们发现的规律,如Barriuso等[29]发现节杆菌属BB1 (Arthrobacter sp.)可以改变松树根际微生物群落,并且降低生物多样性,但是却显著促进松树的生长以及菌根化能力。我们结合细菌数量的结果,推测施加菌剂可能在一定范围内降低有害物种的丰度,提高了有益物种的丰度,可能造成有益物种的种类较为单一化,从而导致土壤微生物多样性的降低,而具体原因有待我们进一步实验探究。
微生物接种对根际微生物的影响已有很多报道。大部分研究发现接种解淀粉芽孢杆菌会明显提升变形菌门的丰度,如Wan等[30]研究发现接种解淀粉芽孢杆菌(Bacillus amyloliquefaciens) SN16-1到番茄根际,造成变形菌门、酸杆菌门、放线菌门、芽单胞菌门和拟杆菌门丰度的提高;Shen等[31]利用大田实验研究发现将解淀粉芽孢杆菌(Bacillus amyloliquefaciens)NJN-6与有机肥混合接种到香蕉根际,可以显著提高变形菌门和拟杆菌门的丰度。本实验研究结果表明菌剂FH-1处理(FH)土壤中的γ-变形菌纲、绿弯菌门显著高于空白对照(CK)(P < 0.05)(表 3)。本文的研究结果也表明接种解淀粉芽孢杆菌可以提高变形菌门的丰度。但是与之前的研究结果有一定的差异,可能是由于解淀粉芽孢杆菌接种的目标作物不同、环境不同或施肥方式不同等造成,具体原因有待于我们进一步探究。通过LEfSe分析发现菌剂FH-1处理(FH)可以造成厚壁菌门的芽孢杆菌目、变形菌门的红螺菌目等一些相关物种的富集。这些富集的物种可能通过以下途径促进植物生长:(a)改变土壤理化性质,促进矿质元素的供应,促进植物生长;(b)分泌激素或其他小分子物质,作为信号物质,促进植物生长;(c)分泌抗生素或其他拮抗物质,抑制病害微生物生长,间接促进植物的生长;(d)改变土壤结构,为植物生长提供更好的物理空间,例如水分、氧气通透性增强,促进植物生长等。本文中富集的一些物种(如芽孢杆菌纲、芽孢杆菌目、S035、S0280等)与土壤速效氮磷钾显著负相关,说明其可能通过提供矿质元素促进水稻生长。很多芽孢杆菌具有解磷、解钾的能力,如张云霞等[28]利用小麦盆栽实验研究发现枯草芽孢杆菌(Bacillus subtilis)JT-1可以增加土壤中可溶性磷的含量,促进小麦的生长。如万兵兵等[32]利用烟草盆栽实验发现弯曲芽孢杆菌(Bacillus flexus)YC4可提高土壤中有效钾的含量,显著促进烟草的株高和鲜重。本文中富集的一些物种(如绿弯菌门、PAUC34f、4-29浮霉菌纲、A31、H39、Gemmatales、红螺菌目、AKIW659、0319-6A21、生丝微菌科、红螺菌科、EB1003和HB2-32-21)与水稻生理特征显著正相关,说明其可能分泌激素等促进水稻生长。红螺菌是典型的光合细菌,Yu等[33]通过分析Rhodospirillales humicireducens SgZ-5T的基因组,发现有许多可能负责植物激素生成的基因。菌剂FH-1为何富集特定物种以及富集物种如何促进水稻生长还需要进一步的实验证明。
在已有的大部分文献报道中,施加微生物菌剂会改变土壤理化性质。如麻瑞阳[34]利用玉米盆栽实验发现,与空白对照相比,接种枯草芽孢杆菌(Bacillus subtilis subsp)NX-11可以提高土壤中的有效磷、有效钾的含量。申鸿等[35]发现与空白对照相比,接种牛粪-复合菌剂(B. amyloliquefaciens GN03/Bacillus pumilus RP01/Bacillus circulans JK02=1:1:1)的生姜土壤全氮、全磷、全钾、速效磷含量、速效钾含量均显著提高。我们的实验结果研究发现施加菌剂FH-1(FH)和空白对照(CK)之间的土壤理化性质无显著性差异,这可能表明不仅菌剂FH-1处理(FH)自身的固氮、解磷、解钾能力在土壤中没有充分发挥,而且菌剂FH-1处理(FH)富集的物种在土壤中亦未显著发挥固氮、解磷、解钾等能力。
相关性分析表明施加菌剂FH-1及其富集的相关物种可能在土壤养分循环和作物养分吸收中发挥着重要作用,群落功能分析进一步显示菌剂FH-1处理可促进氮循环和光合自养功能,菌剂FH-1及其富集的物种可能确实会促进植物对氮、磷等养分的吸收。菌剂FH-1处理在促进氮循环的同时也显著提升了反硝化功能。反硝化功能的加强可能会减少氮素的有效性,降低土壤中氮素营养的含量,对农业生产不利。本文的根际微生物群落功能是基于原核16S rDNA高通量测序结果利用FAPROTAX预测的。结果显示30.26%的数据可以与数据库匹配,即约70%的微生物物种功能未进行注释和计算。因此需要利用其他方法(如荧光定量PCR、宏基因组等)进一步深入研究菌剂FH-1对水稻根际微生物群落功能(尤其是氮循环)的影响。
综上表明,施加微生物菌剂FH-1可显著促进水稻生长,对土壤理化性质无显著影响,但可以显著改变微生物群落结构和功能,富集有益物种。因此我们推测解淀粉芽孢杆菌FH-1是通过调控根际微生物群落结构和功能促进水稻生长。本研究将拓宽我们对微生物-植物-土壤相互作用的了解,加深我们对微生物促进植物生长机制的认识,并可为微生物肥料的研发和应用提供理论指导。
| [1] |
Yi XY, Yuan M, Yin CB. The chemicals input status and transformation path of the planting industry in China. Engineering Science, 2017, 19(4): 124-129.
(in Chinese) 易小燕, 袁梦, 尹昌斌. 我国种植业化学品投入状况与转变路径研究. 中国工程科学, 2017, 19(4): 124-129. |
| [2] |
Li J, Shen DL, Jiang X. The current situation and development countermeasures of microbial fertilizer industry in China. Agricultural Quality & Standards, 2003(3): 27-29.
(in Chinese) 李俊, 沈德龙, 姜昕. 我国微生物肥料行业的现状与发展对策. 农业质量标准, 2003(3): 27-29. DOI:10.3969/j.issn.1674-8255.2003.03.016 |
| [3] |
Zheng MY, Li HM, Zhao JS, Liu HW, Xie BQ. Current situation and developmental trend of microbial fertilizer researches. Acta Agriculturae JiangXi, 2018, 30(11): 52-56.
(in Chinese) 郑茗月, 李海梅, 赵金山, 刘华伟, 谢宝琦. 微生物肥料的研究现状及发展趋势. 江西农业学报, 2018, 30(11): 52-56. |
| [4] |
Guo QR. Discussion on reducing pollution induced by methane, fertilizer and pesticide in rice with drip irrigation under mulch film. Crop Research, 2012, 26(3): 278-281.
(in Chinese) 郭庆人. 膜下滴灌水稻栽培技术对降低甲烷气体排放以及化肥、农药施用污染的探讨. 作物研究, 2012, 26(3): 278-281. DOI:10.3969/j.issn.1001-5280.2012.03.18 |
| [5] | Pham VTK, Rediers H, Ghequire MGK, Nguyen HH, de Mot R, Vanderleyden J, Spaepen S. The plant growth-promoting effect of the nitrogen-fixing endophyte Pseudomonas stutzeri A15. Archives of Microbiology, 2017, 199(3): 513-517. DOI:10.1007/s00203-016-1332-3 |
| [6] | de Salamone IEG, Funes JM, di Salvo LP, Escobar-Ortega JS, D'Auria F, Ferrando L, Fernandez-Scavino A. Inoculation of paddy rice with Azospirillum brasilense and Pseudomonas fluorescens: impact of plant genotypes on rhizosphere microbial communities and field crop production. Applied Soil Ecology, 2012, 61: 196-204. DOI:10.1016/j.apsoil.2011.12.012 |
| [7] | Wang JJ, Wang H, Yin TT, Xu S, Zhao W, Wang J, Huang ZY. The persistence and performance of phosphate-solubilizing Gluconacetobacter liquefaciens qzr14 in a cucumber soil. 3 Biotech, 2017, 7(5): 294. DOI:10.1007/s13205-017-0926-z |
| [8] | Yuan J, Yu L, Ling N, Raza W, Shen QR, Huang QW. Plant-growth-promoting traits and antifungal potential of the Bacillus amyloliquefaciens YL-25. Biocontrol Science and Technology, 2015, 25(3): 276-290. DOI:10.1080/09583157.2014.971711 |
| [9] | Kang YJ, Shen M, Wang HL, Zhao QX. A possible mechanism of action of plant growth-promoting rhizobacteria (PGPR) strain Bacillus pumilus WP8 via regulation of soil bacterial community structure. The Journal of General and Applied Microbiology, 2013, 59(4): 267-277. DOI:10.2323/jgam.59.267 |
| [10] |
Shen RF, Zhao XQ. Role of soil microbes in the acquisition of nutrients by plants. Acta Ecologica Sinica, 2015, 35(20): 6584-6591.
(in Chinese) 沈仁芳, 赵学强. 土壤微生物在植物获得养分中的作用. 生态学报, 2015, 35(20): 6584-6591. |
| [11] | van der Heijden MGA, Bardgett RD, van Straalen NM. The unseen majority: soil microbes as drivers of plant diversity and productivity in terrestrial ecosystems. Ecology Letters, 2008, 11(3): 296-310. DOI:10.1111/j.1461-0248.2007.01139.x |
| [12] | van Bruggen AHC, Goss EM, Havelaar A, van Diepeningen AD, Finckh MR, Morris Jr JG. One health-cycling of diverse microbial communities as a connecting force for soil, plant, animal, human and ecosystem health. Science of the Total Environment, 2019, 664: 927-937. DOI:10.1016/j.scitotenv.2019.02.091 |
| [13] | Mendes R, Kruijt M, de Bruijn I, Dekkers E, van der Voort M, Schneider JHM, Piceno YM, DeSantis TZ, Andersen GL, Bakker PAHM, Raaijmakers JM. Deciphering the rhizosphere microbiome for disease-suppressive bacteria. Science, 2011, 332(6033): 1097-1100. DOI:10.1126/science.1203980 |
| [14] | Zamioudis C, Pieterse CMJ. Modulation of host immunity by beneficial microbes. Molecular Plant-Microbe Interactions, 2012, 25(2): 139-150. DOI:10.1094/MPMI-06-11-0179 |
| [15] | Ranjan K, Priya H, Ramakrishnan B, Prasanna R, Venkatachalam S, Thapa S, Tiwari R, Nain L, Singh R, Shivay YS. Cyanobacterial inoculation modifies the rhizosphere microbiome of rice planted to a tropical alluvial soil. Applied Soil Ecology, 2016, 108: 195-203. DOI:10.1016/j.apsoil.2016.08.010 |
| [16] | de Salamone IEG, di Salvo LP, Ortega JSE, Sorte PMFB, Urquiaga S, Teixeira KRS. Field response of rice paddy crop to Azospirillum inoculation: physiology of rhizosphere bacterial communities and the genetic diversity of endophytic bacteria in different parts of the plants. Plant and Soil, 2010, 336(1/2): 351-362. |
| [17] | Gowtham HG, Murali M, Singh SB, Lakshmeesha TR, Narasimha Murthy K, Amruthesh KN, Niranjana SR. Plant growth promoting rhizobacteria-Bacillus amyloliquefaciens improves plant growth and induces resistance in chilli against anthracnose disease. Biological Control, 2018, 126: 209-217. DOI:10.1016/j.biocontrol.2018.05.022 |
| [18] |
Wang JW, Zhen J, Xie BE, Liu YY, Li GJ. Isolation and screening of organic phosphorus-solubilizing bacterium and its initial identification. Henan Science, 2011, 29(1): 31-34.
(in Chinese) 王继雯, 甄静, 谢宝恩, 刘莹莹, 李冠杰. 有机磷降解菌的分离筛选及初步鉴定. 河南科学, 2011, 29(1): 31-34. DOI:10.3969/j.issn.1004-3918.2011.01.010 |
| [19] |
Yin TT, Wang JJ, Liu Y, Liang YJ, Wang XB, Han YF, Wang X, Cheng MJ, Huang ZY. The screening of efficient phosphorus-solubilizing bacteria and the primary study on its mechanism of plant-growth-promoting. Biotechnology Bulletin, 2015, 31(12): 234-242.
(in Chinese) 银婷婷, 王敬敬, 柳影, 梁亚杰, 王兴彪, 韩一凡, 王夏, 程美娟, 黄志勇. 高效解磷菌的筛选及其促生机制的初步研究. 生物技术通报, 2015, 31(12): 234-242. |
| [20] |
Wu X, Gan BC, Huang ZQ, Peng WH. Screening and identification of A IAA biosynthesis strain and optimization of its culture condition. Journal of Sichuan Agricultural University, 2014, 32(4): 432-435, 461.
(in Chinese) 吴翔, 甘炳成, 黄忠乾, 彭卫红. 一株产IAA菌株的筛选、鉴定及培养条件优化. 四川农业大学学报, 2014, 32(4): 432-435, 461. DOI:10.3969/j.issn.1000-2650.2014.04.013 |
| [21] |
Huang G, Gao H, Wang C, Zhao Q, Zhang WF, Dang J, Ma XT, Yan X, Gao JP. ACC 30 strain with ACC deaminase activity: its isolation, identification and growth-promoting effect. Microbiology China, 2013, 40(5): 812-821.
(in Chinese) 黄盖, 高焓, 王琛, 赵倩, 张文峰, 党娟, 马晓棠, 颜霞, 高建平. ACC脱氨酶活性菌株ACC 30的分离、鉴定及其促生作用. 微生物学通报, 2013, 40(5): 812-821. |
| [22] |
You H, Pu Q, Wen F, Rao JF, Li O, Hu XF. Isolation and screening of bacteria strain with ACC deaminase activity and its effect on hairy root of Salvia miltiorrhiza. Journal of Zhejiang Sci-Tech University (Natural Sciences), 2017, 37(5): 720-726.
(in Chinese) 尤红, 普倩, 文芳, 饶君凤, 李欧, 胡秀芳. ACC脱氨酶菌株的分离筛选及对丹参毛状根的影响. 浙江理工大学学报(自然科学版), 2017, 37(5): 720-726. |
| [23] | Pang G, Cai F, Li RX, Zhao Z, Li R, Gu XL, Shen QR, Chen W. Trichoderma-enriched organic fertilizer can mitigate microbiome degeneration of monocropped soil to maintain better plant growth. Plant and Soil, 2017, 416(1/2): 181-192. |
| [24] |
Zhu YG, Shen RF, He JZ, Wang YF, Han XG, Jia ZJ. China soil microbiome initiative: progress and perspective. Bulletin of Chinese Academy of Sciences, 2017, 32(6): 554-565.
(in Chinese) 朱永官, 沈仁芳, 贺纪正, 王艳芬, 韩兴国, 贾仲君. 中国土壤微生物组:进展与展望. 中国科学院院刊, 2017, 32(6): 554-565. |
| [25] | Cai F, Pang G, Li RX, Li R, Gu XL, Shen QR, Chen W. Bioorganic fertilizer maintains a more stable soil microbiome than chemical fertilizer for monocropping. Biology and Fertility of Soils, 2017, 53(8): 861-872. DOI:10.1007/s00374-017-1216-y |
| [26] | Wamberg C, Christensen S, Jakobsen I, Müller AK, Sørensen SJ. The mycorrhizal fungus (Glomus intraradices) affects microbial activity in the rhizosphere of pea plants (Pisum sativum). Soil Biology and Biochemistry, 2003, 35(10): 1349-1357. DOI:10.1016/S0038-0717(03)00214-1 |
| [27] | Han LJ, Wang ZY, Li N, Wang YH, Feng JT, Zhang X. Bacillus amyloliquefaciens B1408 suppresses Fusarium wilt in cucumber by regulating the rhizosphere microbial community. Applied Soil Ecology, 2019, 136: 55-66. DOI:10.1016/j.apsoil.2018.12.011 |
| [28] |
Zhang YX, Lei P, Xu ZQ, Feng XH, Xu H, Xu XJ. Screening of a high-efficiency phosphate solubilizing bacterium Bacillus subtilis JT-1 and its effects on soil microecology and wheat growth. Jiangsu Journal of Agricultural Sciences, 2016, 32(5): 1073-1080.
(in Chinese) 张云霞, 雷鹏, 许宗奇, 冯小海, 徐虹, 许仙菊. 一株高效解磷菌Bacillus subtilis JT-1的筛选及其对土壤微生态和小麦生长的影响. 江苏农业学报, 2016, 32(5): 1073-1080. DOI:10.3969/j.issn.1000-4440.2016.05.019 |
| [29] | Barriuso J, Ramos Solano B, Santamaría C, Daza A, Gutiérrez Mañero FJ. Effect of inoculation with putative plant growth-promoting rhizobacteria isolated from Pinus spp. on Pinus pinea growth, mycorrhization and rhizosphere microbial communities. Journal of Applied Microbiology, 2008, 105(5): 1298-1309. DOI:10.1111/j.1365-2672.2008.03862.x |
| [30] | Wan TT, Zhao HH, Wang W. Effect of biocontrol agent Bacillus amyloliquefaciens SN16-1 and plant pathogen Fusarium oxysporum on tomato rhizosphere bacterial community composition. Biological Control, 2017, 112: 1-9. DOI:10.1016/j.biocontrol.2017.05.014 |
| [31] | Shen ZZ, Wang BB, Lv NN, Sun YF, Jiang XY, Li R, Ruan YZ, Shen QR. Effect of the combination of bio-organic fertiliser with Bacillus amyloliquefaciens NJN-6 on the control of banana Fusarium wilt disease, crop production and banana rhizosphere culturable microflora. Biocontrol Science and Technology, 2015, 25(6): 716-731. DOI:10.1080/09583157.2015.1010482 |
| [32] |
Wan BB, Liu Y, Wu Y, Liu SL, Wang GW, Zhang DY, Jiang Y. Screening, identification of phosphate-and potassium-solubilizing PGPR and its promoting effect on tobacco. Journal of Henan Agricultural Sciences, 2016, 45(9): 46-51.
(in Chinese) 万兵兵, 刘晔, 吴越, 刘世亮, 王国文, 张东艳, 姜瑛. 烟草根际解磷解钾菌的筛选鉴定及应用效果研究. 河南农业科学, 2016, 45(9): 46-51. |
| [33] | Yu Z, Yang GQ, Liu XM, Wang YQ, Zhuang L, Zhou SG. Complete genome sequence of the nitrogen-fixing bacterium Azospirillum humicireducens type strain SgZ-5T. Standards in Genomic Sciences, 2018, 13: 28. DOI:10.1186/s40793-018-0322-2 |
| [34] |
Ma RY. Screening, separation and identification of NX-11 strain with the abilitity of solubilizing phosphate and potassium and analysis of effect microbial fertilizer. Master Dissertation of Agricultural University of Hebei Province, 2013. (in Chinese) 麻瑞阳.高效解磷解钾菌株NX-11的分离筛选鉴定及作用效果分析.河北农业大学硕士学位论文, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10086-1014105134.htm |
| [35] |
Shen H, Wu B, Li HH, Liu YQ, Wu XW, Yang XY. Screening of plant growth-promoting bacteria from purple soil and growth promoting effects of its complex microbial inoculant on ginger germchit. China Vegetables, 2018(6): 54-59.
(in Chinese) 申鸿, 吴波, 李洪海, 刘奕清, 吴兴文, 杨星勇. 紫色土植物促生菌筛选及其复合菌剂对生姜种苗的促生效应. 中国蔬菜, 2018(6): 54-59. |
 2019, Vol. 59
2019, Vol. 59




