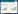中国科学院微生物研究所,中国微生物学会,中国菌物学会
文章信息
- 张子辉, 黄沈鑫, 陶航, 张烨, 赵耀, 纪兆林, 陈孝仁. 2019
- Zihui Zhang, Shenxin Huang, Hang Tao, Ye Zhang, Yao Zhao, Zhaolin Ji, Xiaoren Chen. 2019
- 辣椒疫霉质外体疏水小蛋白SCR82编码基因的转录特征、异源表达和功能
- Gene transcriptional pattern, prokaryotic expression and functional analysis of an apoplastic, hydrophobic and small effector SCR82 from Phytophthora capsici
- 微生物学报, 59(8): 1586-1599
- Acta Microbiologica Sinica, 59(8): 1586-1599
-
文章历史
- 收稿日期:2018-12-23
- 修回日期:2019-02-16
- 网络出版日期:2019-02-25
2. 南京农业大学植物保护学院, 江苏 南京 210095
2. College of Plant Protection, Nanjing Agricultural University, Nanjing 210095, Jiangsu Province, China
疫霉属(Phytophthora)隶属于色菌界(Chromista)卵菌门(Oomycota),包含一百多种重要的植物病原菌,引起的植物疫病常年危害农林业生产[1]。其中,辣椒疫霉(P. capsici)侵染危害茄科(如辣椒、番茄、茄子等)、葫芦科(如西瓜、黄瓜和南瓜等)和豆科中数百种农作物,引起世界性分布的土传毁灭性病害[2-3]。近年来,随着我国种植产业结构的优化调整,以果蔬为主的设施农业得到快速发展,由辣椒疫霉引起的植物疫病经常暴发成灾,对设施农业的威胁日趋严重[4-5]。由于疫霉菌在亲缘关系上与真菌相差甚远,多数杀菌剂对防治植物疫病无效,加之抗性品种利用尚不理想,一直缺乏针对植物疫病有效的防治手段[1-3]。从植物免疫抗性的角度入手深入解析辣椒疫霉与植物互作机理,对设计植物疫病防控新策略具有重要的指导意义。
为建立成功的侵染和定殖,疫霉菌分泌出两类效应蛋白以影响植物的免疫系统:进入植物质外体空间的效应蛋白(apoplastic effectors)以及进入植物细胞内的效应蛋白(cytoplasmic effectors)[6-8]。质外体效应蛋白主要包括病原物相关的分子模式(pathogen/microbe-associated molecular patterns,PAMPs) (例如elicitins、TGases、CBELs、NLPs和GH12等)、植物防御相关酶的抑制子和PcF/SCR蛋白等,它们在植物细胞之间以及植物细胞膜与细胞壁之间的质外体空间里发挥作用,操控植物的免疫反应[6, 9-10]。PcF/SCR效应蛋白是一类与恶疫霉(P. cactorum)的PcF蛋白具有序列同源性且富含半胱氨酸残基(≥4个)的小分子量(≤300 aa)泌出蛋白,能够引起植物细胞死亡(plant cell death,PCD)[6-7]。最先从恶疫霉的培养滤液中发现的PcF是一个由52个氨基酸残基组成的酸性蛋白质,含有6个半胱氨酸、1个4-羟脯氨酸和3个保守的二硫键,能引起草莓和番茄坏死,引起植物防御酶苯丙氨酸解氨酶表达的变化[11-12]。核磁共振发现PcF蛋白在空间上具有一个由二硫键稳固住的螺旋-环-螺旋折叠,结构类似橄榄树花粉过敏原Ole-e6蛋白,推测其可能模拟植物信号蛋白的作用[13]。随后,在其他疫霉菌中也发现了PcF的同源蛋白[14-15],这类蛋白统一称为PcF/SCR效应蛋白,一般依据其编码的氨基酸个数前面冠以“SCR”来命名[6-7, 14]。结构预测这些蛋白表面的一段保守氨基酸SK(E/C)C可能是这类效应蛋白引起植物组织死亡的结构决定子[14-15]。我们最近发现,除PcF外恶疫霉至少还含有13个PcF/SCR效应蛋白,进一步分析发现辣椒疫霉、寄生疫霉(P. parasitica)、腐霉菌(Pythium spp.)和拟南芥明霜霉(Hyaloperonospora arabidopsidis)等卵菌中也存在该类效应蛋白[16-19]。这些效应蛋白的编码基因在疫霉菌侵染植物的过程中上调表达[17-20]。我们鉴定发现,恶疫霉的SCR96等效应蛋白引起番茄和本氏烟的细胞死亡,该基因的稳定沉默导致恶疫霉的致病力下降且对活性氧的敏感性增强[18-19]。综上可知,PcF/SCR效应蛋白引起PCD,在疫霉菌的致病过程中可能发挥重要的作用,对它们的认知可为破解植物疫病菌的致病机理提供重要的知识。
我们的前期研究利用PVX瞬时表达系统分析了疫霉菌PcF/SCR效应蛋白诱导本氏烟和番茄细胞死亡的活性[18-19],但该系统仅局限于茄科植物[21]。为进一步分析该类蛋白是否对非茄科寄主及其他非寄主植物具有广谱PCD诱导活性,解析其生物学功能与蛋白三维结构的关系,获得足量的纯化蛋白显得十分重要。截至目前,仅恶疫霉PcF及其致病疫霉(P. infestans)同源蛋白等少数几个PcF/SCR效应蛋白在酵母和大肠杆菌中得到了表达,但由于疏水性强存在可溶性蛋白量低等问题[12-14],尚无后续研究报道。基于前期辣椒疫霉转录组数据[16],我们鉴定了一个PcF/SCR效应蛋白SCR82。本研究首先分析了scr82基因在辣椒疫霉生长发育和侵染寄主阶段的转录水平;克隆获得该基因的cDNA和基因组全长序列;对蛋白进行了理化性状、二级结构及同源性分析;将该基因整合到含6×His-SUMO序列的pET28a(+)质粒中,利用大肠杆菌进行诱导表达,通过镍柱纯化得到了可溶的融合蛋白;该蛋白不引起本氏烟和拟南芥叶片的细胞死亡,但激发本氏烟的防卫反应。这些结果为进一步分析该蛋白的生物学功能以及深入解析疫霉菌与植物互作机制奠定了坚实的基础。
1 材料和方法 1.1 材料 1.1.1 供试菌株:大肠杆菌(Escherichia coli) Rossette 2菌株、辣椒疫霉菌株Pc537均由本实验室保存。利用Chen等(2013)[16]中的方法获得辣椒疫霉的菌丝、游动孢子囊、游动孢子和萌发休止孢。
1.1.2 供试植物:本氏烟(Nicotiana benthamiana)栽培于含有无菌土的塑料杯中,置于22-25 ℃、16 h/8 h光暗交替温室,生长4-6 w后使用。灌根接种本氏烟前2 h进行浇灌,以保证接种时土壤湿润。接种时,每株本氏烟的根部滴加5 mL辣椒疫霉游动孢子悬浮液(1×106孢子/mL),以接种无菌水的本氏烟作为对照。拟南芥(Arabidopsis thaliana)生态型Col-0的种子低温春化后栽培于基质(蛭石:营养土湿重比=2:1)中,在16-18 ℃、16 h/8 h光暗交替、湿度为60%-70%的生长室中培养,生长5-6 w后使用。
1.1.3 质粒:表达载体pET28a(+)购自Novagen公司,TA载体pMD19-T购自TAKARA公司。载体pRSFDuet-1 (含6×His-SUMO)由美国加州大学河滨分校马文勃教授提供。
1.1.4 主要试剂:限制性内切酶(Nco Ⅰ、BamH Ⅰ、Hind Ⅲ)、T4 DNA连接酶、反转录酶M-MLV (RNase H-)、引物Oligo d(T)18、Recombinant RNase Inhibitor、DNase Ⅰ、RNAiso Plus购自TAKARA公司。RNA纯化试剂盒(RNAclean Kit)购自北京天根生物。Phusion高保真DNA聚合酶、Ni-NTA琼脂糖树脂购自ThermoFisher公司。质粒提取试剂盒、DNA凝胶回收试剂盒购自杭州爱思进公司。Bradford法蛋白浓度测定试剂盒购自Solarbio公司。
1.1.5 主要仪器:核酸和蛋白分析的电泳仪、电泳槽购自Bio-Rad公司。LS-P96G型PCR仪、MaxQ4000摇床购自ThermoFisher公司。
1.2 生物信息学分析和引物设计将转录组测序获得的PcF/SCR效应蛋白基因的EST序列[16]在辣椒疫霉基因组数据库[DOE Joint Genome Institute (JGI) LT1534 v11.0] (http://genome.jgi-psf.org/Phyca11/Phyca11.home.html)进行序列比对(程序tBlastx,期望值E≤10-70),下载匹配的基因序列。根据基因序列模型(ID 96045)和表达载体克隆需使用的酶切位点设计基因扩增引物对、RT-PCR引物对(表 1)。在FungiDB (http://fungidb.org)和NCBI (https://www.ncbi.nlm.nih.gov/)数据库检索蛋白的同源序列(BLASTp,E≤10-5)。利用BioEdit软件对序列进行剪接、拼接、蛋白翻译和比对。
| Primer | Sequence (5′→3′)* | Purpose |
| 96045-snpF | ACCAAGCCAAACTCCAGCTA | Full length cloning |
| 96045-snpR | TAGCCAATGCTTCAGTGGTG | Full length cloning |
| 96045-BamH Ⅰ-F | CACGGATCCATGGAAGACCCGCTTTACTGCCAG | Sense primer for cloning and prokaryotic expression |
| 96045-Hind Ⅲ-R | TCTAAGCTTGTTACAGCGGCTTAGCGCACTTC | Antisense primer for cloning and prokaryotic expression |
| 96045-F | ATGAACTTCAAGACCTGCTTCG | Sense primer for RT-PCR analysis |
| 96045-R | TTACAGCGGCTTAGCGCACTTC | Antisense primer for RT-PCR analysis |
| Ubc-F | GAAGCGGATCAACAAAGAGC | Sense primer for RT-PCR analysis |
| Ubc-R | AAGCAGTGAGCAGATCGACA | Antisense primer for RT-PCR analysis |
| NbEF1-α-qRTF | AAGGTCTACCAACCTTGAC | Sense primer for RT-qPCR analysis |
| NbEF1-α-qRTR | ACGTAGGGGTTTGTCTGAG | Antisense primer for RT-qPCR analysis |
| Nbmc1-qpF | GCGGTCATGGAACCACATAC | Sense primer for RT-qPCR analysis |
| Nbmc1-qpR | CTGACTAAAGCCTCCACCCA | Antisense primer for RT-qPCR analysis |
| Nbpox-qpF | CCCTCTTGATTTCACAACACCA | Sense primer for RT-qPCR analysis |
| Nbpox-qpR | CCAGTCAGCAGCACTTCATC | Antisense primer for RT-qPCR analysis |
| Nbsod-qpF | GCTCCATGATGCCATTTCCA | Sense primer for RT-qPCR analysis |
| Nbsod-qpR | TCGATAGCCCAACCAAGAGA | Antisense primer for RT-qPCR analysis |
| sumo-RSF-F | CAAGCTGATCAGACCCCTGAAG | Sense primer for sequencing |
| T7 terminator primer | GCTAGTTATTGCTCAGCGG | Antisense promer for sequencing |
| *Restriction sites in primer sequences are underlined. Primers were designed based on the gene models (scr82 ID 96045 and Ubc ID 510705) from the P. capsici genome database (https://genome.jgi.doe.gov/Phyca11/Phyca11.home.html) and four N. benthamiana genes (NbEF1-α, NbMC1, NbPOX and NbSOD) from NCBI database (https://www.ncbi.nlm.nih.gov/). | ||
利用SignalP 3.0 (http://www.cbs.dtu.dk/services/SignalP-3.0/)预测蛋白的信号肽序列。利用TMHMM Server. v.2.0 (http://www.cbs.dtu.dk/services/TMHMM/)分析跨膜结构域。利用ProtParam (http://web.expasy.org/protparam/)分析蛋白的物理化学性质。利用PSIPRED蛋白序列分析工作站(http://bioinf.cs.ucl.ac.uk/psipred/#)中PSIPRED 3.3、FFPred和DISOPRED3程序分析蛋白结构。
1.3 核酸提取利用RNAiso Plus提取疫霉和植物样品的总RNA,随后用DNase Ⅰ去除总RNA中残留的基因组DNA,再使用RNA纯化试剂盒纯化RNA样品。辣椒疫霉菌丝的基因组DNA按照Zelaya-Molina等(2011)[22]的方法提取。用1%琼脂糖凝胶电泳检测基因组DNA和总RNA的完整性,用紫外分光光度法进行浓度和纯度测定。
1.4 RT-(q)PCR分析依据陈孝仁等(2018)[23]的方法,利用反转录酶M-MLV (RNase H-)和引物Oligo d(T)18将纯化过的RNA反转录成第1链cDNA。半定量RT-PCR的反应体系和程序参照Chen等(2013)[16]的方法进行,辣椒疫霉泛素连接酶基因(ubiquitin-conjugating enzyme,Ubc)[16]作为RT-PCR分析的内参基因(表 1)。实时定量PCR (qPCR)参考陈孝仁等(2018)[23]的方法进行,本氏烟翻译延长因子(elongation factor 1-alpha,NbEF1α)基因作为内参基因(表 1),数据处理按照Pfaffl (2001)[24]的方法进行。所有的RT-(q)PCR重复3次。
1.5 基因全长高保真扩增利用Phusion DNA聚合酶和基因特异引物对辣椒疫霉cDNA样品进行扩增。PCR扩增体系含有:5×High Fidelity buffer (含7.5 mmol/L Mg2+) 5 μL,DNA 100-300 ng,DMSO 0.75 μL,上下游引物(10 μmol/L)各1.25 μL,dNTPs (10 mmol/L) 0.5 μL,Phusion DNA聚合酶(2 U/μL) 0.25 μL,无菌水补齐到25 μL。PCR反应程序为:98 ℃ 30 s;98 ℃ 10 s,60 ℃ 10 s,72 ℃ 10 s,33个循环;72 ℃ 5 min。利用引物对96045-snpF/R(表 1)对基因组DNA的扩增和片段TA克隆按照陈孝仁等(2018)[23]的方法进行。
1.6 重组表达质粒的构建为增强表达蛋白的可溶性便于后续检测,利用Nco Ⅰ、BamH Ⅰ将载体pRSFDuet-1[25]中的6×His-SUMO序列切下,连入同样酶切过的pET28a(+)。重组质粒转入DH5α进行扩繁,利用引物对sumo-RSF-F/T7 terminator primer (表 1)测序确认连接正确。
为便于原核表达,扩增的基因片段不含信号肽编码序列。利用BamH Ⅰ、Hind Ⅲ同时酶切基因片段、表达载体pET28a(+)-6×His-SUMO,经电泳后切胶回收。利用T4 DNA连接酶将回收片段与载体骨架连接,使His-SUMO标签与目的蛋白N端融合。重组质粒转入DH5α进行扩繁,质粒提取后经sumo-RSF-F/T7 terminator primer (表 1)测序进行验证。构建成功的重组质粒pET28a(+)-6×His-SUMO::scr82经热激转入大肠杆菌Rossette 2菌株。
1.7 蛋白的原核表达及SDS-PAGE分析将Rossette 2单克隆接种到含有卡那霉素(50 μg/mL)、氯霉素(25 μg/mL)的5 mL LB培养液(含0.2%葡萄糖)中,37 ℃、225 r/min振荡培养12 h。然后将起始菌液按1:100的比例加入到含有相同抗生素的400 mL新鲜LB培养液(含0.2%葡萄糖)中,在37 ℃、225 r/min振荡条件下培养至OD600为0.5-0.6时,加入异丙基硫代半乳糖苷(isopropyl β-D-1-thiogalactopyranoside,IPTG)诱导约16 h。IPTG的诱导终浓度分别设置为0.1、0.2、0.5、1 mmol/L,诱导温度分别设置为22 ℃、37 ℃。
离心(4 ℃、4000 r/min离心20 min)收集诱导表达后的大肠杆菌,菌体重新悬浮于20 mL的裂解缓冲液(50 mmol/L Tris-HCl,1 mol/L NaCl,25 mmol/L imidazole,1 mmol/L DTT,1 mmol/L PMSF,pH 8.0)中,然后置于冰上,利用超声破碎仪进行细胞破碎:超声破碎10 s,停止20 s,功率 < 200 W,持续破碎15 min。然后4 ℃、12000 r/min离心15 min分离上清和沉淀。
500 μL上清和对应沉淀中分别加入500 μL的SDS上样缓冲液(4% SDS,10% 2-mercaptoethanol,20% glycerol,0.004% bromophenol blue,125 mmol/L Tris-HCl,pH 6.8),悬浮混匀,煮沸5 min后,于4 ℃、12000 r/min离心10 min。取上清15 μL进行SDS-PAGE分析,浓缩胶、分离胶浓度分别为5%、15%,电泳条件为150 V、1 h。
1.8 目的蛋白的纯化轻轻颠倒数次Ni-NTA琼脂糖树脂原装瓶,利用剪去尖头的1 mL移液器枪头吸取1.5 mL混合液,放入一个容积为10 mL、底端孔径为30-35 μm纯化柱,依靠重力让其自然分层,去掉保护液。加入5 mL缓冲液A (不含DTT和PMSF的裂解缓冲液),轻轻颠倒,重悬树脂,洗涤树脂和柱子,重复洗3次,去掉溶液。将超声破碎后的上清液加入到纯化柱中,盖好盖子后在4 ℃轻轻晃动20 min,去掉上清,重复加入剩余的细胞破碎溶液。通过缓冲液A洗涤纯化柱和树脂5次后,最后利用2 mL缓冲液B (50 mmol/L Tris-HCl,1 mol/L NaCl,250 mmol/L imidazole,pH 8.0)将蛋白从树脂上洗脱下来,利用透析法置换为1×PBS缓冲液(1×phosphate-buffered saline)。利用SDS-PAGE检测洗脱的蛋白溶液,利用Bradford法测定纯化蛋白浓度。
1.9 叶片浸润和染色取完全展开的本氏烟和拟南芥叶片渗透接种纯化蛋白。用无菌针头在叶片下表皮造成一个微小伤口,用无针头的注射器将10-20 μL蛋白溶液注射到叶片中。原核表达的大豆疫霉(P. sojae)糖苷水解酶家族12 (GH12)蛋白XEG1蛋白[9] (10 mg/mL)作为本氏烟叶片注射的阳性对照。为避免蛋白浓度影响实验结果,同时注射稀释5或10倍的蛋白溶液以进行比较。处理过的叶片置于22 ℃培养箱中,第2天起观察症状的出现。
为方便观察细胞死亡表型,注射后的本氏烟叶片置于Farmer’s溶液(乙酸、乙醇和氯仿按照1:6:3的体积比配制)中浸泡30 s,再置于0.05%的Trypan blue溶液中25 ℃下浸泡12 h。在用水漂洗干净叶片表面的染料后,利用95%乙醇对叶片进行水浴脱色,被染成蓝色的即为死亡的植物细胞。
2 结果和分析 2.1 scr82在辣椒疫霉生长发育和侵染寄主阶段的转录模式前期转录组数据表明该基因在辣椒疫霉生长发育阶段表达[16]。为了解该基因在侵染过程中发挥的作用,分别提取辣椒疫霉游动孢子灌根接种1.5、3、6、12、24、36、72 h后的本氏烟根部总RNA,同时提取辣椒疫霉4个生长发育阶段(菌丝、孢子囊、游动孢子和萌发休止孢)的总RNA,分析该基因在侵染和生长发育阶段的转录水平。结果(图 1)表明,除菌丝阶段之外,其余3个生长发育阶段(孢子囊、游动孢子和萌发休止孢)均检测到该基因的转录本。值得注意的是,萌发休止孢阶段为疫霉菌侵染前期阶段,该基因在此阶段的转录水平远高于游动孢子囊和游动孢子阶段;在侵染寄主阶段,该基因的转录水平普遍高于3个生长发育阶段,在接种后24 h该基因的转录达到最高峰,随后随着时间延长而下降。结果表明,该基因在辣椒疫霉萌发休止孢和侵染寄主阶段上调表达,可能参与了辣椒疫霉的侵染过程。
|
| 图 1 scr82基因在辣椒疫霉侵染寄主和生长发育阶段的转录水平 Figure 1 The transcriptional pattern of scr82 during the infection of N. benthamiana and developmental stages of P. capsici. MY, vegetative mycelia; SP, zoosporangia; ZO, zoospores; GC, germinating cysts; 1.5-72 h, N. benthamiana roots at 1.5, 3, 6, 12, 24, 36, 72 hours post-inoculation. cDNA from sterile water-inoculated plants (Mock) and sterile water (W) were used as negative control templates in RT-PCR. |
2.2 SCR82编码基因的克隆
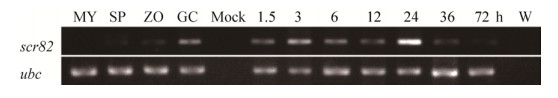
前期获得了scr82在生长发育阶段表达的EST序列[16]。通过与辣椒疫霉基因组数据库比对获得基因模型(JGI gene model 96045),据此设计引物,经RT-PCR从萌发休止孢的cDNA中获得了一条250-500 bp的条带(图 2)。经克隆测序,该379 bp的DNA片段中包含一个大小为249 bp的完整开放阅读框(NCBI登录号KT215396),位于23-271 bp区域;序列的1-22 bp、272-379 bp区域分别为5′-、3′-非翻译区。与从基因组DNA中获得的基因序列进行比较,发现该基因不含内含子。利用scr82的基因组序列、开放阅读框序列与辣椒疫霉基因组数据库和转录组数据[16]进行比对,发现该基因为单拷贝基因,未发现旁系同源基因。
|
| 图 2 基因scr82的cDNA扩增产物 Figure 2 RT-PCR product of the gene scr82 from cDNA of P. capsici germinated cysts. M: DL2000 DNA marker; lane 1: germinated cyst cDNA. |
2.3 SCR82编码基因推测的氨基酸序列
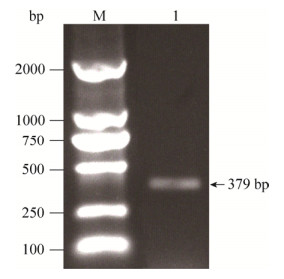
预测基因scr82编码的蛋白长度为82个氨基酸,N端头21个氨基酸为信号肽序列,全长序列含有7个半胱氨酸残基(cysteine,Cys),其中成熟肽段含有6个Cys (图 3);SCR82不存在跨膜结构域,经FFPred预测在质外体空间发挥作用(GO:0005615,extracellular space);预测蛋白相对分子量大小约为8.89 kDa,理论等电点为4.54,脂溶指数(aliphatic index)为77.32,亲水性平均系数(grand average hydropathy,GRAVY)为0.028,不稳定系数(instability index)为31.76,推测SCR82是一个稳定的疏水蛋白。
|
| 图 3 SCR82蛋白的二级结构、同源序列和固有不规则结构预测 Figure 3 The secondary structure, homologue sequences and intrinsic disorder profile of SCR82. A: The amino acid sequence and predicted secondary structure of SCR82: c random coil, h α-helix. The signal peptide on N-terminus is highlighted by a black brace on the top of the sequence. The cysteine residues were marked by black asterisks on the top. B: Protein sequences were aligned and shaded (60% threshold for shading) for consensus using BioEdit. The homologues of SCR82 compared here include PcF from P. cactorum, PHYCI_83830 from P. cinnamomi, PITG_22677 from P. infestans, PPTG_05820 from P. parasitica, and PSURA_43241 from P. ramorum. The conserved cysteine sites are marked at the top by black asterisks for better visualization. The four amino acids SK(E/C)C thought to be involved in PCD-inducing activity of PcF was underlined. C: Intrinsic disorder profile of SCR82. The disordered regions were identified and annotated by DISOPRED. Amino acid residues were considered disordered when the blue line is above the confidence threshold 0.5 (the grey dashed line). The orange line indicates the disordered residues with protein binding activity. |
经软件分析,在二级结构上该蛋白由α-螺旋(α-Helix)和不规则卷曲(random coil)结构组成(图 3)。将SCR82序列在FungiDB和NCBI数据库中进行序列比对,挖掘它在真菌、卵菌、细菌等生物中的同源性序列,结果发现只有5个疫霉菌含有该蛋白的同源蛋白,其中它与恶疫霉PcF的序列相似性达67%,相同性达59%;与致病疫霉PITG_22677的序列相似性达71%,相同性达59% (图 3)。推测认为是PcF中负责激发PCD的保守氨基酸SK(E/C)C在SCR82中变为SRDC (图 3)。在蛋白数据库中进行比对,没有发现该蛋白含有任何已知的功能域。DISOPRED分析发现,第5至第12位、第55位至第63位的氨基酸序列可能参与蛋白互作(图 3)。
2.4 scr82基因的原核表达及蛋白纯化前面的生物信息学分析表明,scr82编码的蛋白具有强疏水性。因此,为增强原核表达蛋白的可溶性,载体pRSFDuet-1[25]中的6×His-SUMO片段被Nco Ⅰ、BamH Ⅰ酶切下来,与同样酶切过的pET28a(+)连接,构建出原核表达改进型载体pET28a(+)-6×His-SUMO,其表达的标签肽段6×His-SUMO大小约为15 kDa。
不含信号肽的scr82基因序列克隆进改良载体。含有重组质粒pET28a(+)-6×His-SUMO::scr82的大肠杆菌Rossette 2菌株在不同温度条件(22 ℃、37 ℃)下受不同浓度(0.1、0.2、0.5、1 mmol/L)的IPTG诱导,测试不同条件组合下的可溶性蛋白的表达情况。结果发现,在22 ℃条件下经0.2 mmol/L IPTG诱导过夜(~16 h),SDS-PAGE检测到菌体裂解液中诱导表达的约24 kDa的蛋白条带,分子量大小与预期符合(图 4),表明其为本研究所需的融合蛋白(标签肽段15 kDa+目的蛋白8.89 kDa),但蛋白表达量不高;表达产物也存在于菌体沉淀中,表明该蛋白形成了包涵体。同样条件下检测到空载体表达的6×His-SUMO标签肽段(图 4)。未能在其他温度和IPTG浓度条件下检测到预期的蛋白条带。
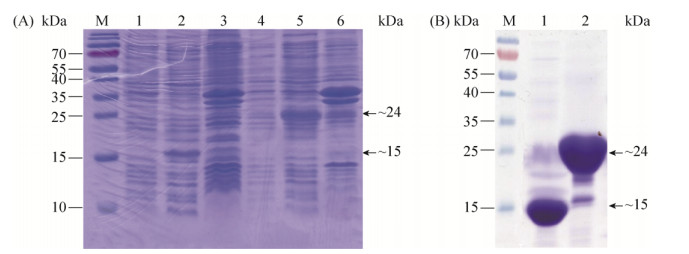
|
| 图 4 SCR82融合蛋白的原核表达和纯化 Figure 4 Prokaryotic expression and purification of SCR82 fused with the 6×His-SUMO tag. The proteins were separated on SDS-PAGE gels and stained by Coomassie blue. A: The crude proteins from E. coli cells. M, Protein ladder; lane 1-3, empty expression vector; lane 4-6, SCR82. lane 1 and 4, the supernatants of un-induced cells; lane 2, 3, 5, 6, the induced cells; lane 2 and 5, the supernatants of induced cells. The arrows indicated the 6×His-SUMO tag and recombinant SCR82, respectively; lane 3 and 6, the pellets of induced cells. B: The purified proteins. M, Protein ladder; lane 1, the 6×His-SUMO tag; lane 2, recombinant SCR82. |
在此基础上,本研究对该粗蛋白进行镍柱亲和层析纯化,用含500 mmol/L咪唑的洗脱液将蛋白洗脱。SDS-PAGE发现在15 kDa附近存在明显的6×His-SUMO标签肽段,在24 kDa附近存在明显的诱导表达蛋白(图 4),表明亲和层析纯化获得了目的蛋白。通过Bradford法测定标签肽段浓度为14 mg/mL,SCR82融合蛋白的浓度为30 mg/mL。
2.5 SCR82融合蛋白不触发本氏烟和拟南芥的PCD将融合蛋白注射入本氏烟和拟南芥叶片后观察,发现其均不能引起两种植物叶片的细胞死亡(图 5)。浸润后第4天观察,在本氏烟叶片上,30 mg/mL的蛋白原液及其稀释液均像空载体阴性对照一样不引起肉眼可见的细胞死亡症状;而阳性对照XEG1则引起明显的植物细胞死亡表型,即使稀释了10倍也具有活性。在拟南芥叶片上,蛋白原液和空载体阴性对照均导致叶片枯死,可能是缓冲液对拟南芥叶片具有一定的毒性,而稀释5倍后两者均不能产生明显的症状。进一步延长观察时间,均未发现融合蛋白引起本氏烟和拟南芥叶片的PCD。
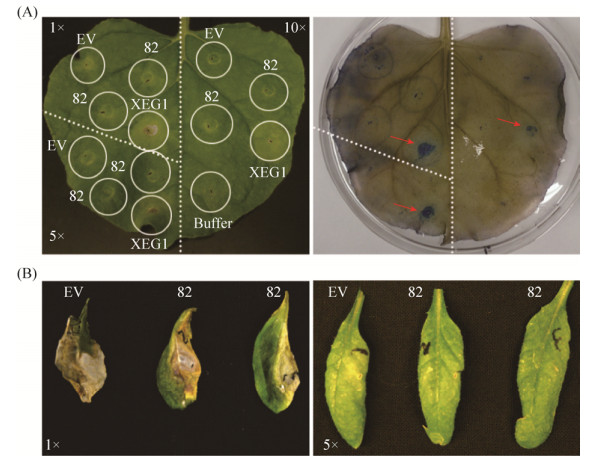
|
| 图 5 SCR82融合蛋白活性检测 Figure 5 Activity test of recombinant SCR82 on N. benthamiana and A. thaliana leaves. The protein solutions (SCR82, empty vector and XEG1) without dilution (i.e. 1×) or with 5-10 fold dilutions (5×, 10×), and PBS buffer were infiltrated into the lower surface of N. benthamiana (A) and A. thaliana (B) leaves. Photographs were taken 4 days after infiltration. A: the same N. benthamiana leaf without (left panel) or with Trypan blue stained (right panel). The red arrows indicated the lesions caused by the positive control P. sojae XEG1. B: A. thaliana leaves. To simplify the labelling, SCR82 was shorten into the number '82'. EV, the empty vector pET28a(+)-6×His-SUMO expressing the tag His-SUMO. Buffer, 1× PBS buffer. |
2.6 SCR82融合蛋白触发植物的防卫反应
由于融合蛋白不引起本氏烟和拟南芥叶片的PCD,我们进一步分析该蛋白是否触发植物的防卫反应。将空载体阴性对照、SCR82融合蛋白5倍稀释液分别浸润本氏烟叶片,分别于0、12、24 h后提取植物总RNA,分析植物防卫反应中3个标志基因NbMC1 (metacaspase 1)、NbSOD (superoxide dismutase)、NbPOX (peroxidase)[26]的转录水平变化。结果(图 6)发现,SCR82融合蛋白引起本氏烟体内这3个抗性相关基因的表达量变化;相比于0 h对照,NbMC1、NbSOD在蛋白浸润12 h、24 h后表达量均显著升高,而NbPOX在浸润24 h后表达量显著升高。结果说明,SCR82融合蛋白激发了本氏烟体内防卫相关基因的表达。
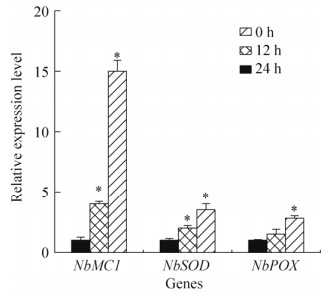
|
| 图 6 SCR82诱导本氏烟抗性相关基因的表达 Figure 6 Expression changes of disease resistance-related genes in N. benthamiana triggerred by recombinant SCR82. The recombinant SCR82 was infiltrated into N. benthamiana leaves and the expression levels of three resistance-related genes, NbMC1 (metacaspase 1), NbSOD (superoxide dismutase) and NbPOX (peroxidase) were checked by RT-qPCR at 12, 24 h post-infiltration and compared to those at 0 h (normalized to the value 1). Error bars are s.e. and the asterisks (*) denote statistically significant difference (Student t-test, P < 0.01). |
3 讨论
前期研究认为,PcF/SCR是一类在植物质外体空间起作用的疫霉菌效应蛋白,能够引起植物细胞死亡[6-7]。目前,仅有恶疫霉、致病疫霉中少数几个成员得到克隆[11, 15, 18-20],PcF得到推测的三维结构[13],致病疫霉SCR74、恶疫霉SCR96等蛋白的序列多态性和转录表达特征得到分析[18, 20],通过基因沉默分析了scr96的功能[18],但对PcF/SCR的生物学功能的认识仍极其有限,还不清楚它们在疫霉菌致病过程中所起的作用及其机制。本研究克隆分析了辣椒疫霉中首个PcF/SCR效应蛋白SCR82,为揭示该效应蛋白的功能以及拓宽我们对该类效应蛋白的认识奠定了物质基础。
已有研究表明,PcF/SCR编码基因多在疫霉菌侵染植物的过程中上调表达[17-20]。本研究分析发现,scr82在辣椒疫霉萌发休止孢和侵染寄主阶段上调表达,说明它可能参与了辣椒疫霉侵染寄主植物的过程(图 1)。克隆后比对发现,SCR82与恶疫霉PcF蛋白具有67%的序列相似性,而且在樟疫霉(P. cinnamomi)、致病疫霉、寄生疫霉和橡树疫霉(P. ramorum)中也存在高度同源(> 60%的序列相似性)的蛋白(图 3),但未在真菌、细菌、动物和植物等其他物种中发现同源蛋白;检索公共数据库未发现该蛋白含有任何已知的功能域,这些综合说明SCR82是一个疫霉菌中保守的新型效应蛋白,可能具有重要的生物学功能。分析其参与致病的作用及其机制,有助于帮助理解PcF/SCR的生物学功能。通过分析不同物种的PcF/SCR的功能也可以来研究病原物-寄主的共同进化关系。
我们前期利用PVX系统在烟草和番茄中进行瞬时表达,鉴定出恶疫霉SCR96、SCR113等效应蛋白可引起茄科植物的PCD[18-19],但发现辣椒疫霉SCR82的瞬时表达可能不能引起茄科植物的PCD。为进一步分析该蛋白的功能,我们构建了带有6×His-SUMO标签的pET28a(+)::scr82表达载体,并将该载体导入大肠杆菌中,成功诱导其表达,并经镍柱纯化获得了可溶的纯化蛋白(图 4)。前期分析说明SCR82是一个疏水小蛋白。蛋白表达结果表明,利用SUMO标签可以使此类疏水蛋白表达后较好地溶于水(图 4),SUMO标签可用于类似疏水蛋白的表达研究。电泳结果显示,含标签的融合蛋白大小约为24 kDa,从而判断SCR82大小约为9 kDa,这与经氨基酸序列推断的假定蛋白大小一致,说明SCR82的确属于小分子蛋白。我们进一步利用纯化的蛋白注射本氏烟和拟南芥叶片,结果发现融合蛋白未能引起这两种植物的PCD (图 5)。序列比对发现,PcF中被认为是负责激发PCD的保守氨基酸SK(E/C)C基序在SCR82中则为SRDC (图 3)。结合之前PVX系统瞬时表达结果,推测SCR82可能不引起PCD。类似地,致病疫霉含有20个PcF/SCR基因,但目前仅发现PcF/SCR.1引起本氏烟的PCD[15]。最近,我们预测恶疫霉至少含有14个PcF/SCR基因,结果只发现scr96、scr113可引起本氏烟和番茄的PCD,而scr99、scr121不能引起本氏烟的PCD、但可引起番茄的PCD[18-19]。这些结果综合表明,不是所有的PcF/SCR效应蛋白都可引起PCD,并且一些PcF/SCR效应蛋白的PCD触发活性具有寄主选择性。当然,SCR82不引起PCD还有其他可能性,例如是否是融合的标签过大影响了SCR82蛋白本身的性状?或是原核表达系统不适合该类真核蛋白的表达以致影响了其性状?回答这些问题仍需进一步的分析,或利用Thrombin蛋白酶去掉融合的标签再进行分析,或选用真核表达系统来进行该类疏水小蛋白的异源表达分析。本研究进一步分析了SCR82重组蛋白处理本氏烟后抗性相关基因的表达,发现植物抗性相关的3个标志基因剧烈上调表达(图 6),这说明该蛋白诱导了植物防卫反应的产生。类似地,已有研究发现PcF、SCR74等效应蛋白能够引起植物防卫反应相关的苯丙氨酸解氨酶表达的变化[11-12, 14]。一直以来,人们认为PcF/SCR效应蛋白可能作为PAMP分子激活植物的免疫抗性机制[6-7],但尚无实验证据系统证明。因此,分析SCR82是否是一个PAMP也成为下一步研究的内容。
目前普遍认为效应蛋白对于疫霉菌侵染致病具有重要作用,但并不清楚PcF/SCR效应蛋白参与疫霉菌侵染致病的机制[6-8]。一些研究者推测,PcF/SCR可能是疫霉菌中的“孤儿”无毒蛋白(“orphan” avirulence proteins),通过与植物的抗性R蛋白或受体结合发挥作用[20, 27]。但是,另外一些研究者则根据一些PcF/SCR效应蛋白引致植物坏死的表型,认为它们可能是一类毒素[6, 11]。然而,目前尚未证明上述任一观点,首要的问题就是仍不明确该类效应蛋白对疫霉菌侵染致病的影响以及在植物中的互作因子。为进一步明确SCR82在辣椒疫霉侵染过程中所起的作用,我们正利用疫霉菌CRISPR/Cas9技术[28]敲除辣椒疫霉中scr82基因。SCR82属于PcF/SCR质外体小蛋白,这类蛋白作用的植物靶标可能位于植物细胞壁或细胞膜上[6-7, 18],而蛋白小分子量及其定位空间的特殊性使常规的酵母双杂交等植物互作蛋白筛选难以进行。本研究获得的SCR82蛋白将有利于体外His Pull-down及Co-IP实验的开展,通过鉴定与其结合互作的植物蛋白,可最终阐明其作用机制。
本研究通过转录分析、基因克隆、蛋白性状分析预测及同源性比较、蛋白原核表达及纯化、植物浸润实验和抗性相关基因表达水平分析,对辣椒疫霉PcF/SCR效应蛋白SCR82进行了初步研究,为进一步阐明该效应蛋白在辣椒疫霉侵染致病过程中所起的作用奠定了基础。
| [1] | Erwin DC, Ribeiro OK. Phytophthora diseases worldwide. St Paul: American Phytopathological Society, 1996. |
| [2] | Kamoun S, Furzer O, Jones JDG, Judelson HS, Ali GS, Dalio RJ, Roy SG, Schena L, Zambounis A, Panabières F, Cahill D, Ruocco M, Figueiredo A, Chen XR, Hulvey J, Stam R, Lamour K, Gijzen M, Tyler BM, Grünwald NJ, Mukhtar MS, Tomé DF, Tör M, Van Den Ackerveken G, McDowell J, Daayf F, Fry WE, Lindqvist-Kreuze H, Meijer HJ, Petre B, Ristaino J, Yoshida K, Birch PR, Govers F. The top 10 oomycete pathogens in molecular plant pathology. Molecular Plant Pathology, 2015, 16(4): 413-434. DOI:10.1111/mpp.12190 |
| [3] | Lamour KH, Stam R, Jupe J, Huitema E. The oomycete broad-host-range pathogen Phytophthora capsici. Molecular Plant Pathology, 2012, 13(4): 329-337. DOI:10.1111/j.1364-3703.2011.00754.x |
| [4] |
Qiao N, Ma RL, Wang RL, Cheng Y, Jiao YS. Research progress on the happening and resistance of blight in pepper. Journal of Shanxi Agricultural Sciences, 2016, 44(6): 885-888.
(in Chinese) 乔宁, 马蓉丽, 王瑞丽, 成妍, 焦彦生. 辣椒疫病的发生及抗性研究进展. 山西农业科学, 2016, 44(6): 885-888. DOI:10.3969/j.issn.1002-2481.2016.06.41 |
| [5] |
Xi YD, Chen GH, Xie BY, Peng HX. Research progress of global spread, damage and biological characteristics of Phytophthora capsici. Northern Horticulture, 2016, 40(11): 199-203.
(in Chinese) 席亚东, 陈国华, 谢丙炎, 彭化贤. 辣椒疫霉菌全球传播与危害及生物学特性研究进展. 北方园艺, 2016, 40(11): 199-203. |
| [6] | Kamoun S. A catalogue of the effector secretome of plant pathogenic oomycetes. Annual Review of Phytopathology, 2006, 44: 41-60. DOI:10.1146/annurev.phyto.44.070505.143436 |
| [7] | Wawra S, Belmonte R, Löbach L, Saraiva M, Willems A, van West P. Secretion, delivery and function of oomycete effector proteins. Current Opinion in Microbiology, 2012, 15(6): 685-691. DOI:10.1016/j.mib.2012.10.008 |
| [8] | McGowan J, Fitzpatrick DA. Genomic, network, and phylogenetic analysis of the oomycete effector arsenal. mSphere, 2017, 2(6): e00408-17. |
| [9] | Ma ZC, Zhu L, Song TQ, Wang Y, Zhang Q, Xia YQ, Qiu M, Lin YC, Li HY, Kong L, Fang YF, Ye WW, Wang Y, Dong SM, Zheng XB, Tyler BM, Wang YC. A paralogous decoy protects Phytophthora sojae apoplastic effector PsXEG1 from a host inhibitor. Science, 2017, 355(6326): 710-714. DOI:10.1126/science.aai7919 |
| [10] | Wang Y, Wang YC. Trick or treat:microbial pathogens evolved apoplastic effectors modulating plant susceptibility to infection. Molecular Plant-Microbe Interactions, 2018, 31(1): 6-12. DOI:10.1094/MPMI-07-17-0177-FI |
| [11] | Orsomando G, Lorenzi M, Raffaelli N, Dalla Rizza M, Mezzetti B, Ruggieri S. Phytotoxic protein PcF, purification, characterization, and cDNA sequencing of a novel hydroxyproline-containing factor secreted by the strawberry pathogen Phytophthora cactorum. Journal of Biological Chemistry, 2001, 276(24): 21578-21584. DOI:10.1074/jbc.M101377200 |
| [12] | Orsomando G, Lorenzi M, Ferrari E, de Chiara C, Spisni A, Ruggieri S. PcF protein from Phytophthora cactorum and its recombinant homologue elicit phenylalanine ammonia lyase activation in tomato. Cellular and Molecular Life Sciences, 2003, 60(7): 1470-1476. DOI:10.1007/s00018-003-3079-7 |
| [13] | Nicastro G, Orsomando G, Ferrari E, Manconi L, Desario F, Amici A, Naso A, Carpaneto A, Pertinhez TA, Ruggieri S, Spisni A. Solution structure of the phytotoxic protein PcF:the first characterized member of the Phytophthora PcF toxin family. Protein Science, 2009, 18(8): 1786-1791. DOI:10.1002/pro.168 |
| [14] | Orsomando G, Brunetti L, Pucci K, Ruggeri B, Ruggieri S. Comparative structural and functional characterization of putative protein effectors belonging to the PcF toxin family from Phytophthora spp. Protein Science, 2011, 20(12): 2047-2059. DOI:10.1002/pro.742 |
| [15] |
Zhao DM, Xu J, Yang ZH, Zhu JH, Zhu LD. Cloning and function analysis of necrosis-inducing gene PcF/SCR.1 in Phytophthora infestans. Journal of Agricultural Biotechnology, 2014, 22(6): 744-752.
(in Chinese) 赵冬梅, 徐进, 杨志辉, 朱杰华, 朱丽丹. 致病疫霉坏死基因PcF/SCR.1的克隆及功能分析. 农业生物技术学报, 2014, 22(6): 744-752. DOI:10.3969/j.issn.1674-7968.2014.06.010 |
| [16] | Chen XR, Xing YP, Li YP, Tong YH, Xu JY. RNA-Seq reveals infection-related gene expression changes in Phytophthora capsici. PLoS One, 2013, 8(9): e74588. DOI:10.1371/journal.pone.0074588 |
| [17] | Chen XR, Zhang BY, Xing YP, Li QY, Li YP, Tong YH, Xu JY. Transcriptomic analysis of the phytopathogenic oomycete Phytophthora cactorum provides insights into infection-related effectors. BMC Genomics, 2014, 15: 980. DOI:10.1186/1471-2164-15-980 |
| [18] | Chen XR, Li YP, Li QY, Xing YP, Liu BB, Tong YH, Xu JY. SCR96, a small cysteine-rich secretory protein of Phytophthora cactorum, can trigger cell death in the Solanaceae and is important for pathogenicity and oxidative stress tolerance. Molecular Plant Pathology, 2016, 17(4): 577-587. DOI:10.1111/mpp.12303 |
| [19] | Chen XR, Huang SX, Zhang Y, Sheng GL, Zhang BY, Li QY, Zhu F, Xu JY. Transcription profiling and identification of infection-related genes in Phytophthora cactorum. Molecular Genetics and Genomics, 2018, 293(2): 541-555. DOI:10.1007/s00438-017-1400-7 |
| [20] | Liu ZY, Bos JIB, Armstrong M, Whisson SC, Da Cunha L, Torto-Alalibo T, Win J, Avrova AO, Wright F, Birch PR, Kamoun S. Patterns of diversifying selection in the phytotoxin-like scr74 gene family of Phytophthora infestans. Molecular Biology and Evolution, 2005, 22(3): 659-672. DOI:10.1093/molbev/msi049 |
| [21] |
Chen XR, Wang YC. Advances on the methods used for the functional analysis of oomycete genes. Journal of Agricultural Biotechnology, 2012, 20(5): 568-575.
(in Chinese) 陈孝仁, 王源超. 卵菌基因功能分析方法的研究进展. 农业生物技术学报, 2012, 20(5): 568-575. DOI:10.3969/j.issn.1674-7968.2012.05.014 |
| [22] | Zelaya-Molina LX, Ortega MA, Dorrance AE. Easy and efficient protocol for oomycete DNA extraction suitable for population genetic analysis. Biotechnology Letters, 2011, 33(4): 715-720. DOI:10.1007/s10529-010-0478-3 |
| [23] |
Chen XR, Zhang Y, Huang SX, Xing YP, Ji ZL. Sequence polymorphism, gene transcriptional pattern and function analysis of the RXLR effector PcAvh2 from Phytophthora capsici. Acta Microbiologica Sinica, 2018, 58(12): 2204-2215.
(in Chinese) 陈孝仁, 张烨, 黄沈鑫, 邢玉平, 纪兆林. 辣椒疫霉RXLR型效应子PcAvh2的序列多态性、基因转录特征及功能. 微生物学报, 2018, 58(12): 2204-2215. |
| [24] | Pfaffl MW. A new mathematical model for relative quantification in real-time RT-PCR. Nucleic Acids Research, 2001, 29(9): e45. DOI:10.1093/nar/29.9.e45 |
| [25] | Ma KW, Jiang SS, Hawara E, Lee D, Pan SQ, Coaker G, Song JK, Ma WB. Two serine residues in Pseudomonas syringae effector HopZ1a are required for acetyltransferase activity and association with the host co-factor. New Phytologist, 2015, 208(4): 1157-1168. DOI:10.1111/nph.13528 |
| [26] | Mafurah JJ, Ma HF, Zhang MX, Xu J, He F, Ye TY, Shen DY, Chen YY, Rajput NA, Dou DL. A virulence essential CRN effector of Phytophthora capsici suppresses host defense and induces cell death in plant nucleus. PLoS One, 2015, 10(5): e0127965. DOI:10.1371/journal.pone.0127965 |
| [27] | Bos JIB, Armstrong M, Whisson SC, Torto TA, Ochwo M, Birch PRJ, Kamoun S. Intraspecific comparative genomics to identify avirulence genes from Phytophthora. New Phytologist, 2003, 159(1): 63-72. DOI:10.1046/j.1469-8137.2003.00801.x |
| [28] | Fang YF, Tyler BM. Efficient disruption and replacement of an effector gene in the oomycete Phytophthora sojae using CRISPR/Cas9. Molecular Plant Pathology, 2016, 17(1): 127-139. |
 2019, Vol. 59
2019, Vol. 59