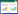中国科学院微生物研究所,中国微生物学会,中国菌物学会
文章信息
- 马晓田, 常保璇, 黄柳琴, 蒋宏忱. 2020
- Xiaotian Ma, Baoxuan Chang, Liuqin Huang, Hongchen Jiang. 2020
- Shewanella putrefaciens CN32对粘土附着态铵氮释放的影响
- Effects of Shewanella putrefaciens CN32 on the release of clay-sorbed NH4+
- 微生物学报, 60(6): 1192-1205
- Acta Microbiologica Sinica, 60(6): 1192-1205
-
文章历史
- 收稿日期:2020-03-28
- 修回日期:2020-05-15
- 网络出版日期:2020-05-18
近半个世纪以来,世界人口急剧增长,随之而来的是对粮食巨大的需求,促生了农业生产对化学肥料的强烈依赖性,这种状况在我国表现尤为突出。由于土壤中氮素是制约农作物生长的最主要因素之一,施用氮肥成为了提升粮食产量最有效的措施之一[1]。因此,世界氮肥使用量长期呈猛烈上升趋势,尤其是我国,氮肥的施用量远高于世界平均水平[2]。据世界粮农组织统计数据显示(FAOSTAT,www.fao.org),全世界化肥氮(主要为NH4+基氮肥)使用总量自1961年11.6×106 t急速增长到2014年的137.9×106 t后才趋于平稳,而此间中国使用量由0.5×106 t增长到了30.9×106 t,且中国年平均每公顷耕地氮肥使用量是世界平均水平的3倍以上,农作物对这些过量施加的氮肥利用率往往低于40%[3]。因此,尽管氮肥对粮食增产功不可没,但过剩的氮肥导致了大量氮素的流失、淋滤进入地表水体或者地下水,是中国大量湖泊、河流、近海等水体富营养化以及大面积地下水氮污染的最主要污染源之一[4]。
事实上,长期过量的施加氮肥不仅污染环境,也大大增加了土壤的氮负荷。氮肥的主要形态为铵基(NH4+)氮肥,因为土壤中的颗粒细小(< 2 μm)的粘土矿物常带有永久负电荷(晶体结构中低价阳离子类质同象替换高价阳离子)且具有极大的比表面积,可以通过吸附等方式有效减缓NH4+基氮肥的流失。因此,在农耕土壤大量施入NH4+基氮肥的背景下,相当可观的NH4+以粘土附着态的形式被截留在土壤中。前人对全球范围土壤的统计研究发现,每千克土壤可吸附10–90 mg(粗砂土)至60–460 mg(粘质土)的NH4+,可占施入NH4+氮肥的30%;每公顷表层土壤(0–30 cm)中的粘土能够固定350–3800 kg的NH4+-N(多占土壤总氮含量2%–25%),而这一比例在粘土含量高、缺乏根系的下层土壤则更高(多占总氮含量14%–85%)[5]。因此,粘土附着态NH4+是人为活动造就的一个巨大土壤氮库,其释放过程及机理不仅决定了土壤供氮的效率,也与氮素持续流失造成水体污染密切相关,因此了解粘土矿物附着态NH4+的释放过程及机理至关重要。
粘土附着态NH4+的含量并非一成不变,其稳定性受粘土矿物学性质差异以及多种环境因素影响巨大。粘土附着态NH4+包括吸附于粘土矿物外表面、侧面断键或2:1型矿物层间的NH4+,其中前两种被视为可交换性附着态NH4+,相对较易通过生物或非生物作用从粘土矿物上脱离下来;而插层在2:1型矿物层间的NH4+往往被称为固定态NH4+,因为NH4+(1.43 Å)的离子半径与K+(1.33 Å)相近,正好吻合四面体基面氧原子形成的六边孔洞的大小,使2:1型矿物层间坍塌,层间距减小至1 nm,导致NH4+圈闭而难以通过阳离子交换作用置换出来[6]。在不同的粘土中,NH4+主要的吸附方式和存在形态可能不同,例如缺乏层间结构的高岭石主要将NH4+吸附在矿物表面、层间膨胀和阳离子可交换性更高的蒙脱石固定NH4+的能力高于蛭石等,也正是粘土对NH4+吸附方式的不同导致在外界因素干扰下其吸附的NH4+释放难易程度的不同[7-8]。目前,对影响粘土矿物附着态NH4+释放研究较多的因素主要包括K+离子[9]、腐殖质[10]、植物根系[11]、氧化还原条件[12]等。这些因素中有些直接影响粘土附着态NH4+的阳离子交换和扩散过程,如离子特征与NH4+极相似的K+可以与NH4+发生竞争吸附[13],腐殖质与高岭石形成复合体增强了阳离子交换能力从而增加了对NH4+吸附量等;另一些因素则是通过影响粘土的矿物学特征改变粘土矿物对NH4+的吸附能力,如水稻田淹水带来的铁还原环境导致粘土负电性增加从而增加对NH4+的吸附能力[14]。
然而事实上,除以上因素之外,土壤微生物是影响粘土附着态NH4+稳定性的一个非常重要但极少被重视的角色。微生物在土壤中数量极其庞大,可通过同化吸收NH4+、改变粘土矿物微环境及转化NH4+形态(如硝化作用)等方式影响粘土附着态NH4+的稳定性,从而影响其释放过程[15]。其中,微生物通过分泌有机酸或胞外聚合物(extracellular polymeric substances,EPS)不仅可以帮助细胞截留环境中的有机和无机分子,为细胞提供营养物质,还能协同其他代谢物共同破坏矿物的晶格结构,帮助细菌与矿物相互接触形成细菌-矿物复合体,从而形成相对封闭的微环境,加速矿物的风化过程[16]。因此,本研究选取土壤中多种代表性粘土矿物,包括蛭石、蒙脱石、伊蒙混层矿物及黑云母,以及一种土壤中常见的能分泌EPS的功能微生物(腐败希瓦氏菌Shewanella putrefaciens CN32)为研究对象,分析这些粘土吸附NH4+的能力以及在CN32作用下它们释放附着态NH4+的过程,探究该微生物与粘土矿物相互作用的过程。以期可以通过模拟实验得到该微生物影响粘土矿物附着态NH4+的释放过程和机制。
1 材料和方法 1.1 吸附NH4+的粘土制备本实验选取蒙脱石、伊蒙混层矿物、蛭石及黑云母这四种粘土矿物为代表,因为它们是土壤中常见的主要粘土矿物类型[14]。其中蒙脱石(NAu2)和伊蒙混层矿物(ISCz)购买于美国粘土矿物学会(http://www.clays.org/),蛭石(简称Ver)及黑云母(简称Bt)来自我国新疆地区某矿床。以上粘土矿物首先研磨过筛,浸泡分散于0.5 mol/L NaCl溶液中,利用斯托克斯沉降公式分选出粒径小于2 μm的组分;然后对该粒径组分用清水多次洗涤,洗去多余NaCl后用于制备吸附NH4+的粘土。不同的粘土吸附NH4+的方式可能存在很大差异(可交换性或固定态NH4+),但也是影响附着态NH4+稳定性的天然因素,因此制备NH4+吸附的粘土时并未区分NH4+附着状态。吸附NH4+的粘土制备方法如下:用1 mol/L的NH4Cl配置成50 g/L的粘土悬浊液,搅拌2 h弃去上清,重新加入新鲜的1 mol/L NH4Cl,如此反复3次,最后离心收集粘土,水洗6次去除多余的NH4Cl,烘干研磨待用。
1.2 菌株培养及计数本次实验选用的菌株为腐败希瓦氏菌Shewanella putrefaciens CN32(以下简称CN32),分离自新墨西哥州Morrison地层开采的地下岩芯样品,是一株广泛被研究的模式菌株。取CN32储存菌液(–80 ℃条件下储存于40%甘油中)培养于LB培养基(10 g/L蛋白胨,5 g/L酵母粉,10 g/L NaCl)中复苏24 h (30 ℃,150 r/min)。之后,取1 mL转接至新鲜的100 mL灭菌后的LB培养基中,在摇床上培养16 h,使其生长处于对数期后,离心收集菌体,利用碳酸氢钠缓冲液(2.5 g/L NaHCO3,0.1 g/L KCl)清洗3遍,利用吖啶橙直接计数法在荧光显微镜(Leica DM5000B,Germany)下观察并计数。所有接种、清洗与稀释操作均在超净工作台完成。
1.3 微生物作用于吸附NH4+的粘土本次实验共设置5个系列,分别以四种吸附NH4+的粘土(标记为NH4+-NAu2、NH4+-ISCz、NH4+-Ver和NH4+-Bt,粘土浓度均为5 g/L)和溶解态NH4Cl(浓度为0.5 mmol/L)为唯一氮源,培养基其他成分包括0.1 g/L NaCl、0.05 g/L KH2PO4、0.05 g/L MgCl2·6H2O、0.02 g/L CaCl2·2H2O、2 mL/L微量金属元素溶液、1 mL/L维他命溶液以及1 g/L lactate-Na;其中微量金属元素溶液的每升母液成分包括:NTA 1.5 g,MgSO4 3 g,MnSO4·H2O 0.5 g,NaCl 1 g,FeSO4·7H2O 0.1 g,CaCl2·2H2O 0.1 g,CoCl2·6H2O 0.1 g,ZnCl2 0.13 g,CuSO4·5H2O 0.01 g,H3BO3 0.01 g,Na2MoO4 0.025 g,NiCl2·6H2O 0.025 g,Na2WO4·2H2O 0.025 g;维他命溶液的母液组分包括(L–1):biotin 2 mg,folic acid 2 mg,pyridoxine HCl 10 mg,riboflavin 5 mg,thiamine 5 mg,nicotinic acid 5 mg,B-12 0.1 mg,p-aminobenzoic acid 5 mg,thioctic acid 5 mg;将培养基和相应的粘土混合后高温灭菌,之后分别接种等浓度上述收集的新鲜菌液(CN32终浓度为1×109 cell/mL),同时设立不接种菌液的空白对照。以上每组培养设置两个平行对照组。
1.4 粘土矿物附着态N含量的测试粘土矿物附着态N在微生物作用前等同于吸附的NH4+,在微生物作用后还包含可能吸附的有机N(如生物量及EPS)。粘土矿物附着态N含量变化通过元素分析仪测定:在选取的时间点吸取5 mL粘土溶液,离心去除上清液并用去离子水清洗(3次),得到粘土沉淀冷冻烘干,用碳氮元素分析仪(Elementar Unicube,Germany)测试其总C、N的含量。
1.5 释放到上清中NH4+离子浓度的测试粘土释放到上清中的NH4+分光光度法测定[15]:显色试剂为1︰2的体积比混合溶液1(85 g/L sodium salicylate和0.6 g/L sodium nitroprusside)和溶液2(0.3 mol/L NaOH溶液),取0.6 mL样品加入0.3 mL的显色试剂,混合均匀后向样品中加入0.12 mL的0.1% sodium dichloroisocyanurate,混合均匀后避光30 min,于660 nm波长下测定样品的吸光度并确定上清NH4+离子的浓度(岛津UV1750)。
1.6 总蛋白含量(total protein)的测试由于粘土矿物的干扰难以对微生物菌体含量进行计数,因此通过测定蛋白总含量的方式来反映微生物含量的变化。测试方法采用改进的Bradford法[19]:取0.9 mL粘土悬浊液,加入0.1 mL的0.2 mol/L NaOH溶液,摇匀后煮沸10 min,冷却后离心(10000×g,10 min),取上清液0.8 mL加入到0.2 mL的Bradford reagent中反应5 min,于595 nm波长下测定样品的吸光度并确定溶液中总蛋白含量。
1.7 EPS的提取与测定为了研究EPS对附着态NH4+释放的影响,采用Tallon提取法[20]:将3 mL粘土悬浊液在4 ℃下离心(15000×g,15 min),弃上清液,沉淀用3 mL 1 mol/L NaCl洗涤后再次离心(4 ℃下15000×g,15 min),弃上清液;向得到的沉淀中加入3 mL 50 mmol/L EDTA后在4 ℃下孵育4 h,并间隔一定时间轻微振荡,后在4 ℃下离心(6000×g,30 min);保留上清液,并向上清液中加入两倍体积(即6 mL)的冷乙醇,4 ℃下孵育过夜后即沉淀出EPS;将沉淀的EPS离心弃上清,风干后用3 mL蒸馏水溶解。对EPS的两个主要组分碳水化合物和蛋白质组分根据标准苯酚/硫酸法[21]和Bradford法[19]进行定量分析。定量过程中的标准物质采用葡萄糖和蛋白质(BSA,Sigma-Aldrich)。
1.8 傅里叶变换红外光谱分析(FTIR)原始粘土、微生物作用与空白对照中的粘土利用傅里叶变换红外光谱分析(FTIR)分析粘土矿物结构及组成的潜在变化。取0.5 mL粘土溶液样品后,离心后去除上清液,并用无菌水洗涤3遍,待样品自然晾干后,取2 mg粉末样品与200 mg KBr迅速充分研磨,压片后上机测试。扫描范围为中红外400–4000 cm–1,扫描次数50次。
2 结果和讨论 2.1 粘土附着态NH4+的含量通过元素分析测定吸附NH4+前后的粘土矿物N含量表明,实验选取的四种粘土矿物均能够吸附一定量的NH4+。其中,蒙脱石NAu2对NH4+的吸附量最高,其次是蛭石Ver和伊蒙混层矿物ISCz,而黑云母Bt对NH4+的吸附量最低。经计算,当使用5 g/L吸附NH4+的粘土矿物用于微生物与矿物相互作用实验时,体系中附着态NH4+的总含量为0.49–3.32 mmol/L(表 1)。
| Mineral | N content/ (mg/kg) | Adsorbed NH4+ in 5 g/L clay suspension/(mmol/L) |
| NAu2 | 10 | 3.32 |
| NH4+-NAu2 | 9310 | |
| Ver | 390 | 2.36 |
| NH4+-Ver | 7000 | |
| ISCz | 390 | 1.51 |
| NH4+-ISCz | 4610 | |
| Bt | 220 | 0.49 |
| NH4+-Bt | 1600 |
所选的粘土矿物NH4+的吸附量与其矿物学性质差异息息相关。蛭石和蒙脱石所带的负电荷一般较多,因此吸附的NH4+也较多,但二者NH4+吸附的主要方式可能差异较大:蛭石的负电荷多在四面体片上,而蒙脱石多在次表面的八面体面体片层上,且蛭石的层间膨胀性和阳离子交换能力都比蒙脱石差,因此,蛭石外表面吸附NH4+的能力强于蒙脱石,而蒙脱石层间吸附NH4+的能力强于蛭石。而伊蒙混层矿物中的伊利石层负电量低,层间K离子含量高,阳离子交换能力弱,导致其整体的NH4+吸附能力弱于蒙脱石。黑云母中K含量较高,负电量和阳离子交换能力都很低,因此黑云母吸附的NH4+含量较少。
2.2 CN32影响粘土矿物附着态NH4+的稳定性 2.2.1 粘土附着态N含量的变化:以粘土附着态NH4+为唯一氮源培养S. putrefaciens CN32后,通过对比微生物作用前后粘土矿物吸附的N含量发现,CN32确实能够促进粘土矿物附着态NH4+的释放,但促进程度受粘土矿物类型影响较大(图 1)。从无菌对照组来看,四种粘土矿物在培养液中初期都能够自发地释放一部分NH4+,释放的相对含量从高到低依次为黑云母 > 伊蒙混层矿物 > 蒙脱石 > 蛭石,表明它们吸附NH4+的稳定性依次增强(即黑云母 < 伊蒙混层矿物 < 蒙脱石 < 蛭石)。而在CN32作用体系中,粘土附着态N相较于无菌对照组进一步降低,半个月内,NAu2、ISCz和Ver附着态N的释放程度较大,释放的增加量分别为32%、22%和20%(释放量分别为1.06 mmol/L、0.3 mmol/L和0.47 mmol/L,图 1-A–C),而Bt NH4+吸附量极少,在没有微生物作用下会自动地完全释放(后面讨论不再涉及)(图 1-D)。因此,CN32促进粘土附着态NH4+释放的效果由强到弱依次为蒙脱石 > 伊蒙混层矿物 > 蛭石。
|
| 图 1 吸附NH4+的蒙脱石(A)、蛭石(B)、伊蒙混层矿物(C)及黑云母(D)在S. putrefaciens CN32作用下粘土颗粒上N含量随时间的变化 Figure 1 Variation of clay-sorbed N on smectite (A), vermiculite (B), smectite-illite mixlayer mineral (C) and biotite (D) in the incubation with and without inocula of S. putrefaciens CN32 cells. The error bar represented standard error of duplicates. |
值得注意的是,在CN32作用于粘土的过程中,部分释放的NH4+可被微生物体吸收同化转变为有机N。这些有机N可能重新吸附在矿物表面,因此微生物作用后的粘土附着态N含量事实上包括了剩余的附着态NH4+及可能吸附在粘土矿物上的有机N,因此,根据测定的粘土附着态N含量的变化(图 1)可能低估了实际的CN32促进NH4+释放效果。不过,不同类型粘土对微生物有机N的吸附效率可能不同,例如在ISCz体系中,CN32作用前期(0–5 d,图 1-C)无菌对照组反而比微生物作用组固体N含量更低,表明可能有相当数量的有机N吸附在ISCz上;而其他粘土体系中,微生物作用体系一直低于无菌对照组NH4+含量,表明这些粘土吸附有机N较少,或吸附的有机N低于CN32促进NH4+的释放量。
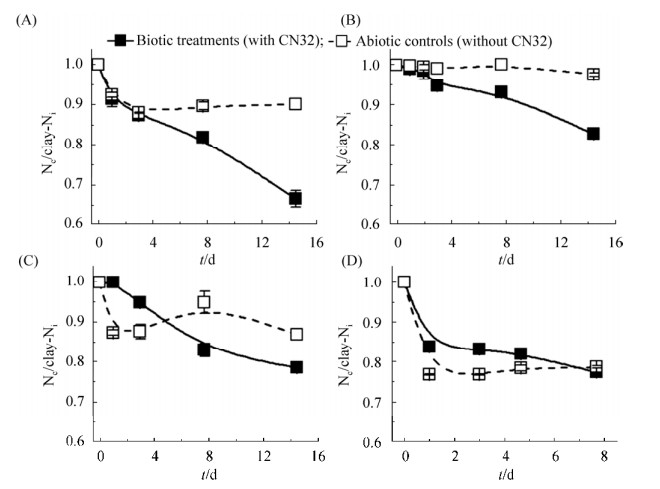
2.2.2 上清液中NH4+离子的浓度变化:在实际土壤中,粘土附着态NH4+在微生物作用下释放成为溶解态NH4+后,可能被转化为易淋滤的NO3-造成N流失抑或直接被生物吸收利用,因此实验监测了CN32促进粘土附着态NH4+释放后溶液中的溶解态NH4+含量变化(图 2-B–E),同时也测定了CN32以溶解态NH4+培养时NH4+消耗的行为(图 2-A)。结果表明,以溶解态NH4+为氮源培养CN32时,初期(0–4 d)溶液的NH4+相对于无菌对照组仅有极少量的减少,且pH几乎无波动(6.74–6.92),而并未发生接种入细胞体后吸附NH4+导致其浓度明显下降的现象;然而在整个培养过程中NH4+浓度持续下降,表明微生物在持续吸收同化NH4+,因此可以推测CN32菌体或其分泌物对NH4+的吸附作用可能明显弱于微生物的吸收同化作用。
|
| 图 2 S. putrefaciens CN32作用于溶解态NH4+(A)及吸附NH4+的蒙脱石(B)、蛭石(C)、伊蒙混层矿物(D)、黑云母(E)时溶液中NH4+浓度的变化 Figure 2 Dissolved NH4+ variation in the mesocosm where S. putrefaciens CN32 cells were grown with dissolved NH4+ (A), NH4+-sorbed smectite (B), vermiculite (C), smectite-illite mixlayer mineral (D), and biotite (E) as the sole N source, respectively. The error bar represented standard error of duplicates. |
在粘土体系中,NAu2在CN32作用下释放到溶液中的NH4+浓度略高于无菌组(图 2-B),而其他粘土矿物组中微生物作用下溶液中NH4+的累积浓度始终低于无菌组(图 2-C–E)。决定CN32作用下溶解态NH4+含量是否高于无菌组含量的因素有二:一是CN32促进矿物附着态NH4+释放的效率,二是CN32同化吸收NH4+的效率(CN32可有效同化吸收较多量的溶解态NH4+,图 2-A),当前者大于后者时,则表现为溶液中NH4+高于无菌组;反之,当CN32同化NH4+高于促进释放效率时,反而使溶液中NH4+浓度低于无菌组。因此,CN32作用下NAu2附着态NH4+的释放速率最快、释放量最多,从而使上清NH4+的累积量高出CN32同化吸收所需NH4+量,表现出比无菌对照组中更高的NH4+累积量,而在其他三个粘土体系中(Ver、ISCz及Bt)附着态NH4+的释放效率低于CN32的同化吸收的效率,从而使体系中累积的NH4+量低于无菌组。这一发现与上文中粘土附着态N的结果相互印证,即在CN32作用下NAu2释放附着态NH4+的效率和释放量高于其他三类粘土。同时,CN32快速同化吸收释放到溶液中的NH4+,造就矿物附着态NH4+与溶解态NH4+存在较高的势差,可能在促进粘土附着态NH4+不断被“泵出”释放发挥了重要作用。该结果也表明,微生物促进土壤中粘土附着态NH4+的释放并不一定会造成更多的N流失,反而可以促进粘土附着态NH4+的生物利用性,从而使土壤固定氮肥的利用率提高。
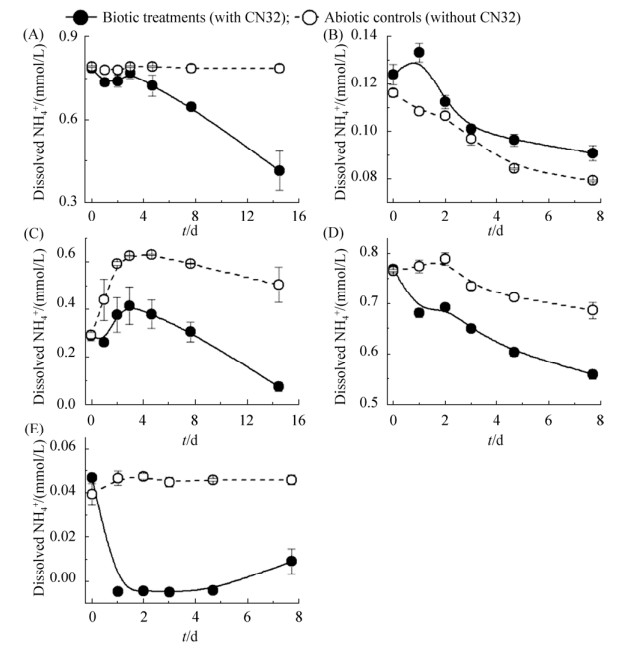
2.3 总蛋白含量变化由于实验体系中粘土矿物颗粒对微生物细胞计数的干扰,本实验通过测定微生物蛋白含量的变化来反映CN32的生长状况。结果表明,以溶解态NH4+为唯一氮源培养CN32时,其总蛋白含量始终处于一个稳定值(~90 mg/L,图 3-A),表明实验培养过程中菌体并未发生大量繁殖,因此推测CN32同化吸收NH4+可能主要用于合成一些代谢产物,主要是胞外多糖EPS。
|
| 图 3 S. putrefaciens CN32在溶解态NH4+(A)及吸附NH4+的蒙脱石(B)、蛭石(C)、伊蒙混层矿物(D)、黑云母(E)培养体系中菌蛋白含量的变化 Figure 3 Variation of protein contents in the S. putrefaciens CN32 cells grown with dissolved NH4+ (A), NH4+-sorbed smectite (B), vermiculite (C), smectite-illite mixlayer mineral (D), and biotite (E) as the sole N source, respectively. The error bar represented standard error of duplicates. |
在粘土培养体系中,以NH4+-Bt为底物培养时微生物蛋白含量与溶解态NH4+培养体系极其相近(图 3-E),表明黑云母颗粒表面对CN32及其产生的EPS几乎没有吸附作用,且由于黑云母体系释放的NH4+极少,在该体系中CN32代谢活性低下。与Bt不同,NAu2、Ver及ISCz体系中可提取总蛋白初始数量低于溶液体系中数量(图 3-B–D),表明这三种矿物对CN32菌体有一定吸附能力。在Ver和ISCz体系中,二者初始时刻提取的菌体蛋白仅为~20 mg/L,表明大量的菌蛋白吸附在粘土表面难以被提取出来,但随着培养时间的增加,Ver体系中可提取总蛋白含量出现明显增长,最终保持稳定(90 mg/L),ISCz也出现类似但较低的可提取总蛋白增加(稳定在40 mg/L,应是受限于ISCz附着态NH4+释放量较少),表明CN32作用于Ver或ISCz促进了菌蛋白的释放,可能是由于其分泌的代谢产物(如EPS)改变了菌蛋白在这两种粘土表面的吸附强度;而在NAu2体系中,可提取的菌蛋白初始含量约为45 mg/L (尽管微生物作用组测量值约为75 mg/L,但无菌对照组的背景值约为30 mg/L,这可能是受极少量颗粒极细小的难以沉降的NAu2胶体的干扰,因此CN32作用下菌蛋白浓度应约为45 mg/L);与Ver和ISCz体系不同的是,尽管NAu2释放的NH4+最多,CN32合成的代谢产物可能更多,但NAu2体系可提取的菌蛋白含量始终几乎不变,表明NAu2对菌蛋白具有更强的吸附能力,这在近期本课题组通过可以获得粘土表面元素和分子组成的分析技术(time of flight SIMS,ToF-SIMS)的研究也发现了微生物来源有机质能有效地吸附在矿物表面[22]。因此,粘土矿物多对微生物有机质具有一定的吸附能力,吸附强度受矿物类型影响较大,依次为蒙脱石 > 蛭石 > 伊蒙混层矿物 > 黑云母。
2.4 EPS含量变化胞外聚合物EPS是CN32已知的能够大量分泌到细胞外部的代谢产物,其主要成分为多糖和蛋白质。同时,前人研究也表明EPS通过促进细胞与矿物之间的紧密接触,能够有效促进矿物吸附物质甚至矿物结构中的营养元素的释放[23]。因此,本实验监测了与粘土作用过程中CN32产生的EPS中多糖与蛋白质的含量变化。结果显示,相对于无菌对照组,以溶解态NH4+培养时EPS(多糖及蛋白)含量都在前期(0–4 d)少量上升后达到平稳,表明有少量的EPS生成(图 4-A)。而以粘土附着态NH4+为底物培养,EPS的变化受不同的粘土类型影响大:NAu2体系中EPS蛋白含量未发生增加甚至略有减少(图 4-B),与菌体总蛋白变化趋势类似,但EPS多糖类保持增长模式明显增加(图 4-B),表明NAu2对CN32菌体及其产生的EPS吸附性都很强,尤其是蛋白类结构物质;与NAu2不同,Ver培养体系中EPS蛋白类含量显著增加(图 4-C),与图 3中总蛋白增加趋势一致,表明Ver对EPS的吸附性较弱;ISCz和Bt的EPS含量变化(图 4-D和E)较弱,与二者释放的NH4+较少、转化生成的EPS较少有关。
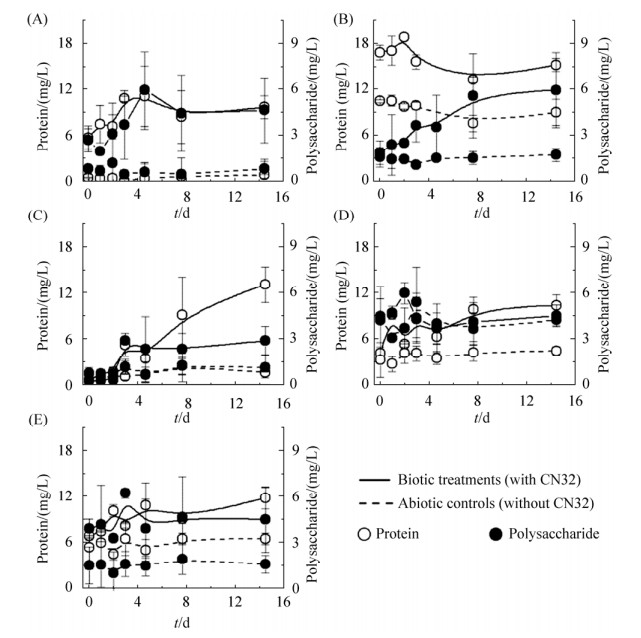
|
| 图 4 S. putrefaciens CN32在以溶解态NH4+(A)及吸附NH4+的蒙脱石(B)、蛭石(C)、伊蒙混层矿物(D)、黑云母(E)培养体系中EPS的蛋白(空心)及多糖组分(实心)含量的变化 Figure 4 Variation of protein (open circle) and polysaccharide (solid circle) contents in EPS derived from S. putrefaciens CN32 cells that were grown with dissolved NH4+ (A), NH4+-sorbed smectite (B), vermiculite (C), smectite-illite mixlayer mineral (D), and biotite (E) as the sole N source, respectively. The error bar represented standard error of duplicates. |
2.5 FTIR结果
实验进一步对各粘土矿物吸附NH4+前后以及被CN32作用后的矿物进行了FTIR分析。根据前人研究,峰值在900–1200 cm–1的强吸收峰往往是粘土矿物硅氧四面体层的Si-O振动峰(如图 5),是层状硅酸盐矿物的指纹峰;位于1640 cm–1左右的吸收峰和3400–3750 cm–1宽缓峰分别为-OH(包括八面体羟基以及自由水分子)的弯曲振动峰和伸缩振动峰,其强度往往与层间水分子含量、结构-OH周围环境变化等密切相关;而NH4+的N-H弯曲振动峰一般出现在1400 cm–1附近,其对称伸缩振动峰一般出现在3140 cm–1附近,且二者的峰值强度一般与粘土附着态NH4+量显著相关[24]。对比四种粘土矿物的FTIR图谱(图 5),可以明显发现NH4+吸附和解吸附过程中其特征峰的变化,例如,NAu2和Ver吸附NH4+量最大,二者在1401 cm–1和3140 cm–1处的NH4+的N-H弯曲振动峰和伸缩振动峰都明显增强,而在NH4+吸附量较低的ISCz与Bt中这两个特征峰的变化则相对较少;而当CN32作用后,NAu2中NH4+被大量释放使得1401 cm–1处的吸收峰则几乎消失(图 5-A),而在释放程度较低的Ver和ISCz中该特征峰变化则相对较弱(图 5-B和C)。
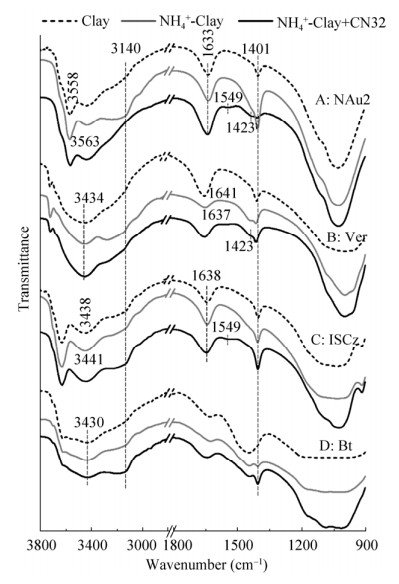
|
| 图 5 蒙脱石(A)、蛭石(B)、伊蒙混层矿物(C)及黑云母(D)在吸附NH4+及与S. putrefaciens CN32作用前后的FTIR图谱 Figure 5 FTIR spectra showing the spectral difference on the montmorillonite (A), vermiculite (B), montmorillonite mineral (C), and biotite (D) in the controls and treatments (with adsorpted NH4+, and with adsorped NH4+ and inocula of S. putrefaciens CN32 cells), respectively. |
NH4+往往通过静电引力吸附在粘土矿物表面或阳离子交换进入矿物层间,前人研究表明NH4+可与粘土矿物-OH形成氢键,且粘土矿物含水量发生变化均有助于NH4+的吸附[25]。本研究中通过FTIR图谱的变化也可以反映NH4+在不同粘土中吸附方式的差异。例如,NAu2和ISCz八面体中OH伸缩振动带的红外吸收峰在吸附NH4+后发生了明显变化,分别由3558 cm–1和3438 cm–1移至3563 cm–1和3441 cm–1,这种转变意味着粘土矿物在吸附NH4+后,其表面羟基周围环境发生了变化,表明NH4+吸附主要发生在粘土表面且与粘土矿物表面羟基基团的相互作用密切相关;而Ver在吸附NH4+后,其位于1641 cm–1处水分子的OH弯曲振动带移至1637 cm–1,并且几乎失去了夹层中的大多数水分子[26],表明NH4+可能进入到层间结构排挤了吸附态的水分子,这种较为紧密的吸附方式使蛭石附着态NH4+较难释放[27];相反,Bt中3430 cm–1处八面体OH伸缩振动带及1622 cm–1处水分子的OH弯曲振动带在吸附NH4+前后均未发生偏移。因此,NAu2和ISCz对NH4+的吸附应主要与OH基团之间的静电相互作用有关,Ver对NH4+的吸附则可能通过层间阳离子交换为主,而这两种吸附方式在Bt中较弱,使黑云母吸附NH4+的能力较弱。
此外,EPS吸附在矿物表面在FTIR图谱上也有所体现,例如,CN32作用后,1549 cm–1处代表EPS蛋白组分的N-H或C-H振动峰,1423 cm–1吸收峰代表COO-官能团的C-O振动峰,在吸附EPS较强的NAu2上均明显出现,在吸附EPS蛋白组分较弱的Ver中仅出现较强的C-O振动峰,而在与NAu2较相似的伊蒙混层矿物中则出现较弱的N-H/C-H振动峰。前人研究表明,EPS可以与矿物表面结合水或羟基形成氢键紧密结合[23, 28],因此,EPS可能与NH4+的吸附位点出现了竞争性的关系,并改变了粘土矿物表面的微环境,从而促进了矿物吸附物质甚至矿物结构中的营养元素的释放[29]。
3 结论本文研究了土壤中四种典型的粘土矿物与产EPS细菌相互作用下粘土附着态氨氮的稳定性。结果表明,粘土附着态NH4+的吸附量及稳定性受粘土矿物学性质影响极大。其中,附着态NH4+含量依次为蒙脱石 > 蛭石 > 伊蒙混层矿物 > 黑云母(吸附量极低,后面不予讨论),而CN32作用可以有效增加粘土附着态NH4+释放量,相对释放量依次为蒙脱石 > 伊蒙混层矿物 > 蛭石;FTIR光谱分析表明NH4+与EPS在粘土矿物上的吸附能力都与矿物的羟基(结构水或层间水)含量紧密相关。由此可推测EPS与NH4+对羟基竞争吸附可能是促进CN32释放的重要原因之一。值得注意的是,CN32作用下粘土释放的NH4+并没有主要以溶解态形式累积于溶液中,而是被CN32吸收同化转化为生物有机氮,从微生物总蛋白和EPS的测试结果来看,不同的粘土体系中均有一定量的微生物来源有机质吸附在粘土表面(尤其是蒙脱石)难以被提取出来,表明CN32吸收NH4+后转化的有机氮能够有效地吸附在粘土表面。换言之,CN32的作用促进了滞留在土壤中(吸附在粘土矿物上)的氨基氮肥释放,将其转化为有机氮继而吸附在矿物表面,可能有助于减少无机氮肥流失。因此,分泌胞外聚合物的微生物可能在降低土壤氮肥流失、转化土壤氮肥污染过程中发挥着重要作用。这也说明了研究其他类型功能微生物对粘土附着态NH4+影响十分必要,为降低土壤氮肥施用量及其流失造成的污染问题提供思路。
| [1] | Zhang X. Biogeochemistry:A plan for efficient use of nitrogen fertilizers. Nature, 2017, 543(7645): 322. DOI:10.1038/543322a |
| [2] | Galloway JN, Cowling EB. Reactive nitrogen and the world:200 years of change. AMBIO:A Journal of the Human Environment, 2002, 31(2): 64-72. DOI:10.1579/0044-7447-31.2.64 |
| [3] | Han YG, Fan YT, Yang PL, Wang XX, Wang YJ, Tian JX, Xu L, Wang CZ. Net anthropogenic nitrogen inputs (NANI) index application in Mainland China. Geoderma, 2014, 213: 87-94. DOI:10.1016/j.geoderma.2013.07.019 |
| [4] | Yu C. Managing nitrogen to restore water quality in China. Nature, 2019, 567(7749): 516-520. DOI:10.1038/s41586-019-1001-1 |
| [5] | Lu CY, Zhang XD, Chen X. Fixation of labeled (15NH4)2SO4 and its subsequent release in black soil of Northeast China over consecutive crop cultivation. Soil and Tillage Research, 2010, 106(2): 329-334. DOI:10.1016/j.still.2009.11.009 |
| [6] | Nommik H, Vahtras K. Retention and fixation of ammonium and ammonia in soils. Nitrogen in Agricultural Soils, 1982, nitrogeninagrics: 123-171. |
| [7] | Qiu SJ, Peng PQ, Li L. Effects of applied urea and straw on various nitrogen fractions in two Chinese paddy soils with differing clay mineralogy. Biology and Fertility of Soils, 2012, 48(2): 161-172. DOI:10.1007/s00374-011-0613-x |
| [8] | Juang TC, Wang MK, Chen HJ, Tan CC. Ammonium fixation by surface soils and clays. Soil Science, 2001, 166(5): 345-352. DOI:10.1097/00010694-200105000-00005 |
| [9] | Beuters P, Scherer HW, Spott O, Vetterlein D. Impact of potassium on plant uptake of non-exchangeable NH4+-N. Plant and Soil, 2015, 387(1-2): 37-47. DOI:10.1007/s11104-014-2275-6 |
| [10] | Zhang WZ, Chen XQ, Zhou JM, Liu DH, Wang HY, Du CW. Influence of humic acid on interaction of ammonium and potassium ions on clay minerals. Pedosphere, 2013, 23(4): 493-502. DOI:10.1016/S1002-0160(13)60042-9 |
| [11] | Martin HC, Denis AA, Philippe R, Candido P, David EP. Evidencing overwinter loss of residual organic and clay-fixed nitrogen from spring-applied, 15N-labelled pig slurry. Canadian Journal of Soil Science, 2014, 94(1): 1-8. |
| [12] | Zhang YS, Scherer HW. Ammonium fixation by clay minerals in different layers of two paddy soils after flooding. Biology and Fertility of Soils, 1999, 29(2): 152-156. DOI:10.1007/s003740050538 |
| [13] | Scherer HW. Dynamics and availability of the non-exchangeable NH4+-N-a review. European Journal of Agronomy, 1993, 2(3): 149-160. DOI:10.1016/S1161-0301(14)80124-X |
| [14] | Zhang Y, Scherer H. Mechanisms of fixation and release of ammonium in paddy soils after flooding. Biology and Fertility of Soils, 2002, 35(3): 184-188. DOI:10.1007/s00374-002-0458-4 |
| [15] | Dai QW, Zhao YL, Dong FQ, Bin W, Huang YB. Interaction between bentonite and Bacillus litoralis strain SWU9. Applied Clay Science, 2014, 100: 88-94. DOI:10.1016/j.clay.2014.07.017 |
| [16] | Hans CF, Jost W. The biofilm matrix. Nature Reviews Microbiology, 2010, 8(9): 623-633. DOI:10.1038/nrmicro2415 |
| [17] |
Xiong Y, Xu JQ. Frequency distribution of clay minerals in the soils of China. Acta Pedologica Sinica, 1964, 12(3): 266-274.
(in Chinese) 熊毅, 许冀泉. 中国土壤中粘粒矿物的分布规律. 土壤学报, 1964, 12(3): 266-274. |
| [18] | Kandeler E, Gerber H. Short-term assay of soil urease activity using colorimetric determination of ammonium. Biology and Fertility of Soils, 1988, 6(1): 68-72. |
| [19] | Bradford MM. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Analytical Biochemistry, 1976, 72(1-2): 248-254. DOI:10.1016/0003-2697(76)90527-3 |
| [20] | Tallon R, Bressollier P, Urdaci MC. Isolation and characterization of two exopolysaccharides produced by Lactobacillus plantarum EP56. Research in Microbiology, 2003, 154(10): 705-712. DOI:10.1016/j.resmic.2003.09.006 |
| [21] | DuBois M, Gilles KA, Hamilton JK, Rebers PA, Smith F. Colorimetric method for determination of sugars and related substances. Analytical Chemistry, 1956, 28(3): 350-356. DOI:10.1021/ac60111a017 |
| [22] | Zeng Q, Huang LQ, Ma JY, Zhu ZH, He C, Shi L, Liu W, Wang X, Xia Q, Dong HL. Bio-reduction of ferrihydrite-montmorillonite-organic matter complexes:Effect of montmorillonite and fate of organic matter. Geochimica et Cosmochimica Acta, 2020, 276: 327-344. DOI:10.1016/j.gca.2020.03.011 |
| [23] | Hong ZN, Chen WL, Rong XM, Cai P, Dai K, Huang QY. The effect of extracellular polymeric substances on the adhesion of bacteria to clay minerals and goethite. Chemical Geology, 2013, 360: 118-125. |
| [24] | Petit S, Righi D, Madejová J. Infrared spectroscopy of NH4+-bearing and saturated clay minerals:A review of the study of layer charge. Applied Clay Science, 2006, 34(1-4): 22-30. DOI:10.1016/j.clay.2006.02.007 |
| [25] | Alshameri A, He HP, Zhu JX, Xi YF, Zhu RL, Ma LY, Tao Q. Adsorption of ammonium by different natural clay minerals:characterization, kinetics and adsorption isotherms. Applied Clay Science, 2018, 159: 83-93. DOI:10.1016/j.clay.2017.11.007 |
| [26] | Cheng Y, Huang TL, Shi XX, Wen G, Sun YK. Removal of ammonium ion from water by Na-rich birnessite:Performance and mechanisms. Journal of Environmental Sciences, 2017, 57: 402-410. DOI:10.1016/j.jes.2016.11.015 |
| [27] | Pérez ML, Balek V, Poyato J, Perez RJ, Šubrt J, Bountsewa I, Beckman I, Málek Z. Study of natural and ion exchanged vermiculite by emanation thermal analysis, TG, DTA and XRD. Journal of Thermal Analysis and Calorimetry, 2003, 71(3): 715-726. DOI:10.1023/A:1023353521235 |
| [28] | Cao YY, Wei X, Cai P, Huang QY, Rong XM, Liang W. Preferential adsorption of extracellular polymeric substances from bacteria on clay minerals and iron oxide. Colloids and Surfaces B:Biointerfaces, 2011, 83(1): 122-127. DOI:10.1016/j.colsurfb.2010.11.018 |
| [29] | Mao Y, Daniel LN, Whittaker N, Saffiotti U. DNA binding to crystalline silica characterized by Fourier-transform infrared spectroscopy. Environmental Health Perspectives, 1994, 102(suppl 10): 165-171. DOI:10.1289/ehp.94102s10165 |
 2020, Vol. 60
2020, Vol. 60