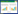中国科学院微生物研究所,中国微生物学会,中国菌物学会
文章信息
- 张耀超, 左艳萍, 周芳, 唐成芳, 张琳梅. 2020
- Zhang Yaochao, Zuo Yanping, Zhou Fang, Tang Chengfang, Zhang Linmei. 2020
- 落叶松脂醇-4-β-D-吡喃葡糖苷抑制变异链球菌生长和生物膜形成的作用研究
- Effect of lariciresinol-4-beta-D-glucopyranoside on the growth and biofilm formation of Streptococcus mutans
- 微生物学报, 60(7): 1479-1487
- Acta Microbiologica Sinica, 60(7): 1479-1487
-
文章历史
- 收稿日期:2019-11-27
- 修回日期:2020-01-15
- 网络出版日期:2020-03-09
龋齿是与细菌生物膜形成相关的口腔感染性疾病,严重影响人们的口腔和身体健康。变异链球菌(Streptococcus mutans,S. mutans)是龋齿最关键的病原菌,其在牙齿表面定殖并导致牙齿脱矿,是牙菌斑生物膜的重要组成部分[1-3]。变异链球菌通过其表面的黏结素,识别并结合唾液凝集素和酸性富脯蛋白,介导变异链球菌附着于牙齿表面形成牙菌斑,进而将生物膜中的一些糖类代谢为酸类物质,降低微环境中的pH值,导致牙釉质脱矿,产生龋齿[4]。因此,研究开发抑制变异链球菌的增殖和抑制生物膜形成的药物和方法对于龋齿治疗具有重要意义。
目前大量研究致力于抗变异链球菌生物膜形成的药物研发。Chen等发现抗微生物肽LL-37的衍生物IG-13-1和IG-13-2通过破坏细菌细胞膜引起细胞内成分外泄而导致细菌死亡,进而抑制变异链球菌生物膜的形成。在分子水平IG-13-1和IG-13-2可抑制炎症因子肿瘤坏死因子-α (tumor necrosis factor,TNF-α)和核因子κB (nuclear factor κB,NF-κB)的表达[5]。研究发现天竺葵甲醇提取物具有显著的抗变异链球菌活性,其中根提取物的抗菌作用最强[6]。Bach等发现从越南毛杜鹃叶分离到的罗丹明酮通过抑制细菌细胞膜上质子移位膜ATP酶(membrane-bound proton translocating ATPase,F-ATPase)和磷酸转移酶系统的活性可以降低变异链球菌的产酸和糖酵解能力,并抑制变异链球菌生物膜的形成[7]。Phillip等发现蔓越莓乳香酚提取物具有很强的降低变异链球菌代谢活性,抑制酸生成和生物膜形成的功能[8]。此外,姜黄素和抗菌肽也已被应用于口腔生物学的研究[9-10]。
落叶松脂醇-4-β-D-吡喃葡糖苷是从板蓝根中提取的一种木质素,而板蓝根常用于感染、感冒、发热和炎症性疾病等的治疗。已有研究发现落叶松脂醇-4-β-D-吡喃葡糖苷对流感病毒A/PR/8/ 34(H1N1)具有强烈的抑制作用,分子机制上落叶松脂醇-4-β-D-吡喃葡糖苷通过下调H1N1流感病毒感染诱导的TNF-a、IL-6和IP-10等分子发挥作用[11-12]。本研究发现落叶松脂醇-4-β-D-吡喃葡糖苷可抑制变异链球菌生物膜生长,并进一步研究了其调控机制和生物毒性。
1 材料和方法 1.1 材料准备和细菌培养变异链球菌UA159由中国科学院微生物研究所赠送,采用脑心浸液培养基(brain-heart infusion,BHI,Difco,美国)培养(95%空气,5% CO2)。
落叶松脂醇-4-β-D-吡喃葡糖苷购自美国Sigma-Aldrich公司(货号:PHL83536)。
1.2 生长曲线测定生长曲线测定根据文献报道方法进行[13]。以培养于BHI培养基的细菌悬液作为对照组,落叶松脂醇-4-β-D-吡喃葡糖苷加入细菌悬液使终浓度为10 μg/mL和50 μg/mL作为处理组,然后37 ℃厌氧培养24 h,每4 h取等量的培养体系采用PBS缓冲液稀释10倍后接种于BHI固体培养基。37 ℃厌氧培养48 h后,计数克隆形成单位(colony forming units,CFUs),并绘制生长曲线。本实验重复3次。
1.3 变异链球菌生物膜形成检测变异链球菌生物膜形成实验根据文献报道方法进行[14]。将–80 ℃保存的变异链球菌复苏,培养于BHI培养基,将变异链球菌液接种到96孔板(100 μL/孔)。在生物膜形成实验中,采用不同浓度的落叶松脂醇-4-β-D-吡喃葡糖苷(0,1,5,10,25,50和75 μg/mL)进行处理,对照组采用相同体积的去离子水处理。培养4到24 h后,去除培养基,使用PBS (pH 7.0)仔细清洗3次。落叶松脂醇- 4-β-D-吡喃葡糖苷处理组和对照组的生物膜生存率使用MTT法检测。每孔加入100 μL MTT试剂(2 mg/mL MTT,Sigma-Aldrich,美国),避光37 ℃处理3 h,然后轻轻去除MTT试剂,每孔加入150 μL二甲基亚砜溶解细胞内甲酰胺晶体。最后使用酶标仪于490 nm进行检测。本实验重复3次。
1.4 RNA提取和定量PCR检测变异链球菌过夜培养后,采用新鲜的BHI培养基稀释并接种到24孔板,设置50 μg/mL落叶松脂醇-4-β-D-吡喃葡糖苷处理组和对照组,厌氧培养24 h后,5000 r/min离心5 min,收取细菌,并采用无菌的PBS洗涤2次。
RNA提取:加入溶菌酶(15 μg/mL)并超声裂解12 s,然后采用TRIzol (Thermo Scientific,美国)抽提变异链球菌的总RNA。采用RevertAid First Strand cDNA Synthesis Kit (Thermo Scientific,美国)进行逆转录反应后,采用实时定量PCR方法检测brpA、recA、nth、luxS、ffh、smx、gtfB和gtfC基因的mRNA水平,16S rRNA作为内参。PCR程序为:95 ℃ 10 min;95 ℃ 10 min,60 ℃ 30 s,40个循环;72 ℃ 32 s。PCR反应在ABI7300实时定量PCR仪上进行,采用2-ΔΔCt方法计算相对表达量。引物序列如下:luxS上游引物(82–105):5′-GAGTTTGGACCTAAAGGCGATCTT-3′,下游引物(370–394):5′-CTTTGTAATTCCCACAGGAC TCAAT-3′;brpA上游引物(469–488):5′- GAAGGG CTGGTTCAGTTGGT-3′,下游引物(861–883):5′- CACCGTCAATAGTCGTTCCTTCT-3′;ffh上游引物(887–907):5′-TGGGAATGGGAGACTTGCTT A-3′,下游引物(1172–1191):5′- GCTCGGAGTTAG GAGGTCAG-3′;recA上游引物(345–366):5′- CCAGATTCAGGAGAACAGGGTC-3′,下游引物(800–822):5′-ATTCACCTGTACGAGAAATGCC T-3′;nth上游引物(50–71):5′- CGCTTTATCCAGA TGCTGTTCC-3′,下游引物(419–439):5′- AAATAC GGCTGACATGGGTGT-3′;smx上游引物(140–159):5′-TATCTGCCAAAGGTCCCACG-3′,下游引物(538–556):5′-AACGGCGATTGGAAGAAGG-3′;gtfB上游引物(407–425):5′-AAACAACCGAAGCT GATAC-3′,下游引物(475–496):5′-CAATTTCTTT TACATTGGGAAG-3′;gtfC上游引物(2362–2383):5′- GTGCGCTACACCAATGACAGAG-3′,下游引物(2447–2469):5′-GCCTACTGGAACCCAAACAC CTA-3′;16S rRNA上游引物(314–333):5′- GCAGTAGGGAATCTTCGGCA-3′,下游引物(778–802):5′-GTATCTAATCCTGTTCGCTACCCA C-3′。本实验重复3次。
1.5 氧敏感性检测96孔板中加入100 μL变异链球菌悬液。生物膜形成方法同上,采用50 μg/mL落叶松脂醇- 4-β-D-吡喃葡糖苷处理。生物膜生长72 h后,加入0.2%的过氧化氢(58.8 mmol/L,Sigma-Aldrich,美国)分别处理30、60和120 min。生物膜生存率采用MTT法检测。本实验重复3次。
1.6 细胞毒性检测人单核细胞系THP(ATCC,美国)用于检测落叶松脂醇-4-β-D-吡喃葡糖苷的细胞毒性[15]。第一类实验接种单核细胞到6孔板(每孔105细胞),培养基中加入终浓度25、50和75 μg/mL的落叶松脂醇-4-β-D-吡喃葡糖苷进行培养;第二类实验接种单核细胞到6孔板(每孔105细胞),然后感染变异链球菌(106 CFU)并在培养基中加入终浓度25、50和75 μg/mL的落叶松脂醇-4-β-D-吡喃葡糖苷进行培养。在37 ℃和5% CO2条件下处理24 h后,采用台盼蓝排斥实验进行检测。离心收集细胞,采用含10%胎牛血清的RPMI培养基重悬细胞。然后取100 μL细胞悬液与等体积的台盼蓝溶液混合,冰上处理5 min,然后在显微镜下计数细胞。细胞存活率为:未染色细胞/(染色细胞+未染色细胞)。本实验重复3次。
1.7 乳酸脱氢酶(LDH)活性分析乳酸脱氢酶活性检测按照文献报道方法进行[15]。接种单核细胞到6孔板(每孔106细胞),然后感染变异链球菌(106 CFU)并在培养基中加入终浓度25、50和75 μg/mL的落叶松脂醇-4-β-D-吡喃葡糖苷进行培养。在37 ℃和5% CO2条件下处理24 h后,收集培养基检测LDH活性(Promega,美国)。取50 μL培养基置于96孔板,并加入50 μL底物溶液后混匀,常温避光处理30 min。然后加入50 μL酸溶液终止反应。采用酶标仪在490 nm处采集数据。本实验重复3次。
1.8 统计分析所有数据表示为平均值±标准差(x±s),采用Graphpad软件6.0版本进行统计分析,多组间比较使用单因素方差分析,两组间比较使用T检验,检验水准α=0.05。
2 结果和分析 2.1 落叶松脂醇-4-β-D-吡喃葡糖苷对变异链球菌生长和生物膜形成的影响采用10 μg/mL和50 μg/mL的落叶松脂醇-4- β-D-吡喃葡糖苷处理变异链球菌4到24 h时,结果发现10 μg/mL和50 μg/mL的落叶松脂醇- 4-β-D-吡喃葡糖苷均可以显著抑制变异链球菌的生长。作用24 h后,10 μg/mL和50 μg/mL的落叶松脂醇-4-β-D-吡喃葡糖苷对变异链球菌生长的抑制率分别为29.9%和46.6% (P < 0.05)(图 1)。
|
| 图 1 落叶松脂醇-4-β-D-吡喃葡糖苷处理组(10 μg/mL和50 μg/mL)和对照组变异链球菌生长曲线对比 Figure 1 Comparison of the growth curve of Streptococcus mutans in the Lg treated group (10 μg/mL and 50 μg/mL) and negative control group. **: P < 0.01. |
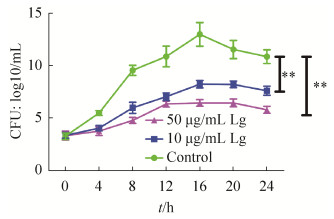
接着实验研究了落叶松脂醇-4-β-D-吡喃葡糖苷对变异链球菌生物膜形成的影响。结果(图 2)发现在作用4 h和24 h后,50 μg/mL和75 μg/mL落叶松脂醇-4-β-D-吡喃葡糖苷几乎全部抑制了生物膜的形成,具体为4 h后50和75 μg/mL落叶松脂醇-4-β-D-吡喃葡糖苷对变异链球菌生物膜形成的抑制率(%)分别为99.03±2.58和99.13±4.23 (P=0.000),24 h后50和75 μg/mL落叶松脂醇- 4-β-D-吡喃葡糖苷对变异链球菌生物膜形成的抑制率(%)分别为99.23±2.87和99.76±4.93 (P=0.000)。作用24 h后,25 μg/mL落叶松脂醇- 4-β-D-吡喃葡糖苷对生物膜形成的抑制率(%)为88.97±4.87 (P=0.000),10 μg/mL落叶松脂醇- 4-β-D-吡喃葡糖苷对生物膜形成的抑制率(%)为49.03±3.23 (P=0.000)(图 2)。这些结果表明落叶松脂醇-4-β-D-吡喃葡糖苷对变异链球菌生长和生物膜形成具有抑制作用。
|
| 图 2 落叶松脂醇-4-β-D-吡喃葡糖苷处理4 h和24 h后,在1、5、10、25、50、75 μg/mL浓度条件下检测生物膜抑制率 Figure 2 The inhibition rate of biofilm under the treatment of Lg at the concentration of 1, 5, 10, 25, 50, 75 μg/mL. ***: P < 0.001. |
2.2 落叶松脂醇-4-β-D-吡喃葡糖苷对变异链球菌生物膜氧敏感性的影响
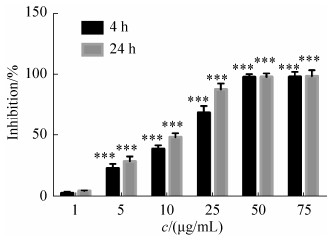
实验进一步研究了落叶松脂醇-4-β-D-吡喃葡糖苷处理后对变异链球菌生物膜氧敏感性的影响。结果发现50 μg/mL落叶松脂醇-4-β-D-吡喃葡糖苷处理后变异链球菌生物膜生存率在0.2%的过氧化氢处理0到120 min时间内基本稳定,而对照组变异链球菌生物膜在0.2%的过氧化氢处理后生存率显著下降,60 min后接近落叶松脂醇-4-β-D-吡喃葡糖苷处理组变异链球菌生物膜的生存率(图 3)。
|
| 图 3 落叶松脂醇-4-β-D-吡喃葡糖苷对变异链球菌生物膜氧敏感性的影响 Figure 3 The effect of Lg on the oxygen sensitivity of Streptococcus mutans biofilm. |
2.3 落叶松脂醇-4-β-D-吡喃葡糖苷对变异链球菌生物膜形成相关基因的影响
Real-time PCR检测发现,与对照组相比,50 μg/mL落叶松脂醇-4-β-D-吡喃葡糖苷处理后可以显著下调生物膜形成相关基因brpA (transcriptional regulator)、recA (recombinase A)、nth (endonuclease Ⅲ)、luxS (S-ribosylhomocysteinase)、ffh、smx、gtfB (glucosyltransferase-Ⅰ)和gtfC (glucosyltransferase- SI)的mRNA表达水平(图 4,P值分别为0.004、< 0.001、0.001、0.005、0.002、0.001、0.004和0.002)。
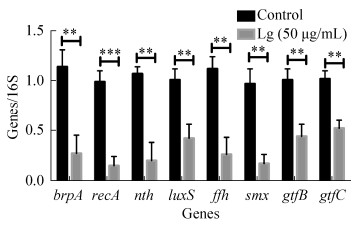
|
| 图 4 落叶松脂醇-4-β-D-吡喃葡糖苷处理后brpA、recA、nth、luxS、ffh、smx、gtfB和gtfC的相对表达量 Figure 4 The relative expression of brpA, recA, nth, luxS, ffh, smx, gtfB and gtfC after Lg treatment. ***: P < 0.01; ***: P < 0.001. |
2.4 落叶松脂醇-4-β-D-吡喃葡糖苷对单核细胞无毒性
采用台盼蓝排斥实验研究了落叶松脂醇- 4-β-D-吡喃葡糖苷对人单核细胞存活率的影响。图 5结果显示25、50、75 μg/mL落叶松脂醇-4-β-D-吡喃葡糖苷处理组与对照组单核细胞的存活率类似(P > 0.05),表明25、50、75 μg/mL落叶松脂醇- 4-β-D-吡喃葡糖苷对单核细胞无毒性。实验同样检测了落叶松脂醇-4-β-D-吡喃葡糖苷对变异链球菌感染的单核细胞存活率的影响。图 6结果发现,变异链球菌处理可以显著降低单核细胞的存活率,而25、50、75 μg/mL落叶松脂醇-4-β-D-吡喃葡糖苷均可以显著抑制变异链球菌感染对单核细胞存活率的下调作用。为了进一步确定落叶松脂醇- 4-β-D-吡喃葡糖苷无细胞毒性,实验检测了培养基中LDH的活性。图 7结果显示当变异链球菌感染单核细胞时,培养基中LDH的活性显著升高(P < 0.05),而当采用25、50、75 μg/mL落叶松脂醇-4-β-D-吡喃葡糖苷分别处理变异链球菌感染的单核细胞后,培养基中的LDH活性显著降低(P < 0.05)。这些结果表明25、50、75 μg/mL落叶松脂醇-4-β-D-吡喃葡糖苷对单核细胞无毒性。
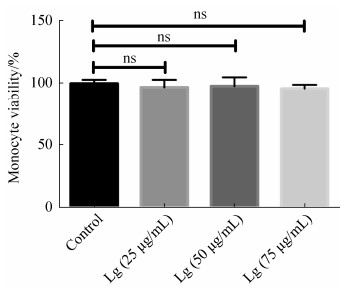
|
| 图 5 落叶松脂醇-4-β-D-吡喃葡糖苷对人单核细胞存活率的影响 Figure 5 The effect of Lg on the survival rate of human monocytes of 25, 50, 75 μg/mL for 24 h. |
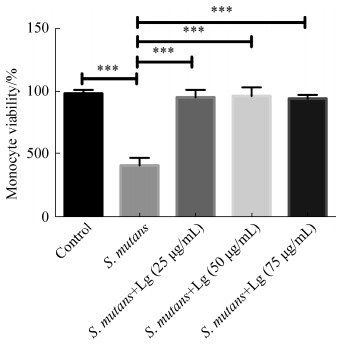
|
| 图 6 落叶松脂醇-4-β-D-吡喃葡糖苷对变异链球菌感染的人单核细胞存活率的影响 Figure 6 The effect of Lg on the survival rate of human monocytes infected with Streptococcus mutans of 25, 50, 75 μg/mL for 24 h. ***: P < 0.001. |
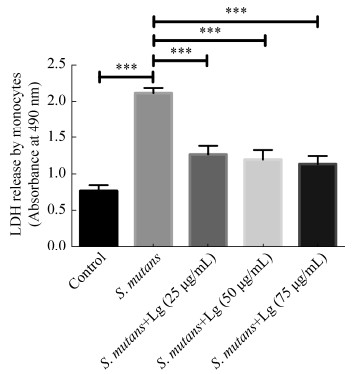
|
| 图 7 落叶松脂醇-4-β-D-吡喃葡糖苷对人单核细胞培养基中LDH活性的影响 Figure 7 The effect of Lg on LDH activity in human monocyte culture medium of 25, 50, 75 μg/mL for 24 h. ***: P < 0.001. |
3 讨论
口腔中,变异链球菌形成的牙菌斑生物膜是龋齿发生的重要致病原因。因此,探索抑制生物膜形成的方法对于龋齿治疗具有重要意义。
截至目前,有大量研究集中于开发能抑制变异链球菌增殖和生物膜形成的药物,这些研究对龋齿的治疗意义重大。Cao等发现人参皂苷Rh2 (ginsenoside Rh2,GS-Rh2)可以抑制变异链球菌生长,并抑制胞外多糖合成和破坏细胞膜,发挥抑制细菌生物膜形成的作用[16]。Hickl等发现地中海草药提取物也具有显著抑制变异链球菌生物膜形成的功能[17]。Lavaee等通过研究发现,硫酸锌与盘尼西林和洗必泰类似具有抑制变异链球菌生长的作用,而且在25 μg/mL和50 μg/mL浓度下,硫酸锌的抑制作用要显著好于乙酸锌[18]。此外,研究发现法尼醇可通过提高变链球菌的氧敏感性,降低生物膜形成相关基因表达水平来抑制龋齿的发生[15]。落叶松脂醇-4-β-D-吡喃葡糖苷作为从板蓝根中提取的一种木质素,对流感病毒A/PR/8/34 (H1N1)具有强烈的抑制作用,分子机制上落叶松脂醇-4-β-D-吡喃葡糖苷可以下调H1N1流感病毒感染诱导的TNF-a、IL-6和IP-10等分子[11-12]。本文结果发现落叶松脂醇-4-β-D-吡喃葡糖苷对变异链球菌的生长和生物膜的形成具有抑制作用。
低pH值可启动变异链球菌的DNA修复机制,以修复细胞内酸性环境引起的DNA损伤,而研究发现重组酶RecA、内切酶nth、无嘌呤嘧啶内切酶smx和ffh基因参与该过程的调控[19]。本实验结果发现落叶松脂醇-4-β-D-吡喃葡糖苷可下调变异链球菌生物膜形成相关基因brpA、recA、nth、luxS、ffh、smx、gtfB和gtfC的mRNA表达水平。此外luxS基因负责调节变异链球菌的氧化应激反应,且luxS基因缺陷菌株表现出耐酸能力降低的现象[20]。而我们的结果也发现落叶松脂醇-4-β-D-吡喃葡糖苷能下调变异链球菌生物膜中luxS基因的表达,表明其抑制了变异链球菌的耐酸能力。综上所述,落叶松脂醇-4-β-D-吡喃葡糖苷通过降低brpA、recA、nth、luxS、ffh、smx、gtfB和gtfC的mRNA表达水平,抑制了变异链球菌的生长和生物膜的形成。
临床应用中,抗菌药物应确保对机体细胞无毒性。本研究中参考文献报道[15]采用人单核细胞研究了落叶松脂醇-4-β-D-吡喃葡糖苷的毒性。结果发现25、50、75 μg/mL落叶松脂醇-4-β-D-吡喃葡糖苷既不影响人单核细胞的存活率,也不影响单核细胞LDH的活性。这些结果表明落叶松脂醇-4-β-D-吡喃葡糖苷无细胞毒性。考虑到落叶松脂醇-4-β-D-吡喃葡糖苷对病毒具有强烈的抑制作用且存在一定的抗炎作用,因此我们下一步将研究落叶松脂醇-4-β-D-吡喃葡糖苷是否对口腔微生态产生影响。
综上所述,本研究结果表明落叶松脂醇- 4-β-D-吡喃葡糖苷具有抑制变异链球菌生长和生物膜形成的作用,分子水平可以下调brpA、recA、nth、luxS、ffh和smx等生物膜形成相关基因的mRNA表达水平,同时研究发现其无细胞毒性,因此有望成为抗菌治疗的潜在药物。
| [1] | Guo JH, Jia R, Fan MW, Bian Z, Chen Z, Peng B. Construction and immunogenic characterization of a fusion anti-caries DNA vaccine against PAc and glucosyltransferase Ⅰ of Streptococcus mutans. Journal of Dental Research, 2004, 83(3): 266-270. DOI:10.1177/154405910408300316 |
| [2] | Mitchell TJ. The pathogenesis of streptococcal infections:from tooth decay to meningitis. Nature Reviews Microbiology, 2003, 1(3): 219-230. DOI:10.1038/nrmicro771 |
| [3] | Kuramitsu HK, He XS, Lux R, Anderson MH, Shi WY. Interspecies interactions within oral microbial communities. Microbiology and Molecular Biology Reviews, 2007, 71(4): 653-670. DOI:10.1128/MMBR.00024-07 |
| [4] |
Chen Y, Zhang XF, Zhu JD. Experimental study on the inhibitory effect of decoction of Bletille striata Reichb. f to Streptococcus mutans. Chinese Journal of Conservative Dentistry, 2007, 17(8): 452-454.
(in Chinese) 陈玉, 张晓芳, 朱剑东. 中药白芨抑制变形链球菌的实验研究. 牙体牙髓牙周病学杂志, 2007, 17(8): 452-454. DOI:10.3969/j.issn.1005-2593.2007.08.006 |
| [5] | Chen Z, Yang G, Lu SS, Chen DW, Fan S, Xu JY, Wu BL, He J. Design and antimicrobial activities of LL-37 derivatives inhibiting the formation of Streptococcus mutans biofilm. Chemical Biology & Drug Design, 2019, 93(6): 1175-1185. |
| [6] | Coronado-López S, Caballero-García S, Aguilar-Luis MA, Mazulis F, Del Valle-Mendoza J. Antibacterial activity and cytotoxic effect of Pelargonium peltatum (Geranium) against Streptococcus mutans and Streptococcus sanguinis. International Journal of Dentistry, 2018, 2018: 2714350. DOI:10.1155/2018/2714350 |
| [7] | Bach QN, Hongthong S, Quach LT, Pham TV, Kuhakarn C, Reutrakul V, Nguyen PTM. Antimicrobial activity of rhodomyrtone isolated from Rhodomyrtus tomentosa (Aiton) Hassk. Natural Product Research, 2019, 1: 1-6. DOI:10.1080/14786419.2018.1540479 |
| [8] | Philip N, Bandara HMHN, Leishman SJ, Walsh LJ. Inhibitory effects of fruit berry extracts on Streptococcus mutans biofilms. European Journal of Oral Sciences, 2019, 127(2): 122-129. DOI:10.1111/eos.12602 |
| [9] | Araújo NC, Fontana CR, Gerbi MEM, Bagnato VS. Overall-mouth disinfection by photodynamic therapy using curcumin. Photomedicine and Laser Surgery, 2012, 30(2): 96-101. DOI:10.1089/pho.2011.3053 |
| [10] | Mai JN, Tian XL, Gallant JW, Merkley N, Biswas Z, Syvitski R, Douglas SE, Ling JQ, Li YH. A novel target-specific, salt-resistant antimicrobial peptide against the cariogenic pathogen Streptococcus mutans. Antimicrobial Agents and Chemotherapy, 2011, 55(11): 5205-5213. DOI:10.1128/AAC.05175-11 |
| [11] | Zhou BX, Li J, Liang XL, Yang ZF, Jiang ZH. Transcriptome profiling of influenza A virus-infected lung epithelial (A549) cells with lariciresinol-4-β-D-glucopyranoside treatment. PLoS One, 2017, 12(3): e0173058. DOI:10.1371/journal.pone.0173058 |
| [12] | Li J, Zhou BX, Li CF, Chen QY, Wang YT, Li ZT, Chen TT, Yang CG, Jiang ZH, Zhong NS, Yang ZF, Chen RC. Lariciresinol-4-O-β-D-glucopyranoside from the root of Isatis indigotica inhibits influenza A virus-induced pro-inflammatory response. Journal of Ethnopharmacology, 2015, 174: 379-386. DOI:10.1016/j.jep.2015.08.037 |
| [13] | Yue JX, Yang HY, Liu SY, Song FF, Guo JM, Huang C. Influence of naringenin on the biofilm formation of Streptococcus mutans. Journal of Dentistry, 2018, 76: 24-31. DOI:10.1016/j.jdent.2018.04.013 |
| [14] | Cao L, Zhang ZZ, Xu SB, Ma M, Wei X. Farnesol inhibits development of caries by augmenting oxygen sensitivity and suppressing virulence-associated gene expression in Streptococcus mutans. Journal of Biomedical Research, 2017, 31(4): 333-343. |
| [15] | Jannadi H, Correa W, Zhang Z, Brandenburg K, Oueslati R, Rouabhia M. Antimicrobial peptides Pep19-2.5 and Pep19-4LF inhibit Streptococcus mutans growth and biofilm formation. Microbial Pathogenesis, 2019, 133: 103546. DOI:10.1016/j.micpath.2019.103546 |
| [16] | Cao X, Ye Q, Fan M, Liu C. Antimicrobial effects of the ginsenoside Rh2 on monospecies and multispecies cariogenic biofilms. Journal of Applied Microbiology, 2019, 126(3): 740-751. DOI:10.1111/jam.14178 |
| [17] | Hickl J, Argyropoulou A, Sakavitsi ME, Halabalaki M, AI-Ahmad A, Hellwig E, Aligiannis N, Skaltsounis AL, Wittmer A, Vach K, Karygianni L. Mediterranean herb extracts inhibit microbial growth of representative oral microorganisms and biofilm formation of Streptococcus mutans. PLoS One, 2018, 13(12). DOI:10.1371/journal.pone.0207574 |
| [18] | Lavaee F, Ghapanchi J, Motamedifar M, Sharifzade Javidi M. Experimental evaluation of the effect of zinc salt on inhibition of Streptococcus mutans. Journal of Dentistry (Shiraz), 2018, 19(3): 168-173. |
| [19] | Fozo EM, Quivey RG Jr. Shifts in the membrane fatty acid profile of Streptococcus mutans enhance survival in acidic environments. Applied and Environmental Microbiology, 2004, 70(2): 929-936. DOI:10.1128/AEM.70.2.929-936.2004 |
| [20] |
Han FS, Han YZ, Liu YX. Construction of LuxS gene deletion of Streptococcus mutans and evaluation of the acid tolerance of the mutant. Chinese Journal of Microbiology and Immunology, 2010, 30(7): 608-612.
(in Chinese) 韩福胜, 韩玉植, 刘宇霞. 变异链球菌LuxS基因缺陷株的建立及其耐酸能力的研究. 中华微生物学和免疫学杂志, 2010, 30(7): 608-612. DOI:10.3760/cma.j.issn.0254-5101.2010.07.005 |
 2020, Vol. 60
2020, Vol. 60