
中国科学院微生物研究所,中国微生物学会,中国菌物学会
文章信息
- 张丹, 岳华, 杨惠兰, 兰书焕, 李旭东, 王臣, 谢翼飞. 2021
- Dan Zhang, Hua Yue, Huilan Yang, Shuhuan Lan, Xudong Li, Chen Wang, Yifei Xie. 2021
- 基于环境微生物资源库快速构建易腐垃圾高效堆肥复合菌剂
- Fast-preparation of compost effective microorganisms (EM) for perishable garbage based Environmental Microbial Repository
- 微生物学报, 61(10): 3199-3210
- Acta Microbiologica Sinica, 61(10): 3199-3210
-
文章历史
- 收稿日期:2020-12-14
- 修回日期:2021-01-20
- 网络出版日期:2021-02-03
2. 环境微生物四川省重点实验室, 四川 成都 610041;
3. 中国科学院大学, 中国 北京 100049
2. Environmental Microbiology Key Laboratory of Sichuan Province, Chengdu 610041, Sichuan Province, China;
3. University of Chinese Academy of Sciences, Beijing 100049, China
近年来,随着乡村振兴战略的有效实施,乡镇和农村的经济飞速发展,人们的生活习惯越发城市化,与此同时,农村产生生活垃圾的种类和数量也在不断增加[1]。据报道,我国典型农村地区的生活垃圾产生量为0.35–0.4 kg/(人·d)[2],且组成复杂,分类回收困难,以厨余废弃物为主的易腐生活垃圾处置不当易导致农村水环境污染与生态破坏[3],对农村易腐垃圾进行无害化、资源化处置是当前乡村生态环境保护的研究重点[4]。
与垃圾焚烧、填埋相比,好氧堆肥是一种垃圾资源化的有效方式,即在有氧情况下,好氧微生物通过分泌胞外酶将附着在微生物体外的有机物质分解为可溶物质渗入胞内代谢降解,最终代谢产物主要是CO2、H2O[5]。在堆肥过程中,微生物会产生特定的水解酶降解原料中的有机物,纤维素酶、脲酶、蛋白酶、淀粉酶等是主要水解酶[6]。有机质降解率与相应水解酶活呈正相关关系,堆体中微生物产酶活性直接影响堆肥品质[7-9]。因此接种适合堆肥原料特性的微生物复合菌剂(effective microorganisms,EM)可以改善堆肥过程[10],提高堆肥产品质量,强化堆肥效果,同时减少堆肥对环境的影响[11]。如Pramanik等发现在堆肥过程中接种微生物复合菌剂可以提高堆肥产品中的腐殖酸、TP、TK等养分含量以及脲酶和磷酸酶的活性[12],Jurado等认为复合菌剂可以刺激堆肥过程中微生物系统的生长及活性,提高难降解成分木质素、纤维素的降解率[13],有利于混合有机原料的堆肥[14]。
近年来大多数研究集中于复合菌剂用于堆肥的效果研究与堆肥进程中微生物群落结构解析上[15],对堆肥复合菌剂构建方法的研究还不够完善。传统的堆肥EM菌构建方法为定向筛选法,即以待降解物质作为唯一碳氮源从环境中筛选功能菌株合成EM菌[16-17],过程烦琐且构建的EM菌功能较为单一。多种微生物组成的复合菌剂成分复杂,菌种资源较少,开发一种菌剂通常需要耗费大量的时间,缺乏一套标准化流程[18]。因此大规模筛选菌株,构建数量丰富微生物资源库,完善菌株的功能信息是快速开发复合菌剂的基础,以待降解物质成分为目标,定向挑选功能菌株进行组配理论上可实现复合菌剂的精准配制。本研究以环境微生物资源库为基础,建立高通量的有机质降解酶酶活检测平台,从降解酶方面评价了各菌株的功能信息。针对农村易腐垃圾堆肥,根据堆肥原料中有机质成分挑选出对应的高产酶菌株,快速构建了一种堆肥复合菌剂,并通过堆肥试验研究菌剂应用效果,验证基于环境微生物资源库构建微生物复合菌剂的方法是否可行,对复合菌剂构建方法的发展有重要意义。
1 材料和方法 1.1 堆肥原料实验用堆肥原料为四川省阿坝州茂县十里沟村易腐生活垃圾,根据该村生活垃圾分类和理化性质特性调整原料配比,就地粉碎后开展堆肥实验。表 1为堆肥原料的理化性质,表 2为主要有机物成分及含量。
| C/N | Moisture content/% | pH | Organic matter/% |
| 27.35±0.75 | 58.75±1.52 | 5.91±0.03 | 41.47±5.35 |
| Protein/% | Starch/% | Cellulose/% | Lignin/% | Fat/% |
| 23.2–37.5 | 17.5–24.6 | 9.3–21.2 | 2.6–7.1 | 11.2–18.7 |
1.2 培养基
LB培养基:胰蛋白胨10 g,NaCl 10 g,酵母提取物5 g,水1000 mL。
PDB培养基:马铃薯300 g,葡萄糖20 g,水1000 mL。
混合培养基(mixture medium):将LB培养基与PDB按9:1比例混合,115 ℃灭菌20 min。
麸皮培养基(bran medium):粉碎后过100目筛的麸皮90.0 g,NaCl 0.5 g,K2HPO4 0.3 g,FeSO4·7H2O 0.1 g,MgSO4·7H2O 0.1 g,水1000 mL,121 ℃灭菌20 min[19]。
红糖培养基(sugar medium):红糖50.0 g,尿素4.0 g,KH2PO4 3.0 g,抗坏血酸1.0 g,H2O 1000 mL,121 ℃灭菌20 min。
1.3 实验菌剂复合菌剂组成菌株:菌株来自于中国科学院成都生物研究所环境微生物资源库。
商品菌剂(BM):购买自广州市微元生物科技有限公司产品——堆肥发酵菌,有效活菌数≥ 2×1010 CFU/g,按照说明书进行活化后使用,活化发酵液中蛋白酶、淀粉酶、纤维素酶、木质素酶、脂肪酶活性分别为64.66、5.72、2.06、14.1、7.4 U/mL。
1.4 高酶活菌株的选择及鉴定采用ELISA试剂盒对微生物资源库182株菌进行产酶活性测定,包括蛋白酶、淀粉酶、脂肪酶、纤维素酶、木质素酶、脲酶。根据堆肥底物成分,挑选出4株蛋白酶高产菌,4株淀粉酶高产菌,4株纤维素酶高产菌,4株木质素酶高产菌,4株脂肪酶高产菌。将菌株送至生工生物工程(上海)股份有限公司进行16S rRNA基因测序,所得序列于NCBI网站使用BLAST对序列进行比对,序列比对地址为http://blast.ncbi.nlm.nih.gov/Blast.cgi。
1.5 高效堆肥复合菌剂CM构建测定以上20株菌株的生长曲线和发酵过程中的产酶特性,采用牛津杯抑菌法测试各菌株间两两拮抗作用。最终选择生长特性相似、拮抗作用弱的8株菌组成CM菌剂。组配比例与堆肥原料中对应的有机成分比例一致。
1.6 CM发酵条件优化单因素实验发酵培养基优化:选择常用的3种复合菌剂发酵培养基:红糖培养基、麸皮培养基和混合培养基,分别接种5%种子液,在30 ℃下,130 r/min的摇床中培养48 h,测定有效活菌数和产酶活性,选出最适复合菌剂发酵培养基。
发酵温度优化:选用最适混合发酵培养基,接种5%种子液,分别在25、30和35 ℃,130 r/min的摇床中培养48 h,测定有效活菌数和产酶活性,选出最适发酵温度。
接种量优化:选用最适混合发酵培养基,分别接种3%、5%和7%种子液,在30 ℃下,130 r/min的摇床中培养48 h,测定有效活菌数和产酶活性,选出最适接种量。
1.7 CM菌剂堆肥应用研究堆肥发酵采用堆肥桶好氧堆肥,设置3个实验组:空白组(CK),商品菌剂组(BM),高效堆肥菌剂组(CM)。将混合均匀后的堆肥原料均分为3份,BM组添加1% 商品菌剂活化液,CM组添加1%高效堆肥菌剂CM发酵液,将其分别堆置于堆肥桶开始堆肥。堆肥过程中翻堆次数和间隔时间,根据堆肥过程中水分和温度等跟踪测试值的变化进行合理调整。
1.8 采样及测定方法堆肥时间30 d,于堆肥第0、5、10、15、20天,分别于堆体表层、中层、深层取等量样品后均匀混合,然后采用四分法获取样品1 kg左右,分为两份装入密封的自封袋,一份风干,一份保存于4 ℃待测。
含水率:称取10 g鲜样于水分测定仪直接测定。
pH:称取10 g鲜样,按样品: 蒸馏水=l: l0 (m/V)进行浸提,振荡1 h后过滤,用pH酸度计直接测定。
温度:堆体温度采用堆肥桶自带温度表盘和水银温度计探入两种方法记录,温度每日一测,分别测定堆体表层、中层和底层温度后取平均值。
C/N:称取3 g过筛细样送至中国科学院成都生物研究所公共实验平台测定。
有机质:采用固体废物有机质的测定灼烧减量法(HJ 761-2015)进行测定。
种子发芽率(GI):称取l0 g风干样,按样品: 蒸馏水=1:l0 (m/V)进行浸提,振荡1 h后过滤待用。采用大白菜种子发芽率实验进行测量:在灭菌培养皿内铺入相应大小的无菌滤纸一张,均匀放进20粒颗粒饱满,大小接近的大白菜种子,用移液管吸取10 mL堆肥浸提液于培养皿中,同时设置蒸馏水对照组,每个样品重复3次,25 ℃黑暗环境中培养24 h,测定种子发芽率和根长。按照公式(1)计算GI。

|
公式(1) |
实验数据统计采用Excel 2016进行分析,相关图表采用origin 2017绘制。
2 结果和讨论 2.1 高酶活菌株的挑选及鉴定从环境微生物资源库挑选20株高产水解酶活性的菌株并进行种属鉴定,结果见表 3。其中包括酵母菌、乳酸菌、光合菌、放线菌、霉菌等,台湾短杆菌Y-11-22产蛋白酶活性最高为74.62 U/mL;尼氏短杆菌Y-11-5产脂肪酶活性最高为12.58 U/mL;HNB产淀粉酶活性为8.82 U/mL,经鉴定为红假单胞菌属;蜡状芽孢杆菌C-1-11产纤维素酶活性最高为3.17 U/mL;Y-1-1产木质素酶活性为12.86 U/mL,经鉴定为酿酒酵母。
| Enzyme | Strains | Enzymatic activity/(U/mL) | Species |
| Protease | Y-11-22 | 74.62 | Brevibacillus formosus |
| PSB-A | 47.34 | Rhodopseudomonas sp. | |
| CL | 45.77 | Lactobacillus delbrueckii bulgaricus | |
| Q-1-7 | 44.02 | Wickerhamomyces anomalus | |
| Lipase | Y-11-5 | 12.58 | Brevibacillus parabrevis |
| Q-1-1 | 11.84 | Saccharomyces cerevisiae | |
| Y-1-4 | 9.56 | Saccharomyces cerevisiae | |
| C-1-1 | 8.68 | Trichoderma longibrachiatum | |
| Amylase | HNB | 28.82 | Rhodopseudomonas sp. |
| PSB-SC | 27.36 | Rhodopseudomonas palustris | |
| CT20056 | 16.34 | Fungal sp. | |
| Q-2-1 | 15.06 | Saccharomyces cerevisiae | |
| Cellulase | C-1-11 | 3.17 | Bacillus cereus |
| AM-C35 | 2.45 | Trichoderma reesei | |
| AM-C34 | 2.18 | Rhizoctonia solani | |
| Y-11-15 | 1.47 | Bacillus sp. | |
| Ligninase | Y-1-1 | 13.71 | Saccharomyces cerevisiae |
| Q-1-4 | 13.39 | Wickerhamomyces anomalus | |
| C-X-4 | 12.86 | Lysinibacillus sphaericus | |
| F-N-3 | 12.41 | Stenotrophomonas sp. |
芽孢杆菌、光合菌、酵母菌、霉菌、短杆菌等是组成复合菌剂的主要菌属,且大量研究表明这些菌属与堆肥过程中碳水化合物的分解、病原菌生长抑制有关。光合菌在自身生长过程中会产生多种维生素和生长素,有效促进其他微生物生长,提高复合菌剂抵抗力[20],何若天通过对光合细菌PSB的研究发现,其释放出的胰凝乳蛋白酶具有抗菌、消炎和防止疾病发生的作用[21]。芽孢杆菌属常被报道具有高产纤维素酶活性,禤金彩等从森林湿泥样品中筛选出一株纤维素酶产生菌L.30,酶活力达4.25 U/mL,经鉴定,该菌为蜡样芽孢杆菌[22]。叶明等从土壤中筛选出一株产纤维素酶的蜡样芽孢杆菌B1,诱变成正突变株后纤维素酶0.373 U/mL,这与本研究中的蜡状芽孢杆菌高产纤维素酶特性一致[23]。酵母菌通常是单细胞,生长快,在液体培养基中能形成絮体,细胞大,代谢旺盛,耐受性高,在复合菌剂中被广泛应用[24]。
2.2 高效堆肥菌剂CM构建测定上述20株菌之间的两两拮抗作用,每株菌对应的拮抗作用菌株数目见表 4。由表可知,Y-11-22、Y-11-5、AM-C35、Q-1-1、CT20056、C-1-11、PSB-SC、C-X-4与大部分菌株间无拮抗作用,根据堆肥原料中蛋白质: 淀粉: 脂肪: 纤维素: 木质素≈4:4:3:3:1,将8株菌按照产蛋白酶菌株: 产淀粉酶菌株: 产脂肪酶菌株: 产纤维素酶菌株: 产木质素酶菌株=4:4:3:3:1的比例构建高效堆肥菌剂CM,菌株组成及配比见表 5。
| Strains | – | + | ++ |
| Y-11-22 | 16 | 1 | 2 |
| Y-11-5 | 14 | 5 | 0 |
| AM-C35 | 14 | 4 | 1 |
| Q-1-1 | 13 | 4 | 2 |
| CT20056 | 13 | 3 | 3 |
| C-1-11 | 13 | 4 | 2 |
| PSB-SC | 12 | 5 | 2 |
| C-X-4 | 11 | 5 | 3 |
| Y-1-4 | 10 | 6 | 3 |
| F-N-3 | 9 | 8 | 2 |
| HNB | 8 | 6 | 5 |
| Y-1-1 | 8 | 10 | 1 |
| Q-1-4 | 7 | 9 | 3 |
| Q-1-7 | 6 | 11 | 2 |
| C-1-1 | 5 | 11 | 3 |
| AM-C34 | 5 | 11 | 3 |
| PSB-A | 4 | 13 | 2 |
| Y-11-15 | 4 | 12 | 3 |
| CL | 3 | 10 | 6 |
| Q-2-1 | 3 | 11 | 5 |
| The Oxford Cup trail is 8 mm. The diameter of the bactericide ring is < 10 mm means no inhibition (–); The diameter of the bactericide ring is 10–15 mm means moderate inhibition (+); The diameter of the bactericide ring is > 15 mm means severe inhibition (++). | |||
| Strains | Y-11-22 | Y-11-5 | Q-1-1 | PSB-SC | CT20056 | C-1-11 | AM-C35 | C-X-4 |
| Proportion/% | 25 | 10 | 10 | 12.50 | 12.50 | 10 | 10 | 10 |
2.3 CM菌剂发酵条件优化 2.3.1 培养基:
适宜的培养基不仅利于菌株的分离、纯化和保存,还对微生物的生长代谢产生巨大影响[25]。实验研究混合培养基、麸皮培养基、红糖培养基3种不同培养基对菌体生长和产酶能力的影响,实验结果如图 1所示。根据复合菌剂中各菌株的生长曲线,选择培养时间为48 h。图 1显示了不同培养基下菌体的生长状况,结果表明,CM菌剂在3种培养基中生长48 h体系内有效活菌数为红糖 > 混合> 麸皮。从图 1可以看出在3种培养基条件下,菌剂产酶活力值为混合培养基和红糖培养基较高,麸皮培养基较低。综合菌体生长情况和产酶能力,选择红糖培养基作为CM菌剂发酵培养基。

|
| 图 1 不同培养基对CM菌剂生长和酶活性的影响 Figure 1 The effect of different media on the growth and enzyme activity of CM agent. |
2.3.2 温度:
微生物的生长过程也是一系列酶促反应过程,细胞新陈代谢所有的化学反应几乎都是在酶的催化下进行的。温度对酶活性有显著影响,越靠近最适温度,酶活性越强,而越远离最适温度,酶活性越弱,甚至失去活性[26]。
图 2显示,CM菌剂在不同温度中生长48 h体系内有效活菌数的大小为30 ℃ > 35 ℃ > 25 ℃。图 2显示,菌株产酶能力在3个发酵温度下为35 ℃ > 30 ℃ > 25 ℃。微生物的生长最适温度和产酶最适温度不一致,在研究中,应根据不同条件和需要选择适宜温度,在本实验中,考虑发酵成本,选择30 ℃作为CM菌剂发酵温度。

|
| 图 2 不同温度对菌剂生长和酶活性的影响 Figure 2 Effects of different temperature on growth and enzyme activity of CM agent. |
2.3.3 接种量:
此次接种为一级种子液接种,接种量是指接入种子液和发酵液的体积比。通常较大接种量可以提高菌体生长速率和菌体浓度,但如果接种量过多、菌体生长过快往往会使溶解氧降低而影响某些发酵产物的合成[27]。本实验研究了3个不同接种量对复合菌剂生长和产酶情况的影响,如图 3所示,接种量分别为3%、5%和7%时,相同培养时间内,接种量越大,菌体有效活菌数越高。从图 3发现,随着接种量的加大,菌体酶活亦在上升。因此,本实验选择7%接种量以备后续实验。

|
| 图 3 不同接种量对菌剂生长和酶活性的影响 Figure 3 Effects of different inoculation amounts on the growth and enzyme activity of CM agent. |
2.4 高效堆肥复合菌剂应用研究 2.4.1 温度:
温度是反映堆肥是否正常进行的直接指标[28]。堆肥过程中对照组和实验组温度变化如图 4所示。堆肥在春天进行,环境温度为20–29 ℃,平均温度为24 ℃。堆肥过程中,温度变化主要经历3个阶段,升温阶段、高温阶段、稳定阶段[29]。CK组升温期为5 d,堆体最高温度为42 ℃,然后迅速降温,堆体温度最终稳定在30 ℃左右;BM组于第3天进入高温期,最高温度为63 ℃,持续高温5 d后温度开始下降;CM组于第7天进入高温期,最高温度为63.5 ℃,高温期持续9–12 d。与CK组相比,BM组和CM组高温期温度更高,持续时间更长,说明易腐垃圾中原有的土著微生物活性不高,无法实现有机成分的快速降解,外加CM菌剂能够通过增加微生物活性加快降解过程,有效促进堆体腐熟。与BM组(最高温度63 ℃,高温期维持时间5 d)和周营等[11]用复合菌剂进行厨余垃圾好氧堆肥高温期相比(最高温度57.3 ℃,高温期维持时间6 d),CM组升温较慢,但温度更高且高温持续时间延长了4–7 d,说明CM菌剂适应环境后能有效延长高温期,高温持续时间长有利于灭杀虫卵、致病菌等有害生物[30]。
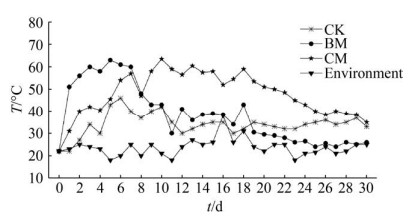
|
| 图 4 堆肥过程中温度变化 Figure 4 Temperature changes during composting. |
2.4.2 pH:
堆肥期间pH变化如图 5所示,CK、BM、CM组总体pH呈现出先上升后下降的趋势,说明在堆肥初期,真菌迅速繁殖代谢有机物产生碱性物质,提高了堆肥系统的酸碱度,随着碱性物质的累积,细菌和放线菌开始生长活动,开始积累有机酸并降低堆肥系统的酸碱度。可以推测出堆肥前期BM组的微生物活性更高,随着堆肥时间的延长,CM组微生物活性高于BM,这与堆体温度变化趋势一致。说明CM菌剂适应环境的过程较慢。在堆肥过程中,微生物不断交互作用调节pH值,两组pH均处于堆肥微生物适宜生长的范围中。
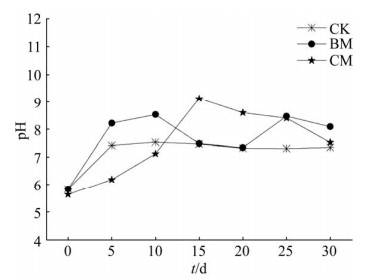
|
| 图 5 堆肥过程中pH变化 Figure 5 pH changes during composting. |
2.4.3 含水率:
含水率可作为评价堆肥进程的物理性指标[30]。因为微生物大都缺乏保水机制,对水分十分敏感,因此堆肥过程中保持适宜的水分含量,是堆肥成功的首要条件。如图 6所示,原始堆肥物料含水率为51%–53%,符合堆肥发酵的最适水分要求。随着堆肥的进行,水分含量降低。由于BM组较早进入高温期,前期其含水率下降较CM组更快,而当CM菌剂组进入高温期,并随着高温期的延长,其含水率下降高于BM组。堆肥结束时CK组和BM组含水率分别为48.51%和32.5%,CM组含水率为28.7%,满足《生物有机肥标准(NY 884-2012)》中相关标准。且CM组含水率比CK组低19.81%,比BM组低3.8%,说明接种CM菌剂更有利于易腐垃圾水分降低,提升堆肥产品品质。

|
| 图 6 堆肥过程中含水率变化 Figure 6 Changes in moisture content during composting. |
2.4.4 有机质与C/N:
堆肥有机质是堆肥肥效的关键影响因素。结果显示,随堆肥时间延长有机质含量总体呈下降趋势。堆肥30 d时CK、BM、CM组的有机质含量分别为56.79%、57.78%、54.36%,有机质降解率分别为27.8%、24.2%和30.4%,说明CM菌剂降解易腐垃圾中的有机质更快,有利于成品腐熟。
微生物新陈代谢需要适量的碳源获得能量,氮源来合成细胞,因此堆肥原料需要满足一定的C/N。此外,在堆肥过程中可用C/N的降低来表征堆肥质量,一般需低于20[31]。如图 7所示,堆肥初始物料C/N在23.84–28.4,满足《生活垃圾堆肥处理技术规范(CJJ 52-2014)》。随着堆肥时间的延长,C/N均呈下降趋势,碳一部分在微生物生长繁殖过程中以CO2的形式释放而得到降低,一部分则用于合成细胞留在堆肥产品中。CK组和BM组C/N在前3 d下降较快,但CM菌剂适应环境正常生长后,C/N从第3天开始迅速下降,说明接种CM菌剂更有利于降低C/N。堆肥30 d,CK组、BM组、CM组C/N分别为17.62、12.59、8.93,下降率为CM > BM > CK,分别为67.7%、53.9%、35.5%,与孙干[32]用固氮菌进行有机堆肥(40 d时C/N为14.09)相比,同时结合各堆体有机质含量可以发现,接种CM菌剂的实验组固氮能力更强,在堆肥过程中氮损失较少,明显优于BM菌剂。
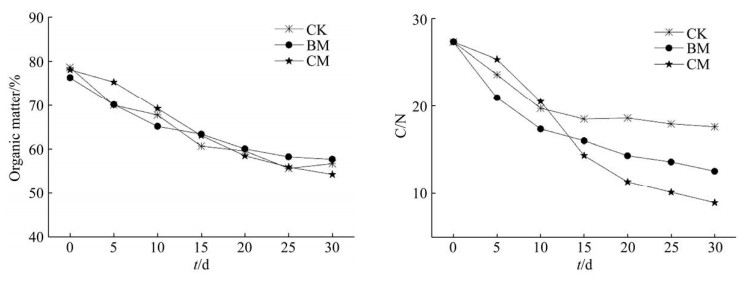
|
| 图 7 堆肥过程中有机质(左)与C/N (右)变化 Figure 7 Organic matter and C/N changes during composting. |
2.4.5 种子发芽率:
种子发芽率(GI)是堆肥腐熟度的重要指标,通常当GI达到60%标志堆肥基本腐熟,达到80%以上标志着堆肥产品完全腐熟。如图 8所示,外接菌剂的BM组、CM组在堆肥进行至第15天时已经实现了基本腐熟。堆肥结束时,CK组、BM组、CM组种子发芽率分别为67.68%、79.61%和87.67%,只有CM组实现了完全腐熟,表明CM组完全腐熟所需时间较少,且发芽率明显高于CK组和BM组,说明接种CM菌剂能缩短腐熟时间,提升堆肥品质。

|
| 图 8 堆肥过程中种子发芽率变化 Figure 8 Changes in seed germination rate during composting. |
3 结论
完善环境微生物资源库188株菌株产酶活信息,根据堆肥原料有机成分定向筛选出高酶活菌株8株,混合发酵组成高效堆肥菌剂CM。单因素探究试验表明CM最适发酵条件为接种7%的种子液于红糖培养基中,30 ℃下培养48 h,有效活菌数为9.59×107 CFU/mL,产酶活能力较单菌显著提升,蛋白酶、淀粉酶、纤维素酶、木质素酶、脂肪酶活性分别为181.76、52.92、1.57、12.81、9.94 U/mL,表明菌株间可能存在协同促进作用。
CM菌剂堆肥产品pH、含水率、有机质含量均满足有机肥标准。与商品菌剂BM相比堆肥效果更好,可使堆体高温期延长4–7 d、含水率降低3.8%,可加快易腐垃圾中有机质降解,降解率提升6.2%,并具有更强的固氮能力,缩短腐熟时间,提升堆肥产品品质。
研究结果表明,基于数量丰富的环境微生物资源库及完善的功能信息,针对降解成分定向精准挑选功能菌株,是一种快速高效的复合菌剂构建方法。此方法可以推广至其他领域,如污染物降解复合菌系的构建、水环境修复菌剂的构建等。
| [1] | 李佩琳. 乡村振兴战略背景下农村生活垃圾问题调查研究. 山东农业大学学位论文, 2020. |
| [2] |
Yan J, Wang ZW, Zhou YJ, Zhang C. Generation status and treatment mode of rural domestic refuse in China. China Environmental Protection Industry, 2014(12): 49-53.
(in Chinese) 闫骏, 王则武, 周雨珺, 张纯. 我国农村生活垃圾的产生现状及处理模式. 中国环保产业, 2014(12): 49-53. DOI:10.3969/j.issn.1006-5377.2014.12.011 |
| [3] |
Cao HQ. The treatment status and problem analysis of rural household garbage. Shanxi Chemical Industry, 2020, 40(3): 209-210.
(in Chinese) 曹海清. 农村生活垃圾处理现状及问题分析. 山西化工, 2020, 40(3): 209-210. |
| [4] |
An XX, Shao JY, Zheng XJ, Guo WP, Wang RP, Qi HS. Discussion on status, problems and countermeasures of biological treatment of perishable waste in China. China Resources Comprehensive Utilization, 2020, 38(2): 99-104, 137.
(in Chinese) 安晓霞, 邵建越, 郑学娟, 郭文鹏, 王润沛, 戚贺松. 浅谈国内易腐垃圾生物处置现状、问题与对策. 中国资源综合利用, 2020, 38(2): 99-104, 137. DOI:10.3969/j.issn.1008-9500.2020.02.029 |
| [5] | Liang C, Das KC, Mcclendon RW. The influence of temperature and moisture contents regimes on the aerobic microbial activity of a biosolids composting blend. Bioresource Technol, 2003, 86(2): 131-137. DOI:10.1016/S0960-8524(02)00153-0 |
| [6] | Rastogi M, Nandal M, Nain L. Seasonal variation induced stability of municipal solid waste compost: an enzyme kinetics study. SN Applied Sciences, 2019, 1(8): 1-16. |
| [7] |
Li HT, Wang H, Zang XY, Liu MT. Correlation study on cellulose activities and ligocellulose degradation during composting. Journal of Northeast Agricultural University, 2016, 47(6): 33-40.
(in Chinese) 李洪涛, 王涵, 臧翔云, 刘美庭. 堆肥过程中纤维素酶活与纤维素降解相关研究. 东北农业大学学报, 2016, 47(6): 33-40. |
| [8] |
Liu Y, Xu XH, Xu J, Sun Y. Effects of adding functional inoculum on lignocellulose degradation in composting. Soils and Fertilizers Sciences in China, 2014(4): 81-86.
(in Chinese) 刘月, 许修宏, 徐杰, 孙瑜. 功能菌剂对堆肥中木质纤维素降解的影响. 中国土壤与肥料, 2014(4): 81-86. |
| [9] |
Tang H, Zhen L, Lei L, Wang MJ, Li YQ, Luo CB. Genome sequencing and bioinformatics analysis of cellulolytic fungus Aspergillus fumigatus HZ1. Acta Microbiologica Sinica, 2021, 61(8): 1-18.
(in Chinese) 唐昊, 郑莉, 雷露, 王明珺, 李沅秋, 罗朝兵. 纤维素降解菌烟曲霉HZ1的基因组测序及生物信息学分析. 微生物学报, 2021, 61(8): 1-18. |
| [10] | Vargas-García MC, Suárez-Estrella F, López MJ, Moreno J. Effect of inoculation in composting processes: modifications in lignocellulosic fraction. Waste Management: New York, NY, 2007, 27(9): 1099-1107. DOI:10.1016/j.wasman.2006.06.013 |
| [11] |
Zhou Y, Zhu NW, Liu BW, Zhang TP. Effect analysis of compound microbial agents and enhancement on kitchen waste aerobic composting. Chinese Journal of Environmental Engineering, 2018, 12(1): 294-303.
(in Chinese) 周营, 朱能武, 刘博文, 张太平. 微生物菌剂复配及强化厨余垃圾好氧堆肥效果分析. 环境工程学报, 2018, 12(1): 294-303. |
| [12] | Pramanik P, Ghosh GK, Ghosal PK, Banik P. Changes in organic-C, N, P and K and enzyme activities in vermicompost of biodegradable organic wastes under liming and microbial inoculants. Bioresource Technology, 2007, 98(13): 2485-2494. DOI:10.1016/j.biortech.2006.09.017 |
| [13] | Jurado M, Suarez-EstrellaF, Lopes M, Vargas-García MC, López-González JA, Moreno J. Enhanced turnover of organic matter fractions by microbial stimulation during lignocellulosic waste composting. Bioresource Technol, 2015(186): 15-24. |
| [14] | Nair J, Okamitsu K. Microbial inoculants for small scale composting of putrescible kitchen wastes. Waste Management: New York, N Y, 2010, 30(6): 977-982. DOI:10.1016/j.wasman.2010.02.016 |
| [15] | Pushpa TB, Sekaran V, Basha SS, Jegan J. Investigation on Preparation, Characterization and Application of Effective Microorganisms (EM) Based Composts-An Ecofriendly Solution. Nature Environment and Pollution Technology, 2016, 15(1): 153. |
| [16] |
Yue D, Wang L, Qiao LJ, Li DH, Zan LF. Screening of high-efficiency cellulose degradation strains and application effect of its compound microbial agents in organic compost. Jiangsu Agricultural Sciences, 2018, 46(17): 273-276.
(in Chinese) 岳丹, 王磊, 乔莉娟, 李丹花, 昝立峰. 高效纤维素降解菌株筛选及其复合微生物菌剂在有机堆肥中的应用效果. 江苏农业科学, 2018, 46(17): 273-276. |
| [17] | Fan YV, Lee CT, Klemeš JJ, Chua LS, Sarmidi MR, Leow CW. Evaluation of Effective Microorganisms on home scale organic waste composting. Journal of Environmental Management, 2018, 216: 41-48. DOI:10.1016/j.jenvman.2017.04.019 |
| [18] |
Yang YH, Wang BC, Shi LC, Wang QH. Development of researching the synthetical application of compound microorganisms. Journal of Chongqing University: Natural Science Edition, 2003, 26(6): 81-85.
(in Chinese) 杨艳红, 王伯初, 时兰春, 王庆红. 复合微生物制剂的综合利用研究进展. 重庆大学学报: 自然科学版, 2003, 26(6): 81-85. |
| [19] |
Liu XH, Wang L. Optimization of medium of mixed culture solid-state fermentation. Journal of Shangqiu Teachers College, 2009, 25(6): 99-102.
(in Chinese) 刘秀花, 王莉. 混菌固体发酵培养基优化研究. 商丘师范学院学报, 2009, 25(6): 99-102. DOI:10.3969/j.issn.1672-3600.2009.06.027 |
| [20] |
Xu CB, Meng XL, Ma XP, Fu BR, Hui XJ. The study on characteristics of photosynthetic bacteria and application of various industries. Xiandai Nongye Keji, 2010(9): 11-12.
(in Chinese) 徐成斌, 孟雪莲, 马溪平, 付保荣, 惠秀娟. 光合细菌的特性及其在产业中的应用. 现代农业科技, 2010(9): 11-12. DOI:10.3969/j.issn.1007-5739.2010.09.001 |
| [21] | 何若天. 畜禽养殖中如何利用光合细菌. 科学种养, 2006(11): 41-42. |
| [22] |
Xuan JC, Liao L, Long H, He XM. Isolation and identification of Bacillus cereus producing cellulase and enzymatic properties analysis. Journal of Southern Agriculture, 2014, 45(6): 984-988.
(in Chinese) 禤金彩, 廖龙, 龙寒, 何秀苗. 一株产纤维素酶蜡样芽孢杆菌的分离鉴定及酶学性质初步研究. 南方农业学报, 2014, 45(6): 984-988. DOI:10.3969/j:issn.2095-1191.2014.6.984 |
| [23] |
Ye M, Ye CJ, Hu SM, Liu HD, Jia GL, Wang FM. Reseach on induced breeding and production condition of cellulose-producing probiotics. Journal of Hefei University of Technology: Natural Science, 2009, 32(11): 1730-1734.
(in Chinese) 叶明, 叶崇军, 胡士明, 刘惠东, 贾光蕾, 王凤美. 纤维素酶益生菌的选育及产酶条件. 合肥工业大学学报: 自然科学版, 2009, 32(11): 1730-1734. DOI:10.3969/j.issn.1003-5060.2009.11.025 |
| [24] | Yang Q, Yang M, Hei L, Zheng S. Using ammonium-tolerant yeast isolates: Candida halophila and Rhodotorula glutinis to treat high strength fermentative wastewater. Environmental Technology, 2003, 24(3): 383-390. DOI:10.1080/09593330309385571 |
| [25] | Egli T. On multiple-nutrient-limited growth of microorganisms, with special reference to dual limitation by carbon and nitrogen substrates. Antonie Van Leeuwenhoek, 1991, 60(3/4): 225-234. |
| [26] | Sala FJ, Burgos J, Condón S, Lopez P, Raso J. Effect of heat and ultrasound on microorganisms and enzymes. New Methods of Food Preservation, 1995: 176-204. DOI:10.1007/978-1-4615-2105-1_9 |
| [27] | Salehizadeh H, Yan N. Recent advances in extracellular biopolymer flocculants. Biotechnology Advances, 2014, 32(8): 1506-1522. DOI:10.1016/j.biotechadv.2014.10.004 |
| [28] |
Li HL, Li LM, Qian K, Xu FZ. Isolation and identification of thermophilic bacteria for efficient dead-pig composting. Acta Microbiologica Sinica, 2015, 55(9): 1117-1125.
(in Chinese) 李海龙, 李吕木, 钱坤, 许发芝. 病死猪堆肥高温降解菌的筛选、鉴定及堆肥效果. 微生物学报, 2015, 55(9): 1117-1125. |
| [29] | Bernal MP, Paredes C, Sanchez-Monedero MA, Cegarra J. Maturity and stability parameters of composts prepared with a wide range of organic wastes. Bioresource Technol, 1998, 63(1): 91-99. DOI:10.1016/S0960-8524(97)00084-9 |
| [30] |
Zhang CM, Jia N, Hu D, Peng JL, Wang ZW. Fermentation effects of chicken manure inoculating with compound inoculants of low temperature character. Chinese Journal of Environmental Engineering, 2016, 10(10): 5881-5885.
(in Chinese) 张翠绵, 贾楠, 胡栋, 彭杰丽, 王占武. 低温型复合发酵菌剂接种鸡粪堆肥的效应. 环境工程学报, 2016, 10(10): 5881-5885. DOI:10.12030/j.cjee.201602071 |
| [31] | Raut MP, William SPMP, Bhattacharyya JK, Chakrabarti T, Devotta S. Microbial dynamics and enzyme activities during rapid composting of municipal solid waste-A compost maturity analysis perspective. Bioresource Technol, 2008, 99(14): 6512-6519. DOI:10.1016/j.biortech.2007.11.030 |
| [32] |
Sun G, Pei ZP, Tu YC, Kong J, Zhang X. Application of complex microbial agents on organic composting process. Northern Horticulture, 2015(15): 166-170.
(in Chinese) 孙干, 裴宗平, 涂永成, 孔静, 张鑫. 复合微生物菌剂在有机堆肥中的应用研究. 北方园艺, 2015(15): 166-170. |
 2021, Vol. 61
2021, Vol. 61




