
中国科学院微生物研究所,中国微生物学会,中国菌物学会
文章信息
- 刘佳, 宋伟, 郭亮, 陈修来, 高聪, 刘立明. 2021
- Jia Liu, Wei Song, Liang Guo, Xiulai Chen, Cong Gao, Liming Liu. 2021
- 多酶组合催化制备L-高苯丙氨酸
- A multi-enzyme cascade reaction for the production of L-homophenylalanine
- 微生物学报, 61(9): 2829-2842
- Acta Microbiologica Sinica, 61(9): 2829-2842
-
文章历史
- 收稿日期:2020-11-12
- 修回日期:2021-02-09
- 网络出版日期:2021-06-11
2. 江南大学药学院, 江苏 无锡 214122
2. School of Pharmaceutical Science, Jiangnan University, Wuxi 214122, Jiangsu Province, China
L-高苯丙氨酸(L-homophenylalanine,L-HPA)是一种常用的非天然手性α-氨基酸,L-HPA及其酯是合成许多医药化学品的重要手性中间体[1-3]。例如,L-HPA是合成血管紧张转化酶抑制剂类药物的重要中间体[4]。血管紧张转化酶抑制剂是一类非常重要的心血管药物,可治疗高血压和充血性心力衰竭,最具代表性药物产品有贝那普利、螺普利、依那普利等[5-6]。此外,L-HPA也是合成β-内酰胺抗生素、乙酰胆碱酯酶抑制剂和中性肽链内切酶抑制剂的中间体。
鉴于L-HPA在医药领域的重要应用,研究人员对L-HPA的制备进行了广泛的研究[7-9]。目前L-HPA的制备方法主要有化学合成法和酶法。化学合成法是生产L-HPA的主要方法,但具有反应条件苛刻、耗资高、污染严重等缺点[10],生物酶法能够以温和且高效的方式生产L-HPA[11-13]。最初,Lo等[14-15]利用海因酶法,以消旋苯乙基海因为原料制备了L-HPA,但转化率仅能达到5%。后来研究人员开发了以转氨酶为催化剂制备L-HPA的方法,Chen等[16]以谷氨酸为氨基供体,利用蛋白质工程改造后的酪氨酸转氨酶催化2-氧-4-苯基丁酸(2-oxygen-4-phenylbutyric acid,OPBA)制备L-HPA,产量达到35.6 g/L,转化率可达95%,是目前酶法生产L-HPA的最高产量。李志强等[17]以L-谷氨酸为氨基供体,采用酪氨酸转氨酶转化OPBA生成L-HPA,产量达到8.45 g/L,转化率可达84.5%。目前转氨酶法生产L-HPA需要额外添加L-氨基酸作为氨基供体,且以昂贵的OPBA为底物,该工艺尚不具有经济可行性。利用氨基酸脱氢酶(amino acid dehydrogenase,AADH)催化手性酮还原胺化,以NH4+为氨基供体,手性氨基酸的生产效率高、对映选择性高,是酶法不对称合成手性氨基酸中最有工业前景的方法[18]。Li等通过底物分步进化策略改造Escherichia coli来源的NADPH依赖性谷氨酸脱氢酶(L-glutamate dehydrogenase,GluDH),以OPBA为底物制备L-HPA,得率仅55.8%[19]。苯丙氨酸脱氢酶(L-phenylalanine dehydrogenase,PheDH)的底物范围广、催化活性高,与甲酸脱氢酶(formate dehydrogenase,FDH)组成的辅酶再生系统可以催化OPBA还原胺化为L-HPA,通过分批补料加入底物和产物原位分离的工艺,体系中底物浓度达到510 mol/L,转化率达到92.5%,L-HPA生产强度达到81.4 g/(L·d)[20]。多酶级联与组合催化可以利用廉价的简单化合物合成昂贵的复杂化合物,同时省去了中间产物分离和纯化的过程,减轻不稳定和有毒的中间产物的积累,提高了生产效率和产量[21-23]。
本研究通过逆合成分析和酶元件库挖掘,将OPBA (C10)拆分为苯乙醛(C8)和甘氨酸(C2)两个简单的合成起始砌块,在苏氨酸醛缩酶(L-threonine aldolase,TA)的催化下缩合合成β位含羟基的高苯丙氨酸类似物,再通过苏氨酸脱氨酶(L-threonine deaminase,TD)脱去氨基和羟基生成OPBA,最后由PheDH催化生成L-HPA,同时FDH催化甲酸铵来实现辅酶NADPH的再生并作为氨基供体。运用多酶组合的方法构建并筛选L-HPA高产菌株,通过对转化体系和转化条件的优化,构建了一条合成非天然氨基酸L-HPA的新途径。
1 材料和方法 1.1 材料 1.1.1 菌株、质粒和引物:本研究所用到的所有菌株和质粒如表 1所示,E. coli JM109、E. coli BL21(DE3)、绿脓假单胞菌(Pseudomonas aeruginosa)、谷氨酸棒杆菌(Corynebacterium glutamicum)、栗褐芽孢杆菌(Bacillus badius)和博伊丁假丝酵母(Candida boidinii)由本实验室保存;质粒pET28a、pRSFDuet-1、pACYCDuet-1、pETDuet-1、pCDFDuet-1由本实验室保存。本研究所用到的引物如表 2所示,引物由苏州金唯智生物科技有限公司合成。
| Strains and plasmids | Description | Source |
| Strains | ||
| E. coli JM109 | Clone host | Our lab |
| E. coli BL21(DE3) | Expression host | Our lab |
| Pseudomonas aeruginosa | Wild type | Our lab |
| Corynebacterium glutamicum | Wild type | Our lab |
| Bacillus badius | Wild type | Our lab |
| Candida boidinii | Wild type | Our lab |
| BL21-PaTA | E. coli BL21(DE3) (pET28a-PaTA) | In this study |
| BL21-CgTD | E. coli BL21(DE3) (pET28a-CgTD) | In this study |
| BL21-BbPheDH | E. coli BL21(DE3) (pET28a-BbPheDH) | In this study |
| BL21-CbFDH | E. coli BL21(DE3) (pET28a-CbFDH) | In this study |
| BL21-C-M1-A-M2 | E. coli BL21(DE3) (C-M1, A-M2) | In this study |
| BL21-C-M1-R-M2 | E. coli BL21(DE3) (C-M1, R-M2) | In this study |
| BL21-C-M1-E-M2 | E. coli BL21(DE3) (C-M1, E-M2) | In this study |
| BL21-A-M1-C-M2 | E. coli BL21(DE3) (A-M1, C-M2) | In this study |
| BL21-A-M1-R-M2 | E. coli BL21(DE3) (A-M1, R-M2) | In this study |
| BL21-A-M1-E-M2 | E. coli BL21(DE3) (A-M1, E-M2) | In this study |
| BL21-R-M1-C-M2 | E. coli BL21(DE3) (R-M1, C-M2) | In this study |
| BL21-R-M1-A-M2 | E. coli BL21(DE3) (R-M1, A-M2) | In this study |
| BL21-R-M1-E-M2 | E. coli BL21(DE3) (R-M1, E-M2) | In this study |
| BL21-E-M1-C-M2 | E. coli BL21(DE3) (E-M1, C-M2) | In this study |
| BL21-E-M1-A-M2 | E. coli BL21(DE3) (E-M1, A-M2) | In this study |
| BL21-E-M1-R-M2 | E. coli BL21(DE3) (E-M1, R-M2) | In this study |
| Plasmids | ||
| pET28a | KanR, His tag, T7 promoter | Our lab |
| pRSFDuet-1 | KanR, His tag, T7 double promoter | Our lab |
| pACYCDuet-1 | CmR, His tag, T7 double promoter | Our lab |
| pCDFDuet-1 | StrR, His tag, T7 double promoter | Our lab |
| pETDuet-1 | AmpR, His tag, T7 double promoter | Our lab |
| pET28a-PaTA | pET28a harboring PaTA | In this study |
| pET28a-CgTD | pET28a harboring CgTD | In this study |
| pET28a-BbPheDH | pET28a harboring BbPheDH | In this study |
| pET28a-CbFDH | pET28a harboring CbFDH | In this study |
| R-M2 | pRSFDuet-1 harboring BbPheDH and CbFDH | In this study |
| A-M2 | pACYCDuet-1 harboring BbPheDH and CbFDH | In this study |
| E-M2 | pETDuet-1 harboring BbPheDH and CbFDH | In this study |
| C-M2 | pCDFDuet-1 harboring BbPheDH and CbFDH | In this study |
| R-M1 | pRSFDuet-1 harboring PaTA and CgTD | In this study |
| A-M1 | pACYCDuet-1 harboring PaTA and CgTD | In this study |
| E-M1 | pETDuet-1 harboring PaTA and CgTD | In this study |
| C-M1 | pCDFDuet-1 harboring PaTA and CgTD | In this study |
| Primer names | Primer sequences (5′→3′) |
| PaTA-F | CGAGCTCGCCTGTCATCGACCTG |
| PaTA-R | CCCAAGCTTTTATGAGCGACGAAAGG |
| CgTD-F | CCCAAGCTTTAAGGAGATATATAATGAGTGAAACATACGTGTCTG |
| CgTD-R | GGGGTACCTTAGGTCAAGTATTCGTACTCAG |
| BbPheDH-F | CGGGATCCGAGCTTAGTAGAAAAAACATC |
| BbPheDH-R | CGAGCTCTTAGTTGCGAATATCCCATTTTG |
| CbFDH-F | CGAGCTCTAAGGAGATATATAATGAAGATCGTTTTAGTCTTATATG |
| CbFDH-R | GGGGTACCTTATTTCTTATCGTGTTTAC |
1.1.2 培养基:
LB培养基(g/L):酵母提取物5,蛋白胨10,NaCl 10,pH自然,固体培养基添加2%的琼脂,用于重组质粒和工程菌的构建;TB培养基(g/L):甘油4,胰蛋白胨12,酵母粉24,KH2PO4 2.31,K2HPO4 12.54,pH自然,用于基因工程菌株发酵培养的表达。
1.2 培养方法培养基装液量均为20%,用250 mL摇瓶进行培养,培养温度37 ℃,诱导温度25 ℃,转速为200 r/min,培养时间为10 h,发酵结束后,4 ℃条件下8000 r/min离心10 min收集菌体。收集的菌体用于蛋白纯化、SDS-PAGE分析以及酶活检测。在培养含各种质粒的工程菌株时,需在灭菌后的培养基中添加终浓度为50 mg/L的相应抗生素(过滤除菌)。
1.3 分子操作采用酶切连接的方式构建所有载体,微生物基因组提取、质粒提取、PCR扩增体系和程序、酶切、DNA片段胶回收、连接、E. coli BL21(DE3)感受态细胞的制备、质粒转化等操作按照相应试剂盒手册的指导进行。多个酶的共表达是通过选择4种拷贝数不同的载体(表 1)来进行表达水平的优化,4种载体的抗性不同但具有相同的多克隆酶切位点,且彼此兼容,单酶和共表达菌株构建过程中均使用质粒携带的T7启动子,目标蛋白均添加His标签。
1.4 转化方法水相包括:在总体积为1 mL的0.1 mol/L磷酸钾缓冲液(pH 8.0)中含有终浓度为20 g/L湿菌体、400 mmol/L甘氨酸、200 mmol/L甲酸铵、50 μmol/L磷酸吡哆醛(PLP)、0.5 mmol/L NAD+;有机相为:0.5 mL正十六烷为溶剂的50 mmol/L苯乙醛溶液。转化温度30 ℃,振荡转化200 r/min,转化时间24–48 h。
转化体系中优化水系的pH:当pH为6.5、7.0、7.5、8.0时,使用0.1 mol/L磷酸钾缓冲液;当pH为8.5、9.0时,使用0.1 mol/L Tris-盐酸缓冲液;当pH为9.0、9.5和10.0时,使用0.1 mol/L碳酸钠-碳酸氢钠缓冲液。
1.5 重组蛋白的分离纯化单酶表达菌株均使用pET28a为带有组氨酸标签的表达质粒,目标蛋白酶可以利用GE重力型镍纯化柱纯化目标蛋白。每克湿细胞菌体用10 mL Buffer A进行重悬,利用超声波细胞破碎仪对细胞进行破碎,超声破碎细胞,破碎功率400 W,工作3 s,停歇7 s,共99个循环。4 ℃条件下12000 r/min离心30 min去除细胞碎片,上清液用0.22 μm滤膜过滤然后用结合液平衡好的Ni柱纯化。先将滤液上载至Ni柱,然后用5倍柱体积Buffer A冲洗镍柱,以去除不能结合的杂蛋白,然后使用0–100%的Buffer B梯度洗脱20个柱体积,收集洗脱液进行SDS-PAGE分析,将含有目的蛋白且条带单一的洗脱样品合并,然后超滤浓缩。最后,将浓缩后的样品上载到GE公司的5 mL脱盐柱上,然后用Buffer C洗脱,收集洗脱样品并超滤浓缩。样品用于酶活测定或者进一步凝胶过滤层析。纯化过程中使用的Buffer按照产品说明书配制。
1.6 重组蛋白的酶活测定苏氨酸醛缩酶(TA)酶活测定方法:反应体系:0.1 mol/L磷酸钠缓冲液(pH 8.0),5 mmol/L苏氨酸,50 μmol/L PLP,200 mmol/L NADH,26 U/mL酵母醇脱氢酶和适量酶液。TA酶活力定义为:在50 ℃条件下,每分钟生成1 mmol/L NAD+所需的酶量为一个单位(U)。NADH在340 nm的摩尔消光系数ε=6220 L/(mol·cm)。
苏氨酸脱氨酶(TD)酶活测定方法:反应体系:0.1 mol/L磷酸钾缓冲液(pH 8.0),1 mmol/L PLP,40 mmol/L苏氨酸和2 μg的酶。加入苏氨酸反应开始,于22 ℃水浴保温15 min,加入1 mL终止液(0.9%醋酸钠和1%氨基脲盐酸盐)。于254 nm (ε=0.52 mmol/cm)测定体系吸光值来计算产物2-酮丁酸的浓度。TD酶活力定义为:在22 ℃条件下,每分钟生成1 mmol/L 2-酮丁酸所需的酶量为一个单位(U)。
苯丙氨酸脱氢酶(PheDH)酶活测定方法:反应液组成为:0.1 mol/L磷酸钾缓冲液(pH 9.0),4 mmol/L苯丙氨酸,0.1 mmol/L NADH。反应混合于30 ℃保温,加入一定单位的PheDH酶液后开始计时,每隔60 s检测NADH在340 nm的减少量。PheDH活力定义为:在pH 9.0、30 ℃条件下,每分钟氧化1 mmol/L NADH所需的酶量为一个单位(U)。
甲酸脱氢酶(FDH)酶活测定方法:反应液组成为:0.1 mol/L磷酸钾缓冲液(pH 7.5),162 mmol/L甲酸钠,1.62 mmol/L NAD+。反应液混合均匀,于30 ℃保温5 min,加入一定单位的FDH酶液后开始计时,每隔1 min检测NADH在340 nm的增加量。FDH活力定义为:在pH 7.5、30 ℃条件下,每分钟还原1 mmol/L NAD+所需的酶量为一个单位(U)。
1.7 L-HPA检测方法转化液8000 r/min离心5 min后分层,取水相中溶液稀释至合适浓度,使用高效液相色谱仪检测L-HPA产量。流动相成分:A相:10 mmol/L KH2PO4缓冲液pH 5.3;B相:按体积比5:3:1混合色谱纯乙腈、甲醇及A相,醋酸调pH至5.3,流动相经0.22 μm滤膜过滤,超声脱气;进样程序:8 μL样品混合4 μL邻苯二甲醛(OPA)进样,在线衍生,梯度洗脱;色谱柱:Agilent ZORBAX SB-Aq,250 mm×4.6 mm,5 μm;检测器:荧光检测器,激发波长330 nm,发射波长465 nm。
2 结果和分析 2.1 L-高苯丙氨酸多酶组合合成路径的设计与构建多酶反应制备L-HPA的路径包含4个酶促反应:第一步是利用TA催化甘氨酸与苯乙醛缩合生成β位含羟基的高苯丙氨酸(第1个酶促反应);再经TD脱去氨基和羟基生成OPBA (第2个酶促反应);第二步是PheDH还原胺化OPBA为L-HPA (第3个酶促反应),同时偶联FDH催化甲酸铵来实现辅酶NADPH的再生(第4个酶促反应),甲酸铵的NH4+是氨基供体,HCOO–用于辅酶再生,原子经济性高(图 1)。
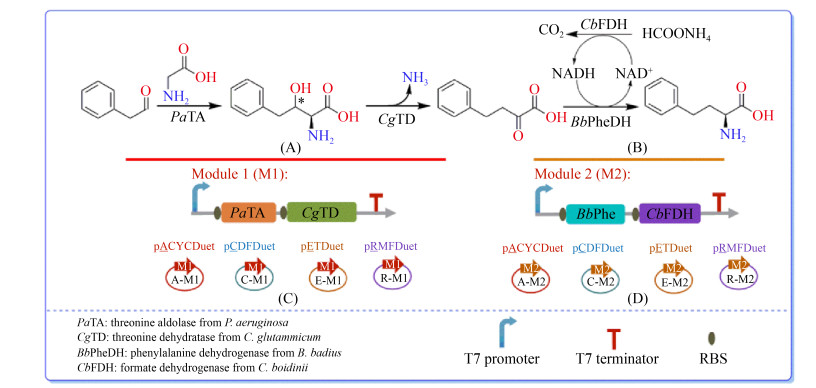
|
| 图 1 模块化组合催化合成L-HPA的反应机制 Figure 1 Reaction scheme for conversion of L-HPA by modular cascade catalysis. A: the basal module catalyzed by PaTA and CgTD; B the expand module catalyzed by BbPheDH and CbFDH; C: plasmids construction of the basal module; D: plasmids construction of the expand module. |
TA底物谱已经从天然底物甘氨酸和乙醛,扩展到一系列的芳香族和脂肪族醛类底物。根据文献报道,P. aeruginosa来源的TA (PaTA)对底物甘氨酸与苯甲醛具有较高的活性[24-25],利用PaTA催化甘氨酸与苯乙醛也可以合成β位含羟基的高苯丙氨酸,因此选择PaTA作为第一步反应的酶。自然界中有两种苏氨酸脱氨酶,包括生物合成型苏氨酸脱氨酶(TD)和生物降解型苏氨酸脱氨酶(TdcB),研究室前期工作中通过数据库筛选8个TD和4个TdcB,以非天然底物苯丝氨酸(β位含羟基的高苯丙氨酸的结构类似物)为筛子,发现C. glutamicum来源的TD (CgTD)对苯丝氨酸具有较高活性,达到4.8 U/mg蛋白[12-13],CgTD对天然底物苏氨酸的相对酶活为30.3 U/mg (表 3),因此选择CgTD作为第二步反应的酶。高选择性AADH介导的不对称还原胺化可以将α-酮酸转化为α-氨基酸,因为AADH参与L-氨基酸的体内代谢,所以绝大多数的AADH只能催化α-酮酸生成相应的L-氨基酸。通过文献调研和数据库挖掘获得了7个L-AADH,包括GluDH[19]、PheDH[20]和亮氨酸脱氢酶(LeuDH),以苯丙酮酸(OPBA的结构类似物)为筛子进行筛选,发现来源于B. badius的BbPheDH对苯丙酮酸的比活力最高,达到了47.3 U/mg蛋白[12-13],BbPheDH对天然底物苯丙氨酸的相对酶活为116.5 U/mg (表 3),因此选择BbPheDH作为第二步反应的酶。由于C. boidinii来源的FDH (CbFDH)具有广泛的工业应用潜力[26-27],因此选择CbFDH作为实验用酶,通过催化甲酸铵来实现辅酶NADH的再生。
| Enzyme | Protein MW/kDa | Specific enzyme activity/(U/mg) | Km/(mmol/L) | Vmax/[mmol/(min·mg)] |
| PaTA | 38.21 | 31.8 | 14.40 | 158.7 |
| CgTD | 46.57 | 30.3 | 27.60 | 30.9 |
| BbPheDH | 41.35 | 116.5 | 0.67 | 222.2 |
| CbFDH | 40.31 | 31.2 | 0.50 | 54.5 |
将构建完成的4株工程菌BL21-PaTA、BL21-CgTD、BL21-BbPheDH和BL21-CbFDH进行诱导表达,取破碎液上清进行SDS-PAGE分析,4株工程菌都出现目标条带(图 2),表明PaTA、CgTD、BbPheDH和CbFDH四个酶在工程菌中都是可溶性表达,4株单酶表达工程菌构建成功。利用重力型镍纯化柱纯化目标蛋白,测定目标酶的酶学性质、最适温度与pH,发现PaTA、CgTD、BbPheDH和CbFDH的最适温度分别为30、30、35、35 ℃,最适pH分别为8.0、7.0、9.5和7.5 (表 3),在pH为8.0、温度为30 ℃时4种酶均能保持85%以上的活性(图 3),因此选择催化体系中pH为8.0,温度为30 ℃。
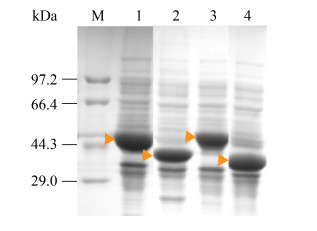
|
| 图 2 基因工程菌株蛋白质表达验证 Figure 2 SDS-PAGE analysis of recombinant strains. M: marker; lane 1: BL21-BbPheDH; lane 2: BL21-CbFDH; lane 3: BL21-CgTD; lane 4: BL21-PaTA. |
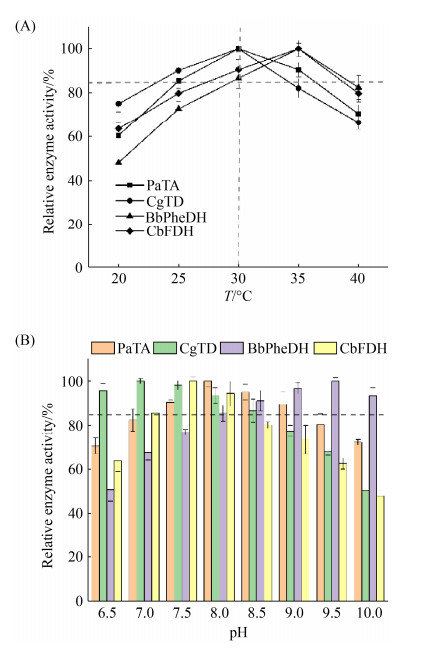
|
| 图 3 不同温度(A)和pH (B)的相对酶活曲线 Figure 3 Effects of different temperatures (A) and pH (B) on PaTA, CgTD, BbPheDH and CbFDH. |
2.2 L-高苯丙氨酸多酶组合合成路径的组装
首先,将构建好的工程菌BL21-PaTA、BL21-CgTD、BL21-BbPheDH和BL21-CbFDH进行培养后收集菌体。然后,用湿菌体作为催化剂进行转化反应,转化24 h后取水相检测,L-HPA的浓度为50.3 mg/L,苯乙醛的摩尔转化率仅为1.12%。
产物浓度低可能是由于底物与中间产物在不同细胞之间的传递效率降低了转化率。使用多细胞体系时,因为组合反应具有顺序性,底物和中间产物需要跨膜传输进入正确的细胞,才能保证反应的顺利进行。所以反应体系中细胞种类越多,底物和中间产物进入正确细胞的概率就越低,反应效率和转化率也就越低。因此,将多酶共表达一个细胞中可能会提高底物和中间产物的传输效率,从而提高L-HPA的产量。
2.3 L-高苯丙氨酸多酶组合合成路径的优化 2.3.1 模块化重组优化转化体系:采用模块式催化(图 1)的方法组装L-HPA的多酶合成途径,将L-HPA的多酶合成途径拆分成不同的模块。根据氨基基团的引入和重构,我们将L-HPA多酶催化路径分为2个单元:基础单元M1 (图 1-A、1-C)和扩增单元M2 (图 1-B、1-D)。M1模块利用PaTA催化的醛缩反应(引入α-NH2和β-OH)和CgTD催化的脱氨反应(删除α-NH2和β-OH),将非手性苯乙醛和甘氨酸组装成潜手性OPBA;M2模块利用BbPheDH重新引入α-NH2,将OPBA转化为手性的L-HPA;此外,M2模块还包括CbFDH用于实现辅酶NADH的再生。我们将M1和M2模块在同一个细胞中组装,用于催化甘氨酸一锅转化生成L-HPA。
2.3.2 不同质粒拷贝数对L-HPA的影响:为了优化L-HPA合成路径酶的表达,我们将M1和M2模块分别引入到不同质粒拷贝数的载体上,对M1和M2模块的表达水平进行组合,以获得最优的工程菌株。
为此,我们首先选取了拷贝数为10 (pACYCDuet-1)、20 (pETDuet-1)、40 (pCDFDuet-1)和100 (pRSFDuet-1)的载体。然后,利用基因串联表达将M1和M2模块分别克隆到上述4个载体上,获得重组载体A-M1、E-M1、C-M1、R-M1、A-M2、E-M2、C-M2和R-M2。将上述具有不同拷贝数的M1和M2模块重组质粒,在宿主E. coli BL21中进行组合表达,获得12株工程菌:BL21-E-M1-R-M2、BL21-E-M1-A-M2、BL21-E-M1-C-M2、BL21-R-M1-E-M2、BL21-R- M1-A-M2、BL21-R-M1-C-M2、BL21-A-M1-E-M2、BL21-A-M1-R-M2、BL21-A-M1-C-M2、BL21-C- M1-E-M2、BL21-C-M1-R-M2和BL21-C-M1-A-M2。利用SDS-PAGE对12株共表达菌株进行蛋白可溶性表达检测(图 4)。虽然利用不同拷贝数载体进行组合表达,但是发现质粒的拷贝数增加与蛋白表达量增加并没有直接正相关。如菌株BL21-A-M1-C-M2 (图 4 Lane 15),M1模块PaTA和CgTD连接的是拷贝数为10的pACYCDuet-1载体,M2模块BbPheDH和CbFDH连接的是拷贝数为40的pCDFDuet-1载体,然而M1模块和M2模块的蛋白条带的深浅粗细没有显著差异,这可能与细胞内部表达蛋白的经济性、不同质粒的性质、目标蛋白的大小、诱导环境等有关。然而12株工程菌经过诱导后都出现4条粗细深浅均有不同的蛋白条带,表明通过不同质粒之间的相互组合以及细胞内部环境的表达调节,实现了4种目标酶的差异性表达。
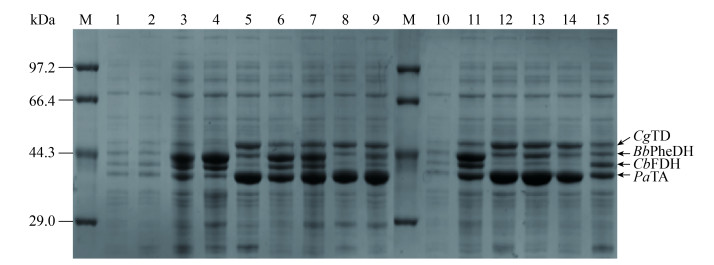
|
| 图 4 多酶共表达菌株中蛋白质表达验证电泳图 Figure 4 SDS-PAGE analysis of multienzyme coexpressed in E. coli BL21. M: marker; lane 1: control cell; lane 2: control cell; lane 3: BL21-A-M1-E-M2; lane 4: BL21-A-M1-R-M2; lane 5: BL21-C-M1-A-M2; lane 6: BL21-C-M1-E-M2; lane 7: BL21-C-M1-R-M2; lane 8: BL21-E-M1-A-M2; lane 9: BL21-E-M1-C-M2; lane 10: control cell; lane 11: BL21-E-M1-R-M2; lane 12: BL21-R-M1-A-M2; lane 13: BL21-R-M1-C-M2; lane 14: BL21-R-M1-E-M2; lane 15: BL21-A-M1-C-M2. |
2.3.3 筛选最优的工程菌:
将构建好的12株工程菌进行发酵培养,经诱导后收集菌体,进行转化实验。转化结果如图 5所示,因各模块酶的表达水平不同,12株工程菌生产L-HPA的能力也有所差异。其中BL21-C-M1-R-M2 (CR)的L-HPA产量最高,达到208.6 mg/L,此时苯乙醛的摩尔转化率为4.66%,表达M1模块的质粒拷贝数为20,表达M2模块的质粒拷贝数为100;BL21-C-M1-E-M2 (CE)、BL21-E-M1-C-M2 (EC)、BL21-E-M1-R-M2 (ER)、BL21-E-M1-C-M2 (EC) 4株菌的L-HPA产量处于较高水平,产量介于170–200 mg/L之间;BL21-R-M1-E-M2 (RE)、BL21-E-M1-A-M2 (EA)、BL21-C-M1-A-M2 (CA)和BL21-A-M1-E-M2 (AE) 4株菌的产量处于中等水平,产量介于140–160 mg/L之间;BL21-A-M1- R-M2 (AR)、BL21-R-M1-A-M2 (RA)和BL21-A- M1-C-M2 (AC) 3株菌的产量较低,低于80 mg/L水平。因此,选取CR工程菌进行下一步实验。
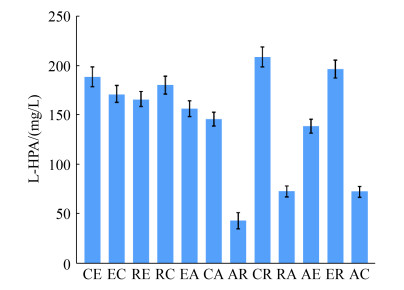
|
| 图 5 不同菌株生产L-HPA性能 Figure 5 L-HPA production performance of different strains. CE: BL21-C-M1-E-M2; EC: BL21-E-M1-C-M2; RE: BL21-R-M1-E-M2; RC: BL21-R-M1-C-M2; EA: BL21-E-M1-A-M2; CA: BL21-C-M1-A-M2; AR: BL21-A-M1-R-M2; CR: BL21-C-M1-R-M2; RA: BL21-R-M1-A-M2; AE: BL21-A-M1-E-M2; ER: BL21-E-M1-R-M2; AC: BL21-A-M1-C-M2. |
2.4 重组菌株生产L-HPA条件优化 2.4.1 甘氨酸的浓度对L-高苯丙氨酸产量的影响:
在TA介导的醛缩反应中,甘氨酸的浓度一般要求超过醛类底物的浓度。为了提高L-HPA的产量,固定苯乙醛底物的浓度为50 mmol/L,研究甘氨酸浓度对L-HPA产量的影响。由图 6-A可知,L-HPA浓度随着甘氨酸浓度的提升而增加。当甘氨酸的浓度为500 mmol/L时,L-HPA的产量最高,达到379.1 mg/L,苯乙醛的摩尔转化率为8.47%;当甘氨酸的浓度超过500 mmol/L时,可能对TA发生底物抑制作用造成酶活降低,L-HPA的产量明显下降。
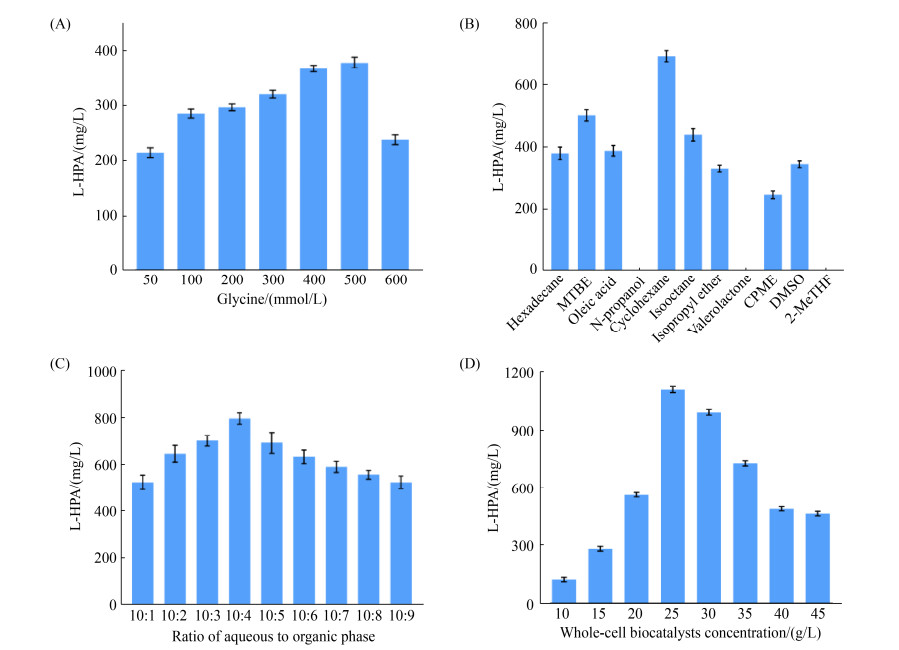
|
| 图 6 L-HPA转化条件优化 Figure 6 Optimization of L-HPA conversion process. A: effects of glycine concentration on L-HPA production; B: effects of organic solvents on L-HPA production; C: effects of two-phase ratios on L-HPA production; D: effects of two-phase ratios on L-HPA production. |
2.4.2 有机相的选择对转化率的影响:
以正十六烷为对照,水相/有机相的比例为2:1,分别研究了甲基叔丁基醚(MTBE)、油酸、正丙醇、环己烷、异辛烷、异丙醚、戊内酯、环戊甲醚(CPME)、二甲基亚砜(DMSO)和2-甲基四氢呋喃(2-MeTHF)对L-HPA产量的影响,结果见图 6-B。使用环己烷和MTBE作为有机相时,L-HPA的产量较对照组分别提高了82.5%和31.9%;使用异辛烷、DMSO和油酸为有机相时,产物的产量变化不大;使用异丙醚和CPME为有机相时,L-HPA产量均下降,分别下降了12.9%和35.6%;使用正丙醇、戊内酯和甲基四氢呋喃为有机相时,可能有机相对酶的毒性较大,均未检测到产物生成。因此选择环己烷为有机相,此时L-HPA的产量为692.1 mg/L,苯乙醛的摩尔转化率为15.4%。
2.4.3 两相比例对L-高苯丙氨酸产量的影响:在前面实验的基础上,对水相和环己烷的比例进行了优化。该实验的目的一方面是为了减少有机相的用量以降低成本,另一方面是为了提高L-HPA产量,结果见图 6-C。分别按照水相: 有机相为10:1、10:2、10:3、10:4、10:5、10:6、10:7、10:8和10:9的比例进行转化实验,当水相和有机相的比例为10:4时,L-HPA的产量最高达到796.6 mg/L,相比于水相: 有机相为10:5 (即2:1) L-HPA产量提高了15.1%。
2.4.4 湿菌体密度对L-高苯丙氨酸产量的影响:当湿菌体密度为10–25 g/L时,L-HPA的产量随着菌体量的增加而升高;当湿菌体密度为25 g/L时,L-HPA的产量达到最高为1105 mg/L,苯乙醛的摩尔转化率为30.8%;之后随着菌体量的增加,产物的浓度反而缓慢下降,可能是因为菌体密度太高,摇瓶振荡转化对细胞有机械损伤,会使得细胞破裂,并将细胞内含物释放到转化体系当中,反应体系粘度增加,影响底物和产物的传递(图 6-D)。因此,在1 L体系转化实验中使用25 g/L湿菌体。
2.5 L-高苯丙氨酸的实验室放大制备及产物鉴定在1 L的三角瓶中添加100 mL水相(包含湿菌体25 g/L,甘氨酸500 mmol/L,PLP 50 μmol/L,NAD+ 0.5 mmol/L,甲酸铵200 mmol/L)和40 mL环己烷有机相(溶解50 mmol/L苯乙醛)进行转化,检测转化过程中前体OPBA和L-HPA的浓度。转化过程曲线如图 7所示,L-高苯丙氨酸产量随着转化时间的增加而逐渐升高,在20 h时达到最大值1226.6 mg/L,苯乙醛摩尔转化率为34.2%,之后L-HPA产量不再增加。利用Dowex 50WX8阳离子交换树脂和制备型薄层层析色谱对转化液水相中L-HPA进行纯化[12],采用高分辨质谱法(HRMS spectrum)对产物进行鉴定(图 8),荷质比为178.08的吸收峰即为L-HPA,表明获得产品确实是L-HPA。
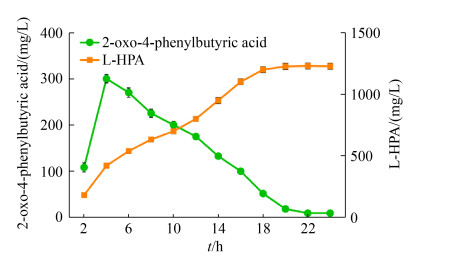
|
| 图 7 L-HPA转化过程曲线 Figure 7 Time course of L-HPA production. |
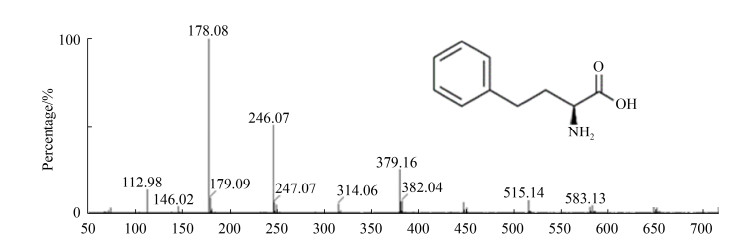
|
| 图 8 高分辨质谱检测L-HPA Figure 8 HRMS spectrum of L-HPA. |
3 讨论
本研究提供了一种以甘氨酸和苯乙醛为底物合成L-HPA的合成新途径。该组合反应是一种以模块组装方式运行的手性基团重置系统,它包括M1和M2模块,利用4种工程菌株进行转化,产量和转化率低。然后,在单一菌株共表达4种目标酶,利用不同表达水平的质粒对模块表达水平进行调节,显著提高了组合催化的效率。最后,通过对转化体系的优化,L-HPA的产量达到1226.6 mg/L,苯乙醛摩尔转化率为34.2%。转化体系中添加含有pET28a空质粒的工程菌株转化时对底物、中间产物OPBA和终产物L-HPA浓度进行检测,并未发现细胞利用底物生长的情况。E. coli对底物、中间产物和终产物都没有通透障碍,然而组合反应具有顺序性,底物、中间产物和NADPH需要跨膜传输进入正确的细胞,才能保证反应的顺利进行,多细胞催化导致产量较低。当利用4酶共表达工程菌株进行转化时,消除了跨细胞的中间产物及NADPH的输送障碍,所以产量得以获得较大提升。对比已有酶法生产L-HPA的报道,转化体系中只添加单一工程菌株CR,使用的底物甘氨酸、苯乙醛和甲酸铵廉价易得,无需添加昂贵的辅酶NADPH,然而L-HPA产量和生产强度与规模化工业应用还有差距。利用PheDH催化可以催化OPBA还原胺化为L-HPA,通过分批加入底物和产物原位分离的工艺,L-HPA生产强度最高达到81.4 g/(L·d)[20],而本研究中由于催化路径长,生产强度只有1.47 g/(L·d)。由于L-HPA催化是由4种酶组成,因此任意一个酶存在缺陷均会影响组合反应的催化效率。需要考虑的关键问题主要包括以下3点:(1) 反应协同性,将反应中多个反应组装,如果各个元件酶的比例不当,会影响整体反应的效率,造成中间产物积累,本研究中对M1和M2单元的表达水平进行组合优化,关键中间产物OPBA并没有过量积累,说明反应的协同性较好;(2) 底物适配性,在非天然组合路径构建过程中,野生型的酶对非天然底物催化效率低甚至不能催化,如CgTD的天然产物为苏氨酸,侧链较短,对侧链较大的底物催化活性较低,制约着L-HPA产量的提高,因此可以通过蛋白质工程策略改造CgTD,拓宽底物谱,进一步提高L-HPA的产量;(3) 环境兼容性,将多个催化反应组装起来,可能会面临不兼容的问题,4种酶的最适pH、最适温度不匹配,不同酶对有机溶剂的耐受性不同,在反应过程中不可避免“牺牲”了部分酶活,尤其是扩增单元BbPheDH和CbFDH的酶活,可以采用区域化的策略,将某一种或多种酶用特殊材料固定化,使酶蛋白与高密度聚电解质结合而改变固定化材料表面局部pH环境[28-29],使这种微环境接近酶的最适pH,进而可改善级联反应的兼容性。
| [1] | Ahmad AL, Oh PC, Abd Shukor SR. Sustainable biocatalytic synthesis of L-homophenylalanine as pharmaceutical drug precursor. Biotechnology Advances, 2009, 27(3): 286-296. DOI:10.1016/j.biotechadv.2009.01.003 |
| [2] | Cho BK, Seo JH, Kang TW, Kim BG. Asymmetric synthesis of L-homophenylalanine by equilibrium-shift using recombinant aromatic L-amino acid transaminase. Biotechnology and Bioengineering, 2003, 83(2): 226-234. DOI:10.1002/bit.10661 |
| [3] |
Ding R, Ma R, Ao YH. An analysis on L-phenylalanine industry at home. Fine and Specialty Chemicals, 2011, 19(7): 1-3.
(in Chinese) 丁锐, 马蓉, 敖永华. 国内L-苯丙氨酸产业浅析. 精细与专用化学品, 2011, 19(7): 1-3. DOI:10.3969/j.issn.1008-1100.2011.07.001 |
| [4] | Wyvratt MJ. Evolution of angiotensin-converting enzyme inhibitors. Clinical Physiology and Biochemistry, 1988, 6(3/4): 217-229. |
| [5] | Ahmad AL, Oh PC, Abd Shukor SR. Sustainable biocatalytic synthesis of L-homophenylalanine as pharmaceutical drug precursor. Biotechnology Advances, 2009, 27(3): 286-296. DOI:10.1016/j.biotechadv.2009.01.003 |
| [6] | Zamai L. The Yin and Yang of ACE/ACE2 pathways: the rationale for the use of renin-angiotensin system inhibitors in COVID-19 patients. Cells, 2020, 9(7): 1704. DOI:10.3390/cells9071704 |
| [7] | Heuson E, Petit JL, Debard A, Job A, Charmantray F, de Berardinis V, Gefflaut T. Continuous colorimetric screening assays for the detection of specific l-or d-α-amino acid transaminases in enzyme libraries. Applied Microbiology and Biotechnology, 2016, 100(1): 397-408. DOI:10.1007/s00253-015-6988-0 |
| [8] | Luo CH, Lin QM, Lin SY, Meng C, Wang H. Cosynthesis of l-homophenylalanine and 2-phenylethanol by recombinant Saccharomyces cerevisiae expressing aspartate aminotransferase from Escherichia coli BL21(DE3). Journal of Bioscience and Bioengineering, 2017, 123(1): 1-7. DOI:10.1016/j.jbiosc.2016.06.013 |
| [9] | Wang YQ, Zhang H, Lu XY, Zong H, Zhuge B. Advances in 2-phenylethanol production from engineered microorganisms. Biotechnology Advances, 2019, 37(3): 403-409. DOI:10.1016/j.biotechadv.2019.02.005 |
| [10] |
Zhang T, Xu SL, Li JH. Study on a new process for the synthesis of homophenylalanine. Journal of Zhejiang University of Technology, 2011, 39(3): 264-267.
(in Chinese) 张婷, 徐时良, 李景华. 高苯丙氨酸的合成新工艺研究. 浙江工业大学学报, 2011, 39(3): 264-267. DOI:10.3969/j.issn.1006-4303.2011.03.007 |
| [11] | Song W, Chen XL, Wu J, Xu JZ, Zhang WG, Liu J, Chen J, Liu LM. Biocatalytic derivatization of proteinogenic amino acids for fine chemicals. Biotechnology Advances, 2020, 40: 107496. DOI:10.1016/j.biotechadv.2019.107496 |
| [12] | Song W, Wang JH, Wu J, Liu J, Chen XL, Liu LM. Asymmetric assembly of high-value α-functionalized organic acids using a biocatalytic chiral-group-resetting process. Nature Communications, 2018, 9(1): 1-9. DOI:10.1038/s41467-017-02088-w |
| [13] | 宋伟. 多酶级联转化甘氨酸生产α-功能化有机酸的研究. 江南大学博士学位论文, 2019. |
| [14] | Lo HH, Kao CH, Lee DS, Yang TK, Hsu WH. Enantioselective synthesis of (S)-2-amino-4-phenylbutanoic acid by the hydantoinase method. Chirality, 2003, 15(8): 699-702. DOI:10.1002/chir.10281 |
| [15] |
Wang YM, Ban R, Liu L, Shen Y. Construction of recombinant Bacillus subtilis by co-expression of heterologous D-hydantoinase and N-carbamoylase. Acta Microbiologica Sinica, 2017, 57(1): 54-65.
(in Chinese) 王亚盟, 班睿, 刘露, 申雨. 异源D-海因酶和N-氨甲酰水解酶共表达重组枯草芽孢杆菌的构建. 微生物学报, 2017, 57(1): 54-65. |
| [16] | Chen ST, Tseng MJ, Sookkheo B. Facile synthesis of L-homophenylalanine by equilibrium shift enzymatic reaction using engineered tyrosine aminotransferase. US: 6146859. 2000-11-14. |
| [17] |
Li ZQ, Wang XY, Lou XY, Liu BY, Zhang L, You S. Synthesis of L-homophenylalanine by tyrosine aminotransferase method. Journal of Shenyang Pharmaceutical University, 2013, 30(5): 399-402, 408.
(in Chinese) 李志强, 王潇莹, 娄晓月, 刘冰滢, 张朗, 游松. 酪氨酸转氨酶法制备L-高苯丙氨酸. 沈阳药科大学学报, 2013, 30(5): 399-402, 408. |
| [18] |
Chen X, Gao XZ, Zhu DM. Catalysis, engineering and application of amino acid dehydrogenases. Acta Microbiologica Sinica, 2017, 57(8): 1249-1261.
(in Chinese) 陈曦, 高秀珍, 朱敦明. 氨基酸脱氢酶的催化机理、分子改造及合成应用. 微生物学报, 2017, 57(8): 1249-1261. |
| [19] | Li H, Liao JC. Development of an NADPH-dependent homophenylalanine dehydrogenase by protein engineering. ACS Synthetic Biology, 2014, 3(1): 13-20. DOI:10.1021/sb400093x |
| [20] | Zhang JL, Zhu TY, Wu XR, Chen YJ. Enhancement of biocatalytic efficiency by increasing substrate loading: enzymatic preparation of l-homophenylalanine. Applied Microbiology and Biotechnology, 2013, 97(19): 8487-8494. DOI:10.1007/s00253-013-5117-1 |
| [21] | Wang JH, Song W, Wu J, Liu J, Chen XL, Liu LM. Efficient production of phenylpropionic acids by an amino-group-transformation biocatalytic cascade. Biotechnology and Bioengineering, 2020, 117(3): 614-625. DOI:10.1002/bit.27241 |
| [22] | Schrittwieser JH, Velikogne S, Hall M, Kroutil W. Artificial biocatalytic linear cascades for preparation of organic molecules. Chemical Reviews, 2018, 118(1): 270-348. DOI:10.1021/acs.chemrev.7b00033 |
| [23] | France SP, Hepworth LJ, Turner NJ, Flitsch SL. Constructing biocatalytic cascades: in vitro and in vivo approaches to de novo multi-enzyme pathways. ACS Catalysis, 2017, 7(1): 710-724. DOI:10.1021/acscatal.6b02979 |
| [24] | Fesko K, Reisinger C, Steinreiber J, Weber H, Schürmann M, Griengl H. Four types of threonine aldolases: Similarities and differences in kinetics/thermodynamics. Journal of Molecular Catalysis B: Enzymatic, 2008, 52/53: 19-26. DOI:10.1016/j.molcatb.2007.10.010 |
| [25] | Franz SE, Stewart JD. Threonine aldolases. Advances in Applied Microbiology, 2014, 88: 57-101. |
| [26] |
Zhang C, Xing XH. Research progress in cofactor regeneration systems. Chinese Journal of Biotechnology, 2004, 20(6): 811-816.
(in Chinese) 张翀, 邢新会. 辅酶再生体系的研究进展. 生物工程学报, 2004, 20(6): 811-816. DOI:10.3321/j.issn:1000-3061.2004.06.001 |
| [27] | Zhao HM, van der Donk WA. Regeneration of cofactors for use in biocatalysis. Current Opinion in Biotechnology, 2003, 14(6): 583-589. DOI:10.1016/j.copbio.2003.09.007 |
| [28] | Zhang YF, Wang Q, Hess H. Increasing enzyme cascade throughput by pH-engineering the microenvironment of individual enzymes. ACS Catalysis, 2017, 7(3): 2047-2051. DOI:10.1021/acscatal.6b03431 |
| [29] | Tan HL, Guo S, Dinh ND, Luo RC, Jin L, Chen CH. Heterogeneous multi-compartmental hydrogel particles as synthetic cells for incompatible tandem reactions. Nature Communications, 2017, 8: 663. DOI:10.1038/s41467-017-00757-4 |
 2021, Vol. 61
2021, Vol. 61




