中国科学院微生物研究所,中国微生物学会
文章信息
- 刘胡林, 徐兴然, 凌开建, 邹祥. 2022
- LIU Hulin, XU Xingran, LING Kaijian, ZOU Xiang.
- 人生殖道源乳酸杆菌的筛选及在小鼠阴道假丝酵母病模型中的应用评价
- Lactobacillus: screening from human reproductive tract and therapeutic effect on a mouse model of vulvovaginal candidiasis
- 微生物学报, 62(11): 4141-4154
- Acta Microbiologica Sinica, 62(11): 4141-4154
-
文章历史
- 收稿日期:2022-05-01
- 修回日期:2022-09-14
- 网络出版日期:2022-10-10
2. 陆军军医大学第一附属医院妇产科, 重庆 400038
2. Department of Obstetrics and Gynecology, the First Affiliated Hospital of Army Military Medical University, Chongqing 400038, China
人和动物阴道内存在复杂的微生物群落,与宿主存在共生关系,被称为阴道微生物群[1]。大多数健康女性的阴道微生物群以乳酸杆菌(Lactobacillus)为优势菌,乳酸杆菌的缺失或减少常常表现为阴道微生态失衡,导致阴道炎症,增加不孕、流产、病毒感染、妇科肿瘤的风险。外阴阴道假丝酵母菌病(vulvovaginal candidiasis,VVC)在育龄女性一生中的发病率高达70%以上,80%的VVC病例由白色念珠菌(Candida albicans)过度繁殖引起。目前主要使用抗真菌疗法,但复发率高达50%[2]。长期阴道用药或口服抗生素以控制复发而导致的耐药性问题日益严重,而目前缺少可替代药物[3]。此外,抗菌药物的局部高浓度可能抑制乳杆菌的生长,引起新的菌群失调状态。因此,临床研究逐渐认识到以乳酸杆菌为主导的阴道菌群恢复性治疗不能被忽略。
乳酸杆菌作为阴道内重要益生菌,通过黏附在阴道上皮产生乳酸维持阴道内低pH环境,并通过多种方式(竞争排斥、产生抑菌物质和调节免疫等)限制其他病原菌的生长,促进阴道微生态平衡[4]。已有研究者将乳酸杆菌用作阴道益生菌疗法,益生菌疗法能改善患者的不适症状,尤其是细菌性阴道病,可提高治愈率、降低复发率,少有不良反应报道[5–6]。Ling等[7]分析了使用抗生素疗法和益生菌疗法后的阴道菌群差异,益生菌通过抑制病原菌过度生长并逐渐稳定地重建阴道稳态,表现出明显的疗效和较低的复发率;Macklaim等[8]也证明口服乳酸杆菌可通过非阴道定殖的方式诱导阴道内乳杆菌的相对丰度以促进患者恢复健康,但尚需大样本临床验证。在国内,目前临床上仅批准了一种阴道乳酸杆菌活菌制剂——定君生(国药准字S20030005),为德氏乳杆菌DM8909,可见临床可用的乳酸杆菌资源仍然有限。
基于上述现状,本研究从中国女性阴道分泌物中分离筛选有良好益生作用的内源性乳酸杆菌,并评价益生特性,进一步丰富临床可用的乳酸杆菌资源,为临床治疗阴道炎症提供替代方案。
1 材料与方法 1.1 材料样品采自53名19–50岁中国育龄女性的阴道分泌物。C. albicans CMCC (F) 98001购自中国食品药品检定研究院。CaSki细胞由陆军军医大学第一附属医院凌开建医生惠赠。
1.2 培养基de Man,Rogosa and Sharpe (MRS)培养基参照文献[9],生物胺测试培养基参照文献[10]。
YPD培养基(g/L):蛋白胨20.0,酵母浸粉10.0,葡萄糖20.0。
5%羊血-哥伦比亚培养基(g/L):胰酪蛋白胨12.0,牛肉浸粉3.0,蛋白胨5.0,可溶性淀粉1.0,酵母浸粉3.0,氯化钠5.0,调节pH至7.3±0.2,115 ℃灭菌30 min,待冷却至50 ℃时加入5%脱纤维羊血,轻摇混匀后倒板。
1.3 乳酸杆菌的分离和鉴定将样品用无菌PBS稀释后,接种在补充有1%碳酸钙的MRS琼脂上,于37 ℃下厌氧培养48 h分离乳酸杆菌。通过观察菌落溶钙圈、革兰氏染色、触酶反应测试和16S rRNA基因测序进行鉴定。
1.4 乳酸杆菌对白色念珠菌拮抗作用测定 1.4.1 乳酸杆菌对白色念珠菌的生长抑制作用同时共培养:收集活化后的C. albicans,调整菌浓度为1×107 CFU/mL,以1% (V/V)接种于新鲜MRS培养基中,收集活化后的乳酸杆菌,调整菌浓度为1×109 CFU/mL,10倍梯度稀释至浓度1×108 CFU/mL和1×107 CFU/mL,以1%接种于新鲜MRS培养基中,使初始接种量为107、106和105 CFU/mL。37 ℃静置培养24 h,用PBS稀释培养液至适宜的梯度,取100 µL培养液涂布于YPD固体培养基,37 ℃培养,对平板中C. albicans菌落计数,结果表示为3个平行的平均值。
差时共培养:收集活化后C. albicans菌液,调整菌液浓度为1×107 CFU/mL,以1% (V/V)接种于新鲜MRS培养基中,静置培养8 h,加入等量新鲜MRS培养基重悬的乳杆菌菌液(1×108 CFU/mL和1×107 CFU/mL)。继续37 ℃静置培养16 h。同前所述的方法对C. albicans培养液计数。
乳酸杆菌无细胞上清液(cell-free excretory supernatants,CFS)对白色念珠菌的生长抑制作用:乳酸杆菌培养48 h,测定pH后用0.22 µm滤膜过滤得到CFS。为探究其pH的影响,用氢氧化钠溶液调节上清液pH到7.0,利用0.22 µm滤膜过滤得pH 7.0的CFS。用牛津杯法和微孔板法测定样品对白色念珠菌的抑菌活性。
1.4.2 乳酸杆菌菌悬液和CFS对白色念珠菌表型转化的抑制作用收集活化后C. albicans菌液,用PBS洗涤3次,用FBS稀释调整菌浓度为106 CFU/mL,同理将乳杆菌用FBS稀释调整菌浓度为108 CFU/mL。无细胞上清液(CFS)制备同前。参照文献[11]诱导C. albicans菌丝相转化,并测定菌丝转化抑制率。抑制率(%)=(OD对照−OD测试)/OD对照×100。结果表示为3个平行实验的平均值。
1.4.3 CFS中抑菌物质初步探索测定方法参照文献[12],以核糖醇为内标,通过三甲基硅烷化法得到硅烷化的CFS衍生物,经GC-MS上机分析,结果保留峰面积0.1%以上自动积峰,用内置标准质谱数据库鉴定代谢物,根据保留时间和质谱相似度(超过80%)匹配确定了潜在代谢物。
1.5 乳酸杆菌的生物学功能和益生特性 1.5.1 不同pH下生长情况和降低pH能力收集活化后菌株调节菌浓度为1×108 CFU/mL,按1%的接种量转接于pH为6.0、4.5和4.0的MRS培养基中,37 ℃厌氧培养,于0、6、12、24、36和48 h取样用酶标仪测定OD600。
收集活化后菌株调节菌浓度为1×108 CFU/mL,按1%的接种量转接于pH为6.0的MRS培养基中,37 ℃厌氧培养,于0、6、12、24、36和48 h取样测定其pH值。
1.5.2 自聚集和共聚集特性测定方法参考文献[13]。以10 000 r/min离心5 min,收集在MRS肉汤中37 ℃厌氧生长至指数期的乳杆菌。用PBS洗涤2次后调节OD600为0.5。取1.4 mL菌悬液均匀混合10 s,37孵育3 h后,取0.2 mL上层悬浮液,并在600 nm处测量吸光度。按公式(1)计算自动聚集百分比。
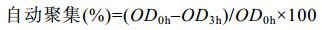
|
公式(1) |
共聚集菌悬液的制备方法与自聚集试验相同。将等体积(0.7 mL)的每种乳杆菌悬液分别与C. albicans菌悬液混合,涡旋10 s。在37 ℃孵育3 h前后测定上层悬浮液的OD600。共聚集率按照公式(2)计算。
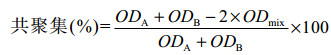
|
公式(2) |
式中:ODA和ODB分别代表培养前Lactobacillus和C. albicans的OD600;ODmix表示共聚集混合物孵育后的OD600。
1.5.3 上皮细胞黏附性平板菌落计数法测定黏附指数,测定方法参考文献[14]。在12孔细胞培养板中,CaSki细胞在10%胎牛血清DMEM培养基中生长至80%融合(37 ℃,5% CO2)。收集活化乳杆菌,用PBS洗涤3次,用新鲜DMEM培养基调整菌浓度(约107 CFU/mL)加入12孔板中,在37 ℃下共培养3 h,之后弃去培养液,用PBS洗涤细胞3次去除未结合的细菌。使用0.1% Triton X-100分离细胞和结合的细菌,连续稀释并涂布MRS琼脂板,37 ℃下厌氧培养48 h,对乳酸杆菌菌落计数。黏附指数的计算为最初添加的细菌总数与结合细胞的细菌数的比值,结果表示为3组平行的平均值。
1.6 乳酸杆菌对小鼠外阴阴道假丝酵母病模型干预作用的初步探索 1.6.1 小鼠分组和模型建立小鼠外阴阴道假丝酵母病模型建立方法参照文献[15],KM雌性8周龄SPF级小鼠饲养在温度25,湿度60%,光照/黑暗12 h周期交替的环境中,可以自由饮水和获取食物。试验动物分组及处理见表 1。小鼠经适应性喂养后,随机分为4组,每组5只,分别为空白对照组(control)、模型对照组(model)、预防组(Pre-LFC)、治疗组(LFC)。除空白组外,雌性小鼠每5天皮下注射0.1 mL戊酸雌二醇油剂(1 mg/mL)以维持假发情状态。试验从皮下接种戊酸雌二醇后第2天开始,进行预防性接种7 d,后以C. albicans阴道内注射创建小鼠外阴阴道假丝酵母菌病模型。造模第2天开始进行治疗性接种7 d。
| Group | N | Administration | |||||
| Estradiol valerate | Preventive inoculum | Dose | C. albicans | Therapeutic inoculum | Dose | ||
| Control | 5 | − | Saline | − | − | Saline | − |
| Model | 5 | 0.1 mg | Saline | − | 106 CFU | Saline | − |
| Pre-LFC | 5 | 0.1 mg | LFC | 108 CFU | 106 CFU | Saline | − |
| LFC | 5 | 0.1 mg | Saline | − | 106 CFU | LFC | 108 CFU |
1.6.2 冲洗液真菌载量变化、菌丝形成检测
造模后每天对小鼠进行称重,观察其阴道口红肿和异常分泌物。处理7 d后,用100 µL生理盐水反复冲洗阴道,收集灌洗液,充分混匀后,取10 µL涂布于YPD培养基(氯霉素抗性),37培养,计算C. albicans数目。另取10 µL充分混匀灌洗液,涂片,自然干燥,用结晶紫染色观察菌丝形成情况和数量。
1.6.3 苏木素-伊红染色检测阴道组织病理改变最后一次阴道内注射24 h后,将小鼠深度麻醉后处死,收集阴道组织,将其固定在4%多聚甲醛中24 h后,使用梯度乙醇脱去组织水分,并使用石蜡进行包埋,用石蜡切片机切4 µm切片,使用H & E染色试剂盒染色,在显微镜下观察并采集图片。
2 结果与分析 2.1 生殖道乳酸杆菌的分离和鉴定从53个样本中共分离得到19株乳酸杆菌,16S rRNA基因扩增测序,经NCBI比对,通过MAGE7.0建树分析(图 1)。初步确定11株为Lactobacillus crispatus,3株为L. fermentum,2株L. gasseri,1株L. johnsonii,1株L. jensenii,1株L. salivarius。根据前期筛选和白色念珠菌抑制活性测试结果,L. crispatus ZH08 (Lc-8)、L. fermentum ZH09 (Lf-9)、L. fermentum ZH11 (Lf-11)和L. crispatus ZH17 (Lc-17) 4株菌对白色念珠菌具有显著拮抗效果,针对4株菌开展进一步研究。
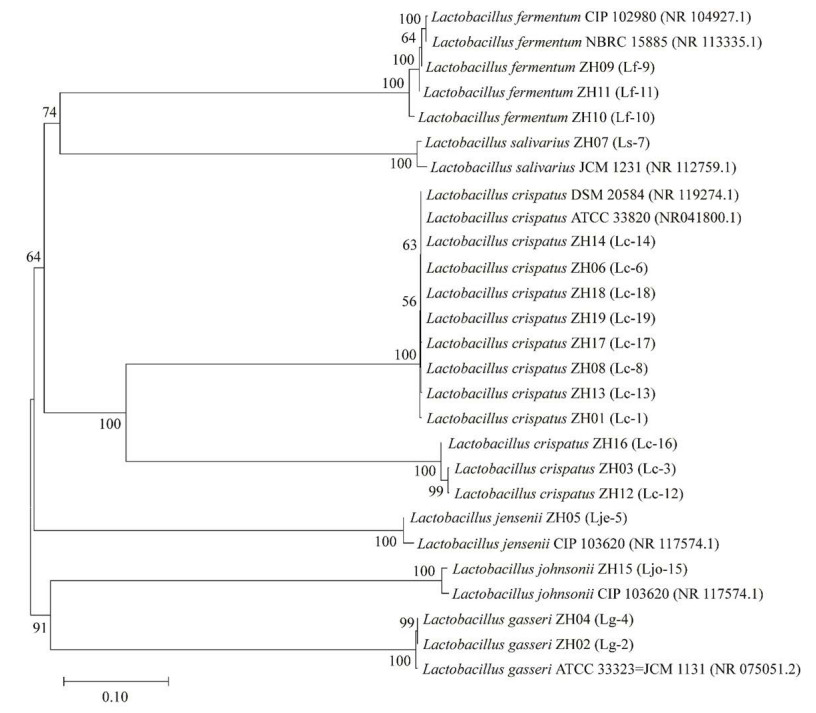
|
| 图 1 基于16S rRNA基因的发育树 Figure 1 Phylogenetic tree of 16S rRNA gene. Numbers in brackets represent the sequences accession number in GenBank, and numbers at the nodes indicate the bootstrap values on NJ analysis of 1 000 resampled data sets. Bar 0.10 represent sequence divergence. |
2.2 乳酸杆菌对白色念珠菌的抑制作用 2.2.1 共培养体系下乳酸杆菌对白色念珠菌生长的抑制作用
当2种微生物一起培养时,共培养技术能够评估一种微生物对另一种微生物生长的影响。我们测试了不同比例白色念珠菌与乳酸杆菌共培养时白色念珠菌的生长情况,如图 2A所示。当C. albicans初始接种量为105 CFU/mL,乳酸杆菌初始接种量为107 CFU/mL,在24 h共培养后,乳杆菌对C. albicans的生长抑制率分别为98.57% (Lc-8)、99.74% (Lf-9)、99.82% (Lf-11)、93.36% (Lc-17)。结果表明,4株乳酸杆菌都能显著抑制C. albicans的生长。

|
| 图 2 乳酸杆菌和无细胞培养液对白色念珠菌的抑制作用 Figure 2 Inhibitory effect of Lactobacillus and cell-free culture medium on C. albicans. A: inhibitory effect in co-culture system; B: inhibition curve of time difference co-culture; C: growth inhibitory effect of CFS on C. albicans; D: inhibitory effect of CFS with pH adjusted to 7.0 on the growth of C. albicans. Error bars in figure represent standard deviation. |
我们模拟了在C. albicans大量生长的患者体内的病理状态,即预先接种C. albicans,使其单独生长到对数期(约1×107 CFU/mL),以乳酸杆菌作为治疗剂攻击活力及数量都占优势的C. albicans。1×108 CFU/mL乳酸杆菌加入后,白色念珠菌的生长受到抑制,后期活菌数减少。培养24 h后(即加入乳酸杆菌16 h),抑制率可达到71.3%–99.9% (图 2B)。结果表明,即使在C. albicans优势生长的培养环境中,本研究中乳酸杆菌的外源补充也能显著地降低白色念珠菌的生长。并且2株发酵乳杆菌的抑制作用显著优于2株卷曲乳杆菌,而且能在生长后期杀灭C. albicans。分析原因可能与发酵乳杆菌更快的生长速度和抑菌产物积累有关。
在共培养体系中,乳酸杆菌可能通过营养竞争和产生抑菌物质抑制C. albicans的生长,为探索乳酸杆菌代谢物的作用,我们进一步评估了4株乳酸杆菌CFS对C. albicans的体外抑制作用。根据所应用的2种方法获得了不同的结果。当使用微孔板法测定时(图 2C),4株乳杆菌的CFS都观察到显著的抑制作用(P < 0.05),抑制率可达到50.6%、42.4%、38.7%和56.3%。相反,使用琼脂扩散法,没有观察到抗菌作用。在Presti等的研究中也发现了同样的现象[16],这可能是由于微量稀释法比琼脂扩散法更敏感[17]。同时,我们观察到CFS对C. albicans的抑制作用在pH调整到7.0后出现了大幅的下降(图 2D),说明CFS中的抑菌物质受到pH变化的影响。
2.2.2 乳酸杆菌和CFS对白色念珠菌菌丝相转化的抑制作用白色念珠菌具有酵母样和菌丝样2种形态,在生理条件下可向菌丝相转化,是一种重要的毒力特征。FBS可诱导C. albicans的菌丝相转化,采用结晶紫对黏附性菌丝体染色,通过测定溶液在590 nm处的吸光度评估菌丝形成情况。如图 3A所示,所有乳杆菌菌悬液皆能显著抑制FBS诱导的白色念珠菌的菌丝形成,其中Lf-11具有显著高于其他菌株的抑制效果,抑制率为70.3%。在CFS处理组(图 3B),Lc-8和Lc-17的CFS具有较高的菌丝形成抑制活性,其抑制率分别为89.6%、88.4%。Lf-9和Lf-11的抑制率分别为39.7%、44.8%。所有培养上清均能显著抑制白色念珠菌的菌丝形成,2株卷曲乳杆菌的CFS显著高于2株发酵乳杆菌CFS的作用,而在同物种之间没有显著性差异。2株发酵乳杆菌菌悬液的抑制作用高于其CFS的抑制作用,说明更依赖于菌体直接发挥作用;相反,卷曲乳杆菌的CFS对C. albicans菌丝相转化的抑制效果强于菌悬液,说明卷曲乳杆菌的抑制作用更依赖于胞外的可溶性成分。
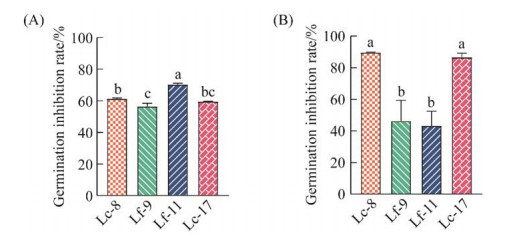
|
| 图 3 乳酸杆菌(A)及CFS (B)对白色念珠菌的表型转化抑制作用 Figure 3 Phenotypic transformation inhibition of Lactobacillus (A) and CFS (B) on Candida albicans. Error bars in figure represent standard deviation, and different letters indicate significant difference (P < 0.05). |
2.2.3 CFS中抑菌物质初步探索
如表 2所示,这些酸在不同菌株中分布并不统一,提示4株乳酸杆菌具有不同的代谢谱。其中,乳酸仍然是乳酸杆菌相对含量最高的酸,且LC-17 > LC-8 > LF-11 > LF-9。值得注意的是,4株乳酸杆菌中皆发现了3-苯乳酸,3-苯乳酸已经被证明能抑制真菌生长和孢子形成[18]。此外,在LF-11中检出了丁酸、在LC-17中检出了丙酸的存在。有关研究表明,乙酸和丙酸对真菌的抑制作用高于乳酸[19],而这些短链脂肪酸被报道可以抑制C. albicans的菌丝形成[20]。这提示我们CFS的抑菌作用可能是数种酸性物质协同的结果,而不是单一的乳酸形成的。
| Compound name | Retention time/min | (As/Ai)/% | |||
| Lc-8 | Lf-9 | Lf-11 | Lc-17 | ||
| Propanoic acid | 5.266 | − | − | − | 9.131 |
| Lactic acid | 5.626 | 1 462.846 | 1 025.802 | 1 191.576 | 2 043.281 |
| Oxalic acid | 9.267 | 17.558 | 11.771 | − | 12.500 |
| Butanedioic acid | 17.394 | 156.413 | 9.793 | 19.051 | 210.237 |
| Butanoic acid | 20.746 | − | − | 5.495 | − |
| Malic acid | 22.889 | − | 6.627 | − | 10.777 |
| 4-aminobutanoic acid | 23.674 | 61.664 | 49.687 | 17.535 | 68.130 |
| 3-phenyllactic acid | 25.064 | 16.925 | 13.703 | 16.299 | 16.983 |
| Phosphoric acid | 29.515 | 16.107 | 18.058 | 15.139 | 17.023 |
| Hexonic acid | 29.615 | 10.069 | 11.867 | 7.772 | 8.938 |
| Citric acid | 30.643 | − | 535.077 | 440.614 | 12.450 |
| Pentanedioic acid | 31.626 | 58.836 | 68.053 | − | 60.134 |
| Palmitic acid | 34.542 | 71.987 | 45.274 | 46.028 | 47.362 |
| Stearic acid | 38.039 | 39.314 | 30.541 | 31.445 | 29.168 |
| −: not detected; As: sample peak area; Ai: internal standard peak area. | |||||
2.3 乳酸杆菌的生物学功能和益生特性 2.3.1 在不同pH下生长情况和降低培养液pH能力
女性阴道内是一个低pH环境,补充的外源阴道乳酸杆菌应能在阴道的低pH环境中生长。4株乳酸杆菌在初始pH为6.0的MRS培养基和在用盐酸酸化至pH为4.5和4.0的MRS培养基中生长情况如图 4A−4C。随着MRS培养基的pH值降低,乳酸杆菌显示出不同程度的pH依赖性生长抑制,测试乳杆杆菌在pH为4.0–4.5范围内均能正常生长。研究表明,正常女性中阴道pH在4.0–4.5之间,在乳酸杆菌缺失或减少的阴道炎患者体内pH高于4.5。总的来说,4株乳酸杆菌能耐受阴道低pH环境,并能正常生长。
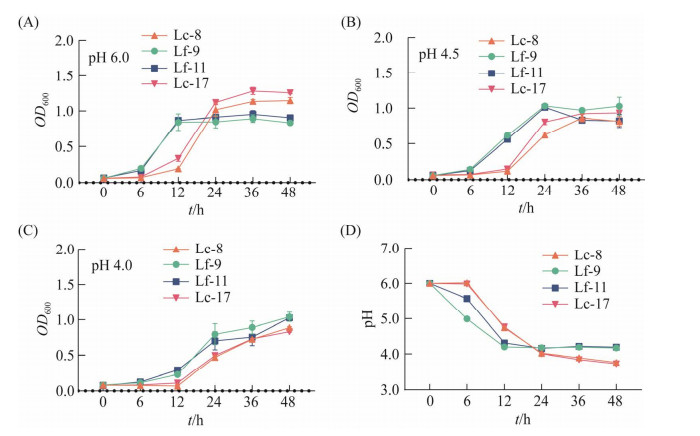
|
| 图 4 4株乳酸杆菌在不同pH下生长情况(A–C)和降低培养液pH能力(D) Figure 4 Growth at different pH (A–C) and ability to reduce pH of culture medium (D) of four Lactobacillus. Error bars in figure represent standard deviation. |
乳酸杆菌是维持阴道内的低pH环境的重要因素,但不同菌株之间降低pH能力不同。4株乳酸杆菌在厌氧条件下降低pH值的能力趋于相似,皆能在24 h内将pH降低到阴道生殖道正常生理pH内(图 4D)。2株卷曲乳杆菌的培养物最低pH值达到3.7,2株发酵乳杆菌培养物的最低pH达到4.2,商业菌株培养物的最低pH达到3.8。同种的乳杆菌具有相似的降低培养液pH的趋势和能力。并且,分离菌株的pH降低速度与其生长速度相关,更快生长的发酵乳杆菌在更短的时间(12 h)内将培养液pH值降低到稳定值,其酸化MRS培养液的速率达到0.15 pH/h。提示了更快恢复阴道内pH的能力。但是单个分离株在pH为6.0的生长并不能预测其在48 h降低培养物pH值的能力,生长相对迟缓的卷曲乳杆菌降低pH的终点值小于2株生长更快的发酵乳杆菌,而更低的pH是有效地抑制其他细菌的生长繁殖重要因素。
2.3.2 聚集与黏附特性黏附有利于乳酸杆菌在阴道上皮定殖。自聚集能力与黏附性有关,是乳酸杆菌在人类和动物粘膜中的重要特征。自动聚集可以显著增加乳酸杆菌在停留时间短的环境中的定殖潜力。自动聚集(形成絮状物)的能力是在生殖道存在的不利条件下维持益生菌数量的关键因素。结果表明,4株筛选乳杆菌的自聚集能力具有显著性差异(P < 0.05),如图 5A所示,Lc-17的自聚集性最高,为80.1%,其次是Lc-8,为58.0%,而Lf-9和Lf-11自聚集能力相对较低,分别为28.45%和27.49%。具有共聚集特性的乳酸杆菌在病原体周围形成具有高浓度抑制物质的微环境,可防止病原体黏附到阴道上皮。我们接着测试了4株筛选乳杆菌对白色念珠菌的共聚集能力,如图 5B所示。其中,Lc-17表现出最高的共聚集能力,其共聚集百分比可达到77.5%,其次为Lc-8,其共聚集百分比可达到74.2%。2株发酵乳杆菌表现出中等共聚集能力,Lf-9对白色念珠菌的共聚集百分比为57.2%,Lf-11对白色念珠菌的共聚集百分比为44.1%。
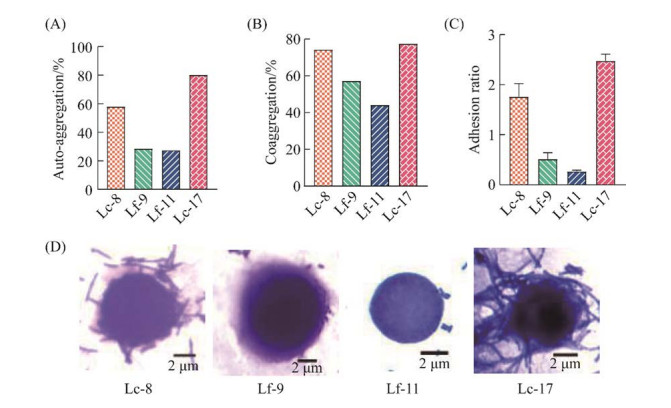
|
| 图 5 聚集性和黏附性测试结果 Figure 5 Agglomeration and adhesion test results. A: the test results of automatic aggregation ability; B: the co-aggregation test results of Lactobacillus and C. albicans; C, D: the adhesion test results of Lactobacillus to Caski cells. Error bars in figure represent standard deviation, and different letters indicate significant difference (P < 0.05). |
乳酸杆菌分别与CaSki细胞共培养3 h,通过平板菌落计数法,计算乳酸杆菌的黏附百分比。结果表明,4株乳酸杆菌不同程度地黏附在CaSki细胞上,如图 5C所示,Lc-17黏附指数为2.48,其次是Lc-8,为1.76,Lf-9和Lf-11的黏附指数相对较低,分别为0.52和0.27。在显微计数法测定乳杆菌黏附指数时,由于卷曲乳杆菌呈丝状黏附,增加了计数的困难,我们采集了显微镜下图像,如图 5D所示,Lc-17、Lc-8菌株大量地黏附于上皮细胞周围,而Lf-9、Lf-11黏附个数相对较少,其结果与平板菌落计数相当。结果表明,2株卷曲乳杆菌拥有极强的黏附能力,这与已报道的该物种的特性相符,提示其通过竞争黏附阴道上皮以排斥病原菌的潜力。
2.4 乳酸杆菌对小鼠外阴阴道假丝酵母病模型干预作用的初步探索前期筛选得到的4株乳酸杆菌具有不同的益生特性,提示它们通过不同的拮抗机制发挥益生作用,发酵乳杆菌具有更快的生长速度和更高的酸化培养液效率,并更多地通过菌体本身抑制C. albicans生长和菌丝相分化,而卷曲乳杆菌可通过强黏附特性以及产生丰富的酸性成分发挥作用。由于很难有一个菌株囊括所有功能特性,为实现优势最大化,我们进一步探究乳酸杆菌组合的抑制作用。如图 6A所示,Lf-11与Lc-17的搭配效果最优,其对C. albicans的24 h生长抑制率达到97.5%,后期选用Lf-11与Lc-17的组合进行下一步研究,并将该组合命名为LFC。2种乳酸杆菌组合抑制,并非2个个体功能的和,可能受2个菌株相互作用的影响和干扰,而低于单个菌株使用的效果。结果显示,LFC的组合抑制效果并未受到较大干扰。研究表明,与单个菌株相比,益生菌组合具有协同黏附作用、协同抗菌作用[21–22]。我们接着构建了小鼠阴道假丝酵母病模型以评价益生菌组合在生理环境的作用。与空白组比较,模型组小鼠都表现出异常的阴道分泌物和组织肿胀,可见白色黏性的阴道分泌物,分泌物镜下可见大量菌丝,说明造模是成功的。造模后第7天,Pre-LFC、LFC组的真菌载量与模型组相比显著减少(图 6B)。灌洗液的革兰氏染色结果表明,Pre-LFC和LFC组灌洗液中菌丝阳性的小鼠比例分别为2/5和1/5,镜下少见菌丝分布(图 6C)。H & E染色显示(图 6D),在感染白色念珠菌后,阴道黏膜受到严重损伤,细胞排列紊乱和炎性细胞浸润(图中箭头所示)。与模型组相比,Pre-LFC、LFC组小鼠阴道炎症和上皮黏膜损伤的显著缓解。
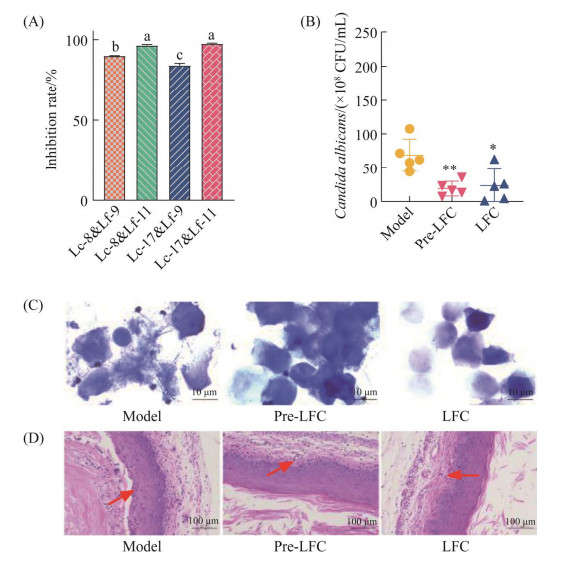
|
| 图 6 乳酸杆菌组合对C. albicans生长的抑制作用(A)及对小鼠假丝酵母病中白色念珠菌的载量(B)、菌丝形成(C)和组织学变化(D)的影响 Figure 6 Inhibitory effect of Lactobacillus combination on C. albicans growth (A) and its effect on candida disease in mice; effects of Lactobacillus on vaginal C. albicans load (B), mycelium formation (C) and tissue morphology (D) in mice with vaginal candidiasis. Error bars in figure represent standard deviation, * P < 0.05 according to one-way ANOVA analysis. |
3 讨论与结论
以往研究证实,共培养体系可以模拟VVC患者中C. albicans与乳酸杆菌共存的生理环境,评估乳酸杆菌与C. albicans的直接作用。本研究中筛选分离的乳酸杆菌可在共培养24 h测定到对白色念珠菌的抑制作用,在Kang等[23]的研究中也观察到在共培养后期的抑制活性,说明乳酸杆菌发挥作用需要形成更高浓度抑制物质的环境。结合在无细胞上清液中观察到的相对较弱的抑制能力,说明除了酸性物质,在共培养体系中可能还存在诱导型抑菌物质的积累,如受共培养细菌诱导产生的细菌素gassericin E[24]。此外,我们通过差时共培养模拟了C. albicans优势生长时外源乳酸杆菌加入对其生长的影响,结果在一定程度上反应了乳酸杆菌逆转C. albicans优势地位的潜力。另一方面,菌丝样的C. albicans被认为是致病的关键,而不能菌丝生长的突变菌株在白色念珠菌阴道炎的小鼠模型中,对阴道上皮细胞的黏附性降低,定植和感染减少[25]。本研究中的乳酸杆菌菌液和产生的可溶性代谢物可以减少C. albicans的菌丝转化,推测是由于细胞相互作用以及酸性代谢物对白色念珠菌菌丝特异性基因的调节[26],该益生特性有望减轻由于C. albicans相转化导致的细胞损伤和炎症。
我们观察到CFS对C. albicans生长抑制作用与pH相关,对其中可能存在的酸性物质进行了非靶向代谢组学分析。结果表明,4株乳杆菌CFS中除了存在大量的乳酸外,还存在种类丰富的其他有机酸,如丙酸、丁酸等。此外,筛选得到4株乳酸杆菌中都检测出3-苯乳酸,据报道3-苯乳酸有抗真菌活性,目前报道产生3-苯乳酸的主要是环境来源的植物乳杆菌,在生殖道乳酸杆菌中较少被报道。
我们初步在小鼠的外阴阴道假丝酵母病模型中进行了验证,7 d的阴道内补充乳酸杆菌表现出相当的抑制C. albicans增殖和菌丝相转化作用。在阴道黏膜组织切片中,乳酸杆菌处理各组观察到阴道组织炎症的缓解和黏膜恢复。本研究结果突出了筛选乳酸杆菌在临床实践中的应用潜力。
综上所述,本研究筛选出4株乳酸杆菌具有较强的益生特性,体外及体内小鼠模型实验均显示其具有明显的抑制白色念珠菌的作用。功能复配的益生菌组合LFC尚需进一步挖掘其内在机制及作用。功能复配的益生菌组合具有良好的应用前景,具有潜在的临床应用价值。
| [1] | Abou Chacra L, Fenollar F. Exploring the global vaginal microbiome and its impact on human health. Microbial Pathogenesis, 2021, 160: 105172. DOI:10.1016/j.micpath.2021.105172 |
| [2] | Sobel JD. Vulvovaginal candidosis. The Lancet, 2007, 369(9577): 1961-1971. DOI:10.1016/S0140-6736(07)60917-9 |
| [3] | Sobel JD, Sobel R. Current treatment options for vulvovaginal candidiasis caused by azole-resistant Candida species. Expert Opinion on Pharmacotherapy, 2018, 19(9): 971-977. DOI:10.1080/14656566.2018.1476490 |
| [4] |
Liu HL, Xu XR, Ling KJ, Zou X. Vaginal microbiome: community characteristics and disease intervention. Chinese Journal of Biotechnology, 2021, 37(11): 3801-3811.
(in Chinese) 刘胡林, 徐兴然, 凌开建, 邹祥. 阴道微生物组: 种群特征与疾病干预治疗. 生物工程学报, 2021, 37(11): 3801-3811. |
| [5] | Cohen CR, Wierzbicki MR, French AL, Morris S, Newmann S, Reno H, Green L, Miller S, Powell J, Parks T, Hemmerling A. Randomized trial of lactin-Ⅴ to prevent recurrence of bacterial vaginosis. The New England Journal of Medicine, 2020, 382(20): 1906-1915. DOI:10.1056/NEJMoa1915254 |
| [6] | Oerlemans EFM, Bellen G, Claes I, Henkens T, Allonsius CN, Wittouck S, van den Broek MFL, Wuyts S, Kiekens F, Donders GGG, Lebeer S. Impact of a lactobacilli-containing gel on vulvovaginal candidosis and the vaginal microbiome. Scientific Reports, 2020, 10: 7976. DOI:10.1038/s41598-020-64705-x |
| [7] | Ling ZX, Liu X, Chen WG, Luo YQ, Yuan L, Xia YX, Nelson KE, Huang SL, Zhang SE, Wang YZ, Yuan JL, Li LJ, Xiang C. The restoration of the vaginal microbiota after treatment for bacterial vaginosis with metronidazole or probiotics. Microbial Ecology, 2013, 65(3): 773-780. DOI:10.1007/s00248-012-0154-3 |
| [8] | Macklaim JM, Clemente JC, Knight R, Gloor GB, Reid G. Changes in vaginal microbiota following antimicrobial and probiotic therapy. Microbial Ecology in Health and Disease, 2015, 26(1): 27799. |
| [9] | De MAN JC, Rogosa M, Sharpe ME. A medium for the cultivation of lactobacilli. Journal of Applied Bacteriology, 1960, 23(1): 130-135. DOI:10.1111/j.1365-2672.1960.tb00188.x |
| [10] | Bover-Cid S, Holzapfel WH. Improved screening procedure for biogenic amine production by lactic acid bacteria. International Journal of Food Microbiology, 1999, 53(1): 33-41. DOI:10.1016/S0168-1605(99)00152-X |
| [11] | Ren JO, Yuan J, Zeng BH, Wei H. An in vitro assessment of inhibitory effect of 16 strains of probiotics on the germination of Candida albicans. African Journal of Microbiology Research, 2010, 4(12): 1251-1256. |
| [12] | Qiao NZ, Yu LL, Zhang CC, Wei CZ, Zhao JX, Zhang H, Tian FW, Zhai QX, Chen W. A comparison of the inhibitory activities of Lactobacillus and Bifidobacterium against Penicillium expansum and an analysis of potential antifungal metabolites. FEMS Microbiology Letters, 2020, 367(18): fnaa130. DOI:10.1093/femsle/fnaa130 |
| [13] | Wang S, Wang QY, Xiao BB, Zhang R, Wang B, Liao QP, Zhuang H, Li T. Characterization of vaginal Lactobacillus strains and their potential antagonistic effects on Candida albicans. British Microbiology Research Journal, 2015, 6(4): 185-195. DOI:10.9734/BMRJ/2015/15116 |
| [14] | Happel AU, Kullin B, Gamieldien H, Wentzel N, Zauchenberger CZ, Jaspan HB, Dabee S, Barnabas SL, Jaumdally SZ, Dietrich J, Gray G, Bekker LG, Froissart R, Passmore JAS. Exploring potential of vaginal Lactobacillus isolates from South African women for enhancing treatment for bacterial vaginosis. PLoS Pathogens, 2020, 16(6): e1008559. DOI:10.1371/journal.ppat.1008559 |
| [15] | De Gregorio PR, Silva JA, Marchesi A, Nader-Macías MEF. Anti-Candida activity of beneficial vaginal lactobacilli in in vitro assays and in a murine experimental model. FEMS Yeast Research, 2019, 19(2): foz008. |
| [16] | Presti I, D'Orazio G, Labra M, La Ferla B, Mezzasalma V, Bizzaro G, Giardina S, Michelotti A, Tursi F, Vassallo M, Di Gennaro P. Evaluation of the probiotic properties of new Lactobacillus and Bifidobacterium strains and their in vitro effect. Applied Microbiology and Biotechnology, 2015, 99(13): 5613-5626. DOI:10.1007/s00253-015-6482-8 |
| [17] | Scorzoni L, Sangalli-Leite F, De Lacorte Singulani J, De Paula ESilva ACA, Costa-Orlandi CB, Fusco-Almeida AM, Mendes-Giannini MJS. Searching new antifungals: the use of in vitro and in vivo methods for evaluation of natural compounds. Journal of Microbiological Methods, 2016, 123: 68-78. DOI:10.1016/j.mimet.2016.02.005 |
| [18] | Svanström Å, Boveri S, Boström E, Melin P. The lactic acid bacteria metabolite phenyllactic acid inhibits both radial growth and sporulation of filamentous fungi. BMC Research Notes, 2013, 6: 464. DOI:10.1186/1756-0500-6-464 |
| [19] | Dagnas S, Gauvry E, Onno B, Membré JM. Quantifying effect of lactic, acetic, and propionic acids on growth of molds isolated from spoiled bakery products. Journal of Food Protection, 2015, 78(9): 1689-1698. DOI:10.4315/0362-028X.JFP-15-046 |
| [20] | Guinan J, Wang SH, Hazbun TR, Yadav H, Thangamani S. Antibiotic-induced decreases in the levels of microbial-derived short-chain fatty acids correlate with increased gastrointestinal colonization of Candida albicans. Scientific Reports, 2019, 9(1): 8872. DOI:10.1038/s41598-019-45467-7 |
| [21] | Scillato M, Spitale A, Mongelli G, Privitera GF, Mangano K, Cianci A, Stefani S, Santagati M. Antimicrobial properties of Lactobacillus cell-free supernatants against multidrug-resistant urogenital pathogens. MicrobiologyOpen, 2021, 10(2): e1173. |
| [22] | Chapman CMC, Gibson GR, Rowland I. Health benefits of probiotics: are mixtures more effective than single strains?. European Journal of Nutrition, 2011, 50(1): 1-17. DOI:10.1007/s00394-010-0166-z |
| [23] | Kang CH, Han SH, Kim Y, Paek NS, So JS. In vitro probiotic properties of Lactobacillus salivarius MG242 isolated from human vagina. Probiotics and Antimicrobial Proteins, 2018, 10(2): 343-349. DOI:10.1007/s12602-017-9323-5 |
| [24] | Maldonado-Barragán A, Caballero-Guerrero B, Martín V, Ruiz-Barba JL, Rodríguez JM. Purification and genetic characterization of gassericin E, a novel co-culture inducible bacteriocin from Lactobacillus gasseri EV1461 isolated from the vagina of a healthy woman. BMC Microbiology, 2016, 16(1): 37. DOI:10.1186/s12866-016-0663-1 |
| [25] | Kornitzer D. Regulation of Candida albicans hyphal morphogenesis by endogenous signals. Journal of Fungi: Basel, Switzerland, 2019, 5(1): 21. |
| [26] | Matsubara VH, Wang Y, Bandara HMHN, Mayer MPA, Samaranayake LP. Probiotic lactobacilli inhibit early stages of Candida albicans biofilm development by reducing their growth, cell adhesion, and filamentation. Applied Microbiology and Biotechnology, 2016, 100(14): 6415-6426. DOI:10.1007/s00253-016-7527-3 |
 2022, Vol. 62
2022, Vol. 62




