
中国科学院微生物研究所,中国微生物学会
文章信息
- 林晓帆, 张诺, 王辉, 王美星, 蒋思婧, 贺妮莎, 张桂敏. 2022
- LIN Xiaofan, ZHANG Nuo, WANG Hui, WANG Meixing, JIANG Sijing, HE Nisha, ZHANG Guimin.
- 一种来源于Phialophora attae的玉米赤霉烯酮内酯水解酶ZHD11F的酶学表征和结构特点
- Enzymatic and structural characterization of a zearalenone lactone hydrolase ZHD11F from Phialophora attae
- 微生物学报, 62(11): 4202-4212
- Acta Microbiologica Sinica, 62(11): 4202-4212
-
文章历史
- 收稿日期:2022-03-31
- 修回日期:2022-04-22
- 网络出版日期:2022-06-19
2. 北京化工大学生命科学与技术学院, 北京 100029
2. College of Life Science and Technology, Beijing University of Chemical Technology, Beijing 100029, China
玉米赤霉烯酮(zearalenone,ZEN)是一种由镰刀菌产生的雌激素类真菌毒素,常见于谷物作物中,是广泛传播的霉菌毒素之一[1]。据联合国粮食及农业组织调查发现,世界上受ZEN污染的谷物占谷物总产量的25%。受ZEN感染的作物被牲畜食用后,ZEN会累积在动物的不同生殖器官或组织中[2],进而竞争性地和动物的雌激素受体结合,导致动物的生殖系统内激素紊乱,进一步影响动物的生殖发育系统[1]。
ZEN的脱毒过程包括依赖物理、化学或生物等方面的手段来削弱或消除其毒性。物理方法包括吸附剂吸附、洗涤、高温加热等方式,虽然可以去除一定量的ZEN,但是存在成本高且效果差等缺点。化学方法包括使用强酸、强碱、强氧化剂、还原剂或氯化剂等来破坏ZEN的化学结构,进而去除其毒性;然而,化学物质的使用会导致饲料营养特性的变化,且存在食品安全方面的问题。而生物降解法,通过微生物细胞吸附或者酶降解法降解ZEN,将ZEN转化为无毒产物,这种方法相对于物理化学方法来说更安全、高效、经济、环保,且不会破坏谷物中的营养物质,逐渐成为ZEN脱毒的重要研究方向[3–5]。据文献报道,ZEN内酯水解酶可以水解ZEN中的内酯键,得到无雌激素毒性的产物。因此,挖掘具有优良性质的ZEN内酯水解酶的工作在持续进行。2002年,Takahashi- Ando等从Clonostachys rosea IFO 7063中鉴定出一个ZEN降解酶的编码基因,命名为zhd101[6]。2014年,Peng等解析了ZHD第1个内酯水解酶ZHD101的结构[7]。2017年,Hui等发现并解析了ZEN内酯水解酶CbZHD的结构,并对该酶进行了表征[8]。2018年,Wang等从Rhinocladiella mackenziei中获取了一个与zhd101同源性为65%的ZEN降解酶编码基因,命名为zhd518,并对ZHD518进行了酶学表征[9]。同年,Zheng等解析了RmZHD(ZHD518)的结构[10]。2020年,Yu等从Phialophora americana中获取了一个ZEN内酯水解酶ZHD607,并在毕赤酵母中进行了异源表达[11]。同年,Zhang等从Gliocladium roseum MA918中鉴定出1个ZEN内酯水解酶ZENG,在大肠杆菌中进行异源表达[12]。2022年,Jiang等从Fonsecaea monophora获取了一个ZEN内酯水解酶ZHD11B,并在大肠杆菌中成功进行异源表达和酶学表征[13]。
目前主要鉴定并研究了6个ZEN内酯水解酶(zearalenone lactone hydrolase,ZHD):ZHD101[6]、CbZHD[8]、ZHD518 (RmZHD)[9]、ZHD607[11]、ZENG[12]、ZHD11B[13],其中前3个已经被解析出晶体结构。ZHD属于α/β-水解酶家族,在结构上具有高度相似的特点:包含一个帽子结构域和一个核心结构域。底物ZEN结合在一个位于核心和帽子结构域之间的深口袋中,毗邻催化三联体Ser-His-Glu[7]。ZHD家族可以裂解ZEN的酯键,使其在失去CO2的同时产生一个具有开放侧链的二羟基苯基衍生物。而对ZHD家族的ZEN内酯水解酶的相关报道较少,通过基因挖掘或者蛋白质定向进化等手段来获取更多ZEN降解的候选酶资源,有助于推进ZEN降解酶的研究。
真菌是一个重要的酶资源库,目前已报道的ZEN内酯水解酶均来源于真菌,本研究在调研过程中发现了1个Phialophora attae来源的基因与ZHD518具有较高同源性,且目前很少有关于这个真菌来源的酶的鉴定与表征,因此,选取这个基因进行研究。本研究从Phialophora attae筛选了1个潜在的ZEN内酯水解酶基因zhd11f,并在大肠杆菌BL21(DE3)内得到可溶性表达,对重组ZHD11F的酶学性质、耐冷机制以及热稳定性进行了探索,为研究此类酶的耐冷机制、广温度范围等提供了研究方向,同时拓展了Phialophora attae来源的酶的功能研究。
1 材料与方法 1.1 菌株和试剂Escherichia coli DH5α克隆菌株和BL21(DE3)表达菌株购自Transgene公司。BamH Ⅰ/Xho Ⅰ等限制性内切酶、Ex Taq DNA聚合酶、T4 DNA连接酶等均购自TaKaRa公司(大连)。PCR产物纯化和胶回收试剂盒、质粒提取试剂盒和蛋白Marker购自于南京诺唯赞生物科技股份有限公司。Bradford蛋白浓度试剂盒购自于Omega Bio-Tek公司。Ni-NTA蛋白纯化树脂、GE HiTrap Desalting柱购自GE Healthcar公司。ZEN购自于Sigma-Aldrich公司。乙腈购于弗顿生化科技有限公司。
1.2 引物ZEN内酯水解酶基因zhd11f (GenBank ID:XM_018142292.1)由生工生物工程(上海)股份有限公司合成。同时设计并合成了用于扩增zhd11f基因的引物ZHD11F-F与ZHD11F-R(表 1)。
| Primers | Sequences (5ʹ→3ʹ) |
| ZHD11F-F | GAATTCATGACCCTGACCAGAATCAGAG |
| ZHD11F-R | TCGAGTCACTCGAGAACGTACTTCCTAGTG |
| H245A-F | GGTGCTTTCCCATACGTTACTCACCC |
| H245A-R | GGGAAAGCACCACCTGGCAACAAGG |
本文中的突变体ZHD11F (H245A)被用来探究ZHD11F的活性位点(表 1)。本研究使用含有突变位点的引物通过PCR对整个环形质粒pET28a-zhd11f进行扩增。回收的线性产物经Dpn I处理后转入大肠杆菌DH5α中完成突变。最后将突变体在BL21(DE3)中诱导、表达和纯化,进行后续酶学研究。
1.3 序列分析、同源性建模和分子动力学模拟蛋白质序列相似性通过在NCBI中进行BLAST分析得到。多序列比对由Clustal X和ESPript[14]得到,信号肽使用SignalP4.1 server (http://www.cbs.dtu.dk/services/SignalP)进行预测。ZHD11F结构通过I-TASSER Suite (http://zhanglab.ccmb.med.umich.edu/I-TASSER/)进行模拟[15]。ZHD11F蛋白结构和重叠采用软件Discovery Studio 2021进行可视化。
ZHD11F和ZHD518的分子动力学模拟在YASARA (http://www.yasara.org)中进行。该模拟系统放置在一个pH 8.0的周期性六面体里,在AMBER 14力场下,首先进行加氢反应和能量最小化,接着系统温度逐渐从0升温到308±0.5 K,并保持稳定。最后,完成一个时长为20 ns的分子动力学模拟,且每100 ps保存一张快照。
1.4 重组表达质粒构建将扩增得到的zhd11f片段用BamH Ⅰ/Xho Ⅰ进行双酶切,同时BamH Ⅰ/Xho Ⅰ双酶切线性化处理表达载体pET28a。经DNA连接酶得到的连接混合物转化进入DH5α,涂布于含有卡那霉素(终浓度为50 µg/mL)的LB固体平板上。挑取阳性转化子,分别使用菌落PCR和BamH Ⅰ/Xho Ⅰ双酶切检验重组质粒,将初步验证正确的质粒送到生工生物工程(上海)股份有限公司进行测序。将测序正确的重组质粒命名为pET28a-zhd11f。
1.5 重组ZHD11F的表达和纯化将重组质粒pET28a-zhd11f转入到大肠杆菌BL21(DE3)中进行表达。使用含有50 µg/mL卡那霉素的LB培养基,在37 ℃、220 r/min的摇床里培养至OD600≈0.6时,添加终浓度为0.1 mmol/L的异丙基硫代半乳糖苷(isopropy-β-D-thiogalactoside,IPTG)诱导ZHD11F的表达,并在18 ℃、220 r/min的摇床中培养18 h,3 800 r/min离心10 min收集菌体。将菌体重悬于20 mL破碎缓冲液(50 mmol/L Tris-HCl,150 mmol/L NaCl,pH 8.0)中,经超声破碎、离心和用0.22 μm滤膜过滤上清后开始纯化。使用Ni-NTA (His•Bind Kit,Novagen)层析柱对ZHD11F进行纯化,结合在层析柱上的目的蛋白,在经10 mL洗杂缓冲液Ⅰ (50 mmol/L Tris-HCl,150 mmol/L NaCl,20 mmol/L咪唑,pH 8.0)和10 mL洗杂缓冲液Ⅱ (50 mmol/L Tris-HCl,150 mmol/L NaCl,30 mmol/L咪唑,pH 8.0)清洗非特异性结合蛋白后,经过洗脱缓冲液(50 mmol/L Tris-HCl,150 mmol/L NaCl,300 mmol/L咪唑,pH 8.0)洗脱5次后收集目的蛋白(每次洗脱1 mL)。最后,经PD-10脱盐柱(GE)除去咪唑后,使用12% SDS-PAGE分析各相蛋白大小及纯度,使用Bradford法以牛血清白蛋白(bovine serum albumin,BSA)作为标准品检测蛋白浓度。
1.6 ZEN内酯水解酶ZHD11F酶活测定总体积为500 µL的酶反应体系,由20 µL的底物ZEN (1 mg/mL ZEN溶在色谱级甲醇)、30 µL的稀释酶液和450 µL的缓冲液(50 mmol/L Tris-HCl,pH 8.0)组成。在特定温度下反应10 min后添加500 µL的色谱级甲醇终止反应。反应后的样品经过滤以后由高效液相色谱(HPLC)测定底物ZEN的残余量。HPLC检测条件为:Agilent Carbohydrate column (5 µm,4.6×150 mm)色谱柱,流速1 mL/min,流动相为60%乙腈和40%水相等度洗脱,上样体积为20 µL,总时长6 min。
底物降解量等于底物总量减去底物剩余量。ZEN降解酶的酶活单位(U)定义为:每分钟降解1 µg底物所用的酶量为一个酶活单位。玉米赤霉烯酮降解酶活力的测定标准选用湖北省地方标准DB42/T 1630–2021。
1.7 温度对酶活和稳定性的影响ZHD11F的酶活测定是在50 mmol/L的Tris-HCI (pH 8.0)缓冲液中进行,在10、15、20、25、30、35、40、45、50 ℃条件下分别反应10 min,来测定ZHD11F的最适反应温度。ZHD11F的热稳定性测定是将ZHD11F分别在35、37、40 ℃分别孵育不同时间:5、10、15、20 min,在35 ℃和pH 8.0条件下测定ZHD11F的残余活性。
1.8 pH对酶活和稳定性的影响pH对酶活的影响是在不同pH的50 mmol/L缓冲液中测定的:Na2HPO4-citric acid (50 mmol/L, pH 4.0–8.0), Tris-HCl (50 mmol/L, pH 7.0–9.0), glycine-NaOH (50 mmol/L, pH 9.0–10.0),pH间隔为0.5。pH稳定性的测试方法是:首先将ZHD11F置于上述缓冲液中,于4 ℃条件下孵育16 h,然后在35 ℃和pH 8.0下测试残余活性。
1.9 金属离子对酶活的影响在35 ℃、pH 8.0的条件下,测定了不同金属离子和EDTA对ZHD11F酶活的影响。各成分的添加量均为5 mmol/L。以不添加任何金属离子的酶活设定为100%。
2 结果与分析 2.1 ZHD11F的生物信息学分析本研究以已报道的zhd101 (GenBank ID:AB076037.1)、zhd518 (GenBank ID:XM_013418296.1)基因为参考基因,通过在NCBI数据库中序列比对,得到来源于Phialophora attae的未知功能蛋白(GenBank ID:XM_018142292.1)基因zhd11f进行后续研究,其中ZHD11F与ZHD518的氨基酸序列同源性为59%,与ZHD101的氨基酸序列同源性为52%。分析显示,zhd11f的基因总长为804 bp,其编码267个氨基酸且没有信号肽,其分子质量和蛋白质等电点(pI)分别为29.8 kDa和5.6。
通过多序列比对分析(图 1)预测ZHD11F的保守区域和催化三联体。结果表明ZHD11F中存在假定的催化三联体,即Ser105-Glu128- His245,进而推测ZHD11F是潜在的ZEN内酯水解酶。
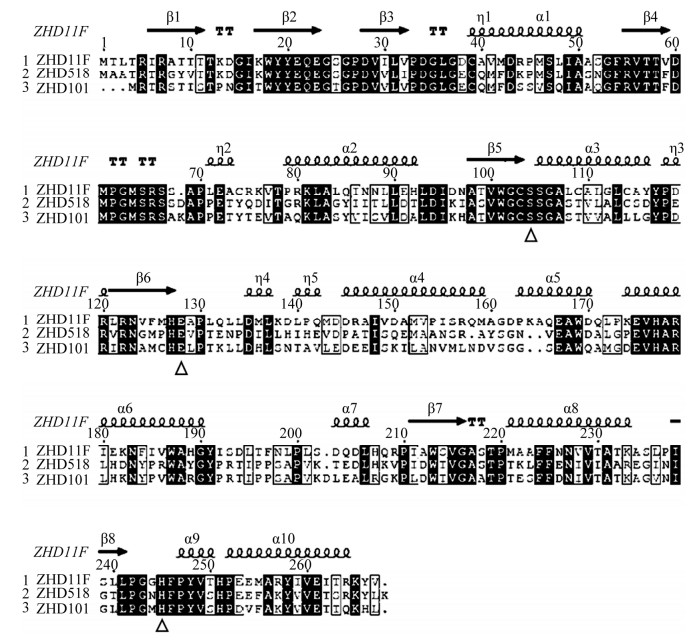
|
| 图 1 ZHD11F与ZHD518、ZHD101的序列比对 Figure 1 Sequence alignment of ZHD11F, ZHD518 and ZHD101. The predicted catalytic residues of ZHD11F (S105-E128-H245) were shown by a hollow triangle. |
2.2 ZHD11F的表达纯化
为了分析ZHD11F蛋白的功能,构建了ZHD11F的大肠杆菌BL21(DE3)/pET28a-zhd11f表达菌株,其N端含有6个组氨酸标签。对表达菌株进行诱导表达及蛋白纯化。将破菌后的细胞提取物与Ni-NTA树脂结合,用含有不同浓度梯度咪唑的缓冲液进行洗杂与洗脱,纯化后的蛋白用GE HiTrap脱盐柱脱盐。SDS-PAGE分析显示,ZHD11F以可溶性形式表达,且纯化后的ZHD11F以单带形式迁移,分子大小为35 kDa左右(图 2)。

|
| 图 2 重组蛋白ZHD11F纯化结果 Figure 2 Purification of recombinant ZHD11F. 12% SDS-PAGE analysis of ZHD11F purified from induced E. coli cells. Lane M: molecular weight maker, from top to bottom in turn are 180, 130, 100, 70, 55, 40, 35, 25, 15 kDa; lane 1: supernatant of induced ZHD11F; lane 2: eluent ZHD11F with 300 mmol/L imidazole; lane 3: imidazole free ZHD11F after desalinization. |
2.3 ZHD11F酶学性质的表征 2.3.1 温度对ZHD11F酶活及稳定性的影响
在10–55 ℃范围内,按照方法1.7测定ZHD11F对ZEN的活性,研究结果发现,在35–40 ℃之间ZHD11F对ZEN的降解效率最高(图 3A),在20–45 ℃之间能保持最高活性的40%以上,且ZHD11F在10 ℃仍能保持20%的相对活性,但当反应温度高于40 ℃时活性迅速下降。ZHD11F的热稳定性分析表明,ZHD11F在35 ℃孵育20 min可以保持原有活性不变,37 ℃孵育20 min可以保持最高活性的40%以上,但在40 ℃孵育20 min失去了75%以上的活性(图 3B)。结果说明ZHD11F是一种低温酶,在35 ℃以下具有较好的热稳定性。
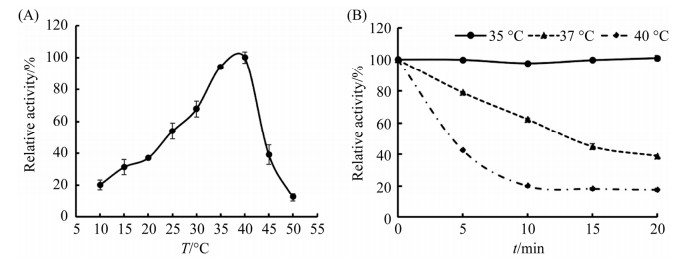
|
| 图 3 温度对ZHD11F酶活及稳定性的影响 Figure 3 Effects of temperature on the activity and stability of ZHD11F. A: effects of temperature on the activity of ZHD11F. To determine the optimum temperature of ZHD11F, the reactions were conducted from 10 ℃ to 50 ℃ in 50 mmol/L Tris-HCl buffer (pH 8.0). Maximum activity was set as 100%. B: effects of temperature on the stability of ZHD11F. The ZHD11F in 50 mmol/L Tris-HCl buffer (pH 8.0) was preincubated at 35 ℃, 37 ℃ and 40 ℃ for 20 min, respectively, sampling every 5 min, followed by residual activity determination at pH 8.0 and 35 ℃. The original activity was set as 100%. Each value of the assay was the arithmetic mean of triplicate measurements. |
2.3.2 pH对ZHD11F酶活及稳定性的影响
经检测发现,ZHD11F的最适pH为8.0,并且ZHD11F在pH 6.0–9.5的范围内具有超过60%的酶活性(图 4A)。pH稳定性结果显示,ZHD11F在pH 5.5–8.5之间保留了超过50%的残余活性(图 4B)。因此,ZHD11F是一种中性偏碱的ZEN降解酶,能够在广泛pH的范围内保持相对较高的活性。ZHD11F的最适反应温度和pH值分别为35 ℃和8.0,在此条件下对ZEN的比酶活为40.04 U/mg。

|
| 图 4 pH对ZHD11F酶活及稳定性的影响 Figure 4 Effects of pH values on the activity and stability of ZHD11F. A: effects of pH value on the activity of ZHD11F. The reactions were conducted at 35 ℃ with ZEN as substrate in different buffers. B: effects of pH value on the stability of ZHD11F. The stability of ZHD11F was determined from pH 5.0 to pH 9.0 at 4 ℃ for 16 h. After preincubation, the residual activity was measured at 35 ℃ and pH 8.0. Each value of the assay was the arithmetic mean of triplicate measurements. |
2.4 金属离子对ZHD11F活性的影响
测试了不同金属离子对ZHD11F催化活性的影响,结果显示添加K+或Ca2+等并不会影响酶的活性,添加Mg2+在一定程度上能够抑制酶活性,而添加Cu2+之后使得酶只保留10%的活性,添加5 mmol/L的EDTA对酶的活性几乎没有影响(表 2)。
| Metal ions (5 mmol/L) | Relative enzyme activity/% |
| No addition | 100.00 |
| Li+ (LiCl) | 94.88±6.86 |
| Na+ (NaCl) | 96.07±6.38 |
| Ca2+ (CaCl2) | 87.38±4.49 |
| Mg2+ (MgCl2) | 66.64±8.83 |
| K+ (KCl) | 91.86±2.96 |
| Co2+ (CoCl2) | 100.26±1.88 |
| Mn2+ (MnCl2) | 110.37±3.52 |
| Cu2+ (CuCl2) | 10.44±1.75 |
| EDTA (5 mmol/L) | 81.54±10.88 |
| All the reactions were performed at the optimum conditions (35 ℃ and pH 8.0) with ZEN as substrate. The activity of enzyme without any additions was set as 100%. | |
2.5 ZHD11F的结构建模及活性位点的测定
本研究以ZEN内酯水解酶ZHD518 (RmZHD,PDB ID:5XO8)的结构为模板,通过网站I-TASSER对ZHD11F的结构进行了模拟。使用Discovery Studio进行三级结构的可视化。ZHD11F的催化三联体Ser105-Glu128- His245与ZHD518 (Ser105-Glu129-His243)是对应的,都位于底物结合口袋中。对2个蛋白中的催化三联体进行标注,明显看到催化三联体之间摆动的角度以及距离均不同(图 5)。将ZHD11F的His245突变为Ala,突变体ZHD11F (H245A) 未检测到酶活性,这一结果表明,His245是ZHD11F的一个重要催化活性位点。

|
| 图 5 ZHD11F与ZHD518催化位点的比较 Figure 5 Comparison between ZHD11F and ZHD518 catalytic sites. Grey stick residues and numbers represented the positions and distances between catalytic residues of ZHD11F (Ser105-Glu128-His245). Black stick residues and numbers represented the positions and distances between catalytic residues of ZHD518 (Ser105-Glu129-His243). |
2.6 ZHD11F耐低温性质及热稳定性分析
Tang等的研究表明,蛋白柔性结构与loop区的增加可能是低温下具有高催化活性的原因之一[16]。将ZHD11F与ZHD518[9]进行结构比对。图 6中显示出,ZHD11F和ZHD518的整体结构上相差不大,但是ZHD11F的loop区明显增加,表明loop区可能是影响ZHD11F耐冷性的因素之一。

|
| 图 6 ZHD11F与ZHD518结构比较 Figure 6 Structure comparison between ZHD11F and ZHD518. The three-dimensional structure of ZHD11F was grey colored, and that of ZHD518 was black colored. The increased loop region in ZHD11F was marked with black circle. |
ZHD11F相比ZHD518[9]的热稳定性显著降低,为了分析热稳定性降低的可能原因,通过分子动力学(molecular dynamics,MD)模拟比较ZHD11F与ZHD518之间的差异。根据主干原子的均方根偏差(root-mean-square deviation,RMSD),所有酶在10 ns内达到平衡。文献显示整体的RMSD值越低,蛋白质灵活性越低,热稳定性越高[17]。图 7A中显示,ZHD11F的RMSD值低于ZHD518,表明ZHD518的结构更加稳定。接着将轨迹文件转换为RMSF随时间的波动数据以分析ZHD11F的灵活区域(图 7B),RMSF代表每个残基的柔韧性,柔韧性强的氨基酸残基在MD模拟中就会出现较大幅度的波动,相对应的RMSF的值就会很高。图 7B中显示,ZHD11F中的Ala73-Val77与Asp162-Glu167区域比ZHD518的相应位置更灵活,推测Ala73-Val77与Asp162-Glu167区域可能是ZHD11F灵活性增加的因素之一,从而降低了ZHD11F整体的热稳定性。

|
| 图 7 ZHD11F与ZHD518的RMSD值以及RMSF值用于热稳定性分析 Figure 7 The RMSD and RMSF values of ZHD11F and ZHD518 are used for thermal stability analysis. A: RMSD value of ZHD11F and ZHD518 during the 20 ns MD simulation; B: RMSF value of ZHD11F and ZHD518 during the 20 ns MD simulation. |
3 讨论与结论
玉米赤霉烯酮在世界范围内十分常见,是由镰刀菌产生的一种F2霉菌毒素,具有很强的雌激素毒性,广泛存在于谷类食物中[18]。利用生物酶法降解ZEN,将ZEN转化为无毒产物,相对于理化方法来说安全且高效。本研究结合生物信息学与酶学性质分析鉴定了一个Phialophora attae来源ZEN内酯水解酶ZHD11F,ZHD11F是一个全新的ZEN内酯水解酶。
对ZHD11F与其他已报道的ZEN内酯水解酶的酶学性质进行比较分析。第一,ZHD11F的最适反应温度为35 ℃,这与大多数ZEN内酯水解酶相似(35–40 ℃)。有趣的是,ZHD11F在20 ℃时保留了40%的酶活活性,10 ℃保留了20%以上的活性,这是目前尚未报道过的具有耐低温性质的ZEN内酯水解酶。热稳定性分析表明,ZHD11F在35 ℃以下具有较好的热稳定性,明显低于大多数的ZEN内酯水解酶(< 45 ℃)。第二,ZHD11F的最适pH值为8.0,除Clonostachys rosea IFO 7063来源的ZHD101[6]的最适pH为9.0以及Gliocladium roseum MA918来源的ZENG[12]的最适pH值为7.0,其余ZEN内酯水解酶最适pH值均为8.0。ZHD11F相比大多数ZEN内酯水解酶拥有更广泛的pH值范围,ZHD11F在pH 6.0–9.5的范围内保留了超过60%的残余活性,而ZHD518[9]、CbZHD[8]、ZHD607[11]、ZENG[12]和ZHD11B[13]分别在pH 6.0–9.0、pH 6.5–9.0、pH 6.0–8.5、pH 7.0–10.0和pH 6.0–9.5的范围内保留了60%以上的活性。第三,ZHD11F与其他ZEN内酯水解酶一样为非金属依赖酶。
ZHD11F和大部分已经报道过的ZHD家族ZEN内酯水解酶一样,具有较宽的反应温度、pH范围,且在中性条件下对ZEN的降解能力最强。但和其他已报道的ZEN降解酶不同,其具备低温下的活性优势。ZHD11F与已报道的ZEN内酯水解酶同源性最高的是ZHD518,结构分析显示,ZHD11F的loop区相较于ZHD518明显增加。Loop区的增多导致酶结构柔韧性的增加,使得酶的构象更容易发生改变,从而减少低温催化时的活化能,维持低温状态下酶的高活性。因此loop区增多导致蛋白柔性结构的增加可能是影响ZHD11F冷活性的重要因素。当然,不同的低温酶使用不同的策略维持低温下的柔韧性[19]。ZHD11F的热稳定性明显低于ZHD518,分子动力学模拟推测Ala73-Val77与Asp162-Glu167可能是影响ZHD11F的柔性结构的相关氨基酸残基,从而影响ZHD11F的热稳定性。关于ZHD11F冷活性的性质,值得在后续工作中进一步深入探讨和验证。在未来的研究中,可以对ZHD11F结构中的loop区以及整体结构中的柔性结构进行合理改造以用于工业应用。
本研究通过基因挖掘鉴定了1个Phialophora attae来源的低温ZEN内酯水解酶ZHD11F,对ZEN的催化活性为40.04 U/mg,在pH 6.0–9.5的范围内具有超过60%的酶活力。ZHD11F在35 ℃以下具有较好的稳定性,其活性在10 ℃和20 ℃时分别能保持20%和40%。更多的loop区增加结构柔韧性是ZHD11F稳定性较差、在低温活性比较高的主要原因。因此,ZHD11F的低温特性和宽广pH范围使得其可以作为ZEN降解酶机制研究的优秀候选者,同时拓展了Phialophora attae来源酶的功能研究。
| [1] | Wang N, Wu W, Pan J, Long M. Detoxification strategies for zearalenone using microorganisms: a review. Microorganisms, 2019, 7(7): E208. DOI:10.3390/microorganisms7070208 |
| [2] | Marin S, Ramos AJ, Cano-Sancho G, Sanchis V. Mycotoxins: occurrence, toxicology, and exposure assessment. Food and Chemical Toxicology, 2013, 60: 218-237. DOI:10.1016/j.fct.2013.07.047 |
| [3] | Hassan YI, Zhou T. Promising detoxification strategies to mitigate mycotoxins in food and feed. Toxins, 2018, 10(3): E116. DOI:10.3390/toxins10030116 |
| [4] | Shanakhat H, Sorrentino A, Raiola A, Romano A, Masi P, Cavella S. Current methods for mycotoxins analysis and innovative strategies for their reduction in cereals: an overview. Journal of the Science of Food and Agriculture, 2018, 98(11): 4003-4013. DOI:10.1002/jsfa.8933 |
| [5] | Varga J, Tóth B. Novel strategies to control mycotoxins in feeds: a review. Acta Veterinaria Hungarica, 2005, 53(2): 189-203. DOI:10.1556/avet.53.2005.2.4 |
| [6] | Takahashi-Ando N, Kimura M, Kakeya H, Osada H, Yamaguchi I. A novel lactonohydrolase responsible for the detoxification of zearalenone: enzyme purification and gene cloning. Biochemical Journal, 2002, 365(1): 1-6. DOI:10.1042/bj20020450 |
| [7] | Peng W, Ko TP, Yang YY, Zheng YY, Chen CC, Zhu Z, Huang CH, Zeng YF, Huang JW, Wang AHJ, Liu JR, Guo RT. Crystal structure and substrate-binding mode of the mycoestrogen-detoxifying lactonase ZHD from Clonostachys rosea. Royal Society of Chemistry Advances, 2014, 4(107): 62321-62325. |
| [8] | Hui R, Hu X, Liu W, Liu W, Zheng Y, Chen Y, Guo RT, Jin J, Chen CC. Characterization and crystal structure of a novel zearalenone hydrolase from Cladophialophora bantiana. Acta Crystallographica Section F-Structural Biology Communications, 2017, 73(pt 9): 515-519. |
| [9] | Wang M, Yin L, Hu H, Selvaraj JN, Zhou Y, Zhang G. Expression, functional analysis and mutation of a novel neutral zearalenone-degrading enzyme. International Journal of Biological Macromolecules, 2018, 118(pt a): 1284-1292. |
| [10] | Zheng YY, Liu WT, Chen CC, Hu XY, Liu WD, Ko TP, Tang XK, Wei HL, Huang JW, Guo RT. Crystal structure of a mycoestrogen-detoxifying lactonase from Rhinocladiella mackenziei: molecular insight into ZHD substrate selectivity. ACS Catalysis, 2018, 8(5): 4294-4298. DOI:10.1021/acscatal.8b00464 |
| [11] | Yu X, Tu T, Luo H, Huang H, Su X, Wang Y, Wang Y, Zhang J, Bai Y, Yao B. Biochemical characterization and mutational analysis of a lactone hydrolase from Phialophora americana. Journal of Agricultural and Food Chemistry, 2020, 68(8): 2570-2577. DOI:10.1021/acs.jafc.9b05853 |
| [12] | Zhang Z, Xu W, Wu H, Zhang W, Mu W. Identification of a potent enzyme for the detoxification of zearalenone. Journal of Agricultural and Food Chemistry, 2020, 68(1): 376-383. DOI:10.1021/acs.jafc.9b06223 |
| [13] | Jiang TZ, Wang MX, Li XY, Wang H, Zhao GQ, Wu P, Lu ZH, Zhang GM. The replacement of main cap domain to improve the activity of a ZEN lactone hydrolase with broad substrate spectrum. Biochemical Engineering Journal, 2022, 182: 108418. DOI:10.1016/j.bej.2022.108418 |
| [14] | Robert X, Gouet P. Deciphering key features in protein structures with the new ENDscript server. Nucleic Acids Research, 2014, 42(W1): W320-W324. DOI:10.1093/nar/gku316 |
| [15] | Roy A, Kucukural A, Zhang Y. I-TASSER: a unified platform for automated protein structure and function prediction. Nature Protocols, 2010, 5(4): 725-738. DOI:10.1038/nprot.2010.5 |
| [16] | Tang YM, Wu P, Jiang SJ, Selvaraj JN, Yang SH, Zhang GM. A new cold-active and alkaline pectate lyase from Antarctic bacterium with high catalytic efficiency. Applied Microbiology and Biotechnology, 2019, 103(13): 5231-5241. DOI:10.1007/s00253-019-09803-1 |
| [17] | Liu Y, Wan Y, Zhu J, Yu Z, Tian X, Han J, Zhang Z, Han W. Theoretical study on zearalenol compounds binding with wild type zearalenone hydrolase and V153H mutant. International Journal of Molecular Sciences, 2018, 19(9): E2808. DOI:10.3390/ijms19092808 |
| [18] | Caldwell RW, Tuite J, Stob M, Baldwin R. Zearalenone production by Fusarium species. Applied Microbiology, 1970, 20(1): 31-34. DOI:10.1128/am.20.1.31-34.1970 |
| [19] | Gianese G, Argos P, Pascarella S. Structural adaptation of enzymes to low temperatures. Protein Engineering, Design and Selection, 2001, 14(3): 141-148. DOI:10.1093/protein/14.3.141 |
 2022, Vol. 62
2022, Vol. 62




