中国科学院微生物研究所,中国微生物学会,中国菌物学会
文章信息
- 徐磊, 杨慧, 刘毅发, 杨子玚, 闫丽萍, 苏雅君, 刘小龙, 宋素泉, 张渊魁, 黄瑜. 2022
- XU Lei, YANG Hui, LIU Yifa, YANG Ziyang, YAN Liping, SU Yajun, LIU Xiaolong, SONG Suquan, ZHANG Yuankui, HUANG Yu.
- 猪脾转移因子对La Sota株鸡新城疫弱毒疫苗的免疫增强作用
- Immunoenhancement on Newcastle disease virus La Sota strain attenuated vaccine by pig spleen transfer factor
- 微生物学报, 62(2): 727-741
- Acta Microbiologica Sinica, 62(2): 727-741
-
文章历史
- 收稿日期:2021-07-03
- 修回日期:2021-09-29
- 网络出版日期:2021-10-26
2. 南京农业大学动物医学院, 江苏 南京 210095;
3. 兆丰华生物科技(南京)有限公司, 江苏 南京 211102;
4. 派生特(福州)生物科技有限公司, 福建 福州 350500;
5. 福建省农业科学院畜牧兽医研究所, 福建 福州 350013;
6. 福建省禽病防治重点实验室, 福建 福州 350013
2. College of Veterinary Medicine, Nanjing Agricultural University, Nanjing 210095, Jiangsu, China;
3. Zhaofenghua Biotechnology (Nanjing) Co., Ltd., Nanjing 211102, Jiangsu, China;
4. Present (Fuzhou) Biotech Company Limited, Fuzhou 350500, Fujian, China;
5. Institute of Animal Husbandry and Veterinary Medicine, Fujian Academy of Agricultural Sciences, Fuzhou 350013, Fujian, China;
6. Fujian Provincial Key Laboratory for Avian Diseases Control and Prevention, Fuzhou 350013, Fujian, China
鸡新城疫(Newcastle disease,ND)是由ND病毒(ND virus,NDV)强毒株感染鸡引起的一种急性、烈性传染病,给世界养鸡业造成了巨大经济损失[1]。NDV属于副黏病毒科、正禽腮腺炎病毒属,只有1种血清型,但具有多种基因型,可分为2个大的谱系:Ⅰ类(ClassⅠ)和Ⅱ类(ClassⅡ)。Class Ⅰ NDV主要为无毒和弱毒型。ClassⅡ NDV主要有Ⅰ–Ⅸ共9个基因型,且各毒株的毒力差异较大,其中,Ⅰ型主要为弱毒;Ⅱ型主要为强毒、中强毒和弱毒株;Ⅲ型至Ⅸ型主要为强毒和中等毒力[1–2],NDV经典强毒F48E9株即为基因Ⅸ型[3]。我国主要采用不同毒力的NDV弱毒疫苗和灭活疫苗防控ND,其中使用最广泛的La Sota弱毒疫苗株为基因Ⅱ型。我国主要流行的NDV基因型具有多样性,不同基因型毒株的生物学特性差异明显[4–5]。基因组较高频率的自身变异、NDV的多宿主特性和疫苗的频繁使用等多种因素,导致了NDV的不断进化、毒力多样性和抗原性变异,我国个别地区还出现了新基因型[6–7]。因此,NDV新型疫苗及其免疫佐剂的研发是将来工作方向[8–9]。
已有多种免疫佐剂用于增强NDV疫苗免疫效果的研究,其中,转移因子(transfer factor, TF)显示出了较好的免疫增效作用[10–12]。TF是由T淋巴细胞释放的一种细胞因子,由多肽和低聚核苷酸组成,分子量小于5 kDa,不含蛋白,无种属特异性、无抗原性、无毒副作用,可以提高动物免疫功能和缓解机体免疫抑制[13–15]。本课题组建立了具有自主知识产权的TF制备方法和检验技术[16–17]。包括本课题组在内的许多学者,在TF提高ND抗体效价、淋巴细胞转化水平、巨噬细胞吞噬能力、T淋巴细胞活力等免疫学指标方面开展了深入研究[18–21],然而在TF提高NDV疫苗攻毒保护率及其作用机理方面鲜有报道。
基于此,为了进一步明确TF对La Sota株鸡新城疫弱毒疫苗的免疫增强作用及其机理,本实验对NDV La Sota弱毒疫苗株与TF联合免疫后NDV F48E9强毒株攻毒的免疫应答进行研究,应用蛋白质芯片技术和血凝抑制(hemagglutination inhibition,HI)试验研究La Sota株感染后鸡外周血细胞因子浓度和ND HI抗体效价(log2x)的动态变化规律,并采用荧光定量RT-PCR方法检测F48E9株攻毒后鸡病毒血症水平,以期为NDV疫苗免疫机理研究、疫苗免疫佐剂研发和更有效预防NDV提供依据。
1 材料与方法 1.1 疫苗与病毒株NDV La Sota株弱毒疫苗(107.17 EID50/羽份)由兆丰华生物科技(南京)有限公司提供,NDV F48E9株强毒[3](105.0 ELD50/mL)由福建省农业科学院畜牧兽医研究所提供。
1.2 主要试剂及仪器Chicken Cytokine Array Kit购自Ray Biotech公司,标准NDV HI抗原(La Sota株)购自中国兽医药品监察所,RNA提取试剂盒购自凯杰生物工程(深圳)有限公司,反转录试剂盒购自GE公司,Taq DNA聚合酶购自Promega公司;Innoscan 300动态激光共聚焦扫描仪购自Innopsys公司,CFX96型荧光定量PCR仪购自BioRad公司,动物饲养隔离器购自苏州市冯氏实验动物设备有限公司。
1.3 TF制备按照本课题组已授权发明专利制备猪脾TF[16–17]:以健康猪脾脏为原料,经匀浆、细胞破碎、分离、灭活、微滤、超滤后精制而成。经检验,所制备TF的pH值、多肽含量、核糖含量和脱E受体法活力分别为7.0 mg/mL、3.5 mg/mL、72.0 μg/mL和15%,细菌内毒素含量小于10 EU/mL,在252 nm波长处有最大吸收,D260 nm/D280 nm比值为2.23,无菌检验、外源病毒检验、支原体检验、蛋白质定性检验、过敏反应检查、异常毒性检查、热原检验和安全检验均合格。
1.4 实验动物SPF鸡购自济南斯帕法斯家禽有限公司(许可证号:SCXK(鲁) 2018 0005)。动物实验在派生特(福州)生物科技有限公司实验动物使用许可实验室(许可证号:SYXK(闽) 2019-0006)开展,并经过了其实验动物管理委员会及实验动物福利伦理委员会的审查,开展动物实验的技术人员、饲养员均具有福建省实验动物从业人员岗位证书。SPF鸡攻毒前在正压动物饲养隔离器中饲养,并给予足够营养的饲料和清洁的饮水;30日龄免疫接种,操作时温和保定,善良抚慰,减少应激反应;44日龄转至负压动物饲养隔离器中攻毒饲养,转运输SPF鸡时给予舒适的环境,避免拥挤,试验结束时对存活鸡采用二氧化碳吸入窒息法进行安乐死。
1.5 TF对La Sota株弱毒疫苗的免疫增强作用分析选取200羽SPF鸡随机分为10组,每组20羽,分别为:单独免疫组1与联合免疫组1 (均点眼免疫105.17 EID50 La Sota株弱毒疫苗)、单独免疫组2与联合免疫组2(均点眼免疫104.17 EID50 La Sota株弱毒疫苗)、单独免疫组3与联合免疫组3(均点眼免疫103.17 EID50 La Sota株弱毒疫苗)、单独免疫组4与联合免疫组4 (均点眼免疫102.17 EID50 La Sota株弱毒疫苗)、对照组1与空白组1 (均不免疫),同时,4个联合免疫组均肌肉注射0.2 mL TF。免疫后14 d,4个单独免疫组、4个联合免疫组与对照组1均肌肉注射0.5 mL (即:104.7 ELD50) NDV F48E9株强毒,并设立空白组1为非免疫非攻毒组,见表 1。每日观察临床症状至攻毒后14 d,剖检病死鸡和试验结束时存活鸡,SPF鸡发病即判为不保护,统计各剂量组SPF鸡的发病率和死亡率,按Reed-Muench法计算半数保护量(median protective dose,PD50)[22]。
| Designation (n) | TF | La Sota strain attenuated vaccine | Virulent strain F48E9 | |||
| Dose/(mL) | Route | Dose/(EID50) | Route | Dose/(ELD50) | Route | |
| Single vaccine group 1 (20) | 0 | / | 105.17 | Eye-drop | 104.7 | i.m. |
| Single vaccine group 2 (20) | 0 | / | 104.17 | |||
| Single vaccine group 3 (20) | 0 | / | 103.17 | |||
| Single vaccine group 4 (20) | 0 | / | 102.17 | |||
| Co-vaccination group 1 (20) | 0.2 | i.m. | 105.17 | |||
| Co-vaccination group 2 (20) | 104.17 | |||||
| Co-vaccination group 3 (20) | 103.17 | |||||
| Co-vaccination group 4 (20) | 102.17 | |||||
| Control group 1 (20) | 0 | / | 0 | / | ||
| Blank group 1 (20) | 0 | / | 0 | / | 0 | / |
| “/” means untreated by the item. | ||||||
1.6 TF增强La Sota株弱毒疫苗免疫效力的机理分析
选取240羽SPF鸡随机分为4组,每组60羽,分别为:单独免疫组、联合免疫组、对照组与空白组,其免疫及攻毒试验设计分别与单独免疫组2、联合免疫组2、对照组1、空白组1一致,并分别于免疫前3 d、免疫后7、14 d以及攻毒后1、3、7、14 d依次抽取各组不重复的5羽SPF鸡(攻毒后优先抽取临床健康鸡),经前翅静脉采集、分离血清进行IL-6、IL-10、IL-16、IL-21共4种细胞因子浓度、ND HI抗体效价和攻毒后NDV F48E9株的病毒血症检测,并统计各组攻毒后的死亡率、发病率和保护率。
1.6.1 血清中IL-6、IL-10、IL-16和IL-21含量测定按照Chicken Cytokine Array Kit操作步骤进行,采用动态激光共聚焦扫描仪读取荧光信号,建立标准曲线,计算样品IL-6、IL-10、IL-16和IL-21浓度。若细胞因子浓度低于阴性对照标准品的荧光信号而不可检出时,本试验以0 pg/mL表示。所得数据用单因素方差分析和最小显著性差法(LSD)分析,P < 0.05为差异显著。
1.6.2 ND HI抗体效价测定ND HI抗体效价测定按照中华人民共和国出入境检验检疫行业标准《新城疫检疫技术规范》(SN/T 0764-2011)进行[23],HI试验测定结果以log2x表示。
1.6.3 血清中NDV F48E9株强毒的检测依据课题组已建立的基因Ⅸ型NDV荧光定量RT-PCR检测方法[24],进行攻毒后血清中NDV F48E9株的病毒血症检测,简述如下。合成特异性引物序列(P1:5′-AGGACACTGACTACT TTG-3′,P2:5′-CCGATAATGGCACCTATA-3′)和TaqMan MGB探针5′-CGT-CTCTGCCTCCT TCCTCC-3′,探针5′端标记的荧光报告基团为FAM,3′端标记的荧光淬灭基团为MGB,扩增片段113 bp。提取病毒核酸,按照下述反应程序完成荧光定量RT-PCR检测:42 ℃反转录30 min;92 ℃预变性10 s,45 ℃ 30 s,72 ℃ 1 min,5个循环;92 ℃ 10 s,60 ℃延伸30 s (此处收集荧光),40个循环。
2 结果与分析 2.1 TF对La Sota株弱毒疫苗的免疫增强作用 2.1.1 临床症状及攻毒保护率免疫后,各组鸡TF注射部位无局部不良反应,且临床表现均正常。攻毒后,单独免疫组1和联合免疫组1的鸡均无发病和死亡,即全部鸡判为保护,保护率为100%。单独免疫组2共有9羽鸡于攻毒2 d后开始出现ND典型临床症状,则11羽鸡判为保护,即保护率为55% (11/20);其中9羽发病鸡中,1羽鸡于攻毒10 d后临床表现恢复正常,余下8羽鸡于攻毒后第3、4和5天分别死亡2、3、3羽,死亡率为40% (8/20)。联合免疫组2共有5羽鸡于攻毒3 d后开始出现ND典型临床症状,则15羽鸡判为保护,即保护率为75% (15/20);其中5羽发病鸡中,1羽鸡于攻毒9 d后临床表现恢复正常,余下4羽鸡于攻毒后第4 d和5 d分别死亡3羽、1羽,死亡率为20% (4/20)。攻毒后,单独免疫组3和4、联合免疫组3和4的全部鸡均于攻毒2 d后开始出现ND典型临床症状,即全部鸡判为不保护,保护率均为0%;其中,联合免疫组3和4最后病死鸡的日龄相比单独免疫组3和4分别延迟了1 d,单独免疫组3、联合免疫组3、单独免疫组4和联合免疫组4鸡均全部死亡,死亡时间分别集中在:攻毒后3 d至5 d、3 d至6 d、3 d至4 d、3 d至5 d,即死亡率均为100%。此外,攻毒后对照组1开始出现临床症状和病死鸡的日龄最早,分别为攻毒后第1天和第2天,20羽鸡均全部发病并死亡,死亡时间集中在攻毒后2 d至4 d,即:死亡率为100% (20/20),保护率为0% (0/20)。试验中,空白组1鸡均无发病、无死亡(图 1和图 2)。
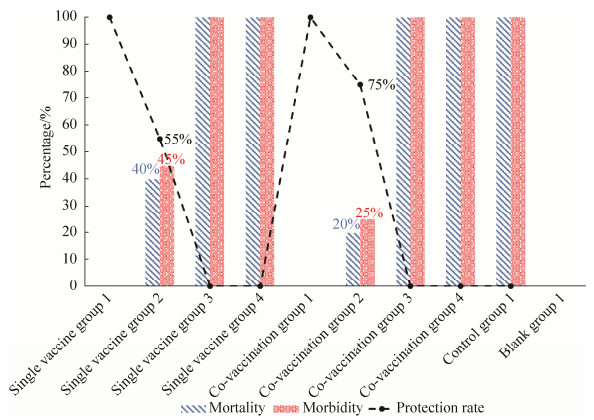
|
| 图 1 攻毒后各组的死亡率、发病率和保护率 Figure 1 The mortality, morbidity and protection rate of each group after challenge. |
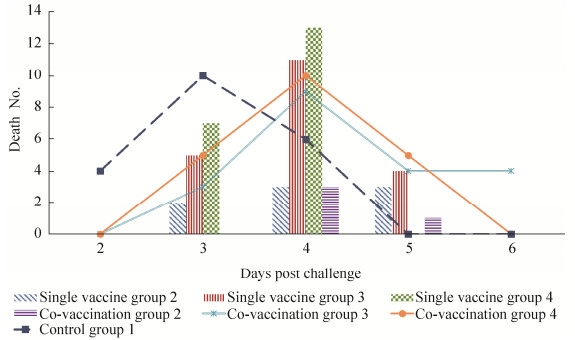
|
| 图 2 死亡数量和时间 Figure 2 Death No. and time. |
2.1.2 剖检变化及PD50
攻毒后,各组病死鸡出现全身粘膜和浆膜出血,心冠脂肪有针尖大小出血点,脑部点状出血且有炎症,肾脏出血、肿大,肌胃角质层下有出血点,气管和腺胃乳头出血,腺胃粘膜水肿,脾脏表面有白色坏死点,嗉囊充满酸臭味的稀薄液体,十二指肠弥漫性出血,空肠与回肠有溃疡,盲肠扁桃体枣核样坏死,直肠出血、坏死,泄殖腔粘膜出血等ND典型剖检病变。攻毒后,单独免疫组2与联合免疫组2中各有1羽病愈鸡,没有出现ND典型剖检病变,仅十二指肠和腺胃乳头出现少量的出血点,脾脏表面出现少量的白色坏死点。攻毒后14 d,剖检各组免疫保护鸡和空白组1鸡,没有发现上述病变。
统计NDV La Sota株弱毒疫苗各不同剂量组的攻毒试验结果并计算PD50(表 2),结果显示,单独免疫组和联合免疫组中疫苗的一个PD50分别为12 023 EID50和6 918 EID50,表示该La Sota株弱毒疫苗单独接种需要12 023 EID50可以使50%的鸡获得攻毒保护,而与TF联合免疫仅需接种6 918 EID50即可使50%的鸡获得攻毒保护,比单独免疫组中疫苗PD50减少了42.5%。
| Groups | Inoculation dose | Observational results | Cumulative results | |||||
| NDV vaccines/ EID50 |
TF/mL | Morbidity No. | Protection No. | Protection ratio | Morbidity No. | Protection No. | Protection rate/% | |
| Single vaccine group 1 | 105.17 | 0 | 0 | 20 | 20/20 | 0 | 31 | 100 |
| Single vaccine group 2 | 104.17 | 0 | 9 | 11 | 11/20 | 9 | 11 | 55 |
| Single vaccine group 3 | 103.17 | 0 | 20 | 0 | 0/20 | 29 | 0 | 0 |
| Single vaccine group 4 | 102.17 | 0 | 20 | 0 | 0/20 | 49 | 0 | 0 |
| Co-vaccination group 1 | 105.17 | 0.2 | 0 | 20 | 20/20 | 0 | 35 | 100 |
| Co-vaccination group 2 | 104.17 | 0.2 | 5 | 15 | 15/20 | 5 | 15 | 75 |
| Co-vaccination group 3 | 103.17 | 0.2 | 20 | 0 | 0/20 | 25 | 0 | 0 |
| Co-vaccination group 4 | 102.17 | 0.2 | 20 | 0 | 0/20 | 45 | 0 | 0 |
| Single vaccine groups: distance ration=(55%–50%)/(55%–0%)=0.09; lg PD50=4.17+0.09×(–1)=4.08. Co-vaccination groups: distance ration=(75%–50%)/(75%–0%)=0.33; lg PD50=4.17+0.33×(–1)=3.84. | ||||||||
2.2 TF增强La Sota株弱毒疫苗免疫效力的机理
在TF增强La Sota株弱毒疫苗免疫效力的机理分析中,单独免疫组、联合免疫组、对照组与空白组各有60羽鸡,其免疫及攻毒试验设计分别与上述免疫增强作用分析中单独免疫组2(20羽鸡)、联合免疫组2(20羽鸡)、对照组1(20羽鸡)、空白组1(20羽鸡)一致,试验结果如下。
2.2.1 攻毒保护结果统计攻毒后各组的死亡率、发病率和保护率(图 3),结果显示,联合免疫组的死亡率、发病率和保护率分别为25%、25%和75%,单独免疫组分别为45%、45%和55%,对照组分别为100%、100%和0%,空白组鸡无发病和死亡。
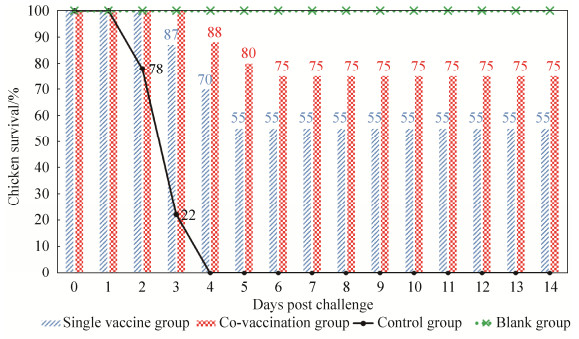
|
| 图 3 攻毒后各组试验鸡的存活情况 Figure 3 The survival chickens of each group after challenge. |
2.2.2 IL-6含量的变化
免疫前IL-6含量,各组接近且差异不显著。免疫后,联合免疫组与单独免疫组明显增加,分别于攻毒后第1天和第3天达到高峰值(1 178.31 pg/mL和956.63 pg/mL),联合免疫组于免疫后第7天、第14天和攻毒后1 d、7 d高于其余组,但差异不显著。攻毒后,对照组明显增加,于攻毒后第3天达到最高值(936.46 pg/mL),此时对照组IL-6含量与联合免疫组、单独免疫组差异不显著,但均极显著高于空白组(P < 0.01)。试验中,空白组鸡IL-6含量稳定,均值维持在157.80 pg/mL左右,见图 4。
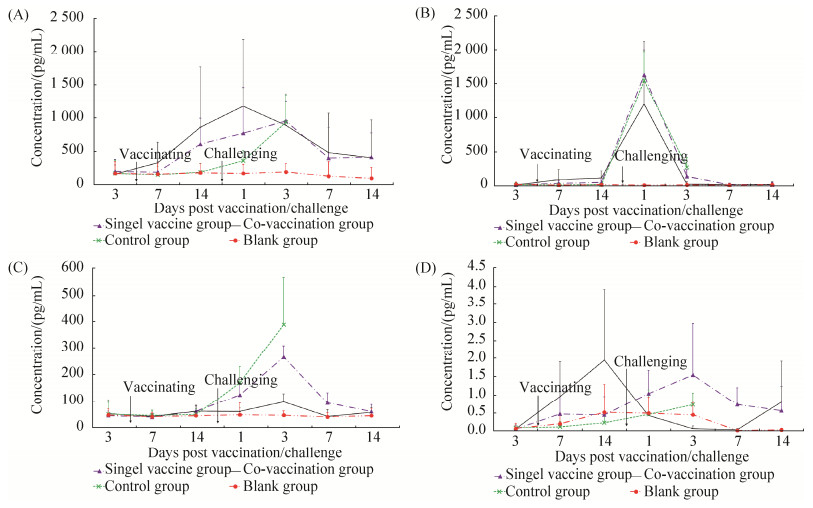
|
| 图 4 免疫或攻毒后各组实验鸡外周血IL-6、IL-10、IL-16和IL-21的变化 Figure 4 Levels of IL-6 (A), IL-10 (B), IL-16 (C) and IL-21 (D) in PBMC after vaccination or challenge. The standard deviation in the figure is the square root of the variance of the cytokine content in the group at each time point, reflecting the degree of dispersion between the cytokine content of individuals within the group at each time point. |
2.2.3 IL-10含量的变化
免疫前IL-10含量,各组接近且差异不显著。免疫后尤其是攻毒后,联合免疫组与单独免疫组明显增加,均于攻毒后第1天达到高峰值,分别为1 198.81 pg/mL和1 627.41 pg/mL,联合免疫组于免疫后第7天、第14天高于其余组,但差异不显著。攻毒后,对照组明显增加,于攻毒后第1天达到高峰值(1 546.21 pg/mL),此时对照组IL-10含量与联合免疫组、单独免疫组差异不显著,但均极显著高于空白组(P < 0.01);攻毒后第3天对照组IL-10含量(270.38 pg/mL)极显著高于其余组(P < 0.01),而此时联合免疫组、单独免疫组与空白组差异不显著。试验中,空白组鸡IL-10含量稳定,均值维持在15.40 pg/mL左右,见图 4。
2.2.4 IL-16含量的变化免疫前IL-16含量,各组接近且差异不显著。免疫后第14天,联合免疫组和单独免疫组IL-16含量接近且略高于其余组,但差异不显著。攻毒后,联合免疫组、单独免疫组与对照组明显增加,均于攻毒后第3天达到最高值,分别为97.25 pg/mL、265.06 pg/mL与388.39 pg/mL。其中,攻毒后第1天和第3天单独免疫组与对照组极显著高于联合免疫组与空白组(P < 0.01),攻毒后第7天单独免疫组显著高于联合免疫组与空白组(P < 0.05)。试验中,空白组鸡IL-16含量稳定,均值维持在44.90 pg/mL左右,见图 4。
2.2.5 IL-21含量的变化免疫前IL-21含量,各组接近且差异不显著。免疫后,联合免疫组明显增加,于免疫后第14天达到高峰值(1.94 pg/mL),且于免疫后第7天、第14天高于其余组,但差异不显著。攻毒后,单独免疫组与对照组明显增加,均于攻毒后第3天达到最高值,分别为1.54 pg/mL与0.72 pg/mL,单独免疫组于攻毒后第1、3和7天均高于其余组,其中,攻毒后第3天单独免疫组显著高于联合免疫组与空白组(P < 0.05),攻毒后第7天单独免疫组极显著高于联合免疫组与空白组(P < 0.01)。试验中,空白组鸡IL-21含量稳定,均值维持在0.24 pg/mL左右,见图 4。
2.2.6 ND HI抗体效价测定结果免疫前,各组ND HI抗体均不可检出。免疫后ND HI抗体效价,联合免疫组和单独免疫组均明显增加,均于第7天达到峰值,联合免疫组(7和5.2)于第7天、14天均高于单独免疫组(4.4和4),分别提高了2.6和1.2,并于第7天差异极显著(P < 0.01)。攻毒后ND HI抗体效价,联合免疫组和单独免疫组于第1天均明显下降,分别为2和2.6;但是,均于3 d后明显增加,其中,联合免疫组(4.4、8.4和7.3)于第3天、7天和14天均高于单独免疫组(3.8、8和6.6),分别提高了0.6、0.4和0.7,但差异不显著。试验中,对照组和空白组ND HI抗体均不可检出,见图 5。
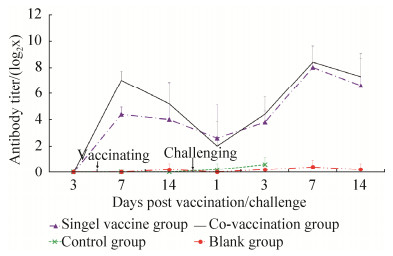
|
| 图 5 免疫或攻毒后各组ND HI抗体的变化 Figure 5 Levels of ND HI antibody after vaccination or challenge. The standard deviation in the figure is the square root of the variance of the ND HI antibody titer in the group at each time point, reflecting the degree of dispersion between the ND HI antibody titer of individuals within the group at each time point. |
2.2.7 血清中NDV F48E9株强毒的检测结果
攻毒后NDV F48E9株强毒的病毒血症占比(表 3),联合免疫组和单独免疫组均下降,分别于第3天和第7天后降为0%。其中于第1和3天,联合免疫组(20%和0%)比单独免疫组(40%和20%)均减少了20%。对照组最高,第1和3天均达到100%。而空白组为0%。
| Groups | Proportion of viremia | |||
| 1 dpc | 3 dpc | 7 dpc | 14 dpc | |
| Single vaccine group | 2/5 (40%) | 1/5 (20%) | 0/5 (0%) | 0/5 (0%) |
| Co-vaccination group | 1/5 (20%) | 0/5 (0%) | 0/5 (0%) | 0/5 (0%) |
| Control group | 5/5 (100%) | 5/5 (100%) | ||
| Blank group | 0/5 (0%) | 0/5 (0%) | 0/5 (0%) | 0/5 (0%) |
| “dpc” means days post challenge. | ||||
3 讨论
NDV是一种持续进化的病毒,先后出现了多个基因型。因免疫的日龄、剂量、途径以及攻毒的毒株、剂量、途径等的不同,La Sota株弱毒疫苗免疫鸡对不同基因型NDV强毒株的攻毒保护结果不同[25–26]。在本研究中,点眼免疫105.17、104.17、103.17和102.17 EID50 La Sota株弱毒疫苗对104.7 ELD50 NDV F48E9株强毒的攻毒保护率,单独免疫组分别为100%、55%、0%和0%,而联合免疫组分别为100%、75%、0%和0%。其中,免疫104.17 EID50 La Sota株弱毒疫苗时与单独免疫组2的攻毒保护率(55%)相比,联合免疫组2的攻毒保护率(75%)显著提高,提高了20%。结果还显示,联合免疫组中疫苗PD50为6 918 EID50,比单独免疫组中疫苗PD50(12 023 EID50)减少了42.5%,表明与La Sota株弱毒疫苗单独免疫相比,其与TF联合免疫时仅需57.5%的NDV病毒含量即可使免疫鸡获得相同的攻毒保护。这些表明,TF可增强La Sota株弱毒疫苗的攻毒保护率。
20世纪80年代起我国主要以全面免疫NDV疫苗防控ND,对控制ND流行发挥了关键作用。但是,随后我国ND流行病学特点出现了新变化,如:非典型性NDV越来越普遍、多种基因型并存、免疫失败现象日益严重等[1, 7]。本研究观察攻毒后各组鸡临床表现和剖检变化,结果显示,免疫保护鸡均正常,病死鸡呈现出ND典型临床和剖检变化,单独免疫组2与联合免疫组2各有1羽病愈鸡临床症状典型而剖检病变不典型。其中,攻毒后对照组1开始出现临床症状鸡(第1天)和病死鸡(第2天)的日龄最早;相比单独免疫组2,联合免疫组2开始出现临床症状鸡和病死鸡的日龄推迟1 d,而病愈鸡提前1 d恢复正常;相比单独免疫组3和4,联合免疫组3和4最后病死鸡日龄分别推迟1 d。临床症状和剖检变化结果表明,TF联合La Sota株弱毒疫苗联合免疫效果优于单独免疫。
TF是一种安全的免疫制剂[12−21],本研究结果也验证了TF的安全性,肌注后各组鸡临床表现健康。猪脾TF的原料为屠宰废弃物,资源丰富。研究显示,TF无种属特异性[13−17],鸡脾TF和猪脾TF均可增强鸡体免疫功能和鸡疫苗免疫效果[18−21],但鸡脾TF作用于鸡的效果会优于猪脾TF[10−11]。与此研究结果相似,来源于鸡法氏囊的囊素与La Sota株弱毒疫苗联合免疫时攻毒保护率明显高于猪脾TF,而疫苗PD50则明显低于猪脾TF(本课题组研究将另文报道)。囊素对La Sota株弱毒疫苗的免疫增强作用会明显高于猪脾TF,这些是否与免疫佐剂来源动物的种间差异有关需要进一步验证,为疫苗佐剂的研发提供了参考。
在免疫应答和抗感染免疫反应过程中细胞因子发挥着重要作用,IL-6与IL-10均属于Th2型细胞因子,可促进体液免疫应答[27−29]。IL-16是CD4+ T细胞的刺激生长因子和趋化因子,具有免疫调节作用,可诱导IL-2、IL-6及GM-CSF等细胞因子的表达[30]。IL-21是由活化的CD4+ T细胞分泌产生的多功能生物学免疫调节因子,可促进原始CD4+ T细胞向Th1和Th17细胞分化,在促进机体由先天性免疫向获得性免疫的转变中发挥关键作用[31]。本研究采用了蛋白质芯片技术测定上述细胞因子含量,该技术是继以检测RNA和DNA为基础的基因芯片技术后又一项用于生命科学研究的技术平台,其首先在载体(如固相支持物)表面固定大量高密度排列的蛋白探针点阵以制备成芯片,然后将芯片和待检液体样品(体液、细胞和组织提取物)进行孵育反应,反应后用相应的检测系统(如本研究采用的动态激光共聚焦扫描仪)进行检测,通过计算机分析并获得相应蛋白质的表达情况,具有特异性强、敏感性高、重复性好、高通量、微型化、自动化等优点,被广泛应用于蛋白质组学研究、新药研发以及疾病临床诊断等多个生命科学领域,并形成了不同技术基础的蛋白质芯片,如:本研究采用的Ray Biotech公司基于多重夹心ELISA技术的微阵列蛋白质芯片、Ciphergen Biosystems公司基于表面加强激光解吸电离-飞行时间质谱技术的化学型蛋白质芯片、Biochinoup公司基于椭偏光学生物传感技术的光学蛋白质芯片[32]。
本研究细胞因子检测结果显示,免疫后联合免疫组IL-6、IL-10和IL-21含量明显增加,并于免疫后7 d、14 d高于其余组,但差异不显著。其中,联合免疫组IL-6含量高峰值(1 178.31 pg/mL)出现时间(攻毒后1 d)比单独免疫组和对照组(攻毒后3 d)提前了2 d,且峰值更高,比单独免疫组和对照组高峰值(956.63 pg/mL与936.46 pg/mL)分别提高了221.68 pg/mL与241.85 pg/mL。而联合免疫组IL-21含量于免疫后第14天达到高峰值(1.94 pg/mL),比单独免疫组和对照组(攻毒后第3天)高峰值(1.54 pg/mL与0.72 pg/mL)分别提高了0.4 pg/mL与1.22 pg/mL。而IL-16含量没有受NDV La Sota弱毒株免疫和TF肌注的影响,免疫后各组IL-16含量接近。表明TF可提高NDV La Sota弱毒株免疫后IL-6、IL-10和IL-21介导的免疫应答。
IL-6、IL-16和IL-21均为促炎性细胞因子。其中,IL-6可诱导产生急性期蛋白,引发急性期炎性应答反应。IL-16可诱导炎症部位的Th1细胞的迁移、聚集和激活。IL-21是触发、促进炎症反应并导致组织损伤的关键因子[27–28, 30–31]。在本研究中,攻毒后对照组IL-6、IL-16和IL-21含量明显增加。其中,IL-6含量,攻毒后第3天对照组与联合免疫组、单独免疫组差异不显著,但均极显著高于空白组(P < 0.01);IL-16含量,攻毒后第1天和第3天单独免疫组与对照组极显著高于联合免疫组与空白组(P < 0.01),攻毒后第7天单独免疫组显著高于联合免疫组与空白组(P < 0.05);IL-21含量,攻毒后第3天单独免疫组显著高于联合免疫组与空白组(P < 0.05),攻毒后第7天单独免疫组极显著高于联合免疫组与空白组(P < 0.01)。对照组鸡全部死亡前最后一个采血点(攻毒后第3天)的IL-6、IL-16和IL-21含量(936.46 pg/mL、388.39 pg/mL与0.72 pg/mL),分别是此时空白组(193.21 pg/mL、46.24 pg/mL与0.44 pg/mL)的4.8倍、8.4倍与1.6倍。结果表明,IL-6、IL-16和IL-21在NDV F48E9株强毒诱导的炎症反应过程中发挥重要的作用,与其他学者研究结果一致[33],TF可降低NDV F48E9株强毒攻毒后IL-16和IL-21介导的炎症反应。
IL-10是细胞因子合成抑制因子(cytokine synthesis inhibitory factor, CSIF),对免疫应答主要起抑制作用,从而防止过度免疫应答所造成的损害[29]。在本研究中,攻毒后IL-10含量,对照组、单独免疫组与联合免疫组明显增加,于攻毒后第1天即达到高峰值,攻毒后第3天仍分别达到270.38 pg/mL、137.78 pg/mL与27.43 pg/mL,是空白组IL-10含量(15.34 pg/mL)的17.6倍、9.0倍和1.8倍,此时对照组IL-10含量极显著高于其余组(P < 0.01),而联合免疫组、单独免疫组与空白组差异不显著。结果表明,TF可降低NDV F48E9株强毒攻毒后IL-10的免疫应答抑制作用,与其他学者研究结果不同[34],这可能源于本研究采用的研究方法(La Sota弱毒株免疫后F48E9强毒株攻毒)不同。此外,IL-10还是抗炎性细胞因子,可抑制活化的T细胞产生IL-2、IFN-γ等促炎性细胞因子,对炎症反应具有限制作用,在终止炎症反应过程中起重要作用[29]。相比联合免疫组,攻毒后单独免疫组与对照组具有更高的IL-10含量,更有利于抵抗IL-6、IL-16和IL-21介导的炎症反应,但IL-10介导的免疫应答抑制作用会更强,其在NDV F48E9株发病机理中的作用有待进一步研究。
ND HI抗体效价在鸡攻毒保护中发挥重要作用[35],本研究结果也印证了这一点:攻毒后联合免疫组和单独免疫组存活鸡均有较高的ND HI抗体效价,而对照组ND HI抗体始终不可检出。有学者研究显示,市售NDV弱毒疫苗在免疫10–2羽份时对部分NDV强毒株的攻毒保护率可到90%以上,并具有较高的ND HI抗体效价[36]。在本研究中,免疫10–3羽份(即:104.17 EID50)后,联合免疫组ND HI抗体效价(7和5.2)于第7天、第14天均高于单独免疫组(4.4和4),分别提高了2.6和1.2,并于第7天差异极显著(P < 0.01),表明TF可提高NDV La Sota弱毒株的ND HI抗体效价。
NDV F48E9株强毒攻毒后,不同免疫背景鸡的各部位中病毒载量变化不同[37−38]。本研究中,攻毒后第1天联合免疫组与单独免疫组NDV F48E9株的病毒血症占比分别为20%与40%,这与攻毒后第1天两组的ND HI抗体效价明显下降(分别为2和2.6)是否有关及其机理有待进一步研究。攻毒后第1天和第3天对比单独免疫组,联合免疫组NDV F48E9株的病毒血症占比减少了20%。结果表明,TF与NDV弱毒疫苗La Sota株联合免疫可增强ND抗体水平,降低NDV F48E9株强毒攻毒鸡的病毒血症。
4 结论本研究通过攻毒保护试验、细胞因子浓度、ND HI抗体效价和病毒血症水平测定,解析了TF对La Sota株NDV弱毒疫苗的免疫增强作用及机理,揭示了TF可通过提高NDV La Sota弱毒株免疫后IL-6、IL-10、IL-21介导的免疫应答和ND HI抗体效价,以及通过降低NDV F48E9强毒株攻毒后IL-16、IL-21介导的炎症反应、IL-10介导的免疫应答抑制作用和病毒血症,进而提高La Sota株弱毒疫苗的免疫保护率和降低疫苗PD50。
| [1] |
Hu SL, Liu XF. The heredity and evolution of Newcastle disease virus. Chinese Bulletin of Life Sciences, 2016, 28(3): 295-302.
(in Chinese) 胡顺林, 刘秀梵. 新城疫病毒的遗传进化. 生命科学, 2016, 28(3): 295-302. |
| [2] | Miller PJ, Decanini EL, Afonso CL. Newcastle disease: evolution of genotypes and the related diagnostic challenges. Infection, Genetics and Evolution, 2010, 10(1): 26-35. DOI:10.1016/j.meegid.2009.09.012 |
| [3] | Qiu XS, Sun Q, Wu S, Dong L, Hu SL, Meng CC, Wu YT, Liu XF. Entire genome sequence analysis of genotype Ⅸ Newcastle disease viruses reveals their early-genotype phylogenetic position and recent-genotype genome size. Virology Journal, 2011, 8(1): 117. DOI:10.1186/1743-422X-8-117 |
| [4] | Liu YQ, Sun CX, Chi MM, Wen HL, Zhao L, Song YY, Liu N, Wang ZY. Genetic characterization and phylogenetic analysis of Newcastle disease virus from China. Infection, Genetics and Evolution, 2019, 75: 103958. DOI:10.1016/j.meegid.2019.103958 |
| [5] | Dimitrov KM, Afonso CL, Yu QZ, Miller PJ. Newcastle disease vaccines—a solved problem or a continuous challenge?. Veterinary Microbiology, 2017, 206: 126-136. DOI:10.1016/j.vetmic.2016.12.019 |
| [6] | Wei TC, Deng QM, Zhai GS, He CW, Li HQ, Zhang YQ, Zeng RL, Mo ML, Huang T, Wei P. Re-emergence of a genotype Ⅷ virulent Newcastle disease virus isolated from Chinese game fowl after 13 years. Transboundary and Emerging Diseases, 2019, 66(2): 1077-1084. DOI:10.1111/tbed.13129 |
| [7] |
Liu HL, Wang ZL. The history and current status of Newcastle disease. China Animal Health Inspection, 2015, 32(6): 1-4.
(in Chinese) 刘华雷, 王志亮. 新城疫的流行历史与现状. 中国动物检疫, 2015, 32(6): 1-4. DOI:10.3969/j.issn.1005-944X.2015.06.001 |
| [8] | Shahar E, Haddas R, Goldenberg D, Lublin A, Bloch I, Bachner HN, Pitcovski J. Newcastle disease virus: is an updated attenuated vaccine needed?. Avian Pathology, 2018, 47(5): 467-478. DOI:10.1080/03079457.2018.1488240 |
| [9] | Ashraf A, Mahboob S, Andleeb R, Ijaz MU, Shah MS. Status updates of Newcastle disease and amelioration effects of medicinal plants against Newcastle disease virus: a review. Acta Virologica, 2018, 62(1): 3-15. DOI:10.4149/av_2018_101 |
| [10] |
Tian SY, Yang Y, Hu Y, Wu ZW, Zhang ZH, Yuan YY, Li FG. Comparative study of effect on immune efficiency to Newcastle disease with fifteen intensifiers. Journal of Tianjin Agricultural University, 2020, 27(1): 50-52, 57.
(in Chinese) 田澍瑶, 杨雨, 胡玥, 武志伟, 张子卉, 袁艳阳, 李富桂. 15种免疫增效剂对鸡新城疫免疫效果影响的对比研究. 天津农学院学报, 2020, 27(1): 50-52, 57. |
| [11] |
Wu ZW, Yang Y, Hu Y, Yuan YY, Tian SY, Li FG. Comparative study of the effect on the immunity to poultry with transfer factors of different animal species. Heilongjiang Animal Science and Veterinary Medicine, 2020(9): 83-84, 88.
(in Chinese) 武志伟, 杨雨, 胡玥, 袁艳阳, 田澍瑶, 李富桂. 不同动物种类转移因子对家禽免疫效果影响的对比性研究. 黑龙江畜牧兽医, 2020(9): 83-84, 88. |
| [12] | Macias AE, Guaní GE. Transfer factor: myths and facts. Archives of Medical Research, 2020, 51(7): 613-622. DOI:10.1016/j.arcmed.2020.06.016 |
| [13] | Ferreira AO, Polonini HC, Dijkers ECF. Postulated adjuvant therapeutic strategies for COVID-19. Journal of Personalized Medicine, 2020, 10(3): 80. DOI:10.3390/jpm10030080 |
| [14] | Viza D, Fudenberg HH, Palareti A, Ablashi D, Vinci CD, Pizza G. Transfer factor: an overlooked potential for the prevention and treatment of infectious diseases. Folia Biologica, 2013, 59(2): 53-67. |
| [15] | Krishnaveni M. A review on transfer factor an immune modulator. Drug Invention Today, 2013, 5(2): 153-156. DOI:10.1016/j.dit.2013.04.002 |
| [16] | 徐磊, 刘友霖. 猪疫苗特异性猪脾脏转移因子的制备方法及用途。中国: 201310506686.7. 2015-05-13. |
| [17] | 徐磊. 禽疫苗特异性猪脾脏转移因子的制备方法及用途. 中国: 201310507478.9. 2015.07.08. |
| [18] |
Kempová V, Za ovičová M, Kajanová I, Lenka LJ, Klimko L, Kopáček J, ZelnÍk V. Obstacles and limitations of transfer factor biological activity assay design. Acta Virologica, 2020, 64(3): 271-275.
DOI:10.4149/av_2020_303 ovičová M, Kajanová I, Lenka LJ, Klimko L, Kopáček J, ZelnÍk V. Obstacles and limitations of transfer factor biological activity assay design. Acta Virologica, 2020, 64(3): 271-275.
DOI:10.4149/av_2020_303 |
| [19] | Ramaekers JC. Enhancement of immune response by transfer factor. USA: WO2012044960. A1. 2015-04-05. |
| [20] |
Xü L, Chen YX, Liu DQ, Qiu YH, Hu MH, Tan LN, Xie ZW, Liu YL, Liu JB, Huang Y, Zhu GQ. Test study on reinforcing immune efficacy of several important avian vaccine by porcine spleen transfer factor. Chinese Journal of Veterinary Science, 2017, 37(10): 1944-1950.
(in Chinese) 徐磊, 陈月香, 刘道泉, 邱艳红, 胡美华, 谭礼宁, 谢兆文, 刘友霖, 刘俊斌, 黄瑜, 朱国强. 猪脾转移因子增强几种重要禽疫苗免疫效果的测试研究. 中国兽医学报, 2017, 37(10): 1944-1950. |
| [21] |
Xü L, Chen YX, Liu DQ, Qiu YH, Liu JB, Liu YL, Lin BQ, Fu GH, Shi SH, Huang Y, Zhu GQ. Study on reinforcing the immune level of ALV-A/B subgroup antibody positive chicken group by pig spleen transfer factor. Chinese Journal of Preventive Veterinary Medicine, 2017, 39(8): 649-653.
(in Chinese) 徐磊, 陈月香, 刘道泉, 邱艳红, 刘俊斌, 刘友霖, 林伯全, 傅光华, 施少华, 黄瑜, 朱国强. 猪脾转移因子增强禽白血病病毒A/B亚群抗体阳性鸡群免疫水平的研究. 中国预防兽医学报, 2017, 39(8): 649-653. |
| [22] | 中国兽药典委员会. 中华人民共和国兽药典三部(2015年版). 北京: 中国农业出版社, 2016. |
| [23] | 国家质量监督检验检疫总局. 中华人民共和国出入境检验检疫行业标准: 新城疫检疫技术规范SN/T 0764—2011. 北京: 中国标准出版社, 2011. |
| [24] |
Bai QY, Fu GH, Cheng LF, Fu QL, Liu RC, Shi SH, Chen HM, Wan CH, Lin JS, Huang Y. Establishment and application of RT-PCR assay for detection of genotype Ⅸ avian paramyxovirus type 1 in duck. Chinese Journal of Veterinary Science, 2017, 37(10): 1868-1873.
(in Chinese) 白泉阳, 傅光华, 程龙飞, 傅秋玲, 刘荣昌, 施少华, 陈红梅, 万春和, 林建生, 黄瑜. 鸭源基因Ⅸ型禽1型副黏病毒实时荧光定量RT-PCR方法的建立与应用. 中国兽医学报, 2017, 37(10): 1868-1873. |
| [25] |
Wang YL, Xü HY, Li L, Qin ZM. Immune protection of Newcastle disease La Sota vaccine on different genotypes of Newcastle disease isolates. Acta Agriculturae Zhejiangensis, 2009, 21(5): 446-449.
(in Chinese) 王友令, 徐怀英, 李莉, 秦卓明. 新城疫La Sota疫苗对不同基因型流行株的免疫保护. 浙江农业学报, 2009, 21(5): 446-449. |
| [26] |
Hu BX, Yang SH, Xü CT, Zhang L, Huang YY, Zhang XM. Immune protection assay of Newcastle disease live vaccine (LaSota strains) against a genotype Ⅶ NDV isolate. Guangdong Journal of Animal and Veterinary Science, 2012, 37(3): 34-35.
(in Chinese) 胡北侠, 杨少华, 许传田, 张琳, 黄艳艳, 张秀美. 新城疫LaSota活疫苗对基因Ⅶ型分离株的免疫保护性试验. 广东畜牧兽医科技, 2012, 37(3): 34-35. DOI:10.3969/j.issn.1005-8567.2012.03.010 |
| [27] | Rose JS. Interleukin-6 family cytokines. Cold Spring Harbor Perspectives in Biology, 2018, 10(2): a028415. DOI:10.1101/cshperspect.a028415 |
| [28] | Tanaka T, Narazaki M, Masuda K, Kishimoto T. Regulation of IL-6 in immunity and diseases. Advances in Experimental Medicine and Biology, 2016, 941: 79-88. |
| [29] | Bedke T, Muscate F, Soukou SW, Gagliani N, Huber S. IL-10-producing T cells and their dual functions. Seminars in Immunology, 2019, 44: 101335. DOI:10.1016/j.smim.2019.101335 |
| [30] | Cruikshank W, Little F. Lnterleukin-16: the ins and outs of regulating T-cell activation. Critical Reviews in Immunology, 2008, 28(6): 467-483. DOI:10.1615/CritRevImmunol.v28.i6.10 |
| [31] | Gharibi T, Majidi J, Kazemi T, Dehghanzadeh R, Motallebnezhad M, Babaloo Z. Biological effects of IL-21 on different immune cells and its role in autoimmune diseases. Immunobiology, 2016, 221(2): 357-367. DOI:10.1016/j.imbio.2015.09.021 |
| [32] | Gupta S, Manubhai KP, Mukherjee S, Srivastava S. Serum profiling for identification of autoantibody signatures in diseases using protein microarrays. Methods in Molecular Biology, 2017, 1619: 303-315. |
| [33] |
Zeng SQ, Feng ZQ, Liu YP, Yang ZQ. The induction of TLRs-mediated antiviral signaling pathway and inflammatory cytokine in chicken embryo fibroblasts infected with Newcastle disease virus. Journal of Sichuan Agricultural University, 2014, 32(4): 436-441.
(in Chinese) 曾胜强, 冯泽清, 刘益平, 杨志勤. TLRs信号通路和促炎症细胞因子基因在鸡胚成纤维细胞感染新城疫病毒过程中的表达分析. 四川农业大学学报, 2014, 32(4): 436-441. DOI:10.3969/j.issn.1000-2650.2014.04.014 |
| [34] |
She DY, Dong YL, Qin ZM, Li J, Huang DH, Yang KP, Xü HY, Chen YX. Effect of chicken spleen transfer factor on secretion of chicken's intestinal anti-inflammatory and pro-inflammatory cytokines. Chinese Journal of Veterinary Medicine, 2017, 53(2): 3-5.
(in Chinese) 佘德勇, 董玉兰, 秦卓明, 李晶, 黄迪海, 杨昆鹏, 徐怀英, 陈耀星. 鸡脾转移因子对鸡肠道抗炎因子和致炎因子分泌的影响. 中国兽医杂志, 2017, 53(2): 3-5. |
| [35] |
Lin J, Liu YH, Han CH, Ma M, Liu YH, Pan J. Protective efficacy of Newcastle disease vaccine against prevalent strains in recent years. Journal of Anhui Agricultural Sciences, 2009, 37(23): 11021-11022, 11028.
(in Chinese) 林健, 刘月焕, 韩春华, 马明, 刘永宏, 潘洁. 新城疫疫苗对近年流行毒株的保护作用. 安徽农业科学, 2009, 37(23): 11021-11022, 11028. DOI:10.3969/j.issn.0517-6611.2009.23.083 |
| [36] |
Chai H, Song Y, Li Z, Zang YT, Liu XY, Li YH, Wu X. Correlation research of the antibody titer and virus attack protection of Newcastle disease, avian influenza (H9 subtype) and fowl adenovirus inactivated vaccine (strain La Sota+strain TJ+strain HY). Feed Review, 2019(4): 30-32, 36.
(in Chinese) 柴华, 宋扬, 李贽, 藏玉婷, 刘鑫莹, 李应鹤, 武啸. 鸡新城疫、禽流感(H9亚型)、禽腺病毒(Ⅰ群, 4型)三联灭活疫苗(La Sota株+TJ株+HY株)抗体效价与鸡攻毒保护相关性试验. 饲料博览, 2019(4): 30-32, 36. DOI:10.3969/j.issn.1001-0084.2019.04.008 |
| [37] |
Bi YK, Qü Y, Wei QL, Wang WB, Zhao J, Jin ZY, Zhang SX, Wang XL, Yang ZQ, Xiao S. Identification of pathogenic refined classification of the virulent strain F48E9 of the Newcastle disease virus. Animal Husbandry & Veterinary Medicine, 2018, 50(2): 91-96.
(in Chinese) 毕友坤, 屈阳, 卫巧林, 王文彬, 赵杰, 金忠元, 张淑霞, 王兴龙, 杨增岐, 萧飒. 新城疫病毒强毒株F48E9致病性细化分型的鉴定. 畜牧与兽医, 2018, 50(2): 91-96. |
| [38] |
Shi XM, He S, Wang M, Yang GH, Zeng WW, Cui HY, Tong GZ, Wang YF. Evaluation of immune efficacy with gene modified DNA vaccines based on HN gene of Newcastle disease virus. Chinese Journal of Animal and Veterinary Sciences, 2009, 40(10): 1526-1531.
(in Chinese) 石星明, 贺笋, 王玫, 杨桂花, 曾伟伟, 崔红玉, 童光志, 王云峰. 基因修饰的鸡新城疫病毒HN基因DNA疫苗免疫效力评价. 畜牧兽医学报, 2009, 40(10): 1526-1531. DOI:10.3321/j.issn:0366-6964.2009.10.016 |
 2022, Vol. 62
2022, Vol. 62




