
中国科学院微生物研究所,中国微生物学会
文章信息
- 高莹, 李淼, 孙元, 单春华, 仇华吉. 2022
- GAO Ying, LI Miao, SUN Yuan, SHAN Chunhua, QIU Huaji.
- 乳酸乳球菌表达系统的发展现状与前景展望
- Development and prospects of Lactococcus lactis expression system
- 微生物学报, 62(3): 895-905
- Acta Microbiologica Sinica, 62(3): 895-905
-
文章历史
- 收稿日期:2021-06-12
- 修回日期:2021-09-09
- 网络出版日期:2021-12-21
2. 中国农业科学院哈尔滨兽医研究所, 兽医生物技术国家重点实验室, 黑龙江 哈尔滨 150069
2. State Key Laboratory of Veterinary Biotechnology, Harbin Veterinary Research Institute, Chinese Academy of Agricultural Sciences, Harbin 150069, Heilongjiang, China
乳酸菌(lactic acid bacteria,LAB)是一类可以发酵糖类产生有机酸的革兰氏阳性菌[1],包括乳酸乳球菌、乳杆菌和肠球菌等多种属[2]。其中,乳酸乳球菌(Lactococcus lactis)是乳酸菌中最具代表性的菌株,被美国食品和药物管理局(FDA)认为是安全的(GRAS)微生物,常用于食品发酵、药物生产和饲料添加等[3]。L. lactis具有生长速度快、易于操作和遗传背景清楚等特点,因此,常被用作基因工程的宿主菌[4]。近年来,随着分子生物学的发展,L. lactis作为载体在递呈病毒、细菌抗原等方面得到了广泛的应用[5–7]。
目前,研究学者借助生物技术和基因工程等方法成功建立和发展了一系列以L. lactis为核心的克隆和表达系统。利用L. lactis表达系统已经表达了许多病毒、细菌和真核生物来源的蛋白质[8]。L. lactis表达系统可以分为组成型表达系统和诱导型表达系统[9]。不会受到时期、部位和环境等因素影响的基因表达过程被称为组成型表达,而在特定的环境信号刺激下,基因的表达出现增强或减弱,这种易受环境因素影响的表达被称为诱导型表达。随着对L. lactis表达系统的深入研究,采用组成型或诱导型表达系统均可以实现外源蛋白的大量表达[10–11]。但在大多数情况下,诱导型表达系统比组成型表达系统更受青睐,因为诱导型表达系统的启动子可以更好地被控制[12]。1995年,Kuipers及其同事所开发的由乳链菌肽(nisin)控制的基因表达(nisin-controlled expression,NICE)系统是迄今为止最成功的诱导型L. lactis表达系统[13]。直至今日,NICE系统已经可以表达消化酶、细胞因子和外源抗原等多种不同类型的外源蛋白[11]。本文主要以NICE系统为例对乳酸乳球菌表达系统及其应用进行综述。
1 NICE系统概述NICE系统是基于L. lactis自动调节nisin生物合成机制的一种基因表达系统,也是乳酸菌中唯一的商业表达系统[14]。NICE系统包括3个基本要素:(1) 宿主:能表达组氨酸蛋白激酶(NisK)和反应调节蛋白(NisR)的革兰氏阳性菌(如:L. lactis、乳杆菌、链球菌、肠球菌等);(2) 质粒载体:包含一个nisA或nisF启动子区,允许nisin诱导;(3) 诱导因子nisin:是由11个基因编码合成的抗微生物短肽,由NisR和NisK调节表达[13],其在对数生长阶段必须以0.01–10.00 ng/mL的浓度存在[15]。NICE系统利用位于膜上的NisK感知nisin分子并自磷酸化,将磷酸基团转移至细胞内的NisR上,进而诱导nisin基因簇中的2个启动子PnisA和PnisF的转录(图 1)。因此,常利用NICE系统调节各种蛋白质,使其过表达[16]。
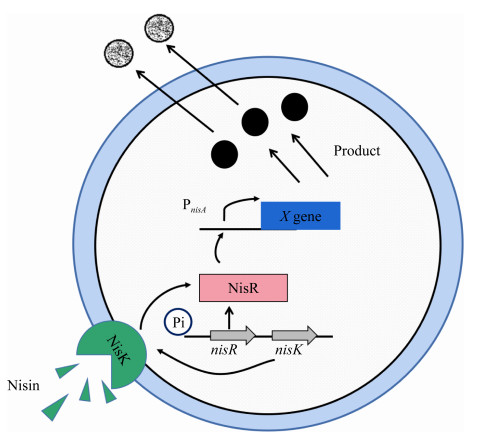
|
| 图 1 Nisin通过Nisk和NisR诱导nisA启动子的转录 Figure 1 Nisin induces nisA promoter transcription through NisK and NisR. Nisin: induction factor; NisK: histidine-protein kinase; NisR: response regulator protein; PnisA: nisA promoter. |
1.1 NICE系统常用宿主菌
NICE系统所用的菌株均为乳制品发酵菌NCDO712无质粒后代—L. lactis subsp. cremoris MG1363的衍生物[17]。其中,NZ9700、NZ9800、NZ9000、NZ3900和NZ3000是NICE系统中常用的5种宿主菌(表 1)。NZ9700是一种可以产生nisin的菌株,常被用作nisin的来源以诱导NICE系统,是由NIZO B8 (可以产生nisin-A)中的nisin-蔗糖转座子Tn5276与MG1614 (MG1363的利福平和链霉素抗性衍生物)缀合得到的[17–19]。NZ9800是NZ9700的衍生物,其在NZ9700的基础上删除了nisA中的4个核苷酸[18]。NZ9800是NICE系统早期宿主菌株之一,因为它可以提供必要的调控基因(nisK和nisR)。该菌株不产生nisin,并且阻止了nisin操纵子的转录,可以通过加入最低抑制量的nisin重新激活该菌株中nisin操纵子的转录[13]。NZ9000是NICE系统的标准宿主菌,也是目前使用最多的菌株,其通过将nisK和nisR基因整合到MG1363的pepN基因中而得到[20]。NZ3000是MG5267的lacF缺失突变体,而MG5267是NCDO712的乳糖操纵子单染色体拷贝的菌株。由于缺失lacF,NZ3000无法在乳糖上生长,但可以通过质粒pNZ8149提供lacF以恢复乳糖的生长[21]。NZ3000利用构建NZ9000时所用的方法将基因nisR和nisK插入到pepN基因中,能够得到NZ3900[22]。NZ3900是根据乳糖生长能力所选择的食品级标准菌株,是为NICE系统的食品级应用而开发的[23]。
| Host strains | Characteristics | Reference |
| NZ9700 | Conjugated by Tn5276 and MG1614. Used as a source of nisin to induce NICE system | [20–22] |
| NZ9800 | A derivative of NZ9700. One of the early host strains of the NICE system | [16, 21] |
| NZ9000 | Most commonly used host strain. Obtained by integrating the nisK and nisR genes into the pepN gene of MG1363 | [23] |
| NZ3000 | The lacF deletion mutant of MG5267 | [24] |
| NZ3900 | Developed for food grade applications of the NICE system | [8, 25] |
1.2 NICE系统常用质粒
在NICE系统中,除了pNZ9530质粒是基于pAMβ1的θ型复制子外,所有的质粒均为基于pSH71的环型复制子[24],常用的表达质粒有pNZ8048、pNZ8148、pNZ8150、pNZ8149、pNZ8021和pNZ8110 (表 2)。其中,pNZ8048是融合表达最常用的质粒[20],它在ATG起始密码子周围引入Nco Ⅰ位点可以对目标基因进行扩增,从而直接克隆与nisA起始密码子融合的基因[25]。pNZ8148和pNZ8150质粒是在pNZ8048质粒的基础上构建的。在pNZ8148质粒中,除去了枯草芽孢杆菌(pSH系列质粒的初始克隆宿主)残余的60 bp的DNA片段,使得质粒符合自克隆指南[8]。改进后的pNZ8148质粒避免了专有使用Nco Ⅰ位点所带来的缺点。在pNZ8150中,位于ATG起始密码子上游的Nco Ⅰ位点被替换为Sca Ⅰ位点,这使得从ATG起始密码子开始,基因就可以被扩增并直接融合到载体上,形成精确的nisA翻译表达[22]。pNZ8149质粒以lacF基因作为食品级选择标记,质粒pNZ8021用于转录融合,质粒pNZ8110主要进行蛋白质分泌[26]。
| Plasmids | Characteristics | Reference |
| pNZ8048 | Most commonly used plasmids for fusion expression | [23, 27] |
| pNZ8148 | Deletion of a 60 bp DNA fragment from Bacillus subtilis to avoid the disadvantage generated by the obligate use of Nco Ⅰ site | [28] |
| pNZ8150 | Sca Ⅰ site used for creating an accurate nisA translational fusion | [25] |
| pNZ8149 | The lacF gene as food grade selection marker | [29] |
| pNZ8021 | Used for transcription fusion | [29] |
| pNZ8110 | Used for protein secretion | [29] |
1.3 NICE系统的特点
利用NICE系统表达外源基因时具有以下特点:(1) NICE系统的NZ9000和NZ3900等宿主菌生长速度快、容易培养,转入外源基因的操作方法简便、技术成熟、成本低且重复性高;(2) 与其他宿主菌相比具有安全、不产生内毒素的特点,可直接口服所表达的蛋白,基因组自身分泌的蛋白质少,免去了目的蛋白的体外提纯等后续加工处理工序[27];(3) 宿主菌NZ3900可用于构建食品级表达系统,有效促进了基因技术的发展,增强产品的安全性;(4) 拥有可以多方面调控的子系统,能够表达毒素蛋白;(5) 可在细胞内和细胞表面表达蛋白或直接将蛋白分泌到胞质中[28];(6) 宿主菌没有胞外蛋白酶也不分泌蛋白酶,降低了外源蛋白被降解的风险,有利于外源蛋白的完整性以及功能的正常发挥;(7) 与其他的乳酸菌宿主菌相比,蛋白表达量高,经诱导后能表达60%的胞内总蛋白[29];(8) 具有黏附性,可作用于机体黏膜,其所表达的蛋白在黏膜处可以持续分泌,刺激机体产生有效的免疫应答。因此,L. lactis表达系统的应用前景十分广阔。
2 NICE系统的发展现状以L. lactis作为宿主菌,构建表达载体用来表达异源蛋白和酶,逐渐成为了食品工业、生物制药和疫苗研究的热点[30]。目前,已利用NICE系统表达不同背景的基因来研究代谢和酶的功能,并生产更多的酶用于食品、医疗或技术应用,现有不少同源或异种的细菌蛋白、膜蛋白、细菌素和抗原利用该系统成功表达[16]。
2.1 在食品领域中的应用NICE系统是应用最广的高效诱导表达系统,其诱导剂、宿主菌和载体都是食品级安全的,因此,NICE系统常被用来表达不同蛋白和多肽用于制备各种乳制品、提高食品的营养价值[31–32]。孙大庆等利用NICE系统表达了具有优良凝乳特性的牛凝乳酶原,为奶酪加工提供了新思路和新方法[33]。孙芝兰等将乳糖酶基因bga电转化入L. lactis NZ9000进行表达,利用高压液相色谱对乳糖的利用率进行分析。结果发现,L. lactis NZ9000-Bga对乳糖的利用能力比对照菌株高1倍,为生产低乳糖的发酵乳制品奠定了基础[34]。Yildiz等利用NICE系统制备了具有抗癌和抗菌功能的细菌素—天青素,该重组菌株可用于食品生物防腐剂的研究[35]。Dong等利用pNZ8149表达载体表达了食品级胆盐水解酶,并提高了其水解酶活性,添加在益生菌制品中可降低血清中的胆固醇含量[36]。
2.2 在动物疫病防控中的应用L. lactis在黏膜水平传递抗原方面具有无可比拟的优越性,且在动物疫病中取得了较好的防治效果。目前,NICE系统已经在微生态制剂、疫苗、饲料添加剂等多个领域得到应用,并在动物疫病的防控中发挥重要作用。
2.2.1 免疫领域产肠毒素大肠杆菌(enterotoxigenic Escherichia coli,ETEC)是断奶仔猪腹泻的主要病原[37]。Song等将ETEC三价肠毒素蛋白STa-LTB-STb、菌毛抗原F5与耶尔森氏菌外膜蛋白H (OmpH)利用NICE系统进行融合表达,利用动物实验证实了口服L. lactis-SLS-F5-OmpH对ETEC攻毒后具有完全的保护作用[37]。猪流行性腹泻病毒(porcine epidemic diarrhea virus,PEDV)是引起猪流行性腹泻的主要原因,其中S蛋白是PEDV的主要结构蛋白[38]。研究者们将PEDV S蛋白中某些区域利用NICE系统进行表达,将表达后的重组菌株进行小鼠体内评价,结果均发现重组L. lactis可以提高小鼠机体的抗PEDV黏膜免疫、体液免疫和细胞免疫水平[39–40]。Sha等将从禽流感H9N2抗原中分离出来的M1和HA2蛋白克隆到L. lactis NZ9000上进行表达并评估了该重组L. lactis的免疫原性和保护作用。结果表明,接种重组L. lacti- M1-HA2的鸡血清抗体、T细胞介导的免疫反应和黏膜分泌IgA (sIgA)水平显著提高。攻毒后,重组L. lactis菌株免疫的鸡体内病毒滴度降低,肺病理损伤减轻。这说明表达H9N2 M1-HA2融合蛋白的重组L. lactis菌株能够诱导黏膜和系统免疫保护[41]。空肠弯曲杆菌(Campylobacter jejuni)是引起人食源性肠炎的主要原因,常由家禽产品带入人体内。Wang等利用L. lactis NZ3900对可降低C. jejuni在鸡肠道内定殖的CjaA基因进行表达并对肉鸡进行口服免疫,分泌表达C. jejuni CjaA基因的重组L. lactis能显著激发特异性抗CjaA血清IgY反应。这说明L. lactis可作为抗C. jejuni定殖的疫苗载体[42]。Shirdast等构建了成功表达布鲁氏菌保护性抗原Omp31的重组L. lactis并对小鼠进行口服和腹腔注射。结果表明,重组L. lactis可以诱导小鼠体液和细胞免疫应答,因此,L. lactis载体疫苗可能成为抵抗布鲁氏菌感染的有效方法[43]。为了开发一种针对口蹄疫病毒(foot-and-mouth disease virus,FMDV)特异性免疫反应的有效黏膜疫苗,Liu等用NICE系统对FMDV VP1基因成功表达。通过体内试验证实了使用重组L. lactis免疫小鼠可以产生高水平的SIgA、抗原特异性血清IgG、IgA和中和抗体,并产生更强的细胞免疫反应和显著的脾淋巴细胞增殖[44]。Naderi-Samani等利用NICE系统成功表达了虹鳟鱼病毒出血性败血症病毒(viral hemorrhagic septicaemia virus,VHSV) G基因,攻毒后发现,重组L. lactis接种组的虹鳟鱼相较空载体组的存活率提高了2倍,并且病毒载量显著降低。通过该研究结果可知,重组L. lactis可作为虹鳟鱼VHS口服疫苗,并有望成为一种有效对抗不同鱼类病原体的方法[45]。Ma等构建了表达鸡球虫病保护性抗原—盲肠型球虫免疫标记蛋白-1 (Eimeria tenella immune mapped protein-1,EtIMP1)的重组L. lactis。通过动物实验发现,免疫该重组L. lactis可以促进淋巴细胞的增殖以及抗体水平的增高,这表明L. lactis表达的EtIMP1蛋白可能成为研发抗盲肠型球虫感染疫苗的候选蛋白[46]。
2.2.2 治疗领域刘淑杰等利用NICE系统对猪表皮生长因子成功表达,给小鼠口服免疫表达后的重组菌株以评价其对葡聚糖硫酸钠(dextran sulfate sodium,DSS)诱导的结肠炎模型小鼠肠道损伤的修复作用。结果表明,表达猪表皮生长因子的重组L. lactis对断奶仔猪肠道具有保护作用[47]。刘霭莎等利用NZ9000成功表达了猪脂联素球状结构域gAd基因,将表达后的gAd蛋白注射到高糖饲喂的小鼠体内,结果显示,表达后的gAd蛋白具有加快糖代谢、降低血糖含量的作用[48]。高铭扬构建了表达柔嫩艾美耳球虫子孢子3-1E的重组L. lactis。鸡口服后可提高抗球虫感染保护效果、提升鸡体重并减少粪便卵囊排出量,降低盲肠病变[49]。Song等利用L. lactis对具有杀菌、抗炎和免疫调节作用的牛乳铁蛋白进行表达,并评价重组L. lactis对DSS诱导的结肠炎模型小鼠肠道损伤的修复作用,结果表明,表达牛乳铁蛋白的重组L. lactis可以改善DSS诱导的小鼠结肠损伤,有望成为治疗牛肠道损伤的一种方法[50]。
2.2.3 微生态制剂等其他领域为了研究重组L. lactis作为饲料添加剂替代抗生素的可行性,何佳等利用表达猪乳铁蛋白的重组L. lactis饲喂断奶仔猪,结果发现,仔猪免疫器官成熟更快,免疫功能增强,生产性能得到改善,平均日增重提高,料重比降低[51]。为了提高商品肉鸡的生长性能和抗病能力,Zhou等利用L. lactis表达系统成功建立和表达了鸡表皮生长因子。通过体内试验表明,L. lactis表达系统表达的鸡表皮生长因子可以提高肉鸡生长性能、免疫功能和肠道发育的潜力[52]。利用植酸酶或具有植酸酶活性的益生菌来增加磷的保留量可以提高鸡肠道对植物磷的利用率。Mohammadi等将来源于大肠杆菌DE3的植酸酶基因(appA)电转化入L. lactis中得到具有产植酸酶潜力的重组L. lactis,并对其在肉鸡体内的功效进行了评价。根据动物实验结果可知,重组L. lactis在鸡肠道环境中体现出植酸酶活性,可以替代商品植酸酶[53]。Pakbaten等利用L. lactis构建了一株具有生产植酸酶潜力的重组L. lactis,为提高其表达和分泌效率,将usp45信号肽添加到appA2表达载体中,在肉鸡饲料中添加该重组L. lactis,可提高肉鸡消化道对植酸酶的利用率,与大肠杆菌商品植酸酶的生产性能相同[54]。
3 NICE系统的展望随着基因工程的发展和新技术的利用,如基因编辑系统CRISPR/Cas9,使得NICE系统的研究逐渐完善,目前已经构建了许多不同的菌株和质粒用于各个领域目的基因的表达,促进了食品、医疗、畜牧兽医等工业的发展。NICE系统作为应用最广的高效诱导型表达系统具有许多优点,可通过对强启动子的调控,避免蛋白过量表达导致的宿主乳酸菌生长停滞或代谢障碍,同时可防止质粒丢失。但同时也存在一定的缺陷,例如诱导外源蛋白表达时需要添加诱导剂,有些诱导剂本身对菌体有杀伤作用,nisin作为诱导剂具有高效无毒的特点,但在发酵过程中添加诱导剂,操作过程比较麻烦;大规模生产吋,添加诱导剂也会增加生产成本,推广较为困难[55]。为了更好地调控NICE系统,研究者们对其做出了一些改进:(1) 在产生nisin的L. lactis或其衍生物以外的宿主中表达蛋白,必须将nisRK基因整合到染色体中,这种操作比较复杂。为了提高NICE系统的可操作性,开发了双质粒NICE系统,使其在没有nisRK基因的菌株中也可以进行表达[56];(2) 为了避免使用抗生素作为选择性标记而释放到环境中所带来的危害,构建了宿主、载体和诱导物均为食品级的NICE系统,不仅保证了生物和生态的安全,还使克隆的基因可以稳定的表达[21];(3) 提高了L. lactis表达的蛋白质的稳定性,减少了外源蛋白的降解。(4) 利用植物乳杆菌(Lactobacillus plantarum)、粪肠球菌(Enterococcus faecalis)、肺炎双球菌(Streptococcus pneumoniae)等低GC含量的革兰氏阳性菌作为宿主菌[16]。虽然该系统已经做了很多改进,但仍存在一些问题和缺陷需要进一步完善:双质粒NICE系统中双质粒菌株和无质粒菌株相比生长速度较慢,达到最大蛋白质产量所需的时间较长且表达水平较低,这使得该表达系统不能很好地对外源蛋白进行分泌;多数乳酸菌菌株已经进化出了针对外源DNA的防御策略,给转化带来困难[57];L. lactis拥有一种独特的的胞外管家蛋白酶htrA,它参与菌株的代谢过程,包括原肽的加工、天然蛋白的成熟和重组蛋白的降解等,容易造成L. lactis表达系统分泌的外源蛋白的降解;当利用L. lactis以外的物种表达蛋白时所获得的蛋白容易降解;不同宿主与载体组合的诱导条件不同;因L. lactis的细胞壁较厚且机械强度大使得外源DNA高效率导入至L. lactis中是一个技术难题;NICE系统不能很好地应用于工业生产[58]。针对这些问题提出了以下改进措施:(1) 对双质粒NICE系统进行修饰,提高生长速度和表达水平,使其在蛋白质分泌中更加可靠;(2) 有效利用CRISPR-Cas9系统对基因组进行定点的精准编辑,使得食品级载体的开发更简单、灵活;(3) 尝试对管家基因(如htrA基因)进行敲除以便降低L. lactis所分泌重组蛋白的降解;(4) 优化菌种的培养条件,包括pH、温度、菌体密度、诱导剂浓度和诱导时间,同时观察菌体蛋白表达情况,将表达条件调整到最佳以此来降低外源蛋白的降解;(5) 整合不同宿主和载体组合的诱导条件,筛选出可适用于多种组合的最佳条件;(6) 对外源DNA导入常用的电击转化方法进行优化,使其能够有效转入L. lactis中;(7) 探寻一种新型高效可控性强的启动子,解决工业生产的高要求。
L. lactis从一种食物细菌到可以产生具有巨大生物经济价值的重要工业产品的微生物细胞工厂已经走过了漫长的道路。除了NICE系统外,L. lactis诱导型表达系统还包括糖诱导表达系统、噬菌体φ31暴发式诱导的表达系统、温控表达系统和pH诱导的表达系统,以及由P21、P23、P32、P44和P59等5种启动子控制的L. lactis组成型表达系统[9, 59]。这些L. lactis表达系统在不同领域均发挥了重要作用。目前,在医学领域中,已利用NICE系统表达不同蛋白预防和治疗各类常见的肠道和呼吸道疾病,如猪流行性腹泻、断奶仔猪腹泻和禽流感等,而其他一些病原的相关研究依旧较少,随着基因工程的发展,NICE系统有望成为防治其他非肠道感染重要动物疫病(如非洲猪瘟)的一种有效方式。尽管有局限性,但作为微生物细胞工厂的NICE系统仍有很大的改进空间。作为安全级宿主菌的L. lactis未来将更有应用前景,能更有效地推动生物医药、食品工业和畜牧兽医业的持续健康发展。
| [1] | Wang M, Gao ZQ, Zhang YG, Pan L. Lactic acid bacteria as mucosal delivery vehicles: a realistic therapeutic option. Applied Microbiology and Biotechnology, 2016, 100(13): 5691-5701. DOI:10.1007/s00253-016-7557-x |
| [2] | Stiles ME, Holzapfel WH. Lactic acid bacteria of foods and their current taxonomy. International Journal of Food Microbiology, 1997, 36(1): 1-29. DOI:10.1016/S0168-1605(96)01233-0 |
| [3] | Mao RF, Wu DL, Wang YF. Surface display on lactic acid bacteria without genetic modification: strategies and applications. Applied Microbiology and Biotechnology, 2016, 100(22): 9407-9421. DOI:10.1007/s00253-016-7842-8 |
| [4] | Bolotin A, Wincker P, Mauger S, Jaillon O, Malarme K, Weissenbach J, Ehrlich SD, Sorokin A. The complete genome sequence of the lactic acid bacterium Lactococcus lactis ssp. lactis IL1403. Genome Research, 2001, 11(5): 731-753. DOI:10.1101/gr.169701 |
| [5] | Lei H, Peng XJ, Ouyang JX, Zhao DX, Jiao HF, Shu HD, Ge XQ. Protective immunity against influenza H5N1 virus challenge in chickens by oral administration of recombinant Lactococcus lactis expressing neuraminidase. BMC Veterinary Research, 2015, 11: 85. DOI:10.1186/s12917-015-0399-4 |
| [6] | Jounai K, Sugimura T, Ohshio K, Fujiwara D. Oral administration of Lactococcus lactis subsp. lactis JCM5805 enhances lung immune response resulting in protection from murine parainfluenza virus infection. PLoS One, 2015, 10(3): e0119055. DOI:10.1371/journal.pone.0119055 |
| [7] | Zhang XJ, Feng SY, Li ZT, Feng YM. Expression of Helicobacter pylori hspA gene in Lactococcus lactis NICE system and experimental study on its immunoreactivity. Gastroenterology Research and Practice, 2015, 2015: 750932. |
| [8] | Le Loir Y, Azevedo V, Oliveira SC, Freitas DA, Miyoshi A, Bermúdez-Humarán LG, Nouaille S, Ribeiro LA, Leclercq S, Gabriel JE, Guimaraes VD, Oliveira MN, Charlier C, Gautier M, Langella P. Protein secretion in Lactococcus lactis: an efficient way to increase the overall heterologous protein production. Microbial Cell Factories, 2005, 4(1): 2. DOI:10.1186/1475-2859-4-2 |
| [9] |
Li F, Li YM, Xu ZW, Zhang L. Research progresses on Lactococcus lactis as cell factory for recombinant protein expression. Biotechnology Bulletin, 2010(5): 61-64, 81.
(in Chinese) 李芳, 李永明, 徐子伟, 张磊. 乳酸乳球菌作为基因工程受体菌研究进展. 生物技术通报, 2010(5): 61-64, 81. |
| [10] | Nouaille S, Ribeiro LA, Miyoshi A, Pontes D, Le Loir Y, Oliveira SC, Langella P, Azevedo V. Heterologous protein production and delivery systems for Lactococcus lactis. Genetics and Molecular Research, 2003, 2(1): 102-111. |
| [11] |
Wang YG, Sun SC, Song L, Guo HH, Shen YL, Guo YX, Meng ZM. Research progress of Lactococcus lactis expression system. Cereals and Oils Processing: Electronic Version, 2015(10): 45-47, 51.
(in Chinese) 王永刚, 孙尚琛, 宋莉, 郭晗晗, 沈雅丽, 郭宇轩, 孟振明. 乳酸乳球菌表达系统的研究进展. 粮油加工: 电子版, 2015(10): 45-47, 51. DOI:10.3969/j.issn.2095-6495.2015.10.010 |
| [12] | Llull D, Poquet I. New expression system tightly controlled by zinc availability in Lactococcus lactis. Applied and Environmental Microbiology, 2004, 70(9): 5398-5406. DOI:10.1128/AEM.70.9.5398-5406.2004 |
| [13] | Kuipers OP, Beerthuyzen MM, De Ruyter PGGA, Luesink EJ, De Vos WM. Autoregulation of nisin biosynthesis in Lactococcus lactis by signal transduction. Journal of Biological Chemistry, 1995, 270(45): 27299-27304. DOI:10.1074/jbc.270.45.27299 |
| [14] | Xiong ZQ, Wei YY, Kong LH, Song X, Yi HX, Ai LZ. Short communication: an inducible CRISPR/dCas9 gene repression system in Lactococcus lactis. Journal of Dairy Science, 2020, 103(1): 161-165. DOI:10.3168/jds.2019-17346 |
| [15] | Tavares LM, De Jesus LCL, Da Silva TF, Barroso FAL, Batista VL, Coelho-Rocha ND, Azevedo V, Drumond MM, Mancha-Agresti P. Novel strategies for efficient production and delivery of live biotherapeutics and biotechnological uses of Lactococcus lactis: the lactic acid bacterium model. Frontiers in Bioengineering and Biotechnology, 2020, 8: 517166. DOI:10.3389/fbioe.2020.517166 |
| [16] | Zhou XX, Li WF, Ma GX, Pan YJ. The nisin-controlled gene expression system: construction, application and improvements. Biotechnology Advances, 2006, 24(3): 285-295. DOI:10.1016/j.biotechadv.2005.11.001 |
| [17] | Gasson MJ. Plasmid complements of Streptococcus lactis NCDO 712 and other lactic streptococci after protoplast-induced curing. Journal of Bacteriology, 1983, 154(1): 1-9. DOI:10.1128/jb.154.1.1-9.1983 |
| [18] | Kuipers OP, Beerthuyzen MM, Siezen RJ, Vos WM. Characterization of the nisin gene cluster nisABTCIPR of Lactococcus lactis. Requirement of expression of the nisA and nisI genes for development of immunity. European Journal of Biochemistry, 1993, 216(1): 281-291. DOI:10.1111/j.1432-1033.1993.tb18143.x |
| [19] | Kuipers OP, De Ruyter PGGA, Kleerebezem M, De Vos WM. Quorum sensing-controlled gene expression in lactic acid bacteria. Journal of Biotechnology, 1998, 64(1): 15-21. DOI:10.1016/S0168-1656(98)00100-X |
| [20] | De Ruyter PG, Kuipers OP, Beerthuyzen MM, Van Alen-Boerrigter I, De Vos WM. Functional analysis of promoters in the nisin gene cluster of Lactococcus lactis. Journal of Bacteriology, 1996, 178(12): 3434-3439. DOI:10.1128/jb.178.12.3434-3439.1996 |
| [21] | Platteeuw C, Van Alen-Boerrigter I, Van Schalkwijk S, De Vos WM. Food-grade cloning and expression system for Lactococcus lactis. Applied and Environmental Microbiology, 1996, 62(3): 1008-1013. DOI:10.1128/aem.62.3.1008-1013.1996 |
| [22] | Mierau I, Kleerebezem M. 10 years of the nisin-controlled gene expression system (NICE) in Lactococcus lactis. Applied Microbiology and Biotechnology, 2005, 68(6): 705-717. DOI:10.1007/s00253-005-0107-6 |
| [23] | Ruyter PGGAD, Kuipers OP, Meijer WC, Vos WMD. Food-grade controlled lysis of Lactococcus lactis for accelerated cheese ripening. Nature Biotechnology, 1997, 15(10): 976-979. DOI:10.1038/nbt1097-976 |
| [24] | Simon D, Chopin A. Construction of a vector plasmid family and its use for molecular cloning in Streptococcus lactis. Biochimie, 1988, 70(4): 559-566. DOI:10.1016/0300-9084(88)90093-4 |
| [25] | Asseldonk M, Vos WM, Simons G. Functional analysis of the Lactococcus lactis usp45 secretion signal in the secretion of a homologous proteinase and a heterologous α-amylase. Molecular and General Genetics MGG, 1993, 240(3): 428-434. DOI:10.1007/BF00280397 |
| [26] | Morello E, Bermúdez-Humarán LG, Llull D, Solé V, Miraglio N, Langella P, Poquet I. Lactococcus lactis, an efficient cell factory for recombinant protein production and secretion. Journal of Molecular Microbiology and Biotechnology, 2008, 14(1/2/3): 48-58. |
| [27] | Schneewind O, Missiakas DM. Protein secretion and surface display in Gram-positive bacteria. Philosophical Transactions of the Royal Society of London Series B, Biological Sciences, 2012, 367(1592): 1123-1139. DOI:10.1098/rstb.2011.0210 |
| [28] | Mohamadzadeh M, Duong T, Sandwick SJ, Hoover T, Klaenhammer TR. Dendritic cell targeting of Bacillus anthracis protective antigen expressed by Lactobacillus acidophilus protects mice from lethal challenge. Proceedings of the National Academy of Sciences of the United States of America, 2009, 106(11): 4331-4336. DOI:10.1073/pnas.0900029106 |
| [29] | Wu CM, Lin CF, Chang YC, Chung TC. Construction and characterization of nisin-controlled expression vectors for use in Lactobacillus reuteri. Bioscience, Biotechnology, and Biochemistry, 2006, 70(4): 757-767. DOI:10.1271/bbb.70.757 |
| [30] |
Sun QZ, Xu JG. Research progress on food-grade expression vector of Lactococcus lactis. Chinese Journal of Microecology, 2006, 18(3): 260-261.
(in Chinese) 孙强正, 徐建国. 乳酸乳球菌食品级表达载体的研究进展. 中国微生态学杂志, 2006, 18(3): 260-261. DOI:10.3969/j.issn.1005-376X.2006.03.049 |
| [31] |
Ni SS, Huang LY. Application of nisin and Lactococcus lactis in the food industry. The Food Industry, 2015, 36(11): 244-247.
(in Chinese) 倪珊珊, 黄丽英. 乳酸链球菌素和乳酸乳球菌在食品工业中的应用. 食品工业, 2015, 36(11): 244-247. |
| [32] | 雷涵. 重组乳酸乳球菌作为黏膜输送载体的研究. 上海交通大学博士学位论文, 2010. |
| [33] |
Sun DQ, Qin LX, Yao LY, Li B, Qu XG, Han XY, Jiang YJ. Production of bovine prochymosin in Lactococcus lactis. Acta Microbiologica Sinica, 2010, 50(5): 628-633.
(in Chinese) 孙大庆, 秦兰霞, 姚丽燕, 李彬, 曲行光, 韩希妍, 姜毓君. 牛凝乳酶原基因在乳酸乳球菌中的表达. 微生物学报, 2010, 50(5): 628-633. |
| [34] |
Sun ZL, Kong WT, Kong J. Expression of lactase gene bga from Paenibacillus sp. K1 in Lactococcus lactis. Journal of Shandong University: Natural Science, 2008, 43(7): 74-77, 82.
(in Chinese) 孙芝兰, 孔文涛, 孔健. Paenibacillus sp. K1乳糖酶基因bga在乳酸乳球菌中的表达. 山东大学学报: 理学版, 2008, 43(7): 74-77, 82. |
| [35] | Yildiz M, Askin H. Heterologous expression of azurin from Pseudomonas aeruginosa in food-grade Lactococcus lactis. Preparative Biochemistry & Biotechnology, 2019, 49(8): 800-806. |
| [36] | Dong ZX, Zhang J, Li HZ, Du GC, Chen J, Lee B. Codon and propeptide optimizations to improve the food-grade expression of bile salt hydrolase in Lactococcus lactis. Protein and Peptide Letters, 2015, 22(8): 727-735. DOI:10.2174/0929866522666150610094829 |
| [37] | Song JJ, Zhao LY, Song MX. A Lactococcus lactis-vectored oral vaccine induces protective immunity of mice against enterotoxigenic Escherichia coli lethal challenge. Immunology Letters, 2020, 225: 57-63. DOI:10.1016/j.imlet.2020.06.007 |
| [38] | Zang Y, Tian Y, Li YG, Xue RX, Hu LP, Zhang D, Sun SF, Wang GS, Chen J, Lan ZR, Lin SL, Jiang SJ. Recombinant Lactobacillus acidophilus expressing S1 and S2 domains of porcine epidemic diarrhea virus could improve the humoral and mucosal immune levels in mice and sows inoculated orally. Veterinary Microbiology, 2020, 248: 108827. DOI:10.1016/j.vetmic.2020.108827 |
| [39] | Guo MR, Yi SS, Guo YB, Zhang S, Niu JT, Wang K, Hu GX. Construction of a recombinant Lactococcus lactis strain expressing a variant porcine epidemic diarrhea virus S1 gene and its immunogenicity analysis in mice. Viral Immunology, 2019, 32(3): 144-150. DOI:10.1089/vim.2018.0108 |
| [40] | 汪淼. 表达猪流行性腹泻病毒中和抗原区重组乳酸乳球菌系统的构建. 东北农业大学硕士学位论文, 2009. |
| [41] | Sha Z, Shang HQ, Miao YQ, Huang J, Niu XY, Chen RC, Hu LP, Huang H, Wei K, Zhu RL. Recombinant Lactococcus lactis expressing M1-HA2 fusion protein provides protective mucosal immunity against H9N2 avian influenza virus in chickens. Frontiers in Veterinary Science, 2020, 7: 153. DOI:10.3389/fvets.2020.00153 |
| [42] | Wang CW, Zhou HZ, Guo FF, Yang B, Su X, Lin J, Xu FZ. Oral immunization of chickens with Lactococcus lactis expressing cjaA temporarily reduces Campylobacter jejuni colonization. Foodborne Pathogens and Disease, 2020, 17(6): 366-372. DOI:10.1089/fpd.2019.2727 |
| [43] | Shirdast H, Ebrahimzadeh F, Taromchi AH, Mortazavi Y, Esmaeilzadeh A, Sekhavati MH, Nedaei K, Mirabzadeh E. Recombinant Lactococcus lactis displaying Omp31 antigen of Brucella melitensis can induce an immunogenic response in BALB/c mice. Probiotics and Antimicrobial Proteins, 2021, 13(1): 80-89. DOI:10.1007/s12602-020-09684-1 |
| [44] | Liu XS, Qi LL, Lv J, Zhang ZW, Zhou P, Ma ZY, Wang YL, Zhang YG, Pan L. The immune response to a recombinant Lactococcus lactis oral vaccine against foot-and-mouth disease virus in mice. Biotechnology Letters, 2020, 42(10): 1907-1917. DOI:10.1007/s10529-020-02900-6 |
| [45] | Naderi-Samani M, Soltani M, Dadar M, Taheri-Mirghaed A, Zargar A, Ahmadivand S, Hassanzadeh R, Goudarzi LM. Oral immunization of trout fry with recombinant Lactococcus lactis NZ3900 expressing G gene of viral hemorrhagic septicaemia virus (VHSV). Fish & Shellfish Immunology, 2020, 105: 62-70. |
| [46] | Ma CL, Li GH, Chen WJ, Jia ZP, Yang XL, Pan XH, Ma DX. Eimeria tenella: IMP1 protein delivered by Lactococcus lactis induces immune responses against homologous challenge in chickens. Veterinary Parasitology, 2021, 289: 109320. DOI:10.1016/j.vetpar.2020.109320 |
| [47] |
Liu SJ, Tao X, Deng B, Men XM, Xu ZW. Construction of recombinant Lactococcus lactis expressing porcine epidermal growth factor and its repair effects on intestinal damage of colitis model in mice. Chinese Journal of Animal Nutrition, 2021, 33(4): 2253-2262.
(in Chinese) 刘淑杰, 陶新, 邓波, 门小明, 徐子伟. 表达猪表皮生长因子重组乳酸乳球菌的构建及其对结肠炎模型小鼠肠道损伤的修复作用. 动物营养学报, 2021, 33(4): 2253-2262. DOI:10.3969/j.issn.1006-267x.2021.04.044 |
| [48] |
Liu AS, Li Y, Hu WF, Wu TS, Li JQ, Chen ZW, Jiang GY, Li L. Expression of porcine globular adiponectin gene in Lactococcus lactis. Chinese Journal of Animal and Veterinary Sciences, 2012, 43(3): 353-357.
(in Chinese) 刘霭莎, 李岩, 胡文锋, 吴同山, 李加琪, 陈真伟, 江冠尧, 黎立. 猪脂联素球状结构域gAd基因在乳酸乳球菌中的表达. 畜牧兽医学报, 2012, 43(3): 353-357. |
| [49] | 高铭扬. 表达鸡艾美尔球虫3-1E蛋白乳酸乳球菌免疫保护效果. 东北农业大学硕士学位论文, 2014. |
| [50] | Song LY, Xie WC, Liu ZH, Guo D, Dongfang Z, Qiao XY, Wang L, Zhou H, Cui W, Jiang YP, Li YJ, Xu YG, Tang LJ. Oral delivery of a Lactococcus lactis strain secreting bovine lactoferricin-lactoferrampin alleviates the development of acute colitis in mice. Applied Microbiology and Biotechnology, 2019, 103(15): 6169-6186. DOI:10.1007/s00253-019-09898-6 |
| [51] |
He J, Huang WW, Meng QS, Jiang YP, Cui W, Qiao XY, Ge JW, Liu M, Li YJ, Tang LJ. Application effects of recombinant Lactococcus lactis expressing porcine lactoferrin of weaner piglets. Chinese Journal of Animal Nutrition, 2014, 26(6): 1579-1586.
(in Chinese) 何佳, 黄薇薇, 孟庆森, 姜艳平, 崔文, 乔薪瑗, 葛俊伟, 刘敏, 李一经, 唐丽杰. 表达猪乳铁蛋白的重组乳酸乳球菌对断奶仔猪应用效果的研究. 动物营养学报, 2014, 26(6): 1579-1586. DOI:10.3969/j.issn.1006-267x.2014.06.019 |
| [52] | Zhou Y, Chen PP, Shi S, Li XW, Shi DS, Zhou ZT, Li ZL, Xiao YC. Expression of Gallus epidermal growth factor (gEGF) with food-grade Lactococcus lactis expression system and its biological effects on broiler chickens. Biomolecules, 2021, 11(1): 103. DOI:10.3390/biom11010103 |
| [53] | Mohammadi Ziarat M, Kermanshahi H, Nasiri Mogaddam H, Majidzadeh Heravi R. Performance of an Escherichia coli phytase expressed in Lactococcus lactis on nutrient retention, bone traits and intestinal morphology in broiler chickens. Journal of Animal Physiology and Animal Nutrition, 2020, 104(3): 909-917. DOI:10.1111/jpn.13332 |
| [54] | Pakbaten B, Majidzadeh Heravi R, Kermanshahi H, Sekhavati MH, Javadmanesh A, Mohammadi Ziarat M. Production of phytase enzyme by a bioengineered probiotic for degrading of phytate phosphorus in the digestive tract of poultry. Probiotics and Antimicrobial Proteins, 2019, 11(2): 580-587. DOI:10.1007/s12602-018-9423-x |
| [55] | 王玉赛. 融合表达TGEV 6Ds与PEDV ps420非抗性标记重组干酪乳杆菌表达系统的构建及免疫效果评价. 东北农业大学硕士学位论文, 2016. |
| [56] | Bryan EM, Bae T, Kleerebezem M, Dunny GM. Improved vectors for nisin-controlled expression in Gram-positive bacteria. Plasmid, 2000, 44(2): 183-190. DOI:10.1006/plas.2000.1484 |
| [57] |
Liang Y, Cui X, Wang Z, Wang T, Xu ZS. Research and application of food-grade expression vectors of lactic acid bacteria. Microbiology China, 2021, 48(3): 906-915.
(in Chinese) 梁琰, 崔欣, 王哲, 王婷, 徐振上. 乳酸菌食品级表达载体的研究与应用. 微生物学通报, 2021, 48(3): 906-915. |
| [58] |
Wang H, Lao X, Huang LL, Fang YC, Xiong ZQ, Ai LZ, Song X. Research progress on expression system and promoter of Lactococcus lactis. Food Science: 1–11. (in Chinese) 王慧, 劳晓, 黄琳琳, 方以诚, 熊智强, 艾连中, 宋馨. 乳酸乳球菌表达系统及其启动子的研究进展. 食品科学: 1–11. |
| [59] |
Wang Y, Hu GX. Advance in food-grade lactic acid bacteria expression system. China Animal Husbandry & Veterinary Medicine, 2010, 37(7): 80-83.
(in Chinese) 王莹, 胡桂学. 食品级乳酸菌表达系统的研究进展. 中国畜牧兽医, 2010, 37(7): 80-83. |
 2022, Vol. 62
2022, Vol. 62




