中国科学院微生物研究所,中国微生物学会
文章信息
- 王晓岑, 罗峥伟, 张聪, 李靖, 毕新月, 王天玉, 李瑞娟, 严黛君, 霍艳丽. 2022
- WANG Xiaocen, LUO Zhengwei, ZHANG Cong, LI Jing, BI Xinyue, WANG Tianyu, LI Ruijuan, YAN Daijun, HUO Yanli.
- HFD对不同性别SD大鼠肠道菌群及室旁核小胶质细胞激活的影响
- Difference in effect of HFD on intestinal microflora, fat metabolism, and brain microglia activation between female and male SD rats
- 微生物学报, 62(5): 1892-1904
- Acta Microbiologica Sinica, 62(5): 1892-1904
-
文章历史
- 收稿日期:2021-10-20
- 修回日期:2021-12-07
- 网络出版日期:2022-01-18
2. 河北北方学院 中医学院,河北 张家口 075000;
3. 河北北方学院 第一临床学院,河北 张家口 075000;
4. 河北北方学院 基础医学院,河北 张家口 075000
2. College of Traditional Chinese Medicine, Hebei North University, Zhangjiakou 075000, Hebei, China;
3. First Clinical College, Hebei North University, Zhangjiakou 075000, Hebei, China;
4. Basic Medical College, Hebei North University, Zhangjiakou 075000, Hebei, China
随着我国生活水平的日益改善,人们的饮食结构逐渐开始向西方化的高脂饮食倾斜,虽然已有研究表明,长期摄入过量脂肪的饮食会导致线粒体功能障碍、氧化应激和中枢神经系统少突胶质细胞丢失,从而造成中枢神经系统功能显著紊乱[1],但目前对于高脂饮食造成中枢神经系统损伤的机制仍知之甚少。不过随着微生物-肠-脑轴(microbiota-gut-brain,MGB)理论的不断发展,逐渐为相关机制的研究打开了实验思路。
MGB是一条复杂的神经体液通路,具有双向信号调节作用。一方面,来自大脑的信号可以改变肠道的感觉运动和分泌功能;另一方面,来自胃肠道的传入信号也可以反向调节大脑功能。有证据显示,高脂饮食不仅可以改变肠道菌群[2],还能迅速引起小胶质细胞增生从而导致下丘脑出现急性炎症反应[3],而肠道菌群的改变又与脑小胶质细胞的激活密切相关[4]。此外,高脂饮食对肠道菌群的影响在不同性别间也存在一定差异[2],研究表明,性别或性类固醇会影响人类和啮齿类动物肠道细菌的分类学组成[5]。因此,我们大胆假设,高脂饮食、肠道菌群和脑小胶质细胞的激活可能存在一定程度的相关性,且这种相关性还可能会在性别因素的影响下呈现出某些差异。
为了证明这一猜想,我们也引用了MGB这一概念,以雌、雄SD大鼠建立动物模型,采用高脂饮食与正常饮食进行对照实验,通过一系列分子生物学技术检测分析在高脂饮食干预下不同性别的大鼠肠道菌群及盲肠中SCFAs的变化,并利用相关基因学检测技术测定不同性别大鼠脑PVN区中相关细胞因子的mRNA相对表达水平,从而将高脂饮食、肠道菌群及脑胶质细胞建立联系,以探究高脂饮食对不同性别SD大鼠肠道菌群及PVN区小胶质细胞激活的影响。
1 材料与方法 1.1 实验动物SPF级SD大鼠24只,雌雄各半,3周龄,购自北京华阜康生物科技股份有限公司,生产证许可证号:SCXK(京)(2014-0004),饲养于河北北方学院实验动物中心SPF级恒温层流室内。本实验符合中华人民共和国动物保护法,并通过河北北方学院动物伦理委员会的批准,实验中按照替代、减少和优化三项原则,尽量减少动物使用数量和减轻动物的痛苦。
1.2 试剂与仪器粪便细菌DNA提取试剂盒(北京奥维森基因科技有限公司);盲肠内容物短链脂肪酸测定试剂盒(上海类聚科技有限公司);Real-Time PCR试剂盒(武汉华联科生物技术有限公司)。
移液枪(利辰科技);离心管(上海雷布斯网络科技有限公司);TGL-16K离心机(湖南湘仪实验室仪器有限公司);VOTEX-5涡旋仪(其林贝尔有限公司);冷冻干燥机(宁波双嘉仪器有限公司);7290A-5975C气相色谱-质谱联用仪(美国安捷伦公司);微量移液枪(美国Rainin PiPet-Lite);无RNA酶离心管(AXYGEN);Icen-24R高速冷冻离心机(杭州奥盛);GE48527 PCR仪(杭州柏恒);荧光定量PCR仪(CFX-Connect 96 Bio-Rad);MTV-1微型涡旋混合仪(杭州奥盛)。
1.3 动物饲料饲料购于北京华阜康生物科技股份有限公司,许可证编号:京饲证(2014)06057,其中维持饲料(型号:1022,蛋白质:22.47%,脂肪12.11%,碳水化合物65.42%,能量值3.42 kcal/g);高脂饲料(型号:H10060,含蛋白质26%,碳水化合物26%,脂肪60%,能量值5.24 kcal/g)。
1.4 实验分组24只断乳的(3周龄)SD大鼠,雌雄各半,随机分成雄性对照组(CM)、雌性对照组(CF)、雄性高脂组(HM)、雌性高脂组(HF),共4组,每组6只。4组大鼠均给予基础饲料适应性喂养7 d后,对照组(CM & CF)饲喂维持饲料,高脂组(HM & HF)饲喂60%高脂饲料至10周龄,饲养环境为昼夜12 h交替,控制室内温度在22- 25 ℃,湿度在55%-65%,食物和水自由摄取。
1.5 样本采集高脂饮食6周后,收集各组大鼠新鲜清洁无污染的粪便样本,迅速置于液氮中,-80 ℃保存备用。将4组大鼠深度麻醉后断头,冰上采集PVN区周围脑组织并迅速置于液氮中,-80 ℃保存备用;采集其盲肠内容物,迅速置于液氮中,-80 ℃保存备用。
1.6 16S rDNA高通量测序法检测子代大鼠肠道菌群多样性样本送至北京奥维森基因科技有限公司,扩增样本中总DNA的16S rDNA功能基因特定区域,并应用Illumina MiSeq平台对样本微生物基因进行测序。下机数据经过QIIME(V1.8.0)软件过滤、拼接、去除嵌合体,再调uclust德尔方法对优质序列按相似度≥97%进行OTU聚类,选取每个类最长的序列为代表序列。然后调用uclust (version 1.2.22 http://www.drive5.com/uclust/downloads1_2_22q.html)数据库对OTU代表序列进行物种注释分析,最终得到每个OTU分类学信息。对于不符合以上标准的OTU归为“未分类细菌门”。根据物种注释结果,选取在门(phylum)和属(genus)分类水平上各物种相对丰度分布做柱形图。利用mothur软件(version 1.31.2)计算肠道微生物α多样性。
Chao1:即菌种丰富度指数,用以估计群落中的OTU数目(公式1)。
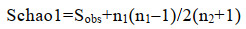
|
公式(1) |
其中Schao1为估计的OTU数,Sobs为观测到的OTU数,n1为只有一条序列的OTU数目,n2为只有两条序列的OTU数目。
Shannon:用来估算样品中微生物多样性指数之一(公式2)。
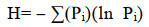
|
公式(2) |
其中Pi为样品中属于第i种的个体的比例,如样品总个体数为N,第i种个体数为ni,则Pi=ni/N
各种之间,个体分配越均匀,H值就越大。
1.7 气相色谱法检测盲肠中的短链脂肪酸样本送至上海类聚科技有限公司,样本预处理后,应用美国安捷伦公司7290A-5975C气相色谱-质谱联用仪(GC-MS)对样本进行检测,使用SIM采集定量测试已知特征离子,利用Mass hunter软件进行积分,利用标准曲线进行含量计算。
1.8 脑组织RNA提取与基因表达分析样本送至武汉华联科生物技术有限公司,首先进行脑组织总RNA提取;然后,按反应程序进行反转录,并将反转录产物置于4℃保存备用;最后,将制备好的cDNA进行PCR扩增。引物序列见表 1。
| Primers | Sequences (5′→3′) | Length/bp |
| CD11b-F | CAAGGAGTGTGTTTGCGTGTC | 204 |
| CD11b-R | TGAGTATGCCGTTCTTTGTTTC | |
| TNF-α-F | CCACGCTCTTCTGTCTACTG | 145 |
| TNF-α-R | GCTACGGGCTTGTCACTC | |
| IL-6-F | TGGAGTTCCGTTTCTACCTGG | 219 |
| IL-6-R | GGATGGTCTTGGTCCTTAGCC | |
| The annealing temperature of all the primer pairs in table 1 was 56 degree centigrade. | ||
1.9 统计学分析
利用SPSS 26.0(SPSS Inc., Chicago, IL, Version 26.0)统计学软件对数据进行统计学分析,所有数据的分析结果均以平均数±标准误差(mean±SEM)表示,两组间的比较采用t检验(t-test),采用Spearman相关系数分析雄性大鼠PVN区CD11b的mRNA相对表达水平与其肠道菌群的多样性及盲肠中乙酸含量的相关性,P < 0.05为显著差异,P < 0.01为极显著差异,有统计学意义。
2 结果与分析 2.1 四组大鼠肠道菌群的α多样性为了研究HFD对不同性别大鼠肠道菌群结构的影响,我们首先利用16S rDNA测序分析了4组大鼠肠道菌群的α多样性,如表 2所示。HM组Chao1指数为350.6±80.09,显著低于CM组(P < 0.05),说明其较CM组的菌群总数明显减少;HM组Shannon指数为3.90±1.11,显著低于CM组(P < 0.05),说明其较CM组的菌群多样性明显减少;HM组PD-whole-tree指数为26.13±4.11,相较于CM组极显著减小(P < 0.01),说明HM组的菌群对进化历史保存的差异明显变小;而HF组的OTU数为359.8±80.98,显著低于CF组(P < 0.05),说明HF组的菌群丰富度明显减少。
| Groups | OTUs | Chao1 | Observed-species | Goods-coverage | PD-whole-tree | Shannon |
| CM | 407.67±54.85 | 409.25±21.52 | 531.22±26.86 | 0.9967±0.00027 | 28.87±1.08 | 4.54±0.35 |
| HM | 370.83±61.67 | 350.6±80.09* | 438.22±93.30 | 0.9975±0.00045* | 26.13±4.11** | 3.90±1.11* |
| CF | 421.17±21.79 | 485.9±61.70 | 398.03±54.31 | 0.9973±0.00038 | 28.87±2.36 | 4.30±0.97 |
| HF | 359.80±80.98* | 450.89±71.01 | 360.82±60.68 | 0.9973±0.00032 | 26.72±3.33 | 3.57±0.77 |
| X±SEM, *: significant difference at the 0.05 level; **: extremely significant difference at the 0.01 level. CM: male control group, CF: femal control group, HM: high-fat mate group, HF: high-fat female group. | ||||||
2.2 四组大鼠肠道微生物在门水平及属水平上的相对丰度
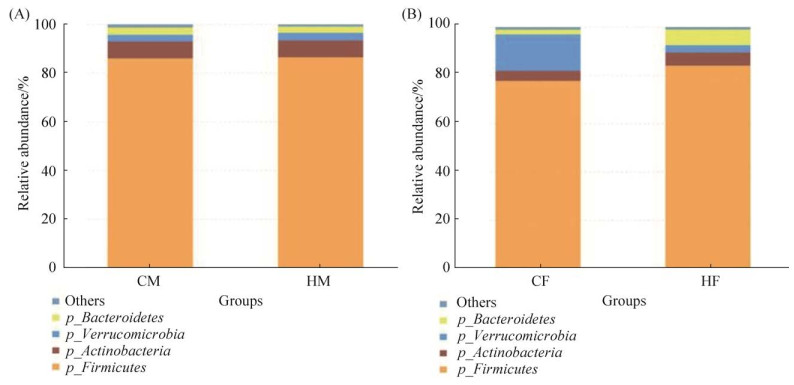
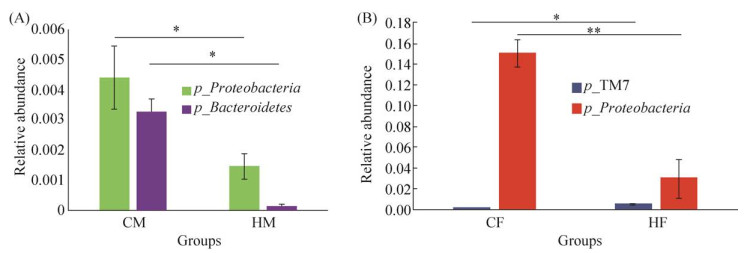
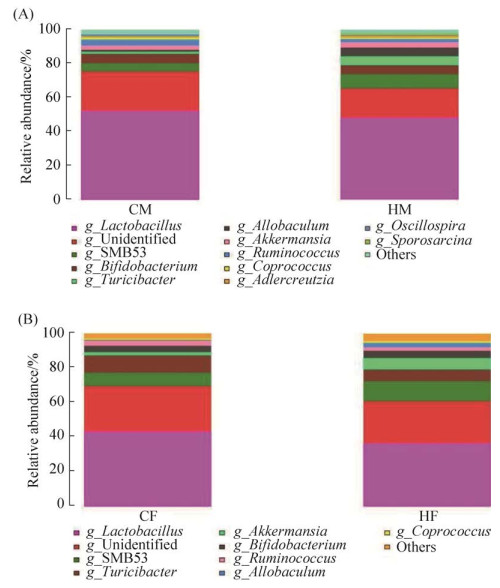
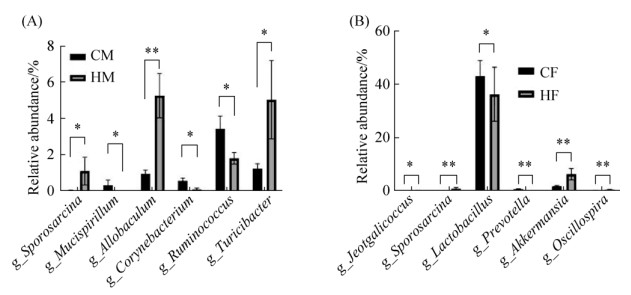
其次,我们分析了4组大鼠肠道菌群的组成,分类分析表明,4组大鼠的优势菌门均为厚壁菌门、放线菌门、疣微菌门和拟杆菌门(图 1),然后通过对4个优势菌门及其他非优势菌门的评估,比较了两组在门水平及属水平上的菌群差异。如图 2所示,HM组大鼠的变形菌门和拟杆菌门相对丰度显著低于CM组(P < 0.05);与CF组相比,HF组大鼠的拟杆菌门相对丰度极显著下降(P < 0.01),而TM7的相对丰富度显著升高(P < 0.05)。此外,在属水平上,4组大鼠肠道菌群中丰度占比最高的均为Lactobacillus菌属(图 3)。如图 4A所示,与CM组相比,HM组Sporosarcina、Turicibacter的相对丰度显著增加(P < 0.05),Allobaculum的相对丰度极显著增加(P < 0.01),而Mucispirillum、Corynebacterium、Ruminococcus的相对丰度显著减少(P < 0.05);如图 4B所示,与CF组相比,Jeotgalicoccus的相对丰度显著增加(P < 0.05),Sporosarcina、Akkermansia、Oscillospira的相对丰度极显著增加(P < 0.01),而Lactobacillus的相对丰度显著减少(P < 0.05)、Prevotella的相对丰度极显著减少(P < 0.01)。
|
| 图 1 SD大鼠肠道菌群在门水平上的相对丰度 Figure 1 Relative abundance of intestinal flora in SD rats at phylum level. A: comparison between CM and HM groups; B: comparison between CF and HF groups. CM: male control group; CF: femal control group; HM: high-fat mate group; HF: high-fat female group. |
|
| 图 2 SD大鼠肠道菌群在门水平上相对丰度变化有显著差异的菌群 Figure 2 Intestinal flora of SD rats showed significant difference in relative abundance at phylum level. A: there is a statistical difference between CM and HM groups; B: there is a statistical difference between CF and HF groups (X±SEM, *: P < 0.05). CM: male control group; CF: femal control group; HM: high-fat mate group; HF: high-fat female group. |
|
| 图 3 SD大鼠肠道菌群在属水平上的相对丰度 Figure 3 Relative abundance of intestinal flora in SD rats at genus level, A: comparison between CM and HM groups; B: comparison between CF and HF groups. CM: male control group; CF: femal control group; HM: high-fat mate group; HF: high-fat female group. |
|
| 图 4 SD大鼠肠道菌群在属水平上相对丰度变化有显著差异的菌属 Figure 4 Genera with significant changes in relative abundance of intestinal flora in SD rats at the genus level. A: there is a statistical difference between CM and HM groups; B: there is a statistical difference between CF and HF groups (X±SEM, *: P < 0.05, **: P < 0.01). CM: male control group; CF: femal control group; HM: high-fat mate group; HF: high-fat female group. |
2.3 基于Unweighted Unifrac距离PCoA主成分分析4组SD大鼠肠道菌群
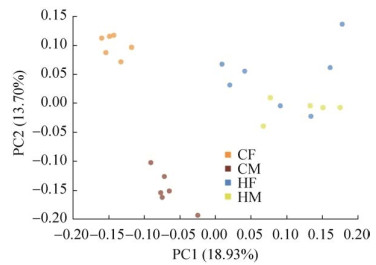
对Unweighted UniFrac距离进行主坐标分析(PCoA),以表达出4组样本之间的差异。由图 5可见,正常饮食组中,CF组与CM组的样本各自成簇,且两组组间距离较远;而高脂饮食组中,HM组与HF组各样本间均较分散,其中HM组更为显著,但两组组间直线距离相对较近。由此表明,高脂饮食分别增大了HM组与HF组组内的肠道菌群差异,而缩小了两组组间的肠道菌群差异。
|
| 图 5 基于Unweighted Unifrac距离PCoA分析HFD对不同性别SD大鼠肠道菌群的相似性或差异性 Figure 5 Analyzed the similarity or difference of high-fat diet to intestinal flora of SD rats of different genders based on the Unweighted Unifrac distance PCoA. CM: male control group; CF: femal control group; HM: high-fat mate group; HF: high-fat female group. |
2.4 LDA Effect Size分析4组SD大鼠肠道菌群的生物标志物
用LDA Effect Size分析检测了4组大鼠肠道菌群在门、纲、目、科、属水平上存在差异的物种。在雄性大鼠两组间对比发现,CM组的瘤胃球菌属(g_Ruminococcus)和疣微菌科(f_Ruminococcaceae)较多;HM组的韦荣球菌科(f_Erysipelotrichaceae)、丹毒丝菌纲(c_Erysipelotrichi)、丹毒丝菌目(o_Erysipelotrichales)和别样棒菌属(g_Allobaculum)较多(图 6A)。在雌性大鼠两组间对比发现,CF组的罗伊氏乳杆菌种(s_Lactobacillus reuteri)、S24-7菌科(f_S24-7)、拟杆菌纲(c_Bacteroidia)、拟杆菌目(o_Bacteroidales)、拟杆菌门(p_Bacteroidetes)较多;HF组韦荣球菌科(f_Erysipelotrichaceae)、丹毒丝菌纲(c_ Erysipelotrich)、丹毒丝菌目(o_Erysipelotrichales) 较多(图 6B)。
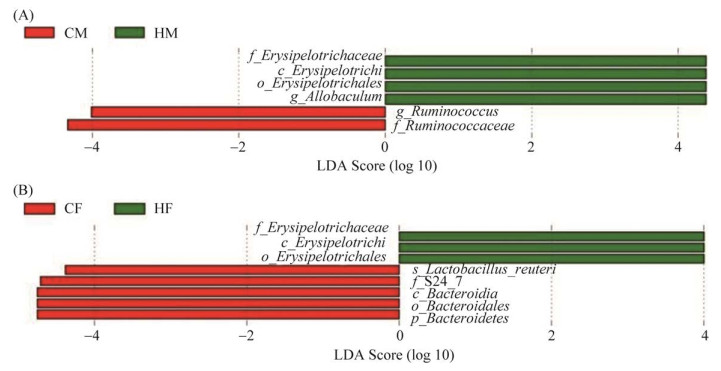
|
| 图 6 LDA Effect Size分析雄性SD大鼠肠道菌群的生物标志物 Figure 6 LDA Effect Size analysis of biomarker of intestinal flora in male SD rats. A: comparison between CM and HM groups; B: comparison between CF and HF groups. CM: male control group; CF: femal control group; HM: high-fat mate group; HF: high-fat female group. |
2.5 四组SD大鼠盲肠中SCFAs的含量
我们检测了4组大鼠盲肠中SCFAs的含量。通过对比我们发现,在雌性大鼠中,与CF组相比,HF组大鼠盲肠中6种短链脂肪酸的含量均无显著性差异。而在雄性大鼠中,如表 3所示,与CM组相比,HM组大鼠盲肠中的乙酸含量则显著下降(P < 0.05),此外,丙酸、丁酸含量也相对下降,但无统计学意义。
| Groups | Acetic acid/ ng | Propanoic acid/ ng | Isobutyric acid/ ng | Butanoic acid/ ng | Isovaleric acid/ ng | Valeric acid/ ng |
| CM | 825.55±98.09 | 384.11±50.01 | 51.01±7.70 | 623.62±105.90 | 37.16±6.78 | 63.68±10.86 |
| HM | 413.28±29.87* | 282.73±24.85 | 53.04±7.17 | 476.32±34.56 | 45.06±5.90 | 75.93±3.39 |
| X±SEM, *: significant difference at the 0.05 level; CM: male control group; CF: femal control group; HM: high-fat mate group; HF: high-fat female group. | ||||||
2.6 四组SD大鼠PVN区CD11b、TNF-α、IL-6的mRNA相对表达水平
利用real-time PCR技术检测了4组SD大鼠PVN区CD11b、TNF-α、IL-6在PVN区的mRNA相对表达水平,结果如图 7所示。与CM组大鼠相比,HM组大鼠的CD11b的mRNA相对表达水平显著升高(P < 0.05),而CF组大鼠与HF组大鼠的3种细胞因子的mRNA相对表达水平均无显著性差异。

|
| 图 7 不同性别SD大鼠PVN区细胞因子的mRNA相对表达水平 Figure 7 mRNA relative expression levels of cytokines in PVN region of SD rats of different genders (X±SEM, *: P < 0.05). CM: male control group; CF: femal control group; HM: high-fat mate group; HF: high-fat female group. |
2.7 HM组大鼠PVN区CD11b表达水平与其肠道菌群的多样性及盲肠中乙酸含量的相关性分析
我们对HM组大鼠中具有显著差异的相关变量进行了相关性分析,结果显示,HM组大鼠PVN区CD11b的mRNA相对表达水平与其盲肠中乙酸含量呈显著负相关(P < 0.05),表明HM组大鼠盲肠中乙酸含量的降低可引起其PVN区CD11b的mRNA相对表达水平升高(表 4)。
| Correlation variable | Coefficient Sig. | CD11b | Acetic acid | Chao1 | Observed _species | PD_ wholetree | Shannon | Absolute number of species at the genus level |
| CD11b | (2-tailed) | 1.000 | ||||||
| Acetic acid | (2-tailed) | -0.683* | 1.000 | |||||
| 0.042 | ||||||||
| Chao1 | (2-tailed) | 0.233 | -0.007 | 1.000 | ||||
| 0.546 | 0.983 | |||||||
| Observed_species | (2-tailed) | 0.167 | 0.462 | 0.636* | 1.000 | |||
| 0.668 | 0.131 | 0.026 | ||||||
| PD_whole_tree | (2-tailed) | 0.250 | 0.420 | 0.657* | 0.958** | 1.000 | ||
| 0.516 | 0.175 | 0.020 | 0.000 | |||||
| Shannon | (2-tailed) | 0.083 | 0.524 | 0.287 | 0.797** | 0.671* | 1.000 | |
| 0.831 | 0.080 | 0.366 | 0.002 | 0.017 | ||||
| Absolute number of species at the genus level | (2-tailed) | 0.378 | -0.004 | 0.521 | 0.792** | 0.778** | 0.563 | 1.000 |
| 0.316 | 0.991 | 0.082 | 0.002 | 0.003 | 0.056 | |||
| X±SEM, *: significant correlation at the 0.05 level; **: extremely significant correlation at the 0.01 level. | ||||||||
3 讨论
近年来,肠道菌群逐渐被人们重视起来,其在体内的动态平衡对机体健康影响巨大。在生命早期,定殖在肠道的微生物群的组成和多样性深深地影响着宿主免疫系统的发育,并维持着宿主晚年的健康[6]。能够影响肠道菌群的因素众多,其中饮食结构是影响成年后肠道菌群的主要因素之一[7]。根据我们的研究结果显示,高脂饮食不仅改变了大鼠肠道菌群的总数、种类及多样性,且对不同性别大鼠的肠道菌群的影响也有所不同。PCoA分析发现,高脂饮食增大了相同性别间的肠道菌群差异,缩小了不同性别间的肠道菌群差异。同时我们还发现,与正常饮食组相比,高脂组大鼠肠道菌群的正常优势菌群减少,如HM组中的变形菌门、杆菌门及瘤胃球菌属(Ruminococcus)、Mucispirillum;HF组中的拟杆菌门及乳杆菌属(Lactobacillus)、普氏菌属(Prevotella)减少,而有害菌群增多,如TM7、f-Erysipelotrichaceae、c-Erysipelotrich、o-Erysipelotrichales等。以上证据均表明,由高脂饮食引起的肠道菌群的改变,无论对于哪种性别的大鼠来说,都是无益的,也就是说,高脂饮食能够诱发雌、雄性大鼠的肠道菌群失调。由于肠道菌群与肠道免疫系统的发育密切相关[8],那么肠道菌群失调无疑会破坏肠道发育,这一结果可能部分解释了为什么高脂饮食被认为是多种疾病发病的危险因素[9]。由此可见,维持肠道内菌群的相对稳定对于人体健康极为重要。
现如今,中枢神经系统的高发病率及高死亡率已然成为全球范围内的巨大挑战,肠道菌群失调不仅与神经系统退行性疾病,如阿尔兹海默症、帕金森病、多发性硬化相关,还会对神经心理疾病,如抑郁症及神经系统发育障碍性疾病,如自闭症造成巨大影响[10-14]。而小胶质细胞的激活也被认为在这些疾病中发挥了重要作用[15]。小胶质细胞是一类分布于中枢神经系统(central nervous system, CNS)的巨噬细胞,是CNS中的固有免疫细胞,属于神经胶质细胞的一种,它被认为是脑实质免疫反应的主要细胞介质,介导中枢神经系统损伤和疾病的内源性免疫反应[16]。小胶质细胞的活化,可对大脑神经元的功能产生不利影响,甚至导致神经元的死亡[17]。而SCFAs是构成肠道内膳食纤维细菌发酵的主要代谢产物,通常被认为是关键的候选介质,多项研究表明[18-20],SCFAs不仅可以通过血脑屏障进入脑组织,还具有抗炎特性,尤其是乙酸、丙酸和丁酸,可强烈减少了一些促炎趋化因子的释放,参与大脑炎症反应调控。一项研究表明,SCFAs具有调节小胶质细胞稳态的作用,以此证明了宿主细菌对小胶质细胞的成熟和功能有重要的调节作用,且复杂的微生物群还能在一定程度上纠正小胶质细胞的损伤[21]。
我们通过检测4组大鼠盲肠中SCFAs含量及其脑PVN区CD11b、IL-6、TNF-α的mRNA相对表达水平发现,与CM组相比,HM组大鼠盲肠中的乙酸、丙酸和丁酸含量均相对下降,其中乙酸含量下降显著(P < 0.05);而PVN区中CD11b的mRNA相对表达水平则显著升高(P < 0.05)。我们的相关性分析表明,HM组大鼠盲肠中的乙酸含量与脑PVN区CD11b的mRNA表达水平呈负相关,相关系数是0.683,而CD11b作为小胶质细胞的标记物,其表达水平大多会随着小胶质细胞的活化而增加[22]。Erny等[21]曾通过实验证明,在小鼠饮水中添加了含丙酸钠、丁酸钠和乙酸钠的混合物,仅用4周就能扭转小胶质细胞密度、形态和成熟度的缺陷,这与我们的研究结果相吻合。此外,LDA Effect Size分析显示,CM组大鼠肠道菌群的生物标志物以g_Ruminococcus和f_Ruminococcaceae为主,但我们却在属水平上观察到HM组大鼠肠道中的Ruminococcus菌属相对丰度显著减少,而Ruminococcus菌属主要的代谢产物正是乙酸[23]。因此我们认为,导致HM组大鼠盲肠中乙酸含量降低的原因可能与高脂饮食诱导的肠道菌群中产乙酸菌的变化有关。综上所述,我们实验证实了高脂饮食可通过干扰雄性大鼠的肠道菌群使其盲肠内的乙酸含量下降,导致其脑PVN区CD11b的mRNA相对表达水平升高,从而对脑小胶质细胞的激活造成了影响。
然而,我们在HF组大鼠盲肠中所测得的6种SCFAs含量与CF组几乎无差异。与CF组相比,HF组大鼠PVN区的CD11b、IL-6、TNF-α的mRNA相对表达水平也无明显差异。此结果表明高脂饮食所致雌性大鼠肠道菌群的改变可能不会通过影响其肠道菌群的代谢产物的改变,而影响雌性大鼠PVN区CD11b、IL-6、TNF-α的mRNA相对表达水平,即高脂饮食虽然可以导致雌性大鼠肠道菌群失调,但可能不会刺激小胶质细胞活化。对于实验结果呈现出的性别差异,我们认为,最可能导致这种差异的因素必然是性激素。Org等[24]就曾将雄性小鼠与去势雄性小鼠的肠道菌群进行了对比,结果证明了性别间肠道微生物群组成的差异在一定程度上是由性激素介导的。大量研究表明,雌激素在多种疾病中均发挥了至关重要的神经保护作用[25-27]。然而,我们的实验尚不能得出相关结论,因此,对于雌激素的神经保护作用及其作用机制仍需进一步研究。
就本次研究结果而言,高脂饮食明显对于雄性大鼠的影响更大。遗憾的是,我们只针对不同性别SD大鼠的幼年到成年时期进行了研究,除找到PVN区小胶质细胞激活的证据外,尚未观察到与大脑炎症有关的证据,也不足以看出高脂饮食对这些大鼠后期肠道菌群及大脑功能的影响。因此,我们尚无法针对这些大鼠后期罹患相关中枢神经系统疾病的风险进行评估。若要探讨高脂饮食是否能够通过肠道菌群影响中枢神经功能从而增加罹患中枢神经系统疾病的风险,还需建立具体疾病模型进一步研究。此外,我们并未对大鼠的肠道菌群做功能性分析,导致该实验仍存在一定局限性,但是我们的研究为不同性别间高脂饮食、肠道菌群和脑小胶质细胞激活的相关性增添了有力证据。
4 结论高脂饮食改变了雌、雄大鼠的肠道菌群组成及多样性,导致大鼠肠道菌群失调。此外,高脂饮食可通过影响雄性大鼠盲肠中的乙酸含量使PVN区CD11b的mRNA相对表达水平升高,从而影响了脑小胶质细胞的激活,其导致雄性大鼠盲肠内乙酸含量下降的原因可能与高脂饮食所致的雄性大鼠肠道菌群的变化有关。然而,在雌性大鼠中,我们并未发现高脂饮食与小胶质细胞激活具有相关性的证据,这说明高脂饮食对脑小胶质细胞的影响在不同性别间存在一定差异。
| [1] | Langley MR, Yoon H, Kim HN, Choi CI, Simon W, Kleppe L, Lanza IR, LeBrasseur NK, Matveyenko A, Scarisbrick IA. High fat diet consumption results in mitochondrial dysfunction, oxidative stress, and oligodendrocyte loss in the central nervous system. Biochimica et Biophysica Acta Molecular Basis of Disease, 2020, 1866(3): 165630. DOI:10.1016/j.bbadis.2019.165630 |
| [2] |
Peng LL, Ding N, Zhao ZG, Li FH, Zhao ZJ. Effects of high-fat diet on gut microbiota in male and female mice. Science and Technology of Food Industry, 2020, 41(1): 86-90.
(in Chinese) 彭利利, 丁宁, 赵正刚, 李芳红, 赵子建. 高脂饮食对不同性别小鼠肠道菌群的影响. 食品工业科技, 2020, 41(1): 86-90. |
| [3] | Shoelson SE, Lee J, Goldfine AB. Inflammation and insulin resistance. The Journal of Clinical Investigation, 2006, 116(7): 1793-1801. DOI:10.1172/JCI29069 |
| [4] | Castillo-Ruiz A, Mosley M, George AJ, Mussaji LF, Fullerton EF, Ruszkowski EM, Jacobs AJ, Gewirtz AT, Chassaing B, Forger NG. The microbiota influences cell death and microglial colonization in the perinatal mouse brain. Brain, Behavior, and Immunity, 2018, 67: 218-229. DOI:10.1016/j.bbi.2017.08.027 |
| [5] |
Yang L, Ge WP, Wang R, Liang XZ, Wu XY, Xi ML, Jin XD. Influence of age, gender, and delivery mode on the differential analysis of intestinal flora in infants. Acta Nutrimenta Sinica, 2019, 41(4): 352-357.
(in Chinese) 杨莉, 葛武鹏, 王瑞, 梁秀珍, 吴小勇, 郗梦露, 靳欣迪. 不同月龄、性别、分娩方式对婴儿肠道菌群差异性分析. 营养学报, 2019, 41(4): 352-357. |
| [6] | Xie RX, Sun Y, Wu JY, Huang SM, Jin G, Guo ZX, Zhang YJ, Liu TY, Liu X, Cao XC, Wang BM, Cao HL. Maternal high fat diet alters gut microbiota of offspring and exacerbates DSS-induced colitis in adulthood. Frontiers in Immunology, 2018, 9: 2608. DOI:10.3389/fimmu.2018.02608 |
| [7] |
Yin YS, Wang X. Comparative study for factors that affect microbiota colonization in experimental mice. Laboratory Animal Science, 2012, 29(4): 12-18.
(in Chinese) 尹业师, 王欣. 影响实验小鼠肠道菌群的多因素比较研究. 实验动物科学, 2012, 29(4): 12-18. |
| [8] | Wesemann DR, Portuguese AJ, Meyers RM, Gallagher MP, Cluff-Jones K, Magee JM, Panchakshari RA, Rodig SJ, Kepler TB, Alt FW. Microbial colonization influences early B-lineage development in the gut Lamina propria. Nature, 2013, 501(7465): 112-115. DOI:10.1038/nature12496 |
| [9] | Hotamisligil GS. Inflammation and metabolic disorders. Nature, 2006, 444(7121): 860-867. DOI:10.1038/nature05485 |
| [10] | Jangi S, Gandhi R, Cox LM, Li N, Von Glehn F, Yan R, Patel B, Mazzola MA, Liu SR, Glanz BL, Cook S, Tankou S, Stuart F, Melo K, Nejad P, Smith K, Topçuolu BD, Holden J, Kivisäkk P, Chitnis T, De Jager PL, Quintana FJ, Gerber GK, Bry L, Weiner HL. Alterations of the human gut microbiome in multiple sclerosis. Nature Communications, 2016, 7: 12015. DOI:10.1038/ncomms12015 |
| [11] | Cattaneo A, Cattane N, Galluzzi S, Provasi S, Lopizzo N, Festari C, Ferrari C, Guerra UP, Paghera B, Muscio C, Bianchetti A, Volta GD, Turla M, Cotelli MS, Gennuso M, Prelle A, Zanetti O, Lussignoli G, Frisoni GB. Association of brain amyloidosis with pro-inflammatory gut bacterial taxa and peripheral inflammation markers in cognitively impaired elderly. Neurobiology of Aging, 2017, 49: 60-68. DOI:10.1016/j.neurobiolaging.2016.08.019 |
| [12] | Aizawa E, Tsuji H, Asahara T, Takahashi T, Teraishi T, Yoshida S, Ota M, Koga N, Hattori K, Kunugi H. Possible association of Bifidobacterium and Lactobacillus in the gut microbiota of patients with major depressive disorder. Journal of Affective Disorders, 2016, 202: 254-257. DOI:10.1016/j.jad.2016.05.038 |
| [13] | Kang DW, Park JG, Ilhan ZE, Wallstrom G, Labaer J, Adams JB, Krajmalnik-Brown R. Reduced incidence of Prevotella and other fermenters in intestinal microflora of autistic children. PLoS One, 2013, 8(7): e68322. DOI:10.1371/journal.pone.0068322 |
| [14] |
Zhao C, Yu HY, Li W, Shi J, Qin B. Structural changes of gut microbiota in patients with Parkinson's disease. Chinese Journal of Neurology, 2018, 51(7): 498-503.
(in Chinese) 赵程, 于会艳, 李薇, 时晶, 秦斌. 帕金森病患者肠道菌群变化的研究. 中华神经科杂志, 2018, 51(7): 498-503. DOI:10.3760/cma.j.issn.1006-7876.2018.07.004 |
| [15] | Salter MW, Stevens B. Microglia emerge as central players in brain disease. Nature Medicine, 2017, 23(9): 1018-1027. DOI:10.1038/nm.4397 |
| [16] | Colonna M, Butovsky O. Microglia function in the central nervous system during health and neurodegeneration. Annual Review of Immunology, 2017, 35: 441-468. DOI:10.1146/annurev-immunol-051116-052358 |
| [17] |
Ke LN, Zhao XZ, Xu JW, Wang W. Action of activated microglia in hippocampal neurons of rat damage induced by hypoxia. Acta Anatomica Sinica, 2009, 40(5): 737-742.
(in Chinese) 柯荔宁, 赵小贞, 徐剑文, 王玮. 活化的小胶质细胞在大鼠海马神经元缺氧损伤中的作用. 解剖学报, 2009, 40(5): 737-742. DOI:10.3969/j.issn.0529-1356.2009.05.009 |
| [18] | Mitchell RW, On NH, Del Bigio MR, Miller DW, Hatch GM. Fatty acid transport protein expression in human brain and potential role in fatty acid transport across human brain microvessel endothelial cells. Journal of Neurochemistry, 2011, 117(4): 735-746. |
| [19] | Nastasi C, Candela M, Bonefeld CM, Geisler C, Hansen M, Krejsgaard T, Biagi E, Andersen MH, Brigidi P, Ødum N, Litman T, Woetmann A. The effect of short-chain fatty acids on human monocyte-derived dendritic cells. Scientific Reports, 2015, 5: 16148. DOI:10.1038/srep16148 |
| [20] | Tan J, McKenzie C, Potamitis M, Thorburn AN, MacKay CR, Macia L. The role of short-chain fatty acids in health and disease. Advances in Immunology, 2014, 121: 91-119. |
| [21] | Erny D, Hrabě De Angelis AL, Jaitin D, Wieghofer P, Staszewski O, David E, Keren-Shaul H, Mahlakoiv T, Jakobshagen K, Buch T, Schwierzeck V, Utermöhlen O, Chun E, Garrett WS, McCoy KD, Diefenbach A, Staeheli P, Stecher B, Amit I, Prinz M. Host microbiota constantly control maturation and function of microglia in the CNS. Nature Neuroscience, 2015, 18(7): 965-977. |
| [22] | Kettenmann H, Hanisch UK, Noda M, Verkhratsky A. Physiology of microglia. Physiological Reviews, 2011, 91(2): 461-553. |
| [23] |
Liu SZ, Zhang Y, Zhang MW, Sun YM, Wei ZC. Research progress on producing mechanism and physiological functions of intestinal short chain fatty acids. Guangdong Agricultural Sciences, 2013, 40(11): 99-103.
(in Chinese) 刘松珍, 张雁, 张名位, 孙远明, 魏振承. 肠道短链脂肪酸产生机制及生理功能的研究进展. 广东农业科学, 2013, 40(11): 99-103. |
| [24] | Org E, Mehrabian M, Parks BW, Shipkova P, Liu XQ, Drake TA, Lusis AJ. Sex differences and hormonal effects on gut microbiota composition in mice. Gut Microbes, 2016, 7(4): 313-322. |
| [25] | Huang C, Yuan P, Wu J, Huang J. Estrogen regulates excitatory amino acid carrier 1 (EAAC1) expression through sphingosine kinase 1 (SphK1) transacting FGFR-mediated ERK signaling in rat C6 astroglial cells. Neuroscience, 2016, 319: 9-22. |
| [26] | Lu Y, Sareddy GR, Wang J, Zhang Q, Tang FL, Pratap UP, Tekmal RR, Vadlamudi RK, Brann DW. Neuron-derived estrogen is critical for astrocyte activation and neuroprotection of the ischemic brain. The Journal of Neuroscience, 2020, 40(38): 7355-7374. |
| [27] | El-Khatib YA, Sayed RH, Sallam NA, Zaki HF, Khattab MM. 17β-estradiol augments the neuroprotective effect of agomelatine in depressive- and anxiety-like behaviors in ovariectomized rats. Psychopharmacology, 2020, 237(9): 2873-2886. |
 2022, Vol. 62
2022, Vol. 62