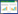中国科学院微生物研究所,中国微生物学会
文章信息
- 谢倩, 韩喜球, 魏铭聪, 邱中炎, 董传奇, 吴月红, 吴雪停, 余娟. 2022
- XIE Qian, HAN Xiqiu, WEI Mingcong, QIU Zhongyan, DONG Chuanqi, WU Yuehong, WU Xueting, YU Juan.
- 西北印度洋卡尔斯伯格脊卧蚕热液羽流影响区细菌群落结构特征及其演化
- Characteristics and evolution of bacterial communities in the Wocan hydrothermal plume-influenced zone, Carlsberg Ridge, northwestern Indian Ocean
- 微生物学报, 62(6): 1974-1985
- Acta Microbiologica Sinica, 62(6): 1974-1985
-
文章历史
- 收稿日期:2022-03-07
- 修回日期:2022-05-10
- 网络出版日期:2022-05-17
2. 自然资源部第二海洋研究所, 自然资源部海底科学重点实验室, 浙江 杭州 310012;
3. 浙江大学海洋学院, 浙江 舟山 316021;
4. 中国海洋大学海洋地球科学学院, 山东 青岛 266100;
5. 自然资源部第二海洋研究所 自然资源部海洋生态系统动力学重点实验室, 浙江 杭州 310012
2. Key Laboratory of Submarine Geosciences & Second Institute of Oceanography, Ministry of Natural Resources, Hangzhou 310012, Zhejiang, China;
3. Ocean College, Zhejiang University, Zhoushan 316021, Zhejiang, China;
4. College of Marine Geosciences, Ocean University of China, Qingdao 266100, Shandong, China;
5. Key Laboratory of Marine Ecosystem Dynamics & Second Institute of Oceanography, Ministry of Natural Resources, Hangzhou 310012, Zhejiang, China
海底热液喷口释放的高温流体与周围冷海水相遇后迅速混合形成热液羽流,在热浮力作用下,热液羽流可上升数百米直到与周围环境达到浮力平衡,然后发生横向扩散[1–2]。在羽流扩散过程中由于环境物理化学条件的变化,不断有热液颗粒物形成、演化和沉降,向海底输入热液沉积物[3–4]。中性浮力羽流层及其下方受热液颗粒物影响的区域统称为热液羽流影响区。
与周围海水相比,热液羽流中富含NH4+、Mn2+、Fe2+、CH4、H2S、H2等还原性化学物质,能为微生物的生长和繁殖提供电子供体与能量[5–6]。1986年,Winn等[7]首次报道东太平洋胡安德富卡洋脊Endeavour段热液羽流中生活有大量的微生物。之后,在全球不同区域的热液羽流中发现了γ-变形菌纲(Gammaproteobacteria)、弯曲菌纲(Camplylobacteria)、α-变形菌纲(Alphaproteobacteria)和δ-变形菌纲(Deltaproteobacteria)以及古菌奇古菌门(Thaumarchaeota)和广古菌门(Euryarchaeota)等类群[8–13]。已有研究表明热液羽流中微生物群落的组成在时间和空间上存在变化性[14–23]。Sylvan等[16]发现当热液活动加强时,羽流中细菌群落以弯曲菌纲为主,反之,则以γ-和α-变形菌纲为主。热液羽流上升阶段中常见有产水菌科(Aquificaceae)、嗜氢热菌科(Hydrogenothermaceae)等嗜热菌和化能自养的硫单胞菌属(Sulfurovum)、硫卵菌属(Sulfurimonas)和卡氏杆菌属(Caminibacter)等弯曲菌纲类群[19–20],而中性浮力羽流中一般由Sulfurimonas和SUP05类群占据主导地位[17]。虽然,前人对热液羽流的微生物多样性及其生态特征开展了一定程度的研究,但由于深海羽流的观测和取样的难度和高成本,对羽流开展长周期的立体观测十分稀少,关于活动热液区附近不同空间结构微生物多样性认知有限,特别是由于海底热液活动通常具有“幕式”特点,零星的瞬时采样分析结果不能全面、忠实地反映热液区及其周边微生物的组成、丰度和特征。
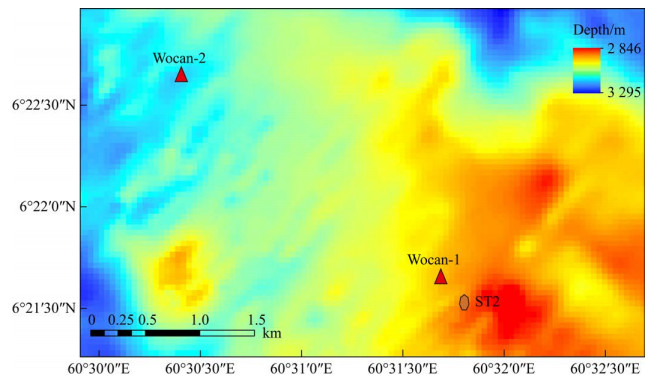
卧蚕1号热液区(6°22′N,60°31′E,水深3 000 m)位于西北印度洋卡尔斯伯格脊一新火山脊上,属典型的镁铁岩型高温热液系统[24],由中国大洋28航次于2013年发现[4]。经2017年蛟龙号载人深潜调查测量,热液喷口流体实测最高温度为359 ℃,中性浮力羽流层深度位于2 550–2 850 m,厚度约300 m (韩喜球等,未发表)。经对热液沉积物岩心的地球化学分析和定年,该热液区在过去1 069年以来持续活动,但活动强度存在变化,热液来源的铁通量为9 483–10 834 mg/(cm2·ka)[4]。2018年7月,中国大洋49航次在该热液区东南侧约300 m (60°31′48.468″E,6°21′32.364″N)投放了一组沉积物捕获器锚系潜标(图 1,2),分别在距离海底300 m和40 m处(即中性浮力羽流扩散区和热液颗粒物沉降区)按每15 d的时间序列间隔采集水样及其颗粒物样品,18个月后收回。本文通过抽提水样中的DNA,采用高通量测序技术,分析微生物多样性,旨在对比分析中性浮力羽流扩散区和热液颗粒沉降区细菌群落结构的差异及其影响因素,为精细刻画深海热液羽流影响区微生物与环境之间的相互作用提供重要信息。
|
| 图 1 卧蚕热液区地形图与沉积物捕获器锚系潜标(ST2)观测位置 Figure 1 Bathymetric map of the Wocan hydrothermal field and the location of station ST2 where sediment trap mooring system deployed. |
|
| 图 2 热液羽流和样品采集位置示意图 Figure 2 Schematic diagram of hydrothermal plume and the sampling site. |
1 材料与方法 1.1 样品采集
所布放锚系潜标由重块、声学释放器和2个沉积物捕获器(McLANE PARFLUX Mark 78H-21)组成,其中2个沉积物捕获器分别距底300 m和40 m,在离底150 m高度放置了一个自容式的浊度仪(Seapoint)和海流计。每个沉积物捕获器各携带21个500 mL取样管,其漏斗状锥形沉积物捕获器顶部的截面积为0.5 m2 (顶部直径80 cm;底部直径2.5 cm),在马达驱动下每管样品对准采样口收集样品的时间为15 d,采样时间为2018年7月至2019年5月,总时长为11个月,浊度仪则每0.5 h测量1次水体浊度。该套装置于2019年6月由中国大洋57航次回收,在海底的时长为18个月。
在潜标投放前,沉积物捕获器的各取样管均装用纯净水配制的浓度为4%的福尔马林溶液。潜标布放成功后通过声学三角测量法确定锚系位置,位置误差为±20 m。潜标回收后,样品迅速储存在–20 ℃冰箱中。本文重点选择浊度异常时段采集的水样和其他代表性样品进行生物多样性分析,具体样品信息见表 1。
| Sample ID | Sampling time | Height (m above the seafloor) | Turbidity anomaly |
| ST2_T_2 | 2018.08.13–2018.08.27 | 300 | + |
| ST2_T_5 | 2018.09.27–2018.10.11 | 300 | +++ |
| ST2_T_8 | 2018.11.11–2018.11.25 | 300 | – |
| ST2_T_10 | 2018.12.11–2018.12.25 | 300 | – |
| ST2_T_12 | 2019.01.10–2019.01.24 | 300 | + |
| ST2_T_16 | 2019.03.11–2019.03.25 | 300 | ++ |
| ST2_T_21 | 2019.05.25–2019.06.09 | 300 | + |
| ST2_B_2 | 2018.08.13–2018.08.27 | 40 | + |
| ST2_B_5 | 2018.09.27–2018.10.11 | 40 | +++ |
| ST2_B_7 | 2018.10.27–2018.11.10 | 40 | – |
| ST2_B_9 | 2018.11.26–2018.12.10 | 40 | – |
| ST2_B_16 | 2019.03.11–2019.03.25 | 40 | ++ |
| ST2_B_20 | 2019.05.10–2019.05.24 | 40 | – |
| +++, ++, +, –: represent for the intensities of hydrothermal anomalies from very strong, strong to minor and no anomaly, respectively. | |||
1.2 样品DNA提取
本文采用CTAB法提取水样DNA[8]。样品利用0.22 μm滤膜过滤,收集滤膜于离心管中。加入适量DNA抽提缓冲液,反复冻融3次,添加适量蛋白酶和溶菌酶后在摇床中孵育;加入20% SDS于65 ℃水浴锅中水浴2 h,然后加入等体积酚: 氯仿: 异戊醇(25:24:1)混匀后离心,收集上层水相;加入0.6倍体积的异丙醇,混匀后室温孵育1 h;离心后弃上清,加入预冷的70%乙醇,混匀后–20 ℃过夜;离心,吸出乙醇,加入50 μL无菌水溶解并保存于–80 ℃。提取的DNA送至上海美吉生物医药科技有限公司进行微生物高通量测序。
1.3 16S rRNA基因高通量测序细菌以16S rRNA基因的V3–V4区为目标序列,所用引物为338F (5′-ACTCCTACGGG AGGCAGCAG-3′)和806R (5′-GGACTACHVG GGTWTCTAAT-3′)。PCR反应条件:95 ℃ 3 min;95 ℃ 30 s,53 ℃ 30 s,72 ℃ 30 s,37个循环;72 ℃ 10 min。PCR扩增结束后,通过2%琼脂糖凝胶电泳验证扩增产物。扩增产物经质检合格后进行细菌16S rRNA基因测序,利用Illumina MiSeq平台进行高通量测序。样品16S rRNA基因序列已上传至NCBI,登录号为SPRJNA809103。
1.4 数据处理和分析样品经Ilumina MiSeq双端测序之后,首先对原始测序数据进行优化与质控。使用Fastp软件对原始测序序列进行质控,利用Flash软件进行拼接。过滤reads尾部质量值20以下的碱基,设置50 bp的窗口,如果窗口内的平均质量值低于20,从窗口开始截去后端碱基,过滤质控后50 bp以下的reads,去除含N碱基的reads;将2条reads进行序列比对,按照PE reads之间的overlap关系将成对的reads拼接为一条;根据序列首尾两端的barcode和引物序列区分样品得到有效序列,并校正序列方向,最终得到各样本的有效序列。
利用美吉生物云平台进行微生物多样性分析。使用Uparse软件,按97%相似性对有效序列进行OTU聚类。采用RDP classifier贝叶斯算法对各个OTU代表序列进行物种分类,比对数据库为Silva数据库。使用Mothur计算样本中细菌群落α多样性指数,包括Shannon指数、Chao指数和Coverage值。利用R语言vegan软件包进行细菌群落的非度量多维尺度分析(non-metric multidimensional scaling,NMDS)。利用R语言stats软件包进行物种组间差异分析,检验方法为Wilcox秩和检验,检验的显著性阈值为P < 0.05。
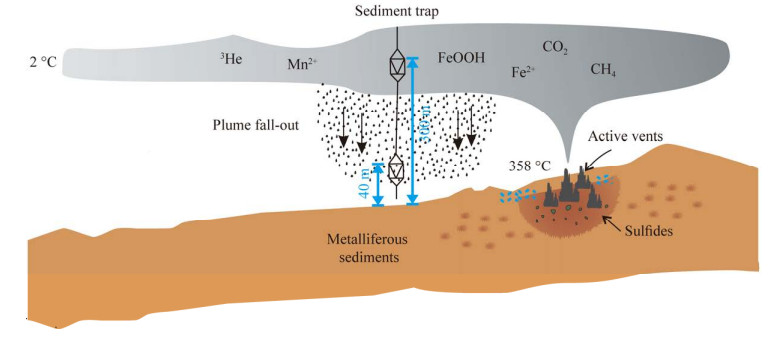
2 结果与分析 2.1 羽流浊度采样点在2018.07.19–2019.06.30期间的羽流浊度变化如图 3所示。结果表明在大多数时间内浊度值接近0,但在以下几个时间段羽流浊度值明显升高:(1) 2018.09.25–2018.10.16,浊度最大值为2.70 FTU;(2) 2018.11.20–2018.11.22,浊度最大值为8.80 FTU;(3) 2019.03.09–2019.03.15,浊度最大值为0.87 FTU;(4) 2019.06.15–2019.06.24,浊度最大值为4.8 FTU。
|
| 图 3 采样点浊度值随时间的变化 Figure 3 The variation of turbidity with the time at the sampling site. |
2.2 细菌群落α多样性
13个样品共获得704 885 reads细菌有效序列,序列经拆分、去冗余后,在97%的相似度下进行OTU聚类,共获得1 838个细菌OTUs。基于OTU的α多样性分析,获得了不同样品细菌群落的Shannon指数、Chao指数和Coverage值(表 2)。结果显示,所有样品的Coverage值都很高,表明测序结果能够充分反映样品中细菌群落。对相同时间内收集的不同高度样品的细菌Shannon指数和Chao指数进行分析,发现下层样品(ST2T-H40)的细菌Shannon指数和Chao指数高于上层样品(ST2T-H300)。在同一层位,随着时间变化,样品中细菌的Shannon指数和Chao指数变化明显,表明细菌类群多样性和丰富度存在随时间演化的现象。
| Height/m | Sample ID | Shannon | Chao | Coverage |
| 300 | ST2_T_2 | 3.527 | 429.529 | 0.999 |
| ST2_T_5 | 2.195 | 700.123 | 0.997 | |
| ST2_T_8 | 3.961 | 1 056.279 | 0.997 | |
| ST2_T_10 | 3.319 | 812.114 | 0.997 | |
| ST2_T_12 | 3.095 | 266.333 | 1.000 | |
| ST2_T_16 | 2.945 | 267.143 | 1.000 | |
| ST2_T_21 | 2.408 | 166.429 | 0.999 | |
| 40 | ST2_B_2 | 3.604 | 453.400 | 0.998 |
| ST2_B_5 | 3.731 | 736.900 | 0.998 | |
| ST2_B_7 | 2.842 | 634.509 | 0.997 | |
| ST2_B_9 | 2.794 | 503.706 | 0.999 | |
| ST2_B_16 | 3.357 | 750.481 | 0.998 | |
| ST2_B_20 | 1.677 | 457.318 | 0.998 |
2.3 细菌群落β多样性
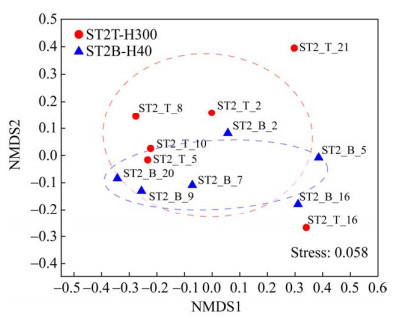
通过对样品进行NMDS分析(图 4)可知,上下两层水样的细菌群落组成存在部分重叠,组成较为相似。在图 4中同一层位不同时间收集的样品之间也具有一定的间距,表明不同时间收集的样品中细菌群落组成也存在差异。
|
| 图 4 基于Bray-Curtis距离算法的细菌群落差异非度量多维标度(NMDS)分析 Figure 4 NMDS analysis of bacterial community based on Bray-Curtis distance. |
2.4 细菌群落组成
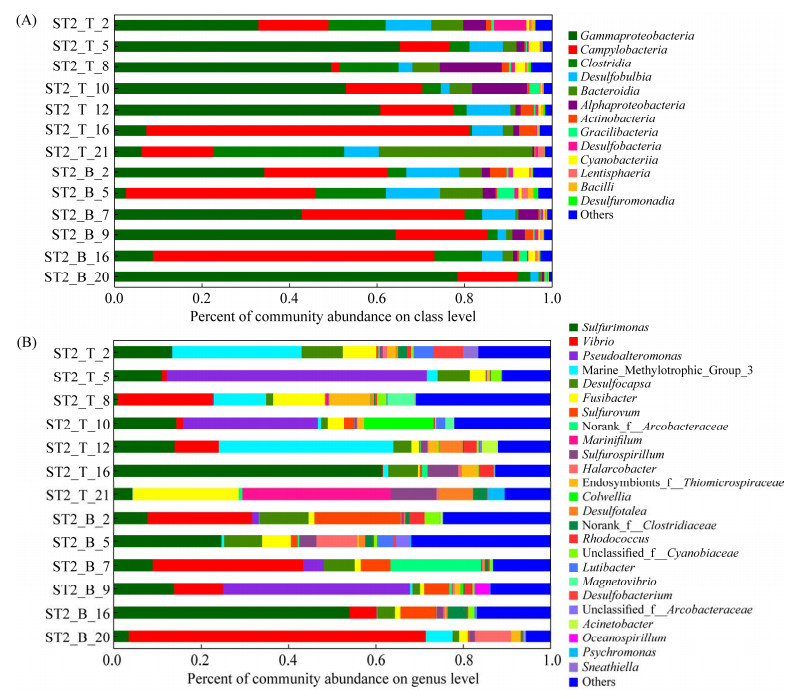
对13个样品的OTUs代表序列进行比对鉴定得到47门、119纲、272目、436科、699属的细菌物种信息。在纲水平上,样品中细菌群落主要属于以下类群:γ-变形菌纲(Gammaproteobacteria) (2.70%–78.25%)、弯曲菌纲(Camplylobacteria) (1.82%–73.76%)、拟杆菌纲(Bacteroidia) (0.72%–35.16%)、梭菌纲(Clostridia) (0.56%–29.93%)、α-变形菌纲(Alphaproteobacteria) (0.43%–14.16%)和脱硫叶菌纲(Desulfobulbia) (1.88%–12.54%) (图 5A)。在属水平上,硫单胞菌属(Sulfurimonas) (0.81%–61.60%)、弧菌属(Vibrio) (0.00%–67.86%)、假交替单胞菌属(Pseudoalteromonas) (0.00%–59.66%)、MMG-3 (Marine-Methylotrophic-Group 3) (0.00%–39.99%)、脱硫叶菌属(Desulfocapsa) (1.61%–11.29%)、纺锤状菌属(Fusibacter) (0.40%–24.34%)和硫卵菌属(Sulfurovum) (0.00%–19.76%)是样品中的主要类群(图 5B)。
|
| 图 5 样品细菌群落组成 Figure 5 Composition of bacterial communities. A: the relative abundance of bacterial species at class level; B: the relative abundance of bacterial species at genus level. |
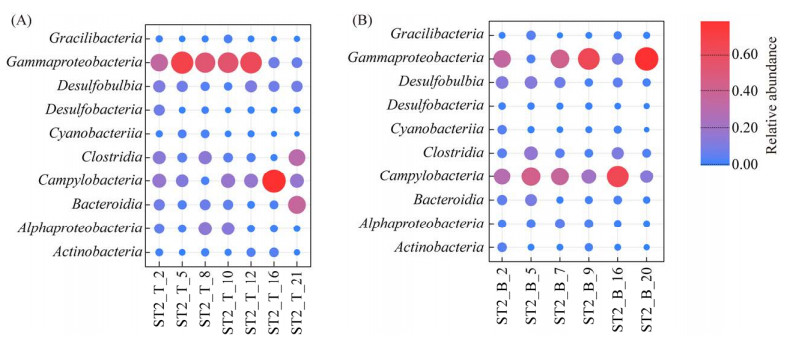
对不同层位的样品中进行物种差异分析,结果如图 6所示,结果表明上层样品的γ-变形菌纲和α-变形菌纲的平均相对丰度高于下层样品,而弯曲菌纲、拟杆菌纲、梭菌纲和脱硫叶菌纲的平均相对丰度则相反,且弯曲菌纲的相对丰度在不同层位具有显著性差异(P < 0.05)。对同一层位不同采样时间的样品进行分析(图 7),发现上层样品中γ-变形菌纲在样品(ST2_T_2、5、8、10、12)相对丰度高(32.95%–65.25%),在样品(ST2_T_16、21)相对丰度(< 10%)显著下降;下层样品中,γ-变形菌纲相对丰度在样品(ST2_B_2、7、9、20)中相对丰度高(34.31%–78.26%),而在样品(ST2_B_5、16)中显著下降。上下层样品中弯曲菌纲相对丰度一直处于较高水平,并在样品ST2_B_5 (42.94%)、ST2_T_16 (73.76%)和ST2_B_16 (64.37%)中明显升高。梭菌纲相对丰度在样品ST2_B_5和ST2_B_16中较高,ST2_T_16最低(< 1%)。拟杆菌纲相对丰度除了ST2_T_21达到35.16%外,其余均较低(< 10%)。α-变形菌纲在样品(ST2_B_7、ST2_B_9、ST2_T_10)中相对丰度较高。

|
| 图 6 不同高度样品(ST2T-H300和ST2T-H40)的细菌主要类群组间差异对比 Figure 6 Comparison of main bacterial species in the samples collected from different water depths (ST2T-H300 and ST2T-H40). |
|
| 图 7 不同高度样品细菌类群相对丰度随时间变化 Figure 7 The relative abundance of bacterial community in samples at different heights over time. A: ST2T-H300; B: ST2T-H40. |
3 讨论 3.1 热液羽流影响区细菌群落随时间的变化
本文所研究的样品中优势细菌类群相对丰度在时间上呈现动态变化现象。弯曲菌纲是典型的深海热液喷口微生物种群,常作为指示热液输入的细菌菌群[9, 25]。样品中普遍存在弯曲菌纲,且几乎所有样品中其相对丰度均超过10%,最高值出现在2019年3月11日至25日时段采集的16号样品,其上层丰度为73.76% (ST2_T_16),下层丰度为64.37% (ST2_B_16)。样品中的弯曲菌纲主要包括硫单胞菌属和硫卵菌属,两者均是重要的自养硫氧化细菌,受硫化物的浓度和海水混合程度的调控[26–28]。在16号样品采样期间,浊度异常值升高且持续时间较长,表明热液活动增强时弯曲菌纲相对丰度增加。在5号样品采样期间浊度值升高更显著,但ST2_T_5样品中弯曲菌纲相对丰度(11.5%)升高并不明显,究其原因,可能是因为该时期中性浮力羽流中的硫化物颗粒大量形成发生了沉降,导致该层水体中的硫化氢浓度和硫化物颗粒含量减少。在浊度值无明显变化期间采样的样品(ST2_B_7、ST2_B_9、ST2_T_10)中则α-变形菌纲相对丰度较高。α-变形菌纲主要来源于背景海水群落,该类群的增加表明了海水群落的影响增强[18–19, 29–30]。Sylvan等[16]研究也发现,随着热液物质输入的减少,热液羽流样品中弯曲菌纲减少,γ-变形菌纲和α-变形菌纲增加,微生物群落会随羽流活动的衰减而发生动态转移,逐渐与背景海水中群落接近,与本研究结果相印证,即卧蚕热液羽流影响区优势菌群在时间上的演化与热液羽流强度的动态变化有关。
3.2 热液羽流影响区细菌群落在垂向空间上的演化本文所研究的样品中优势细菌类群相对丰度在垂向空间上也呈现不同的特征。上下两层样品中弯曲菌纲的丰度存在显著差异(P < 0.05),离底40 m (ST2B-H40)处弯曲菌纲的平均相对丰度更高,在离底300 m (ST2T-H300)处则γ-变形菌纲的平均相对丰度更高(图 6)。前人研究认为弯曲菌纲和γ-变形菌纲相对丰度比例受硫化物浓度调控,弯曲菌纲在硫化物浓度高的环境中更活跃[31–32]。由于上层捕获器位于离卧蚕活动热液区仅300 m之遥的羽流中性浮力层内,下层沉积物捕获器位于羽流中性浮力层以下,接受热液颗粒物沉降。我们认为浮力羽流下面的采集的样品(ST2B-H40)弯曲菌纲丰度较高,是因为羽流颗粒沉降区较丰富的热液硫化物颗粒物有利于弯曲菌纲生长,即弯曲菌纲的丰度主要受硫化物颗粒物含量调控。通过数值模拟,热液颗粒物的分布与其密度和粒径大小密切相关,粒径0.1–0.5 mm的黄铁矿颗粒可以被羽流在水平方向输送13–720 m[33–34]。通过表层沉积物的矿物学分析,的确发现卧蚕热液区周边的沉积物中富含羽流沉降来源的硫化物和铁氢氧化物颗粒[35–36]。Xie等[37]从卧蚕热液羽流中分离出一株弯曲菌纲的新种,发现能够以分子氢、硫化物、元素硫等为能源进行化学自养生长,Huber等[38]对比研究了过滤和未过滤羽流中的细菌群落,发现含热液颗粒物样品中弯曲菌纲的丰度更高,均支持了本文的研究结论。
4 结论本文采用Illumina MiSeq高通量测序技术,分析卧蚕热液羽流影响区不同位置的时间序列样品中细菌群落结构及其演化规律。结果显示,由于受到较强的热液输入影响,研究区细菌优势类群为γ-变形菌纲和弯曲菌纲。在时间尺度上,细菌类群相对丰度随着热液活动的强度起伏发生变化,当热液活动加强时,弯曲菌纲相对丰度升高,α-变形菌纲相对丰度降低。认为细菌群落结构在时间上的演化受到热液羽流输入量波动的影响。在垂向空间上,发现弯曲菌纲在下方羽流颗粒沉降区的相对丰度高于上方中性浮力羽流层,而γ-变形菌纲则在中性浮力羽流中更加富集。认为细菌群落结构在垂向空间上的演化与热液硫化物颗粒含量密切相关。本研究首次对活动热液区附近羽流影响区内细菌群落垂向空间分布及其在月际尺度上的变化进行研究,进一步补充了深海热液羽流影响区细菌群落结构的时空分布和变化特征信息,为精细刻画深海热液区微生物与环境之间的相互作用及其元素循环过程提供重要信息。
致谢
感谢中国大洋49航次第五航段(首席科学家:自然资源部第二海洋研究所王叶剑研究员)和中国大洋57航次第二航段(首席科学家:自然资源部第二海洋研究所韩喜球研究员)所有参航人员对本研究样品所给予的大力支持与帮助。
| [1] | Baker ET, German CR, Elderfield H. Hydrothermal plumes over spreading-center axes: global distributions and geological Inferences//Humphris SE, Zierenberg RA, Mullineaux LS, Thomson RE. Seafloor hydrothermal systems: physical, chemical, biological, and geological Interactions. Washington: American Geophysical Union, 1995. |
| [2] | Jackson PR, Ledwell JR, Thurnherr AM. Dispersion of a tracer on the East Pacific Rise (9°N to 10°N), including the influence of hydrothermal plumes. Deep Sea Research Part Ⅰ Oceanographic Research Papers, 2010, 57(1): 37-52. DOI:10.1016/j.dsr.2009.10.011 |
| [3] | Baker ET. Hydrothermal plumes//Harff J, Meschede M, Petersen S, Thiede T. Encyclopedia of marine geosciences. Dordrecht: Springer Netherlands, 2014. |
| [4] | Qiu ZY, Han XQ, Li M, Wang YJ, Chen XG, Fan WJ, Zhou YD, Cui RY, Wang LS. The temporal variability of hydrothermal activity of Wocan hydrothermal field, Carlsberg Ridge, northwest Indian Ocean. Ore Geology Reviews, 2021(2): 103999. |
| [5] | Holden J, Breier J, Rogers K, Schulte M, Toner B. Biogeochemical processes at hydrothermal vents: microbes and minerals, bioenergetics, and carbon fluxes. Oceanography, 2012, 25(1): 196-208. DOI:10.5670/oceanog.2012.18 |
| [6] | Gartman A, Findlay AJ, Luther GW. Nanoparticulate pyrite and other nanoparticles are a widespread component of hydrothermal vent black smoker emissions. Chemical Geology, 2014, 366: 32-41. DOI:10.1016/j.chemgeo.2013.12.013 |
| [7] | Winn CD, Karl DM, Massoth GJ. Microorganisms in deep-sea hydrothermal plumes. Nature, 1986, 320(6064): 744-746. DOI:10.1038/320744a0 |
| [8] | Sunamura M, Higashi Y, Miyako C, Ishibashi JI, Maruyama A. Two bacteria phylotypes are predominant in the Suiyo seamount hydrothermal plume. Applied and Environmental Microbiology, 2004, 70(2): 1190-1198. DOI:10.1128/AEM.70.2.1190-1198.2004 |
| [9] | Nakagawa S, Ken TK, Inagaki F, Hirayama H, Nunoura T, Horikoshi K, Sako Y. Distribution, phylogenetic diversity and physiological characteristics of epsilon-Proteobacteria in a deep-sea hydrothermal field. Environmental Microbiology, 2005, 7(10): 1619-1632. DOI:10.1111/j.1462-2920.2005.00856.x |
| [10] | Dick GJ, Tebo BM. Microbial diversity and biogeochemistry of the Guaymas Basin deep-sea hydrothermal plume. Environmental Microbiology, 2010, 12(5): 1334-1347. DOI:10.1111/j.1462-2920.2010.02177.x |
| [11] | German CR, Bowen A, Coleman ML, Honig DL, Huber JA, Jakuba MV, Kinsey JC, Kurz MD, Leroy S, McDermott JM, De Lépinay BM, Nakamura K, Seewald JS, Smith JL, Sylva SP, Van Dover CL, Whitcomb LL, Yoerger DR. Diverse styles of submarine venting on the ultraslow spreading Mid-Cayman Rise. PNAS, 2010, 107(32): 14020-14025. DOI:10.1073/pnas.1009205107 |
| [12] | Sunamura M, Yanagawa K. Microbial cell densities, community structures, and growth in the hydrothermal plumes of subduction hydrothermal systems//Ishibashi J, Okino K. Subseafloor biosphere linked to hydrothermal systems: taiga concept. Tokyo: Springer Japan, 2015. |
| [13] | Li JT, Zhou HY, Fang JS, Wu ZJ, Peng XT. Microbial distribution in a hydrothermal plume of the Southwestern Indian Ridge. Geomicrobiology Journal, 2016, 33(5): 401-415. DOI:10.1080/01490451.2015.1048393 |
| [14] | German CR, Von Damm KL. Hydrothemal processes//Holland HD, Turekian K. Treatise on geochemistry. Amsterdam: Elsevier, 2004. |
| [15] | Amend JP, McCollom TM, Hentscher M, Bach W. Catabolic and anabolic energy for chemolithoautotrophs in deep-sea hydrothermal systems hosted in different rock types. Geochimica et Cosmochimica Acta, 2011, 75(19): 5736-5748. DOI:10.1016/j.gca.2011.07.041 |
| [16] | Sylvan JB, Pyenson BC, Rouxel O, German CR, Edwards KJ. Time-series analysis of two hydrothermal plumes at 9°50′N East Pacific Rise reveals distinct, heterogeneous bacterial populations. Geobiology, 2012, 10(2): 178-192. DOI:10.1111/j.1472-4669.2011.00315.x |
| [17] | Haalboom S, Price DM, Mienis F, Van Bleijswijk JD, De Stigter HC, Witte HJ, Reichart GJ, Duineveld GC. Patterns of (trace) metals and microorganisms in the Rainbow hydrothermal vent plume at the Mid-Atlantic Ridge. Biogeosciences, 2020, 17(9): 2499-2519. DOI:10.5194/bg-17-2499-2020 |
| [18] | Sheik CS, Anantharaman K, Breier JA, Sylvan JB, Edwards KJ, Dick GJ. Spatially resolved sampling reveals dynamic microbial communities in rising hydrothermal plumes across a back-arc basin. The ISME Journal, 2015, 9: 1434-1445. DOI:10.1038/ismej.2014.228 |
| [19] | Djurhuus A, Mikalsen SO, Giebel HA, Rogers AD. Cutting through the smoke: the diversity of microorganisms in deep-sea hydrothermal plumes. Royal Society Open Science, 2017, 4(4): 160829. DOI:10.1098/rsos.160829 |
| [20] | Li JT, Yang J, Sun MX, Su L, Wang H, Gao JQ, Bai SJ. Distribution and succession of microbial communities along the dispersal pathway of hydrothermal plumes on the Southwest Indian Ridge. Frontiers in Marine Science, 2020, 7: 581381. DOI:10.3389/fmars.2020.581381 |
| [21] | Mino S, Makita H, Toki T, Miyazaki J, Kato S, Watanabe H, Imachi H, Watsuji TO, Nunoura T, Kojima S, Sawabe T, Ken TK, Nakagawa S. Biogeography of Persephonella in deep-sea hydrothermal vents of the western Pacific. Frontiers in Microbiology, 2013, 4: 107. |
| [22] | Biddanda B, Ogdahl M, Cotner J. Dominance of bacterial metabolism in oligotrophic relative to eutrophic waters. Limnology and Oceanography, 2001, 46(3): 730-739. DOI:10.4319/lo.2001.46.3.0730 |
| [23] | Reveillaud J, Reddington E, McDermott J, Algar C, Meyer JL, Sylva S, Seewald J, German CR, Huber JA. Subseafloor microbial communities in hydrogen-rich vent fluids from hydrothermal systems along the Mid-Cayman Rise. Environmental Microbiology, 2016, 18(6): 1970-1987. DOI:10.1111/1462-2920.13173 |
| [24] | Wang YJ, Han XQ, Petersen S, Frische M, Qiu ZY, Li HM, Li HL, Wu ZC, Cui RY. Mineralogy and trace element geochemistry of sulfide minerals from the Wocan hydrothermal field on the slow-spreading Carlsberg Ridge, Indian Ocean. Ore Geology Reviews, 2017, 84: 1-19. DOI:10.1016/j.oregeorev.2016.12.020 |
| [25] | Campbell BJ, Engel AS, Porter ML, Ken TK. The versatile Epsilon-proteobacteria: key players in sulphidic habitats. Nature Reviews Microbiology, 2006, 4(6): 458-468. DOI:10.1038/nrmicro1414 |
| [26] | Inagaki F, Takai K, Kobayashi H, Nealson KH, Horikoshi K. Sulfurimonas autotrophica gen. nov., sp. nov., a novel sulfur-oxidizing ε-proteobacterium isolated from hydrothermal sediments in the Mid-Okinawa Trough. International Journal of Systematic and Evolutionary Microbiology, 2003, 53(6): 1801-1805. |
| [27] | Sievert SM, Scott KM, Klotz MG, Chain PSG, Hauser LJ, Hemp J, Hügler M, Land M, Lapidus A, Larimer FW, Lucas S, Malfatti SA, Meyer F, Paulsen IT, Ren QH, Simon J, Class UG. Genome of the epsilonproteobacterial chemolithoautotroph Sulfurimonas denitrificans. Applied and Environmental Microbiology, 2008, 74(4): 1145-1156. DOI:10.1128/AEM.01844-07 |
| [28] | Mino S, Nakagawa S, Makita H, Toki T, Miyazaki J, Sievert SM, Polz MF, Inagaki F, Godfroy A, Kato S, Watanabe H, NunouraT, Nakamura K, Imachi H, Watsuji T, Kojima S, Takai K, Sawabe T. Endemicity of the cosmopolitan mesophilic chemolithoautotroph Sulfurimonas at deep-sea hydrothermal vents. The ISME Journal, 2017, 11(4): 909-919. DOI:10.1038/ismej.2016.178 |
| [29] | Fortunato CS, Larson B, Butterfield DA, Huber JA. Spatially distinct, temporally stable microbial populations mediate biogeochemical cycling at and below the seafloor in hydrothermal vent fluids. Environmental Microbiology, 2018, 20(2): 769-784. DOI:10.1111/1462-2920.14011 |
| [30] | Dick GJ. The microbiomes of deep-sea hydrothermal vents: distributed globally, shaped locally. Nature Reviews Microbiology, 2019, 17(5): 271-283. DOI:10.1038/s41579-019-0160-2 |
| [31] | Akerman NH, Butterfield DA, Huber JA. Phylogenetic diversity and functional gene patterns of sulfur-oxidizing subseafloor epsilonproteobacteria in diffuse hydrothermal vent fluids. Frontiers in Microbiology, 2013, 4: 185. |
| [32] | Anderson RE, Beltrán MT, Hallam SJ, Baross JA. Microbial community structure across fluid gradients in the Juan de Fuca Ridge hydrothermal system. FEMS Microbiology Ecology, 2013, 83(2): 324-339. DOI:10.1111/j.1574-6941.2012.01478.x |
| [33] |
Lou YZ, Han XQ, He ZG, Wang YJ, Qiu ZY. Numerical modeling of hydrodynamic processes of deep-sea hydrothermal plumes: a case study on Daxi hydrothermal field, Carlsberg Ridge. Scientia Sinica: Technologica, 2020, 50(2): 194-208.
(in Chinese) 楼映中, 韩喜球, 贺治国, 王叶剑, 邱中炎. 深海热液羽流动力学特性的数值模拟研究: 以卡尔斯伯格脊大糦热液区为例. 中国科学: 技术科学, 2020, 50(2): 194-208. |
| [34] | Lou YZ, He ZG, Han XQ. Transport and deposition patterns of particles laden by rising submarine hydrothermal plumes. Geophysical Research Letters, 2020, 47(20): e2020GL089935. |
| [35] | Popoola S, Han XQ, Wang YJ, Qiu ZY, Ye Y. Geochemical investigations of Fe-Si-Mn oxyhydroxides deposits in Wocan hydrothermal field on the slow-spreading Carlsberg Ridge, Indian Ocean: constraints on their types and origin. Minerals, 2018, 9(1): e9010019. |
| [36] | Popoola S, Han XQ, Wang YJ, Qiu ZY, Ye Y, Cai YY. Mineralogical and geochemical signatures of metalliferous sediments in wocan-1 and wocan-2 hydrothermal sites on the Carlsberg Ridge, Indian Ocean. Minerals, 2019, 9(1): e9010026. |
| [37] | Xie SB, Wang SS, Li DF, Shao ZZ, Lai QL, Wang YJ, Wei MC, Han XQ, Jiang LJ. Sulfurovum indicum sp. nov., a novel hydrogen-and sulfur-oxidizing chemolithoautotroph isolated from a deep-sea hydrothermal plume in the northwestern Indian Ocean. International Journal of Systematic and Evolutionary Microbiology, 2021, 71(3). |
| [38] | Huber JA, Butterfield DA, Baross JA. Bacterial diversity in a subseafloor habitat following a deep-sea volcanic eruption. FEMS Microbiology Ecology, 2003, 43(3): 393-409. DOI:10.1111/j.1574-6941.2003.tb01080.x |
 2022, Vol. 62
2022, Vol. 62