
中国科学院微生物研究所,中国微生物学会
文章信息
- 仉丽娟, 李雨欣, 范越, 王慧雅, 任凌霄, 丁克强, 王军, 周洪波. 2022
- ZHANG Lijuan, LI Yuxin, FAN Yue, WANG Huiya, REN Lingxiao, DING Keqiang, WANG Jun, ZHOU Hongbo.
- Ni2+胁迫下嗜酸氧化亚铁硫杆菌亚铁氧化应激效应
- Iron oxidation response of Acidithiobacillus ferrooxidans under Ni2+ stress
- 微生物学报, 62(8): 3200-3212
- Acta Microbiologica Sinica, 62(8): 3200-3212
-
文章历史
- 收稿日期:2021-12-20
- 修回日期:2022-02-28
- 网络出版日期:2022-04-27
2. 中南大学 资源加工与生物工程学院,湖南 长沙 410083
2. School of Minerals Processing and Bioengineering, Central South University, Changsha 410083, Hunan, China
嗜酸氧化亚铁硫杆菌(Acidithiobacillus ferrooxidans),革兰氏阴性、化能铁/硫氧化自养菌,通过氧化亚铁或还原态硫获得电子,并合成生物能(ATP)和还原力(NADPH/NADH),同时固定CO2进行自养生长。该菌广泛分布于酸性矿坑水、热泉等极端贫瘠环境,也是目前嗜酸性硫杆菌属中研究与应用最为广泛和深入的菌种。
针对A. ferrooxidans菌,众多研究者系统开展了菌种分离[1]、硫/铁氧化代谢[2]、重金属耐受性[3]和抗氧化性[4]等多方面探索,研究结果解析了嗜酸微生物在贫瘠环境条件下的生理及分子应激策略,拓宽了人类对极端环境下生物适应性的认识,同时也扩大了该类极端微生物研究和应用范围。利用A. ferrooxidans菌特异理化性质形成了节约、循环的矿产资源开采新技术——微生物冶金技术,实现了不同来源“城市矿产”中重金属的无害化、资源化再利用[5–11]。在生物冶金过程中,A. ferrooxidans作为优势菌种与其他极端嗜酸微生物(Acidiphilium sp.和Ferroplasma sp.等)协同促进有价金属的溶出,且通常用于铜、铝、镍、锌等有色金属的提取[12]。而随着浸出的进行,浸出液中的重金属离子逐渐富集。在重金属浓度异常的生长环境中,A. ferrooxidans等极端嗜酸微生物可通过微生物转化、外排作用和螯合作用等方式进行解毒,如OMp家族、Ni2+ (NrsSRBACD)、Mn2+ (MntCAB)、Zn2+ (ZnuABC)、Fe2+/3+/Mn2+/Zn2+ (MtsABC)、Ni2+ (CbiK/CbiM/CbiO)、Fe3+ (AfuABC) 转运等多种重金属转运途径,从而表现出对重金属离子的耐受性[3, 13–15]。Cus system (copper/silver efflux)在A. ferrooxidans菌Cu2+抗性过程中起到重要作用,其以H+为驱动力,将细胞质或周质空间的Cu2+转运至细胞外使细胞解毒[13]。此外,增加σ54表达量能激活细胞响应外界胁迫环境应激信号[16]。孔蛋白Omp40的合成量与A. ferrooxidans细胞外膜渗透性密切关联,进而影响重金属离子对细胞的毒性作用[17]。但是,过高重金属累积环境可以破坏细胞膜结构、中断细胞运输、抑制细胞体内的电子传递,甚至损坏核酸结构,最终导致微生物代谢停滞或死亡[18–20]。
A. ferrooxidans对重金属离子的耐受性与重金属离子种类及其浓度密切相关。Cabrera等研究发现,驯化后A. ferrooxidans能够耐受不同重金属离子,但各重金属的耐受浓度不同,分别最高耐受0.4 g/L Cr3+、10 g/L Cu2+、10 g/L Cd2+、30 g/L Zn2+和30 g/L Ni2+,并通过动力学阐明了在不同重金属胁迫下A. ferrooxidans亚铁氧化能力和动力学行为[18, 20]。此外,不同来源A. ferrooxidans菌株对重金属的毒性耐受不同,进而导致菌株的亚铁氧化能力不同,最终影响嗜酸微生物的重金属浸出效应[15]。长期连续耐受重金属驯化,能增强菌株抗重金属毒性能力[3]和提高生物浸提重金属的效率[21]。目前已有研究报道主要关注不同重金属种类和浓度(胁迫)对A. ferrooxidans亚铁氧化速率和生长的影响,以及微生物耐受重金属的分子机制,且更多集中在Cu2+抗性研究[18–19]。众多研究者选用A. ferrooxidans菌作为主要功能菌开展含Ni固废(如LED等电子废弃物、废旧炼油催化剂等)生物浸出研究[21–23]。但是有关A. ferrooxidans在重金属Ni2+胁迫下,尤其是高浓度Ni2+极端条件下,该菌的亚铁氧化应激响应还很少报道。
因此,本研究选用自电镀废水中分离、纯化获得的A. ferrooxidans菌株,利用两步培养法研究该A. ferrooxidans菌株在不同Ni2+浓度(0–40 g/L)胁迫下微生物亚铁氧化速率、亚铁氧化功能相关的rus操纵子各功能基因表达及胞外电子传递响应情况,最终旨在探明Ni2+胁迫下A. ferrooxidans亚铁氧化应激效应及相关机理。
1 材料与方法 1.1 实验菌种培养条件实验选用的A. ferrooxidans菌株分离自江苏某电镀企业废水。改进的0K基础盐培养基[24]被用于A. ferrooxidans纯菌培养。菌种A. ferrooxidans于灭菌的500 mL锥形瓶中培养,加入180 mL无菌0K基础盐培养基(初始pH值1.80±0.05),接种对数生长期的菌液20 mL (接种菌体浓度约为2×108 cells/mL),添加44.7 g/L FeSO4·7H2O作为亚铁能源,于30、180 r/min摇床中培养至体系亚铁氧化殆尽(或体系氧化还原电位≥580 mV,vs. Pt,Ag/AgCl);同样条件连续传代培养,以保持菌种的高活性。
1.2 耐受Ni2+胁迫实验Ni2+胁迫对A. ferrooxidans亚铁氧化能力的影响实验通过两步培养法完成。(1) 第一步培养:按体积10% (V/V)的接种量将处于对数生长期的A. ferrooxidans接入新鲜灭菌的180 mL 0K基础盐培养基中,获得最终A. ferrooxidans菌体浓度约为2×107 cells/mL,加酸调节初始pH值(1.80±0.05),加入4.5 g/L Fe2+ (FeSO4·7H2O)作为亚铁能源,于30、180 r/min摇床中培养至体系氧化还原电位≥550 mV (vs. Pt,Ag/AgCl)。(2) 第二步胁迫:在第一步培养的摇瓶中添加新的亚铁能源(终浓度为4.5 g/L Fe2+),同时加入不同浓度的Ni2+进行胁迫,添加硫酸(50%,V/V)控制培养体系pH值≤2.00±0.05。其中设定Ni2+胁迫浓度范围为5–40 g/L,按5 g/L梯度逐步增加,同时以不添加Ni2+胁迫(0 g/L)的作为实验对照组。每隔2 h混匀取样,测定不同胁迫条件下总铁(total iron)、亚铁(Fe2+)、体系氧化还原电位(oxidation reduction potential,ORP)等相关环境参数随时间变化。每个胁迫浓度下开展3组平行试验。
亚铁氧化抑制率,即在固定培养时间内(9 h或24 h),相比于对照实验组(0 g/L),胁迫实验组亚铁氧化抑制率(inhibition efficiency)=
分别选取10和40 g/L Ni2+ 2个胁迫条件,以不添加Ni2+的作为对照组,采用两步法培养,收集对照组和2组胁迫组(第二步)培养4、9、24 h的菌体,进行A. ferrooxidans亚铁氧化电子传递链rus操纵子中各相关功能基因表达情况研究。
收集的菌液先真空过滤除去沉淀,接着将过滤菌液于4低温下高速离心收集(12 000 r/min,15 min),将收集的菌体用无菌的0K基础盐培养基(pH 2.00±0.05)清洗2–3次,紧接着将获得的菌体进行RNA实时提取(E.Z.N.A. Bacterial RNA Kit,Omega Bio-tek);然后将验证完整、无杂质污染的总RNA进行反转录合成cDNA (ReverTra Ace qPCR RT Master Mix with gDNA Remover,TOYOBO CO., LTD.)。
实时荧光定量PCR (real-time quantitative PCR)反应在iCycleriQ荧光定量PCR仪(Bio-Rad Laboratories, Inc.)中进行。rus操纵子中各相关功能基因(包括cyc2、rus、cyc1、orf和coxBACD 4个亚基等8个基因)特异性引物(扩增长度约为180 bp)参照Carlos等[25]的研究报道,同时选用alaS作为内参基因[26]进行上述各功能基因差异表达计算[27]。有关实时荧光定量PCR详细操作步骤和注意事项按照Carlos等[25]报道方法。所有扩增组进行3组平行扩增实验,同时以不添加任何cDNA或DNA模板作为空白对照。
1.4 胞外电子传递电化学实验基于上述结果,选取亚铁氧化抑制率最高的Ni2+浓度(40.0 g/L)作为胁迫实验条件,与不添加Ni2+胁迫进行比较,考察Ni2+胁迫对A. ferrooxidans胞外电子传递的影响。
按照上述两步培养法分别获得对照组(不添加Ni2+胁迫)和实验组(40.0 g/L Ni2+胁迫)第二步培养24 h后菌液,分别通过过滤→离心→清洗等一系列操作,获得浓缩菌体,并用少量灭菌的0K基础盐培养基(pH 2.00±0.05)混匀菌体(最终微生物浓度约为1010 cells/mL)待用。A. ferrooxidans菌“微生物电极”制作:2.5×1.0×0.2 cm的ITO导电玻璃清洗(酸洗+无水乙醇浸泡+去离子水清洗)晾干——定量菌液涂抹形成固定菌斑(1 cm×1 cm)——Nafion溶液固定。A. ferrooxidans “微生物电极”循环伏安测试在电化学综合测试系统(PARSTAT4000,普林斯顿)中完成。选用可换膜H型双室电解槽(总体积250 mL)作为电化学反应器,全氟磺酸离子膜N117 (杜邦)将双室隔开,双室电解槽中分别添加120 mL的0K基础盐培养基作为电解液(pH值调为2.0)。对电极为1.0 cm×1.0 cm Pt电极片,放置在电解槽一侧,Ag/AgCl参比电极和A. ferrooxidans “微生物电极”放置在电解槽另一侧,靠近但不可接触。向工作电极施加–0.5–0.8––0.5 V循环扫描电压,控制扫描速度设置为20 mV/s,并动态监测电流响应和时间关系。
1.5 理化分析方法培养体系氧化还原电位(redox potential,ORP)测定选用复合ORP电极进行测定(501型可充式复合ORP电极,雷磁,上海)。pH值测定选用雷磁pH复合电极(PHS-3C型pH计,雷磁,上海)来测定。邻菲啰啉分光光度法(HJ/T 345-2007)测定溶液中总铁和亚铁含量。
2 结果与讨论 2.1 Ni2+胁迫对A. ferrooxidans菌亚铁氧化率和速率影响Ni2+胁迫下A. ferrooxidans菌的亚铁氧化率和速率及体系氧化还原电位变化如图 1所示。在不同Ni2+胁迫浓度添加条件下,各胁迫实验组中亚铁氧化率均随时间逐渐增加(图 1A),残余的亚铁量随时间逐渐减少(图 1B),但不同胁迫组之间变化趋势存在区别。
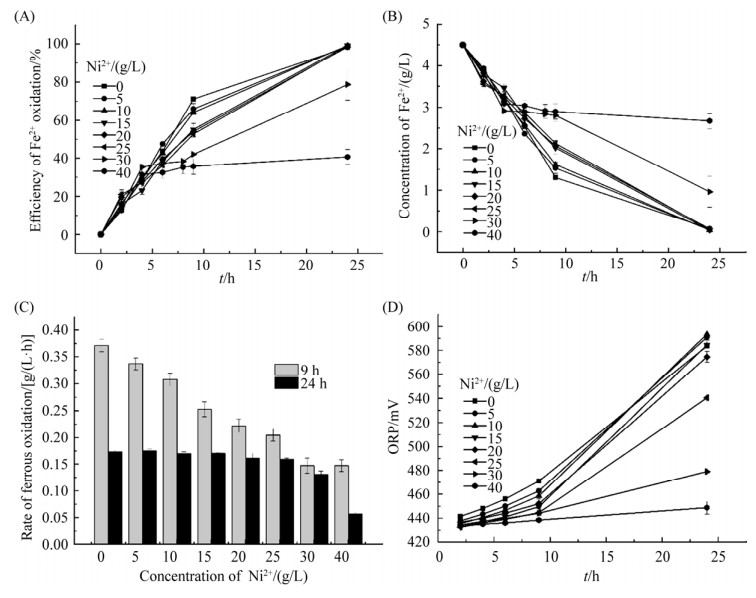
|
| 图 1 Ni2+胁迫对A. ferrooxidans亚铁氧化活性的影响 Figure 1 Effects of Ni2+ on the variations of ferrous oxidation efficiency (A), ferrous iron concentration in solution (B), ferrous oxidation rate (C), and redox potential (D). |
不同胁迫实验组之间比较发现,Ni2+胁迫浓度由0 g/L增加至25 g/L,培养前期(前9 h)各实验组亚铁氧化率随胁迫浓度增加呈现降低趋势,但培养时间延长至24 h,不同实验组的亚铁氧化率趋于完全,即当Ni2+胁迫浓度≤25 g/L时,对A. ferrooxidans的亚铁氧化率(24 h)影响很小,甚至没有影响(图 1A)。但当体系Ni2+胁迫浓度≥30 g/L时,A. ferrooxidans的亚铁氧化率(24 h)降低;30和40 g/L Ni2+胁迫浓度下,A. ferrooxidans的亚铁氧化率(24 h)分别为78.7%和40.6%,显著低于对照组(98.2%),如图 1A所示。其中值得注意的是,40 g/L Ni2+胁迫环境下,培养0–4 h之间,A. ferrooxidans的亚铁氧化率增加;而进一步延长培养时间,A. ferrooxidans的亚铁氧化率缓慢增加并趋于平缓,可能归因于经过4 h高浓度胁迫,Ni2+已经对A. ferrooxidans产生毒性,并抑制了该菌亚铁氧化活性。
不同Ni2+胁迫条件下,A. ferrooxidans的亚铁氧化速率如图 1C所示。比较不同浓度梯度的Ni2+胁迫实验结果发现,对数期期间(9 h以内),Ni2+胁迫浓度的增加对A. ferrooxidans的亚铁氧化速率产生抑制作用。当Ni2+胁迫浓度≤25 g/L时,对数期亚铁氧化速率由0.37 g/(L·h)降低至0.20 g/(L·h)(图 1C),经过24 h培养后的亚铁氧化几乎完全(图 1A),此时亚铁氧化速率趋于一致(图 1C);当添加30或40 g/L Ni2+进行胁迫时,亚铁氧化速率(9 h)分别降低至0.15 g/(L·h)左右(图 1C),经过24 h培养后,亚铁氧化率分别为78.8%和40.6% (图 1A),对应的亚铁氧化速率分别为0.13和0.06 g/(L·h)(图 1C)。
Ni2+胁迫对A. ferrooxidans亚铁氧化抑制率如图 2所示。与亚铁氧化率和速率结果一致,对数生长期内(9 h),Ni2+的添加对A. ferrooxidans菌的亚铁氧化率和速率产生不同的抑制作用;添加胁迫浓度越高,抑制作用越显著;尤其是当添加30或40 g/L Ni2+进行胁迫时,亚铁氧化抑制率增加至52.4%–55.0%。当进一步延长培养时间至24 h,低胁迫浓度(Ni2+≤25 g/L)对A. ferrooxidans菌的亚铁氧化活性的抑制作用可忽略;但Ni2+浓度增加至30或40 g/L,A. ferrooxidans菌的亚铁氧化抑制率(与参照组相比)分别为21.3%和59.4%。
体系氧化还原电位随时间变化如图 1D所示,与亚铁氧化率变化一致(图 1A)。依据E=Eθ (Fe3+/Fe2+)–RT/nF×ln[C(Fe2+)/C(Fe3+)]方程[28–29],体系氧化还原电位与Fe3+/Fe2+摩尔比值密切相关。培养体系A. ferrooxidans亚铁氧化活性越高,Fe2+氧化能力越强,产生的Fe3+越多,对应的体系氧化还原电位越高。当Ni2+胁迫浓度≤25 g/L时,A. ferrooxidans菌亚铁氧化活性较高(图 1C),对应的体系氧化还原电位也迅速升高;但Ni2+胁迫浓度 > 25 g/L时,A. ferrooxidans菌亚铁氧化活性显著受到抑制,对应的亚铁氧化速率降低(图 1C),造成体系氧化还原电位值上升缓滞(图 1D)。
已有研究报道指出,驯化或未驯化A. ferrooxidans最大耐受不超过30 g/L Ni2+,且生长及代谢受到完全抑制[18, 20]。而本研究获得的A. ferrooxidans菌株在两步培养法体系下能够耐受较高的Ni2+胁迫浓度,即A. ferrooxidans能够耐受≤30 g/L Ni2+胁迫,亚铁氧化抑制率(24 h)小于21.3%;但当Ni2+浓度增加至超高浓度40 g/L时,亚铁氧化活性才受到显著抑制(培养24 h后体系的亚铁氧化抑制率约为59.4%)。
2.2 Ni2+胁迫对A. ferrooxidans菌rus操纵子中不同功能基因表达影响研究者利用生物信息学、生理生化和细胞定位等不同技术手段,对A. ferrooxidans中亚铁氧化电子传递链中多个传递体进行研究。目前公认的A. ferrooxidans ATCC 23270亚铁氧化电子传递有“顺电势”与“逆电势” 2种方式进行。当A. ferrooxidans在含有Fe2+培养基中,利用Fe2+进行生长繁殖,同时Fe2+被氧化失去电子,其中少量的电子通过A. ferrooxidans菌中的“逆电势”传递,产生还原力NADH/NADPH,传递途径蛋白编码基因为petI操纵子;绝大部分电子在“顺电势”过程中传给最终受体O2,而rus操纵子的电子氧化传递过程在“顺电势”过程中占据主导作用[30]。“顺电势”具体电子传递路径如下:基质中Fe2+失电子,诱导rus操纵子的表达,其中电子依次传递给A. ferrooxidans表面的外膜蛋白(编码基因cyc2)、周质空间的铜蓝蛋白(编码基因rus)和蛋白二聚体(编码基因cyc1)以及内膜蛋白细胞色素c氧化酶(编码基因coxBACD),最终受体为O2[26, 31–33]。
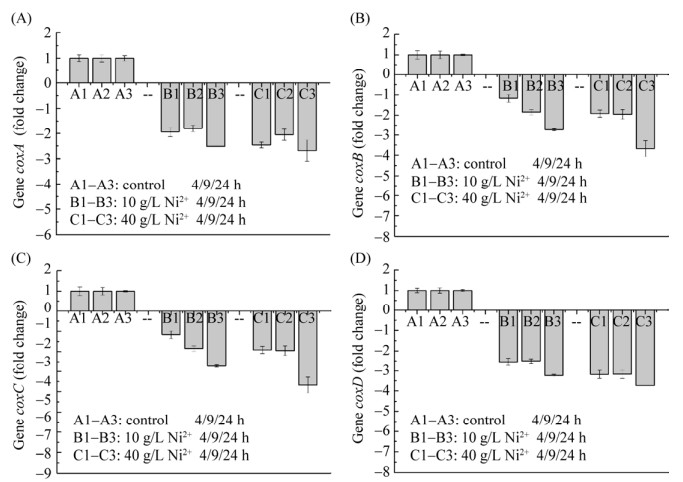
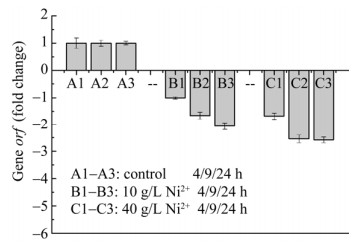
为了从分子角度揭示Ni2+胁迫导致A. ferrooxidans亚铁氧化活性降低的原因(图 1–2),研究以不添加Ni2+胁迫的作为对照组,利用实时荧光定量PCR探究了Ni2+胁迫下A. ferrooxidans亚铁氧化电子传递链中rus操纵子相关基因表达情况,结果如图 3–6所示。结果表明:与对照组相比,在2种不同Ni2+胁迫浓度下,实验组A. ferrooxidans菌rus操纵子不同编码基因表达情况不同。与对照组相比,在浓度10 g/L Ni2+胁迫环境下培养24 h,(1) A. ferrooxidans中cyc2、rus和orf表达下调≤2.0倍(图 3、图 4A和图 6),表明这3个基因表达无明显差异;(2) 培养4、9和24 h取样点的cyc1表达下调3.5–4.4倍(图 4B),表明cyc1基因表达显著下调;(3) coxBACD 4个亚基基因表达于24 h取样点下调最显著,最高下调2.5–3.2倍(图 5)。在40 g/L高浓度Ni2+胁迫下培养24 h,A. ferrooxidans菌rus操纵子不同基因表达情况如下:(1) 培养4、9和24 h取样点的cyc2、rus和orf表达分别下调1.3–2.2倍、2.3–4.0倍和1.7–2.6倍,胁迫时间越长,cyc2、rus和orf基因表达下调越显著(图 3、图 4A和图 6);(2) 培养4–24 h,cyc1下调5.7–16倍(图 4B),下调显著高于对照组和10 g/L Ni2+胁迫实验组;(3) 培养24 h,编码细胞色素c氧化酶4个不同亚基的编码基因coxBACD的表达量分别下调2.0–2.7倍、2.0–3.7倍、5.6–7.4倍和3.2–3.7倍,且下调随胁迫时间延长而越发显著(图 5)。
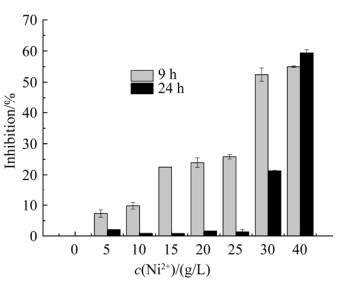
|
| 图 2 不同Ni2+浓度胁迫下,A. ferrooxidans亚铁氧化抑制率 Figure 2 Inhibition efficiency of Fe2+ oxidation by addition of Ni2+. |
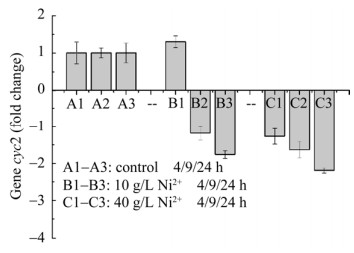
|
| 图 3 Ni2+胁迫对cyc2基因表达影响 Figure 3 Effect of Ni2+ on transcriptional level of gene cyc2. |
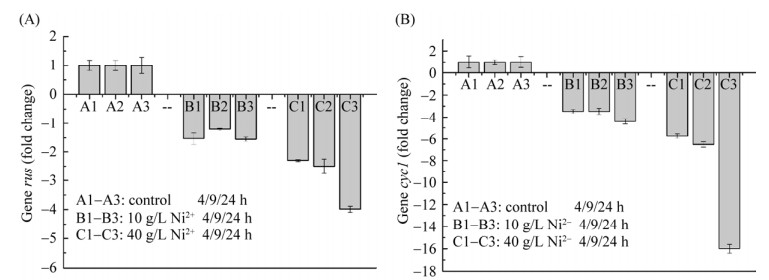
|
| 图 4 Ni2+胁迫对rus (A)和cyc1 (B)基因表达影响 Figure 4 Effect of Ni2+ on transcriptional levels of genes rus (A) and cyc1 (B). |
|
| 图 5 Ni2+胁迫对coxA (A)、coxB (B)、coxC (C)、coxD (D) 4个不同基因表达影响 Figure 5 Effect of Ni2+ on transcriptional levels of genes coxA (A), coxB (B), coxC (C) and coxD (D). |
|
| 图 6 Ni2+胁迫对orf基因表达影响 Figure 6 Effect of Ni2+ on transcriptional level of gene orf. |
无论是低浓度还是高浓度Ni2+胁迫环境,rus操纵子中cyc1和coxBACD基因在胁迫初始(4 h)表达量就开始显著下调,而rus操纵子中其他基因在胁迫培养24 h才出现显著下调情况。因而推断这5个基因(cyc1和coxBACD)表达与Ni2+胁迫有明显的响应关系,推断其编码的蛋白可能是亚铁氧化电子传递链途径中的限速酶。Fe2+氧化“顺电势”电子传递是细胞内、外膜上不同蛋白与蛋白之间的相互作用[31–32]。提高rus操纵子上各功能基因和相应蛋白量的表达量,将有效提高A. ferrooxidans菌亚铁氧化能力,尤其是电子传递途径中的限速酶cyc1或coxBACD基因表达[30]。因此,本研究结果与上述Liu等[30]研究结果相一致。此外,与对照组比较,Ni2+胁迫浓度越高,rus操纵子相关功能基因表达下调量越大(图 3–6)。Fe2+氧化“顺电势”传递蛋白(尤其是关键酶)的基因转录下调(图 3–6),可能使得相应编码传递蛋白表达减少,最终导致亚铁氧化效率降低(图 1)。
2.3 不同Ni2+胁迫浓度下,A. ferrooxidans胞外电子传递情况比较利用线性循环伏安电化学法比较和分析了A. ferrooxidans菌在不同Ni2+胁迫下胞外电子传递响应情况(图 7–8)。
|
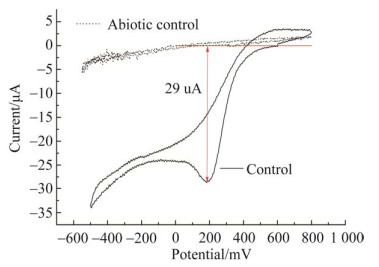
| 图 7 正常培养条件下A. ferrooxidans菌微生物电极循环伏安曲线 Figure 7 Cyclic voltammetry of A. ferrooxidans without any Ni2+ stress. |

|
| 图 8 添加40 g/L Ni2+胁迫下,A. ferrooxidans菌电极循环伏安曲线 Figure 8 Cyclic voltammetry of A. ferrooxidans under the stress of 40 g/L Ni2+. |
图 7为正常培养条件(不添加Ni2+胁迫)下A. ferrooxidans菌体线性循环伏安曲线(电流-电势变化响应)图。空电极ITO导电玻璃工作电极的线性循环伏安曲线(abiotic control)显示无明显氧化/还原电流现象,表明该电极可用于A. ferrooxidans菌“微生物电极”测定。A. ferrooxidans菌微生物电极在一个循环扫描范围(800––500– 800 mV)内,阴极电势≤400 mV时,开始缓慢出现还原电流,降低至约180 mV时出现最大扫描电流还原峰(约为29 µA),表明此时还原反应速率达到最大值;在–500 mV左右出现另一个还原电流峰可能与体系析氢现象有关;正向扫描(–500–800 mV)曲线无明显阳极电流峰。由此可推断,A. ferrooxidans菌胞外电子传递的电化学反应具有不可逆性。
A. ferrooxidans具有胞外电子转移能力,属于电活性微生物。Carbajosa等[34]指出,A. ferrooxidans菌即使在无电子传递中间体的条件下也能够顺利完成从电极表面获得电子并产能,获得高效电化学培养而形成生物膜。A. ferrooxidans亚铁氧化电子传递模型中[32],外膜蛋白cytochrome c作为第一个电子受体在亚铁氧化中发挥重要作用。Castelle等[32]纯化获得A. ferrooxidans细胞外膜上的cytochrome c纯蛋白,指出该外膜蛋白氧化还原电势(560 mV)是目前已发现的细胞色素c中最高的。本研究A. ferrooxidans菌循环伏安曲线显示在低于400 mV缓慢出现还原电流,并在还原电势180 mV时出现最大还原峰值,可能归因于A. ferrooxidans细胞外膜上的cytochrome c (560 mV)与阴极电势(≤400 mV)之间的氧化还原电势差,决定阴极电子被传递链中的cytochrome c接纳,且该微生物电极电化学反应不可逆。
40 g/L Ni2+胁迫导致A. ferrooxidans菌微生物电极在180 mV附近出现的还原峰电流值降低(24.5 µA)(图 8),低于对照组(29.0 µA)(图 7)。循环伏安曲线氧化还原峰高低(或电流值大小)可表示在给定条件下某氧化或还原反应进行速率的快与慢[35]。综合比较图 7和图 8,在相同细胞数下,高浓度Ni2+胁迫最终导致A. ferrooxidans菌胞外获得电子速率和能力降低,最终影响其氧化亚铁能力(图 1)。
2.4 高浓度Ni2+胁迫下,A. ferrooxidans菌亚铁氧化应激机制当功能微生物被接种到寡营养、极端环境中,微生物能够快速适应不利条件显得尤为重要。而长时间耐受性驯化,能够提高A. ferrooxidans菌等嗜酸微生物耐受重金属毒性等不利因素的能力[3]。在含重金属等极端环境下,嗜酸微生物需要表达大量抗性基因或通过菌种间协同作用来抵抗极端的环境压力。结合转录组、蛋白组等技术发现整个群落或微生物在极端环境下,一系列抵抗重金属胁迫、酸胁迫以及胞内氧化胁迫的相关基因具有相对较高的表达活性,这些特殊功能基因的存在使得微生物具有抵抗外界极端条件胁迫的能力,保证了微生物的存活及浸出过程中的功能[3, 13–15]。此外,微生物在寡营养环境下能量代谢也表达较高的活性,进行铁硫氧化获得能量来维持细胞的活性[15]。
rus操纵子是A. ferrooxidans菌中典型的参与亚铁氧化能量代谢的基因簇。rus操纵子相关功能蛋白或编码基因在不同浓度、不同种类重金属胁迫下响应程度存在差异。Martínez-Bussenius等指出,在40 mmol/L Cu2+胁迫下A. ferrooxidans ATCC 53993的rus操纵子相关功能基因表达不受影响或对应的功能蛋白略微上调1.47–1.71倍,可能40 mmol/L的Cu2+浓度对A. ferrooxidans ATCC 53993亚铁氧化代谢没有影响[3];而同样40 mmol/L的Cu2+浓度却造成A. ferrooxidans ATCC 23270中cyc1、cyc2和petC-1等基因表达下调[36]。耐受Cd2+驯化的A. ferrooxidans在100 mmol/L Cd2+胁迫下,铁氧化相关蛋白(尤其是cyc2、cyc1、AcoP和CoxB)表达水平下调[37]。在高浓度(40 g/L) Ni2+胁迫环境下,A. ferrooxidans同样能表达亚铁氧化相关功能基因,完成基本的能量代谢,但rus操纵子不同功能基因表达量比对照组显著下调,尤其是限速酶编码基因cyc1和coxBACD (图 3–6和图 9)。除了cyc1和coxBACD,编码c-型cytochrome蛋白的功能基因cyc2也下调(图 3),可能导致相应的外膜c-型cytochrome蛋白量降低,对应接收Fe2+氧化失去电子的能力也降低。周质空间的铜蓝蛋白(编码基因rus),除了参与电子传递,同时还能结合周质空间过量的Cu2+,降低重金属对微生物的毒性[3]。相反,在高浓度Ni2+胁迫环境下,rus基因表达没有上调,反而显著下调(2.3–4.0倍),表明铜蓝蛋白可能对Ni2+抗性没有作用,与Ranmos-zúñiga等[37]研究结果一致。rus操纵子上各功能基因显著下调,耦合作用下伴随相应的传递蛋白表达量降低,综合导致A. ferrooxidans胞外电子传递能力降低(图 7–8),最终导致A. ferrooxidans亚铁氧化能力降低(图 1),具体如图 9所示。
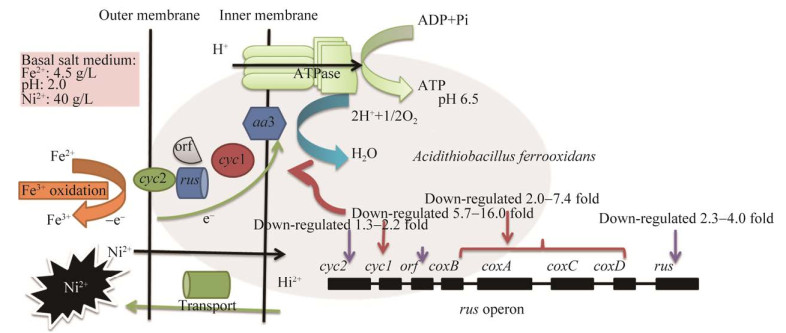
|
| 图 9 重金属Ni2+胁迫下,A. ferrooxidans菌亚铁氧化应激效应 Figure 9 Iron oxidation response of A. ferrooxidans under Ni2+ stress. |
3 结论
A. ferrooxidans由于其独特的亚铁/还原硫氧化自养能力,使其在湿法冶金工艺中发挥重要作用。本研究在两步培养法体系下,通过对亚铁氧化速率、rus操纵子上各功能基因表达和胞外电子传递等测定从宏观到微观探究了A. ferrooxidans在重金属Ni2+胁迫下亚铁氧化应激作用。结果指出:
(1) 与已有研究报道相比,本研究获得A. ferrooxidans菌株在两步培养法体系下能够耐受较高的Ni2+胁迫浓度。A. ferrooxidans能够耐受≤30g/L Ni2+胁迫,亚铁氧化率和速率抑制影响不显著(24 h亚铁氧化抑制率≤21.3%);当Ni2+浓度增加至40 g/L时,亚铁氧化率和速率受到显著抑制,对应的24 h亚铁氧化抑制率约为59.4%。
(2) 超高浓度(40 g/L) Ni2+胁迫环境抑制了A. ferrooxidans菌亚铁氧化代谢活性,导致rus操纵子中各功能基因的表达量降低,尤其是cyc1和coxBACD等5个基因。
(3) rus操纵子不同功能基因表达量降低,相应合成的电子传递蛋白酶量降低,限制了A. ferrooxidans亚铁氧化电子传递作用,导致A. ferrooxidans胞外传递电子能力降低,最终致使A. ferrooxidans菌亚铁氧化活性降低。
在利用A. ferrooxidans生物浸提含Ni的废旧Pb–Ni电池、电镀污泥等固废之前,深入研究该菌在Ni2+胁迫下的耐受性及其亚铁氧化相关基因及其功能应激,将为探明完备的A. ferrooxidans抗重金属机制在理论上打下基础,也为含Ni固废生物浸提实际工程应用提供理论和方法支撑。
| [1] | Chen H, Yang B, Chen XH. Identification and characterization of four strains of Acidithiobacillus ferrooxidans isolated from different sites in China. Microbiological Research, 2009, 164(6): 613-623. DOI:10.1016/j.micres.2007.09.002 |
| [2] | Jung H, Inaba Y, Banta S. Genetic engineering of the acidophilic chemolithoautotroph Acidithiobacillus ferrooxidans. Trends in Biotechnology, 2022, 40(6): 677-692. DOI:10.1016/j.tibtech.2021.10.004 |
| [3] | Martínez-Bussenius C, Navarro CA, Orellana L, Paradela A, Jerez CA. Global response of Acidithiobacillus ferrooxidans ATCC 53993 to high concentrations of copper: a quantitative proteomics approach. Journal of Proteomics, 2016, 145: 37-45. DOI:10.1016/j.jprot.2016.03.039 |
| [4] | Farías R, Norambuena J, Ferrer A, Camejo P, Zapata C, Chávez R, Orellana O, Levicán G. Redox stress response and UV tolerance in the acidophilic iron-oxidizing bacteria Leptospirillum ferriphilum and Acidithiobacillus ferrooxidans. Research in Microbiology, 2021, 172(3): 103833. DOI:10.1016/j.resmic.2021.103833 |
| [5] | Marra A, Cesaro A, Rene ER, Belgiorno V, Lens PNL. Bioleaching of metals from WEEE shredding dust. Journal of Environmental Management, 2018, 210: 180-190. |
| [6] | Yang YK, Chen S, Li SC, Chen MJ, Chen HY, Liu BJ. Bioleaching waste printed circuit boards by Acidithiobacillus ferrooxidans and its kinetics aspect. Journal of Biotechnology, 2014, 173: 24-30. DOI:10.1016/j.jbiotec.2014.01.008 |
| [7] | Jadhav U, Hocheng H. Extraction of silver from spent silver oxide-zinc button cells by using Acidithiobacillus ferrooxidans culture supernatant. Journal of Cleaner Production, 2013, 44: 39-44. DOI:10.1016/j.jclepro.2012.11.035 |
| [8] | Hocheng H, Su CE, Jadhav UU. Bioleaching of metals from steel slag by Acidithiobacillus thiooxidans culture supernatant. Chemosphere, 2014, 117: 652-657. DOI:10.1016/j.chemosphere.2014.09.089 |
| [9] | Park J, Han Y, Lee E, Choi U, Yoo K, Song Y, Kim H. Bioleaching of highly concentrated arsenic mine tailings by Acidithiobacillus ferrooxidans. Separation and Purification Technology, 2014, 133: 291-296. DOI:10.1016/j.seppur.2014.06.054 |
| [10] |
Yu HL, Liu XR, Shen JH, Chi DJ. Bioleaching of copper solvent extraction organics contaminated-chalcopyrite ores by Acidithiobacillus thiooxidans. The Chinese Journal of Nonferrous Metals, 2018, 28(4): 823-829.
(in Chinese) 余华龙, 刘晓荣, 申君辉, 池道杰. 萃取有机物污染黄铜矿的At. thiooxidans菌浸出. 中国有色金属学报, 2018, 28(4): 823-829. |
| [11] |
Lin H, Lin LJ, Dong YB. Bioleaching of copper from waste printed circuit boards by Acidithiobacillus ferrooxidans. Hydrometallurgy of China, 2019, 38(2): 104-109.
(in Chinese) 林海, 林丽娟, 董颖博. 用氧化亚铁硫杆菌从废印刷线路板中浸出铜. 湿法冶金, 2019, 38(2): 104-109. |
| [12] | Priya A, Hait S. Biometallurgical recovery of metals from waste printed circuit boards using pure and mixed strains of Acidithiobacillus ferrooxidans and Acidiphilium acidophilum. Process Safety and Environmental Protection, 2020, 143: 262-272. DOI:10.1016/j.psep.2020.06.042 |
| [13] | Almárcegui RJ, Navarro CA, Paradela A, Albar JP, Von Bernath D, Jerez CA. Response to copper of Acidithiobacillus ferrooxidans ATCC 23270 grown in elemental sulfur. Research in Microbiology, 2014, 165(9): 761-772. DOI:10.1016/j.resmic.2014.07.005 |
| [14] | Hua ZS, Han YJ, Chen LX, Liu J, Hu M, Li SJ, Kuang JL, Chain PS, Huang LN, Shu WS. Ecological roles of dominant and rare prokaryotes in acid mine drainage revealed by metagenomics and metatranscriptomics. The ISME Journal, 2015, 9(6): 1280-1294. DOI:10.1038/ismej.2014.212 |
| [15] | Ma LY, Wang HM, Wu JJ, Wang YG, Zhang D, Liu XD. Metatranscriptomics reveals microbial adaptation and resistance to extreme environment coupling with bioleaching performance. Bioresource Technology, 2019, 280: 9-17. DOI:10.1016/j.biortech.2019.01.117 |
| [16] | Bush M, Dixon R. The role of bacterial enhancer binding proteins as specialized activators of σ54-dependent transcription. Microbiology and Molecular Biology Reviews: MMBR, 2012, 76(3): 497-529. DOI:10.1128/MMBR.00006-12 |
| [17] | Guiliani N, Jerez CA. Molecular cloning, sequencing, and expression of omp-40, the gene coding for the major outer membrane protein from the acidophilic bacterium Thiobacillus ferrooxidans. Applied and Environmental Microbiology, 2000, 66(6): 2318-2324. DOI:10.1128/AEM.66.6.2318-2324.2000 |
| [18] | Cabrera G, Gómez JM, Cantero D. Influence of heavy metals on growth and ferrous sulphate oxidation by Acidithiobacillus ferrooxidans in pure and mixed cultures. Process Biochemistry, 2005, 40(8): 2683-2687. DOI:10.1016/j.procbio.2004.12.005 |
| [19] |
Ye MY, Yan PF, Sun SY, Han DJ, Zhuang SW, Zheng L, Huang SS. Effect of copper ion concentration on growth activity and kinetics of Acidithiobacillus ferrooxidans. The Chinese Journal of Nonferrous Metals, 2016, 26(10): 2238-2245.
(in Chinese) 叶茂友, 严苹方, 孙水裕, 韩大建, 庄圣炜, 郑莉, 黄绍松. 铜离子浓度对嗜酸性氧化亚铁硫杆菌生长特性和生长动力学的影响. 中国有色金属学报, 2016, 26(10): 2238-2245. |
| [20] | Cabrera G, Gómez JM, Cantero D. Kinetic study of ferrous sulphate oxidation of Acidithiobacillus ferrooxidans in the presence of heavy metal ions. Enzyme and Microbial Technology, 2005, 36(2/3): 301-306. |
| [21] | Pourhossein F, Mousavi SM. Enhancement of copper, nickel, and gallium recovery from LED waste by adaptation of Acidithiobacillus ferrooxidans. Waste Management, 2018, 79: 98-108. DOI:10.1016/j.wasman.2018.07.010 |
| [22] | Gholami RM, Borghei SM, Mousavi SM. Bacterial leaching of a spent Mo-Co-Ni refinery catalyst using Acidithiobacillus ferrooxidans and Acidithiobacillus thiooxidans. Hydrometallurgy, 2011, 106(1/2): 26-31. |
| [23] | Rastegar SO, Mousavi SM, Shojaosadati SA, Mamoory RS. Bioleaching of V, Ni, and Cu from residual produced in oil fired furnaces using Acidithiobacillus ferrooxidans. Hydrometallurgy, 2015, 157: 50-59. DOI:10.1016/j.hydromet.2015.07.006 |
| [24] | Silverman MP, Lundgren DG. Studies on the chemoautotrophic iron bacterium Ferrobacillus ferrooxidans. Journal of Bacteriology, 1959, 77(5): 642-647. DOI:10.1128/jb.77.5.642-647.1959 |
| [25] | Carlos C, Reis FC, Vicentini R, Madureira DJ, Ottoboni LMM. The rus operon genes are differentially regulated when Acidithiobacillus ferrooxidans LR is kept in contact with metal sulfides. Current Microbiology, 2008, 57(4): 375-380. DOI:10.1007/s00284-008-9208-7 |
| [26] | Yarzábal A, Appia-Ayme C, Ratouchniak J, Bonnefoy V. Regulation of the expression of the Acidithiobacillus ferrooxidans rus operon encoding two cytochromes c, a cytochrome oxidase and rusticyanin. Microbiology: Reading, England, 2004, 150(Pt 7): 2113-2123. |
| [27] | Livak KJ, Schmittgen TD. Analysis of relative gene expression data using real-time quantitative PCR and the 2−ΔΔCT method. Methods, 2001, 25(4): 402-408. DOI:10.1006/meth.2001.1262 |
| [28] | Ahmadi A, Schaffie M, Manafi Z, Ranjbar M. Electrochemical bioleaching of high grade chalcopyrite flotation concentrates in a stirred bioreactor. Hydrometallurgy, 2010, 104(1): 99-105. DOI:10.1016/j.hydromet.2010.05.001 |
| [29] | De GC, Oliver DJ, Pesic BM. Effect of heavy metals on the ferrous iron oxidizing ability of Thiobacillus ferrooxidans. Hydrometallurgy, 1997, 44(1/2): 53-63. |
| [30] | Liu W, Lin JQ, Pang X, Cui S, Mi S, Lin JQ. Overexpression of rusticyanin in Acidithiobacillus ferrooxidans ATCC 19859 increased Fe(Ⅱ) oxidation activity. Current Microbiology, 2011, 62(1): 320-324. DOI:10.1007/s00284-010-9708-0 |
| [31] | Quatrini R, Appia-Ayme C, Denis Y, Jedlicki E, Holmes DS, Bonnefoy V. Extending the models for iron and sulfur oxidation in the extreme acidophile Acidithiobacillus ferrooxidans. BMC Genomics, 2009, 10: 394. DOI:10.1186/1471-2164-10-394 |
| [32] | Castelle C, Guiral M, Malarte G, Ledgham F, Leroy G, Brugna M, Giudici-Orticoni MT. A new iron-oxidizing/O2- reducing super complex spanning both inner and outer membranes, isolated from the extreme acidophile Acidithiobacillus ferrooxidans. Journal of Biological Chemistry, 2008, 283(38): 25803-25811. DOI:10.1074/jbc.M802496200 |
| [33] |
Yin HQ, Liu ZH, Liu XD. Diversity of iron and sulfur metabolism in bioleaching microorganisms and their interaction with minerals. Acta Microbiologica Sinica, 2018, 58(4): 560-572.
(in Chinese) 尹华群, 刘征华, 刘学端. 冶金微生物的铁硫代谢多样性及其与矿物的相互作用. 微生物学报, 2018, 58(4): 560-572. |
| [34] | Carbajosa S, Malki M, Caillard R, Lopez MF, Palomares FJ, Martín-Gago JA, Rodríguez N, Amils R, Fernández VM, De Lacey AL. Electrochemical growth of Acidithiobacillus ferrooxidans on a graphite electrode for obtaining a biocathode for direct electrocatalytic reduction of oxygen. Biosensors and Bioelectronics, 2010, 26(2): 877-880. DOI:10.1016/j.bios.2010.07.037 |
| [35] | 贾铮, 戴长松, 陈玲. 电化学测量方法. 北京: 化学工业出版社, 2013: 156-178. |
| [36] | Almárcegui RJ, Navarro CA, Paradela A, Albar JP, Von Bernath D, Jerez CA. New copper resistance determinants in the extremophile Acidithiobacillus ferrooxidans: a quantitative proteomic analysis. Journal of Proteome Research, 2014, 13(2): 946-960. DOI:10.1021/pr4009833 |
| [37] | Ramos-Zúñiga J, Gallardo S, Martínez-Bussenius C, Norambuena, Navarro RCA, Paradela A, Jerez CA. Response of the biomining Acidithiobacillus ferrooxidans to high cadmium concentrations. Journal of Proteomics, 2019, 198: 132-144. DOI:10.1016/j.jprot.2018.12.013 |
 2022, Vol. 62
2022, Vol. 62




