中国科学院微生物研究所,中国微生物学会
文章信息
- 肖苗, 董战旗, 肖琴, 胡志刚, 王杰, 陈鹏, 潘敏慧. 2022
- XIAO Miao, DONG Zhanqi, XIAO Qin, HU Zhigang, WANG Jie, CHEN Peng, PAN Minhui.
- 杆状病毒凋亡抑制基因IAP1促进家蚕CyclinB的核内积累
- Baculovirus apoptosis suppressor gene IAP1 promotes nuclear accumulation of CyclinB in Bombyx mori
- 微生物学报, 62(9): 3478-3488
- Acta Microbiologica Sinica, 62(9): 3478-3488
-
文章历史
- 收稿日期:2022-01-15
- 修回日期:2022-03-08
- 网络出版日期:2022-05-27
2. 西南大学农业部蚕桑生物学与遗传育种重点实验室, 重庆 400715
2. Key Laboratory of Sericultural Biology and Genetic Breeding, Ministry of Agriculture and Rural Affairs, Southwest University, Chongqing 400715, China
杆状病毒是一类专性寄生于无脊椎动物的病毒,解析其与宿主之间的相互作用一直是研究热点[1]。世界上近70个国家均有蚕业生产[2],其中属于杆状病毒的家蚕核型多角体病毒(Bombyx mori nucleopolyhedrovirus,BmNPV),是蚕业生产上危害最严重的病原之一[3–5],每年给蚕业生产造成巨大的经济损失[6–7]。前期研究发现,BmNPV感染BmN-SWU1[8]细胞将细胞周期阻滞于G2/M期,以利于自身增殖。细胞周期蛋白CyclinB是细胞周期G2期向M期转换的重要调控因子,其与细胞周期蛋白依赖性激酶1 (cyclin-dependent kinase 1,CDK1)组成复合物调控细胞周期由G2期进入M期[9–12]。研究BmNPV感染过程中CyclinB表达水平及定位变化对解析病毒调控细胞周期的机制具有重要意义,同时探究这一过程中参与调控的宿主基因和病毒基因,可为培育抗BmNPV的家蚕转基因品系提供理论支撑。杆状病毒是一类环状、双链、基因组为超螺旋的DNA病毒[13],其基因组大小为80–180 kb[14–15]。杆状病毒生活周期中可以产生2种不同的病毒粒子[16–17]:包埋型病毒(occusion-derived virus,ODV)和牙生型病毒(budded virus,BV)。ODV介导个体间的传播,BV介导细胞间的传播。杆状病毒感染宿主,将宿主细胞周期阻滞于G2/M期,形成一个有利于病毒自身增殖复制的环境[18]。CyclinB从G1晚期开始表达并逐渐积累,在G2晚期达到最大值,一直维持到分裂中期,随后立即降解。CyclinB的积累和降解在维持正常的细胞周期中起着重要的作用,外部因素或内部因素引起CyclinB的不正常表达都会导致细胞周期的紊乱。在家蚕卵巢细胞中干涉CyclinB会抑制细胞增殖,将细胞周期阻滞在G2/M期[19]。苜蓿银纹夜蛾核型多角体病毒(Autographa californica nucleopolyhedrovirus,AcMNPV)感染Sf9细胞,编码ODV-EC27蛋白与CyclinB竞争性结合CDK1,使G2期向M期转换的重要调控复合物CyclinB-CDK1不能发挥作用,G2期不能进入M期,最终将细胞周期阻滞在G2/M期[20–22],以利于病毒增殖[23]。棉铃虫单核衣壳核型多角体病毒(Heliocoverpa armigera single nucleocapsid nucleopolyhedrovirus,HaSNPV)感染Hz-AM1细胞诱导细胞周期阻滞在G2/M期,并提高CyclinB1表达量[24]。已有研究发现BmNPV感染BmN-SWU1细胞通过BmNPV IAP1下调BmCDK1蛋白水平的表达将细胞周期阻滞于G2/M期[25],与报道的AcMNPV和HaSNPV阻滞细胞周期方式存在差异。BmNPV侵染BmN-SWU1细胞阻滞细胞周期于G2/M期,解析这一过程有利于对BmNPV的防控。在BmNPV侵染BmN-SWU1细胞过程中,探究BmCyclinB表达量及定位变化,鉴定与BmCyclinB发生相互作用的病毒蛋白,为培育抗BmNPV家蚕品系提供分子靶标,同时为解析BmNPV调控宿主细胞周期阻滞周期于G2/M期提供重要线索。
1 材料与方法 1.1 细胞和病毒家蚕卵巢细胞系BmN-SWU1由西南大学家蚕基因组生物学国家重点实验室建立[8]并保存,BmNPV(CQ株)由实验室保存。
1.2 试剂和仪器试剂:各种限制性内切酶、连接酶、DNA Marker、逆转录试剂盒等分子生物学操作试剂购于TaKaRa公司;胶回收试剂盒和RNA提取试剂盒购于Omega公司;抗体和细胞核蛋白与细胞浆蛋白抽提试剂盒购于Beyotime公司;ECL显色液和定量试剂购于Yeasen公司;各种化学试剂购于成都科隆有限公司。
仪器:超高分辨激光共聚焦显微镜(Olympus);荧光定量PCR仪(Bio-Rad);分光光度计(ThermoFish);转膜仪(Bio-Rad);扫描仪(Bio-Rad);化学发光成像仪(Bio-Rad);16 ℃连接仪(Eppendorf)。
1.3 BmCyclinB真核表达载体、BmNPV iap1敲除载体和重组病毒构建利用Primer 5.0进行BmCyclinB的引物设计,其中BmCyclinBHA-BamH I-F的序列为(CGCggatccATGTACCCATACGACGTCCCAGACTACGCTGAAATTCAACTAAGGCGGCAT),BmCyclinB-Not I-R的序列为(ATTTgcggccgcTT AAGGGCTTGGGCTTGATATCT)。用Ex-Taq酶进行扩增,扩增片段和pIZ-V5/His载体用BamH I和Not I内切酶进行酶切,利用Solution I连接,选择阳性克隆进行测序。根据文献[25]进行psl1180-sgBmNPV iap1-Cas9-Flag载体构建。
将BmCyclinBFlag克隆到pFastBac1载体上,随后通过Bac to Bac转座到vBm基因组上[26],构建重组病毒vBm-BmCyclinBFlag。
1.4 RNA提取和逆转录实验细胞转染48 h后以感染复数MOI=5添加病毒,将细胞轻轻吹下,用磷酸缓冲盐溶液(phosphate buffered saline,PBS)清洗1遍,加入TRK裂解液,按试剂盒说明书提取RNA,分光光度计测量RNA浓度后,立即使用逆转录试剂进行逆转录实验。10 µL反应体系包括gDNA Eraser 1 µL,5×gDNA Eraser Buffer 2 µL,RNA 1 µg,RNase Free ddH2O补足到10 µL;42 ℃保温2 min后加PrimeScript RT Enzyme Mix I 1 µL,5×PrimeScript Buffer 24 µL,RT Primer Mix 4 µL,RNase Free ddH2O 1 µL,37 ℃反应30 min;85 ℃保温5 s以终止反应,最后利用家蚕肌动蛋白基因Actin3的扩增引物A3-F (5ʹ-CATGAAGATCCTCACCGAGCG-3ʹ)和A3-R (5ʹ-CGTAGCACAGCTTCTCCTTGATA-3ʹ)[27]检测逆转录反应是否成功。
1.5 荧光定量PCR以逆转录获得的cDNA为模板,进行定量PCR检测,10 µL的体系包括:SYBR®Green Supermix 5 µL、DEPC水5 µL、引物(10 µmol/L)各0.3 µL、模板(反转1 µg RNA) 0.8 µL。反应程序为95 ℃ 30 s;95 ℃ 5 s,60 ℃ 30 s,循环40次;最后95 ℃变性10 s。选用翻译起始因子4A[28](sw22934)作为内参基因,引物为qsw22934-F (5ʹ-TTCGTACTGGCTCTTCTCGT-3ʹ)和qsw22934-R (5ʹ-CAAAGTTGATAGCAATTC CCT-3ʹ)。用于BmCyclinB检测的引物为qBmCyclinB-F (5ʹ-TGTCAAAAATGTTATTCAG CC-3ʹ)和qBmCyclinB-R (5ʹ-TTTCCGTAAAGA GTCAGTTCC-3ʹ)。
1.6 免疫荧光根据TransIT ®-Insect Transfection Reagent说明书将pIZ-BmcyclinB-HA载体进行转染,无菌培养48 h后添毒。PBST (PBS加Tween-20)清洗,加入200 μL 4%多聚甲醛溶液,室温固定15 min,PBST清洗,加入200 μL 1% Triton X-100,室温下通透15 min,PBST清洗。加250 μL封闭液(3% BSA,10%羊血清,90% PBS) 37 ℃封闭1 h。加入一抗,37 ℃孵育2 h,PBST清洗30 min,加入二抗,37 ℃避光孵育1 h,PBST清洗。取干净载玻片,做好标记,将爬片小心取出固定在载玻片上,在荧光共聚焦显微镜下观察。
1.7 细胞核蛋白及细胞浆蛋白分离利用细胞核蛋白与细胞浆蛋白抽提试剂盒进行细胞浆蛋白和细胞核蛋白的分离。将细胞样品吹下,吸出一部分作为总蛋白,其余进行细胞浆蛋白和细胞核蛋白的分离,具体步骤见试剂盒说明书。最后在所得到的总蛋白、细胞核蛋白和细胞浆蛋白中加入5×SDS-PAGE蛋白上样缓冲液,沸水煮10 min,−80 ℃保存备用。
1.8 Western blotting将BmN-SWU1细胞样品吹下离心,沉淀加入IP裂解液(IP裂解液: PMSF=100:1)冰上裂解30 min,然后加入5×SDS-PAGE蛋白上样缓冲液,沸水浴中煮10 min备用。利用SDS-PAGE (12%分离胶,5%浓缩胶)凝胶进行电泳,结束后通过转膜仪将蛋白质电转至PVDF膜上,将膜置于封闭液(含5%脱脂奶粉的TBST缓冲液)中室温封闭2 h,然后以一抗和封闭液比为1:2 000加入HA/Flag抗体(兔/鼠),室温孵育2 h,TBST缓冲液清洗5次,每次6 min,再以二抗和封闭液比为1:5 000加入HRP标记的山羊抗兔/鼠IgG二抗,室温孵育1 h,重复上步清洗步骤。最后加ECL显色液进行曝光。
1.9 免疫共沉淀向细胞中添加重组病毒vBm-BmCyclinBFlag,48 h后,将细胞吹下离心,沉淀中加入1 mL IP裂解液,冰上摇动裂解30 min后吸出100 μL样品作为总蛋白样品。另准备2个新的离心管,做好标记,分别加入50 μL Protein A磁珠,磁力架上用PBST洗涤3次。加入300 μL PBST,2个离心管分别加入3 μL鼠/兔IgG和3 μL Flag(HA)鼠/兔抗体,翻转仪上孵育2 h。磁力架上去除上清,2个离心管中各加入450 μL蛋白样品,翻转仪上孵育2 h。PBST洗涤3次,随后2个离心管中分别加入100 μL IP裂解液和25 μL 5×蛋白上样缓冲液,沸水中煮10 min。磁力架上将煮好的蛋白转移至新的做好标记的离心管中,−80 ℃保存备用。
1.10 银染和质谱鉴定将蛋白样品进行SDS-PAGE电泳后进行以下处理:固定液(甲醇50 mL、冰乙酸12 mL、甲醛50 μL、纯水38 mL)固定1 h;洗涤液(甲醇125 mL、纯水125 mL)清洗2 h;增感液(无水硫代硫酸钠0.01 g、纯水250 mL)增感90 s;超纯水洗涤3次,每次20 s;染色液(硝酸银0.2 g、甲醛75 μL、纯水100 mL)染色,避光孵育30 min;超纯水洗涤3次,每次20 s;显影液(无水硫代硫酸钠6 g、增感液8 mL、甲醛50 μL、纯水92 mL)显色,直到蛋白条带清晰可见后加入终止液(甲醇50 mL、冰乙酸12 mL、纯水38 mL)终止显影,蛋白胶于扫描仪上成像和分析。将差异条带切下送北京华大基因进行质谱鉴定,质谱条带以家蚕数据库和BmNPV基因组信息为参照。
2 结果与分析 2.1 BmNPV感染BmN-SWU1细胞影响BmCyclinB表达探究BmNPV感染对宿主细胞周期G2期向M期转换的关键调控基因BmCyclinB的影响,利用实时荧光定量PCR检测病毒感染0、12、24、36、48 h后BmCyclinB的表达。以未感染病毒的细胞做对照,结果显示,BmNPV感染后,BmCyclinB转录水平发生显著下调(图 1)。
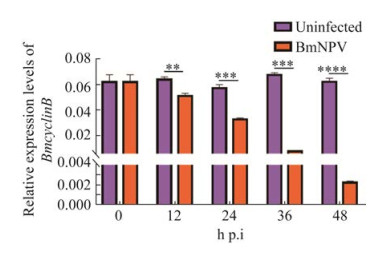
|
| 图 1 BmNPV感染后对BmCyclinB表达的影响 Figure 1 Effect of BmNPV infection on expression of BmCyclinB. A: qRT-PCR analysis of the transcriptional level change of BmCyclinB during BmNPV infection. *: P < 0.05; **: P < 0.01; ***: P < 0.001; ****: P < 0.000 1. |
2.2 BmNPV感染BmN-SWU1细胞促进BmCyclinB在核内积累
为了探究BmNPV对BmCyclinB定位的影响,构建了BmCyclinB过表达载体pIZ-BmcyclinB-HA,并通过定量水平验证,构建成功(图 2A和2B),将其转染细胞,48 h后添毒进行免疫荧光观察。结果显示,在未感染病毒的对照组中,BmCyclinB定位于细胞质,感染病毒后BmCyclinB定位发生改变,细胞质和细胞核都有,但主要定位于细胞核(图 2C)。进一步将表达BmCyclinB的细胞按处于细胞质或细胞核进行统计分析,结果显示,在未感染时,BmCyclinB定位于细胞核占比34.96%,感染12 h占比41.70%,感染24 h占比50.76%,感染48 h占比88.92%,感染病毒后BmCyclinB定位于细胞核内的比例显著增加(图 2D)。
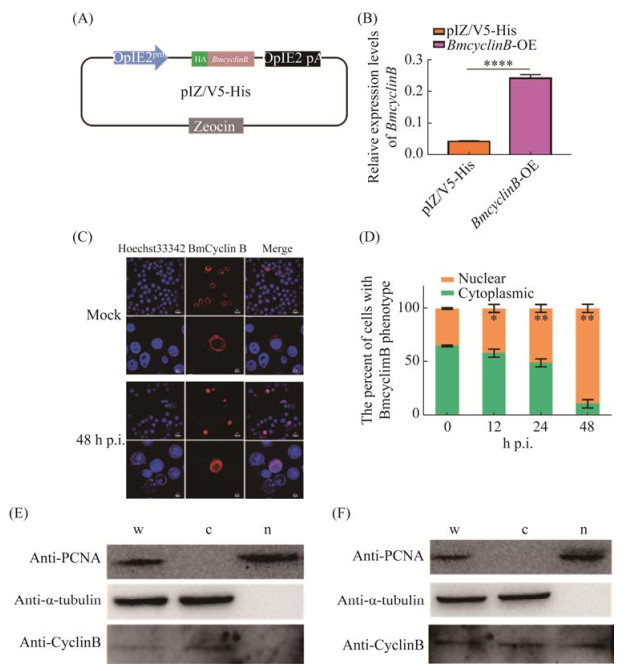
|
| 图 2 BmNPV感染后对BmCyclinB蛋白定位的影响 Figure 2 Effect of BmNPV infection on localization of BmCyclinB. A: schematic diagram of vector construction for overexpression of BmCyclinB; B: detection of expression efficiency after overexpression of BmCyclinB; C: immunofluorescence analysis of the distribution of BmCyclinB during BmNPV infection; D: statistical analysis of nucleoplasmic ratio of BmCyclinB during BmNPV infection; E: Western blotting analysis of the distribution of BmCyclinB before BmNPV infection; F: Western blotting analysis of the distribution of BmCyclinB after BmNPV infection 48 h. w represents whole cell lysates; c indicates the cytoplasmic proteins; n shows the nuclear proteins. *: P < 0.05; **: P < 0.01. |
为了进一步验证BmNPV感染后是否促进BmCyclinB在核内积累,以正常培养的未感染病毒作为对照,进行细胞质蛋白细胞核蛋白分离实验,以微管蛋白tubulin[29]和增殖细胞核抗原[30] (proliferating cell nuclear antigen,PCNA)分别代表细胞质蛋白和细胞核蛋白。Western blotting结果显示,实验组与对照组的细胞质蛋白中未检测到PCNA,细胞核蛋白中未检测到tubulin,说明所收样品符合实验要求,可用于后续实验。对照组中,在总蛋白及细胞质蛋白中均检测到BmCyclinB的表达,但在细胞核蛋白中未检测到BmCyclinB蛋白(图 2E);实验组中,在三者中均检测到了BmCyclinB的表达(图 2F)。以上结果说明BmNPV感染BmN-SWU1细胞促进BmCyclinB于核内积累。
2.3 BmCyclinB互作蛋白分析为了探究BmNPV感染BmN-SWU1细胞促进BmCyclinB核内积累的机制,利用重组病毒vBm-BmCyclinBFlag感染细胞,收集蛋白进行免疫共沉淀实验,银染后切取IgG条带和IP条带进行质谱鉴定。结果显示,与对照IgG相比,vBm-BmCyclinBFlag有5条差异带(图 3A)。质谱结果结合差异条带的大小和蛋白丰度,筛选到与BmCyclinB蛋白互作的病毒蛋白有7个,分别是病毒衣壳蛋白(BV/ODV-C42)、第67个开放阅读框(Bm67)、碱性核酸酶(alkaline nuclease,AN)、凋亡抑制基因(BmNPV IAP1)、通用反式转录因子(global transactivator,Gta)、第128个开放阅读框(Pe38)和第89个开放阅读框(He65)(表 1)。进一步对BmCyclinB与BmNPV IAP1进行了共定位观察,结果显示,BmCyclinB与BmNPV IAP1共定位于细胞核和细胞质,并主要定位于细胞核(图 3B)。免疫共沉淀和免疫印迹分析结果显示,BmCyclinB与BmNPV IAP1蛋白之间存在一定相互作用(图 3C)。
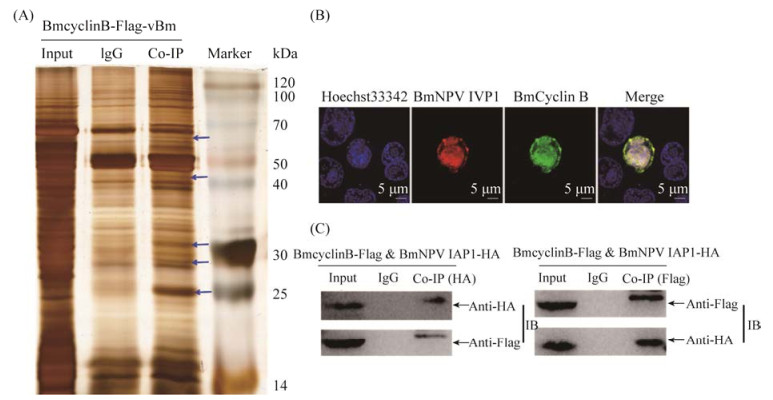
|
| 图 3 BmCyclinB互作病毒蛋白分析 Figure 3 Analysis of BmCyclinB interaction with virus proteins. A: Co-IP silver staining results of BmCyclinB: the different bands were pointed out by the blue arrows; Marker (protein molecular weight marker), Input (cell lysates), IgG (control), Co-IP (IP with anti-Flag antibody); B: Co-location analysis of BmCyclinB and BmNPV IAP1 by immunofluorescence; C: Co-IP assays verifying the interaction of BmCyclinB and BmNPV IAP1. |
| Protein ID | Size/kDa | Protein name | Matches | Score | Protein functions |
| NP_047502.1 | 41.6 | BV/ODV-C42 | 9(8) | 231 | Encoding BV and ODV capsid proteins |
| NP_047484.1 | 27.0 | Bm67 | 5(3) | 84 | Nonstructural protein gene |
| NP_054163.1 | 48.5 | AN | 4(3) | 73 | 5′ to 3′ exonuclease and endonuclease activities |
| NP_047432.1 | 34.0 | BmNPV IAP1 | 1(1) | 48 | Inhibition of apoptosis |
| NP_047448.1 | 59.2 | Gta | 3(2) | 33 | A kind of READ helicase superfamily |
| NP_047549.1 | 36.1 | Pe38[Bm128] | 2(1) | 32 | Activating DNA replication |
| NP_047506.1 | 34.3 | He65[Bm89] | 1(1) | 14 | Early transcriptional genes |
2.4 敲除BmNPV IAP1对BmCyclinB定位的影响
将psl1180-sgBmNPV iap1-Cas9-Flag载体转染进BmN-SWU1细胞,48 h后添毒,以空载为对照,添毒24 h后进行免疫荧光实验,随后用荧光共聚焦显微镜观察BmCyclinB细胞质细胞核分布情况(图 4A)。对表达BmCyclinB的细胞中BmCyclinB处于细胞核的细胞进行统计,结果显示,对照组中接近50%的BmCyclinB进入细胞核,而敲除BmNPV iap1后BmCyclinB进入细胞核的数量显著减少(图 4B)。
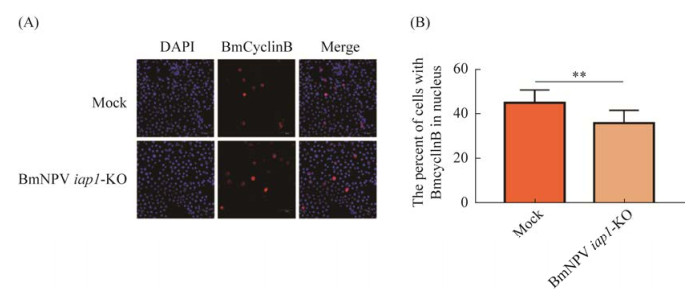
|
| 图 4 敲除BmNPV iap1对BmCyclinB入核的影响 Figure 4 Effect of BmCyclinB into the nucleus after knocking out BmNPV iap1 during BmNPV infection. A: immunofluorescence observed of the distribution of BmCyclinB after knocking down BmNPV iap1; B: analysis of nuclear proportion of BmCyclinB after knocking down BmNPV iap1. *: P < 0.05; **: P < 0.01. |
3 讨论
本文首次探讨了BmNPV与BmCyclinB之间的关系。已有研究表明,BmNPV侵染家蚕细胞将细胞周期阻滞在G2/M期[31]。CyclinB是细胞G2期向M期转换的重要细胞周期蛋白,与CDK1形成CyclinB-CDK1复合物[32],调控G2期向M期的转换[33]。在G2早期,CyclinB-CDK1复合物出核速度快于入核速度;在G2晚期,CyclinB-CDK1复合物出核速度慢于入核速度,在细胞核累积,调控G2期进入M期[34]。本研究结果显示,BmNPV感染导致BmCyclinB转录水平下调;BmCyclinB蛋白定位发生变化,感染前主要定位于细胞质,感染后主要定位于细胞核。进一步通过细胞质细胞核蛋白分离实验证明,BmNPV感染后BmCyclinB蛋白有部分进入细胞核内,而对照组的细胞核蛋白组中未检测到BmCyclinB蛋白。细胞周期分为间期和分裂期两个阶段,其中间期占据整个过程的大部分时间,分裂期只占据小部分,如HeLa细胞周期约为22 h,其中细胞间期为21 h,分裂期为1 h[35],因此本研究在对照组中未检测到BmCyclinB蛋白。
AcMNPV编码的ODV-EC27蛋白能够和CyclinB竞争性结合CDC2和CDC6,调控宿主细胞周期进程,将细胞周期阻断于G2/M期[20]。而BmNPV编码BmNPV IAP1下调BmCDK1的表达,阻滞细胞周期于G2/M期[25]。为了探讨BmNPV侵染BmN-SWU1细胞将细胞周期阻滞在G2/M期的阻滞机制,本研究以BmCyclinB为诱饵钓取了与其相互作用的病毒蛋白。结果发现了7个与BmCyclinB互作的病毒蛋白,分别是BV/ODV-C42、Bm67、AN、BmNPV IAP1、Gta、Pe38和He65。已有研究发现一种鼠凋亡抑制基因TIAP在同步化的NIH 3T3细胞重新进入细胞周期的S期向G2/M期转换过程中高表达[36],暗示其在调节细胞周期转换中发挥重要功能。因此,本文选取了BmNPV IAP1作进一步研究。通过免疫荧光和免疫共沉淀证明BmCyclinB与BmNPV IAP1之间存在一定相互作用,敲除BmNPV IAP1后BmCyclinB定位于细胞核的数量显著减少,BmNPV通过BmNPV IAP1促进BmCyclinB在核内积累,使其不能与CDK1形成复合物行使功能,或者在CyclinB- CDK1复合物未被激活的情况下促进入核,复合物不能正常发挥功能,从而导致细胞周期不能从G2期顺利进入M期,最终将细胞周期阻滞于G2/M期。HaSNPV感染Hz-AM1细胞,阻滞CyclinB1进核,将细胞周期阻滞在G2/M期[24],BmNPV促进CyclinB在核内积累以调控宿主细胞周期,与HaSNPV调控方式存在差异,但可为解析杆状病毒调控宿主细胞周期方式提供参考。
本研究发现BmNPV IAP1与BmCyclinB存在一定相互作用,参与BmNPV调控宿主细胞周期。IAP是凋亡抑制基因,在细胞中起调控细胞凋亡的作用[37–38],本文发现与研究报道的IAP功能不一样,一方面丰富了IAP基因功能研究,另一方面为解析病毒与宿主之间的调控方式提供新思路。最后,细胞周期是一个复杂的调控网络,参与其中的基因涉及很多,通过BmCyclinB钓取的其他病毒蛋白是否也参与BmNPV调控细胞周期的过程,有待进一步研究。
4 结论BmNPV感染BmN-SWU1细胞,通过降低BmCyclinB表达量以及通过BmNPV IAP1促进BmCyclinB在核内积累,以调控宿主细胞周期阻滞在G2/M期。
| [1] | Van Oers MM, Vlak JM. Baculovirus genomics. Current Drug Targets, 2007, 8(10): 1051-1068. DOI:10.2174/138945007782151333 |
| [2] | 顾国达. 世界蚕丝业经济与丝绸贸易. 北京: 中国农业科技出版社, 2001. |
| [3] | Cheng Y, Wang XY, Du C, Gao J, Xu JP. Expression analysis of several antiviral related genes to BmNPV in different resistant strains of silkworm, Bombyx mori. Journal of Insect Science, 2014, 14(76): 76. |
| [4] | Li G, Qian HY, Luo XF, Xu PZ, Yang JH, Liu MZ, Xu AY. Transcriptomic analysis of resistant and susceptible Bombyx mori strains following BmNPV infection provides insights into the antiviral mechanisms. International Journal of Genomics, 2016, 2016: 2086346. |
| [5] | Gomi S, Majima K, Maeda S. Sequence analysis of the genome of Bombyx mori nucleopolyhedrovirus. The Journal of General Virology, 1999, 80(Pt 5): 1323-1337. |
| [6] | Liu TH, Dong XL, Pan CX, Du GY, Wu YF, Yang JG, Chen P, Lu C, Pan MH. A newly discovered member of the Atlastin family, BmAtlastin-n, has an antiviral effect against BmNPV in Bombyx mori. Scientific Reports, 2016, 6: 28946. DOI:10.1038/srep28946 |
| [7] | Xia QY, Zhou ZY, Lu C, Cheng DJ, Dai FY, Li B, Zhao P, Zha XF, Cheng TC, Chai CL, Pan GQ, Xu JS, Liu C, Lin Y, Qian JF, Hou Y, Wu ZL, Li GR, Pan MH, Li CF, Shen YH, Lan XQ, Yuan LW, Li T, Xu HF, Yang GW, Wan YJ, Zhu Y, Yu MD, Shen WD, Wu DY, Xiang ZH, Yu J, Wang J, Li RQ, Shi JP, Li H, Li GY, Su JN, Wang XL, Li GQ, Zhang ZJ, Wu QF, Li J, Zhang QP, Wei N, Xu JZ, Sun HB, Dong L, Liu DY, Zhao SL, Zhao XL, Meng QS, Lan FD, Huang XG, Li YZ, Fang L, Li CF, Li DW, Sun YQ, Zhang ZP, Yang Z, Huang YQ, Xi Y, Qi QH, He DD, Huang HY, Zhang XW, Wang ZQ, Li WJ, Cao YZ, Yu YP, Yu H, Li JH, Ye JH, Chen H, Zhou Y, Liu B, Wang J, Ye J, Ji H, Li ST, Ni PX, Zhang JG, Zhang Y, Zheng HK, Mao BY, Wang W, Ye C, Li SG, Wang J, Wong GKS, Yang HM, Group BA. A draft sequence for the genome of the domesticated silkworm (Bombyx mori). Science, 2004, 306(5703): 1937-1940. DOI:10.1126/science.1102210 |
| [8] | Pan MH, Cai XJ, Liu M, Lv J, Tang H, Tan J, Lu C. Establishment and characterization of an ovarian cell line of the silkworm, Bombyx mori. Tissue and Cell, 2010, 42(1): 42-46. DOI:10.1016/j.tice.2009.07.002 |
| [9] | Pines J. Cyclins and cyclin-dependent kinases: a biochemical view. The Biochemical Journal, 1995, 308(Pt 3): 697-711. |
| [10] | Hydbring P, Malumbres M, Sicinski P. Non-canonical functions of cell cycle cyclins and cyclin-dependent kinases. Nature Reviews Molecular Cell Biology, 2016, 17(5): 280-292. DOI:10.1038/nrm.2016.27 |
| [11] | Lim S, Kaldis P. Cdks, cyclins and CKIs: roles beyond cell cycle regulation. Development: Cambridge, England, 2013, 140(15): 3079-3093. DOI:10.1242/dev.091744 |
| [12] | Gavet O, Pines J. Progressive activation of CyclinB1-Cdk1 coordinates entry to mitosis. Developmental Cell, 2010, 18(4): 533-543. DOI:10.1016/j.devcel.2010.02.013 |
| [13] | Blissard GW, Rohrmann GF. Baculovirus diversity and molecular biology. Annual Review of Entomology, 1990, 35: 127-155. DOI:10.1146/annurev.en.35.010190.001015 |
| [14] | Ihalainen TO, Laakkonen JP, Paloheimo O, Ylä-Herttuala S, Airenne KJ, Vihinen-Ranta M. Morphological characterization of baculovirus Autographa californica multiple nucleopolyhedrovirus. Virus Research, 2010, 148(1/2): 71-74. |
| [15] | Ma XC, Xu HJ, Tang MJ, Xiao Q, Hong J, Zhang CX. Morphological, phylogenetic and biological characteristics of Ectropis obliqua single-nucleocapsid nucleopolyhedrovirus. Journal of Microbiology: Seoul, Korea, 2006, 44(1): 77-82. |
| [16] | Braunagel SC, Summers MD. Molecular biology of the baculovirus occlusion-derived virus envelope. Current Drug Targets, 2007, 8(10): 1084-1095. DOI:10.2174/138945007782151315 |
| [17] | Rohrmann GF. Baculovirus Molecular Biology. 4th ed. Bethesda (MD), National Center for Biotechnology Information (US), 2019. |
| [18] | Monteiro F, Carinhas N, Carrondo MJT, Bernal V, Alves PM. Toward system-level understanding of baculovirus-host cell interactions: from molecular fundamental studies to large-scale proteomics approaches. Frontiers in Microbiology, 2012, 3: 391. |
| [19] | Pan MH, Hong KL, Chen XY, Pan C, Chen XM, Kuang XX, Lu C. BmCyclin B and BmCyclin B3 are required for cell cycle progression in the silkworm, Bombyx mori. Science China Life Sciences, 2013, 56(4): 360-365. DOI:10.1007/s11427-013-4459-3 |
| [20] | Braunagel SC, Parr R, Belyavskyi M, Summers MD. Autographa californica nucleopolyhedrovirus infection results in Sf9 cell cycle arrest at G2/M phase. Virology, 1998, 244(1): 195-211. DOI:10.1006/viro.1998.9097 |
| [21] | Belyavskyi M, Braunagel SC, Summers MD. The structural protein ODV-EC27 of Autographa californica nucleopolyhedrovirus is a multifunctional viral cyclin. Proceedings of the National Academy of Sciences of the United States of America, 1998, 95(19): 11205-11210. DOI:10.1073/pnas.95.19.11205 |
| [22] | Ikeda M, Kobayashi M. Cell-cycle perturbation in Sf9 cells infected with Autographa californica nucleopolyhedrovirus. Virology, 1999, 258(1): 176-188. DOI:10.1006/viro.1999.9706 |
| [23] | Zhang YH, Wei W, Xu P, Qin Q, Chen J, Chen XZ, Chen XP, Zhao XH. The cell cycle phase affects the potential of cells to replicate Autographa californica multiple nucleopolyhedrovirus. Acta Virologica, 2012, 56(2): 133-137. DOI:10.4149/av_2012_02_133 |
| [24] | Zhou R, Yu ZH, Li XQ, Jia F, Wu JH, Chen XW. Heliocoverpa armigera single nucleocapsid nucleopolyhedrovirus induces Hz-AM1 cell cycle arrest at the G2 phase with accumulation of cyclin B1. Virus Research, 2004, 105(2): 113-120. DOI:10.1016/j.virusres.2004.05.001 |
| [25] | Xiao Q, Dong ZQ, Zhu Y, Zhang Q, Yang X, Xiao M, Chen P, Lu C, Pan MH. Bombyx mori nucleopolyhedrovirus (BmNPV) induces G2/M arrest to promote viral multiplication by depleting BmCDK1. Insects, 2021, 12(12): 1098. DOI:10.3390/insects12121098 |
| [26] | Chen TT, Tan LR, Hu N, Dong ZQ, Hu ZG, Jiang YM, Chen P, Pan MH, Lu C. C-lysozyme contributes to antiviral immunity in Bombyx mori against nucleopolyhedrovirus infection. Journal of Insect Physiology, 2018, 108: 54-60. DOI:10.1016/j.jinsphys.2018.05.005 |
| [27] | 陈向云. BmGem1和BmGem2在家蚕细胞中的功能鉴定. 西南大学博士学位论文, 2015. |
| [28] | Wang GH, Xia QY, Cheng DJ, Duan J, Zhao P, Chen J, Zhu L. Reference genes identified in the silkworm Bombyx mori during metamorphism based on oligonucleotide microarray and confirmed by qRT-PCR. Insect Science, 2008, 15(005): 405-413. DOI:10.1111/j.1744-7917.2008.00227.x |
| [29] | Ludueña RF. Multiple forms of tubulin: different gene products and covalent modifications. International Review of Cytology, 1998, 178: 207-275. |
| [30] | González-Magaña A, Blanco FJ. Human PCNA Structure, function, and interactions. Biomolecules, 2020, 10(4): 570. DOI:10.3390/biom10040570 |
| [31] | Baluchamy S, Gopinathan KP. Characterization of a cyclin homolog from Bombyx mori nucleopolyhedrovirus. Virus Research, 2005, 108(1/2): 69-81. |
| [32] | Ji JY, Crest J, Schubiger G. Genetic interactions between Cdk1-CyclinB and the separase complex in Drosophila. Development: Cambridge, England, 2005, 132(8): 1875-1884. DOI:10.1242/dev.01780 |
| [33] | Terzoudi GI, Jung T, Hain J, Vrouvas J, Margaritis K, Donta-Bakoyianni C, Makropoulos V, Angelakis P, Pantelias GE. Increased G2 chromosomal radiosensitivity in cancer patients: the role of cdk1/cyclin-B activity level in the mechanisms involved. International Journal of Radiation Biology, 2000, 76(5): 607-615. DOI:10.1080/095530000138268 |
| [34] | Davy C, Doorbar J. G2/M cell cycle arrest in the life cycle of viruses. Virology, 2007, 368(2): 219-226. DOI:10.1016/j.virol.2007.05.043 |
| [35] | Deplanche M, Filho RA, Alekseeva L, Ladier E, Jardin J, Henry G, Azevedo V, Miyoshi A, Beraud L, Laurent F, Lina G, Vandenesch F, Steghens JP, Le Loir Y, Otto M, Götz F, Berkova N. Phenol-soluble modulin α induce G2/M phase transition delay in eukaryotic HeLa cells. FASEB journal: official publication of the Federation of American Societies for Experimental Biology, 2015, 29(5): 1950-1959. DOI:10.1096/fj.14-260513 |
| [36] | Kobayashi K, Hatano M, Otaki M, Ogasawara T, Tokuhisa T. Expression of a murine homologue of the inhibitor of apoptosis protein is related to cell proliferation. Proceedings of the National Academy of Sciences of the United States of America, 1999, 96(4): 1457-1462. DOI:10.1073/pnas.96.4.1457 |
| [37] | Srinivasula SM, Ashwell JD. IAPs: What's in a name?. Molecular Cell, 2008, 30(2): 123-135. DOI:10.1016/j.molcel.2008.03.008 |
| [38] | Deveraux QL, Roy N, Stennicke HR, Van Arsdale T, Zhou Q, Srinivasula SM, Alnemri ES, Salvesen GS, Reed JC. IAPs block apoptotic events induced by caspase-8 and cytochrome c by direct inhibition of distinct caspases. The EMBO Journal, 1998, 17(8): 2215-2223. DOI:10.1093/emboj/17.8.2215 |
 2022, Vol. 62
2022, Vol. 62




