
中国科学院微生物研究所,中国微生物学会
文章信息
- 刘芸芸, 许慧鑫, 李名杨, 唐琦, 李国辉. 2023
- LIU Yunyun, XU Huixin, LI Mingyang, TANG Qi, LI Guohui.
- 昆虫抗病毒侵染的分子机制研究进展
- Progress in insect resistance to viral invasion
- 微生物学报, 63(1): 139-155
- Acta Microbiologica Sinica, 63(1): 139-155
-
文章历史
- 收稿日期:2022-05-13
- 网络出版日期:2022-08-25
昆虫是目前地球上种类最多、分布最为广泛的一类生物群体,在整个生态系统中占据着极其重要的地位。由于一些昆虫会给农作物带来严重危害,因此它们被视作农业害虫,如蝗虫(直翅目,蝗科)、粉纹夜蛾(鳞翅目,夜蛾科)、甜菜夜蛾(鳞翅目,夜蛾科)以及白粉虱(同翅目,粉虱科)等。感染了病毒的昆虫行动迟缓,取食量降低,且会导致虫体间发生交叉感染,在一定程度上减少了农作物经济损失,有利于农业生产。相反,另一些昆虫,如家蚕遭受病毒感染后,导致其大量死亡,降低了蚕茧产量,给蚕丝产业造成严重的经济损失。蚊子及其他食血性昆虫作为大量病毒病原体的媒介,给全球带来了严重的生活困扰和经济负担。因此,深入了解昆虫免疫系统对病毒增殖的影响,有助于抗病毒机制的发现。细胞免疫和体液免疫是昆虫体内的2种先天免疫系统,细胞免疫依赖昆虫血细胞来完成对病源微生物的包囊、吞噬及黑化作用,并将其杀死[1];体液免疫主要以凝集素、抗菌肽(antimicrobial peptides, AMPs)、抗病毒因子以及溶菌酶等细胞因子,配合多功能的血细胞建立了一个完整、开放的防御体系[2-3]。此外,当昆虫被多种类型的病原体侵染后,机体会产生不同的免疫效应,以应对外来者入侵者的伤害,分子机制也有所不同[4-5]。
昆虫抵抗病原微生物入侵的途径多、能力强,但抵抗病毒侵染的途径却相对较少。目前,已知昆虫抗病毒侵染的先天免疫反应主要有RNA干扰(RNA interference, RNAi)途径、Toll样受体(Toll-like receptor, TLR)途径、免疫缺陷(immunodeficiency, IMD)途径和Janus激酶-信号转导(Janus kinase-signal transducer and activator of transcription, JAK-STAT)途径[6-9]。RNAi途径作为昆虫抗病毒防御的一种重要机制,在蚊子、黑腹果蝇和家蚕等昆虫体内都发挥重要作用,它们通过该信号途径可敏锐地侦查到病毒入侵,从而激活免疫途径限制病毒的复制[10-11]。Toll和IMD信号途径是免疫系统中的经典信号途径,它们都依赖于NF-B通路发挥作用;Toll途径通常被革兰氏阳性细菌或真菌激活,控制抗真菌多肽的表达[12],在果蝇和蚊子以及家蚕肠道免疫反应中发挥着重要作用[13-15];IMD途径主要对革兰氏阴性细菌做出应激反应,并控制抗菌肽的表达,在果蝇的先天免疫中发挥扮演重要角色[16-17]。JAK-STAT信号通路由多种细胞因子介导,以参与昆虫抗病毒防御和免疫调节等过程,其通路相关蛋白及其功能在真核生物进化中高度保守[18-19]。该途径的激活可诱导多个效应基因的表达,包括配体、受体、转录调节因子(STAT)和胞质酪氨酸蛋白激酶(JAK)等。目前JAK-STAT在昆虫抗病毒防御方面的研究主要集中在果蝇、蚊子和家蚕等模式生物中[9, 18, 20]。
除了天然免疫途径外,昆虫宿主细胞中早期凋亡和DNA损伤反应(DNA damage response, DDR)也被认为是宿主抗病毒策略[21-22]。细胞凋亡是一种自主有序的生理性细胞死亡方式,通过主动清除受损、有害或不再需要的细胞,来维持内环境稳定并抵御外来入侵者[23]。DDR主要通过启动细胞周期停滞,诱导细胞凋亡或衰老,从而有效地抑制病毒增殖,对宿主起到保护作用。在这2种应激反应中,杆状病毒是最早在昆虫中被发现的,能够诱导和抑制宿主细胞凋亡和DDR的一类病毒[24]。本文主要对病毒侵染后,昆虫体内激活的JAK-STAT信号通路和宿主细胞中的DDR抗病毒反应机制进行综述,为深入研究家蚕等经济昆虫抗病毒分子机制提供理论依据。
1 JAK-STAT信号通路JAK-STAT通路是一个高度保守的信号转导系统,可以将胞外信号通过受体-酪氨酸激酶-信号传导和转录激活因子-靶基因的级联信号传递到细胞核中,并引发一系列生物学效应[25-26],在哺乳动物和昆虫发育过程及抗病毒侵染中起重要的作用[9]。下文主要对果蝇、蚊子和家蚕3种昆虫中的JAK-STAT抗病毒途径进行综述。
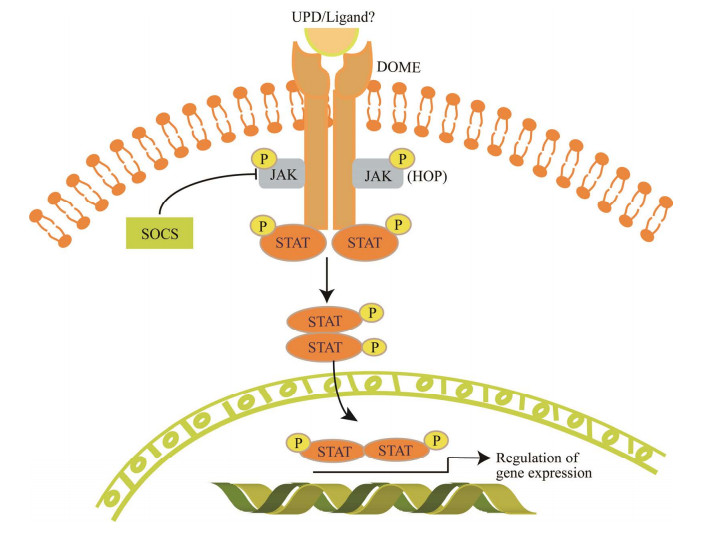
1.1 JAK-STAT信号通路组件和激活机制JAK-STAT通路主要由胞外信号因子(配体)、细胞因子受体、胞质酪氨酸蛋白激酶和转录调控因子4部分组成,广泛参与细胞增殖、分化、凋亡以及免疫调控等过程[19, 27-28]。(1) 生长激素(GH)、白细胞介素(IL)、干扰素(IFN)等都可作为胞外信号因子启动JAK-STAT信号途径,调控细胞的发育、增殖和分化等过程。在果蝇中,已鉴定出胞外配体(unpaired, UPD)[29]。然而,通过生物信息学分析未能在家蚕和蚊子基因组中找到果蝇UPD的同源基因,推测其JAK-STAT信号通路可能由其他未知的配体来介导激活,具体机制还有待深入研究[9]。(2) 受体位于细胞表面、属于单次跨膜蛋白,无同源蛋白,且本身并不具有激酶活性,其胞内段具有与JAK激酶结合的位点,并通过JAK的激活来对靶蛋白的酪氨酸残基进行磷酸化修饰,因此可实现信号从胞外向胞内的传递。多数昆虫的受体为跨膜蛋白Domeless (Dome),是哺乳动物gp130 (IL-6家族细胞因子共用的受体和信号转导子)的直系同源物,与哺乳动物细胞因子Ⅰ类受体(如IL-6受体)存在序列和功能方面的相似性,也具有IL-3受体家族的特征[30]。(3) 酪氨酸蛋白激酶是一类与细胞因子受体相连的Janus酪氨酸激酶(JAK)家族,它们是非跨膜型的酪氨酸激酶,N端结构域与受体结合,C端与激酶结合,其成员包括JAK1、JAK2、JAK3、TYK2。昆虫Janus酪氨酸激酶(hopscotch, Hop)与哺乳动物JAK2的序列极为相似[31]。(4) 调节因子是一类衔接子蛋白,含有一个SH2结构域和一个DNA结合域,即称为信号转导子和转录激活因子(STAT);其中DNA结合域和SH2结构域彼此高度相似,有助于STAT的活化和二聚体的形成。一旦细胞受到刺激,STAT就会发生活化并转入细胞核中[32]。目前已发现7个STAT家族成员[33]。果蝇STAT蛋白称之为STAT92E,与人类STAT5序列高度同源,可参与免疫反应调控过程[34]。细胞因子信号抑制物(SOCS)作为一种JAK-STAT信号通路中的负调控因子,可以抑制JAK或细胞因子受体的活性[35]。
昆虫JAK-STAT通路的激活机制与哺乳动物类似。当昆虫细胞受到外界刺激后,启动JAK-STAT信号途径,胞外信号因子(UPD或未知配体)与质膜受体DOME发生特异性结合,引发受体构象改变并形成同源二聚体,激活HOP,活化的HOP继而磷酸化受体胞内段的酪氨酸残基,使其暴露出具有SH2结构域的STAT的锚定位点;接着STAT利用自身SH2结构域结合到磷酸化的受体上,导致其C端酪氨酸残基被JAK磷酸化,脱离受体,并依靠各自的SH2结构域形成同源或异源二聚体,暴露其核定位信号NLS,最终进入核内与靶基因的DNA启动子序列结合,调控相关基因的表达[9, 27]。这些基因根据组织或细胞环境的差异而对细胞产生不同的影响,包括增殖、分化、迁移、凋亡和细胞存活。当果蝇、蚊子和家蚕等昆虫遭受病毒侵染时,胞内会迅速启动JAK-STAT信号途径调控靶基因的表达,抵抗病毒的侵染并抑制病毒在胞内的增殖,从而在抗病毒侵染中起重要作用[9, 18],JAK-STAT通路激活分子机制如图 1所示。
|
| 图 1 JAK-STAT信号通路模型示意图 Figure 1 Model of JAK-STAT signal pathway involved with expression regulation of target genes. UPD: Extracellular ligands unpaired; DOME: The receptor domeless; JAK: Janus kinase; HOP: Hopscotch; STAT: Janus kinase-signal transducer and activator of transcription; SOCS: Suppressor of cytokine signaling. |
1.2 果蝇JAK-STAT信号通路抗病毒侵染
有研究表明果蝇JAK-STAT通路及其相关调控因子参与了果蝇抗病毒侵染途径[20]。1994年,Binari和Perrimon[36]发现了一个由母体提供的非受体酪氨酸激酶HOP蛋白,属于JAK家族,可参与果蝇胚胎发育过程。HOP是一种分子量为120 kDa的蛋白质,与哺乳动物JAK2存在27%的序列相似性[36]。1996年,Hou等[34]在果蝇上首次确定了无脊椎动物中也存在JAK-STAT信号途径,并发现了一种新的果蝇STAT蛋白(STAT92E),在HOP酪氨酸激酶下游发挥作用,且发现该途径在果蝇基因表达和细胞增殖中也起着重要作用。STAT92E是一种大小为83 kDa的蛋白质,含有一个SH2结构域和一个DNA结合域,与人类STAT5有37%的序列相似性[37]。1998年,Harrison等[38]通过对果蝇的研究发现,在果蝇胚胎发育过程中,UPD可作为JAK-STAT信号通路的配体,激活该途径。UPD是一种分泌蛋白,预测分子量为47 kDa,但在电泳实验结果中显示其实际分子量为65 kDa,推测UPD很可能发生了糖基化修饰[38]。UPD是果蝇JAK-STAT信号通路的配体,目前在脊椎动物中还没有鉴定到它的同源物。在JAK-STAT信号通路中,除了UPD配体之外,后来又鉴定出UPD2和UPD3这2种配体。它们的表达均受多种机制调控,当组织局部受到损伤时,这3种配体都能被诱导激活;UPD2和UPD3这2种配体在病毒感染时也可被诱导激活[29, 39]。2001年,Brown等[30]在果蝇JAK-STAT途径中发现,UPD可诱导跨膜蛋白DOME发出信号。与许多白细胞介素受体一样,DOME具有一个细胞因子结合同源模块(cytokine-binding module, CBM)和细胞外纤维连接蛋白-Ⅲ型结构域(extracellular fibronectin type Ⅲ domain, FnⅢ),且与哺乳动物细胞因子Ⅰ类受体(例如IL-6受体、IL-3受体)在序列和功能方面具有相似性[30]。当受到病原体侵染时,UPD与DOME受体结合,导致HOP的募集和磷酸化,磷酸化的HOP激活下游STAT92E,使其进入到细胞核中,对下游靶基因的表达进行调控,从而影响细胞的增殖、分化和凋亡等过程。
在果蝇JAK-STAT信号通路中,除了UPD、DOME、HOP和STAT92E这4个已被鉴定的主要配体之外,该通路中还包括一些调节因子如eye transformer (ET,又称Latran),其结构类似于DOME受体,不同的是ET有一个较短的细胞质尾巴,且没有STAT92E的结合位点,ET可以与DOME以及HOP发生相互作用,从而抑制胞内的信号转导[40]。负反馈调节因子SOCS36E,类似于哺乳动物的SOCS因子。SOCS36E的中心有一个SH2结构域和一个C末端的SOCS位点,通过竞争性结合JAK或STAT的SH2结构域,诱导其发生泛素化并使其降解,从而影响受体水平[40-41]。
先前相关研究表明,细菌和真菌感染果蝇后,可激活其体液免疫中Toll和IMD这2条信号通路,诱导信号分子AMPs的表达,从而激活下游NF-B转录因子调控免疫反应[5, 16]。果蝇C病毒(drosophila C virus, DCV),是一种二顺反子病毒科的成员,与小核糖核苷酸病毒科有许多共同特征,Dostert等[20]对感染果蝇C病毒的果蝇进一步研究,结果发现,不同于细菌和真菌感染引发的免疫应答,在果蝇胸腔内注射果蝇C病毒混悬液不会导致果蝇血淋巴中AMPs的诱导分泌,但果蝇C病毒感染可触发STAT92E与靶DNA结合,且果蝇C病毒诱导的基因表达调控需要HOP。即除了Toll和IMD先天免疫途径之外,在果蝇体内还存在JAK-STAT第三条信号通路免疫途径,该途径在果蝇体内高度进化保守,在抵抗病毒感染中起重要作用。若JAK-STAT途径未被激活或者激活出现缺陷,将会促进果蝇C病毒在果蝇体内快速增殖,提高果蝇的死亡率,进一步说明JAK-STAT通路在果蝇抗病毒反应中扮演着重要角色。因此,果蝇抗真菌、细菌和病毒的侵染均依赖于Toll、IMD和JAK-STAT这3条信号通路。此外,JAK-STAT信号通路参与果蝇抗病毒免疫的功能,与哺乳动物细胞中干扰素信号转导相关[42],即JAK-STAT通路控制病毒侵染的功能在进化中是保守的。
果蝇中还存在一种名为Vago的小型抗病毒肽,它不依赖于DOME受体,可直接激活JAK-STAT信号通路,限制果蝇C病毒的复制[42]。其Vago基因可编码一个18 kDa的多肽,含有8个保守的半胱氨酸残基[43],但对于Vago如何激活JAK-STAT通路以及在抗病毒免疫反应中的作用仍不清楚,需要进一步探索。Kemp等[44]发现,与野生型果蝇相比,HOP突变型的果蝇更易受果蝇C病毒和蟋蟀麻痹病毒(cricket paralysis virus, CrPV)的感染,即果蝇C病毒感染能诱导细胞因子UPD2和UPD3的表达,激活细胞中JAK-STAT信号通路,触发抗病毒机制。然而,果蝇X病毒(drosophila X virus, DXV)、鸡舍病毒(flock house virus, FHV)和水疱性口炎病毒(vesicular stomatitis virus, VSV)等却没有表现出类似的特性,证明了JAK-STAT途径介导的免疫应答具有病毒侵染的特异性。
1.3 蚊子JAK-STAT信号通路抗病毒侵染蚊子作为虫媒病毒的主要传播者,引发的病毒性疾病给许多国家带来了健康困扰和经济损失[45-46]。其中伊蚊是一些虫媒病毒,如登革热病毒(dengue virus, DENV)、西尼罗河病毒(west nile virus, WNV)、黄热病毒(yellow fever virus, YFV)和寨卡病毒(zika virus, ZIKV)的主要媒介,按蚊是人类疟疾(恶性疟原虫、间日疟原虫和疟疾原虫)的主要媒介,已引起较多传播性疾病[47]。与其他昆虫类似,蚊子也有先天免疫系统,能够抵御各种病原微生物入侵。研究者通过对埃及伊蚊和冈比亚按蚊基因组序列进行分析,发现存在类似果蝇中DOME、HOP和STAT的同源蛋白[48]。1999年,Barillas-Mury等[49]对冈比亚按蚊免疫途径进行研究,发现蚊子中STAT细胞因子可被激活,用来抵抗细菌对蚊子的感染,这也是蚊子中首次被鉴定出来的STAT家族成员参与昆虫免疫反应调控的有力证据。
登革热病毒是一种膜包被的正链RNA病毒,属于黄病毒科,在节肢动物中能引起广泛传播,导致节肢动物发生病毒性疾病[50]。2009年,Souza-Neto等[51]对感染登革热病毒的埃及伊蚊进行研究,发现伊蚊体内的JAK-STAT信号通路被激活。当JAK-STAT途径中的受体DOME和HOP缺失或其表达受到抑制时,可促进登革热病毒对蚊子的感染;当JAK-STAT途径中的负调控因子(protein inhibitor of activated STAT, PIAS)蛋白被沉默时,能增强蚊子对病毒侵染的抵抗力。这些研究结果表明,蚊子体内JAK-STAT信号通路与抗病毒侵染有关。由于蚊子吸入感染登革热病毒的血液后,首先会导致蚊子中肠发生感染,病毒会大量增殖并感染其他组织如气管、脂肪体和唾液腺。在第二次吸血时,蚊子通过这些组织又可将体内的病毒传播给新的宿主[52]。因此,中肠是蚊虫最初暴露在虫媒病毒感染下的组织,也是建立后续免疫反应的关键。2017年,Jupatanakul等[9]对埃及伊蚊免疫途径进行了深入研究,发现JAK-STAT通路具有抗病毒侵染的宿主专一性,即该通路在埃及伊蚊中对登革热病毒有较强的抵抗力,但对另外2种虫媒病毒——寨卡病毒和基孔肯雅尼亚病毒(chikungunya virus, CHIKV)的侵染却没有抵抗力,说明蚊子体内的JAK-STAT信号通路对病毒的侵染具有免疫应答特异性。Vargas等[53]的最新研究表明,在埃及伊蚊幼虫阶段,其免疫激活会提高蚊子成年后对登革热病毒感染的抵抗能力,降低蚊子对虫媒病毒感染的耐受性,即蚊子在成年后期对病原体具有抗性,从而使蚊子更难传播登革热病毒。
Paradkar等[42]在库蚊中也发现了一种分泌肽Vago,与果蝇Vago蛋白同源,是一种类似哺乳动物干扰素的抗病毒细胞因子,通过激活JAK-STAT途径上调病毒感染后STAT依赖的vir-1基因的表达,抑制西尼罗河病毒在库蚊细胞中的增殖。与果蝇类似,Vago激活JAK-STAT信号途径不依赖DOME受体,或许与另一种未知的受体介导有关,其Vago在蚊子抗病毒免疫反应中的具体作用还有待进一步研究。有趣的是,Ahlers等[54]的研究中发现,蚊子在吸血过程中,摄取宿主胰岛素也可激活JAK-STAT途径,从而减少黄病毒科病毒的感染,说明胰岛素信号在昆虫抗病毒反应中发挥了重要作用。此外,Carissimo等[55]的最近研究发现,一种虫媒病毒也可通过按蚊传播,如阿尼昂病毒(alphavirus o՚nyong-nyong, ONNV),这是在按蚊中研究过的唯一虫媒病毒。该病毒侵染也可激活按蚊JAK-STAT途径,并抑制ONNV在宿主中肠中的增殖。综上所述,JAK-STAT通路在蚊子抗病毒途径中起着重要作用。
1.4 家蚕JAK-STAT信号通路抗病毒侵染家蚕核型多角体病毒(Bombyx mori nucleopolyhedrovirus, BmNPV)、家蚕质型多角体病毒(Bombyx mori cypovirus, BmCPV)和家蚕二分浓核病毒(Bombyx mori bidensovirus, BmBDV)都是家蚕的致病病原体,从而导致蚕茧产量降低[56]。其中BmNPV是杆状病毒科的成员,具有环状双链DNA基因组,可侵染家蚕几乎所有组织,是家蚕目前所面临危害性最强的病毒[57]。在BmNPV的复制周期中,有2种不同形式的病毒粒子——出芽型病毒粒子(budded virions, BV)和包埋型病毒粒子(occlusion derived virions, ODV)[58]。在感染过程中,BmNPV首先通过包埋型病毒粒子感染家蚕幼虫中肠细胞,然后通过出芽型病毒粒子感染幼虫其他大部分组织[59-60]。BmN和BmE是家蚕研究中常用的2个细胞系,它们分别来源于家蚕卵巢细胞和胚胎细胞,均可被BmNPV感染,不同于BmCPV和BmBDV;因此,大多数家蚕抗病毒研究集中在BmNPV中[61-62]。目前本实验室已培育出一些家蚕抗性品系,如高抗BmNPV的家蚕新品系NB、华八BC7、华八BC8以及高抗BmBDV家蚕品系798;并从DNA、RNA和蛋白质水平进行了一系列抗性基因筛选工作,但还未鉴定出具有显著抗性功能的基因[63-65]。因此,阐明家蚕抗病毒分子机制有助于新型抗病毒品种的选育及推广应用。此外,本实验室先前相关研究已发现丝氨酸蛋白酶Bm-SP142、V型H+ATP酶(V-ATPase)以及热休克蛋19.9 (Hsp19.9)等均参与了家蚕抗病毒的防御反应[66-68],可抑制病毒的增殖。然而,目前为止,BmNPV或BmBDV感染家蚕的抗性分子机制尚不清楚。因此,深入了解家蚕先天免疫抗病毒机制,为解析BmNPV对不同品系家蚕致病的分子机制提供依据。
据相关文献报道,家蚕先天免疫中JAK-STAT途径也具有一定的抗病毒作用[18]。通过基因组学和生物信息学分析表明,家蚕JAK-STAT信号通路相关因子与黑腹果蝇以及哺乳动物具有高度同源性[69]。在家蚕中发现了多个JAK-STAT信号通路相关基因,包括BmHOP、BmSTAT、BmSOCS2、BmSOCS5、BmSOCS6、BmDRK和BmKen等[70]。细胞因子受体DOME、BmHOP和BmSTAT作为JAK-STAT信号通路的3个主要成员来激活该信号途径,调控靶基因的转录,并诱导昆虫体内发生免疫应答[27]。SOCS和Ken为信号通路的负调控因子,能选择性地调控一些靶基因的表达[71]。下游受体激酶DRK是JAK-STAT信号通路中的正向调控因子,但其作用机制尚不清楚[72]。Liu等[18]的研究证明,BmNPV和BmBDV两种病毒粒子感染家蚕后,导致其中肠中BmSTAT的表达水平显著升高,而被双链RNA病毒BmCPV感染后,BmSTAT基因在中肠的表达水平没有明显变化,表明DNA病毒(BmNPV和BmBDV)侵染后能激活家蚕体内JAK-STAT信号通路,而RNA病毒(BmCPV)感染不能激活该信号通路,即家蚕BmSTAT对不同类型的病毒产生的免疫反应存在差异。Zhang等[73]的研究发现,家蚕黄斑类似病毒(BmMLV)也可诱导BmSTAT的表达量轻微上调,从而激活JAK-STAT信号途径。此外,通过对家蚕抗性品系NB、华八BC8和华八BC7以及敏感性品系306中的JAK-STAT免疫通路进行研究,发现家蚕被BmNPV和BmBDV感染后,细胞因子信号转导抑制因子2 (BmSOCS2)基因在家蚕抗性品系的表达量显著高于感性品系。当BmN细胞中BmSOCS2基因过表达时,细胞对BmNPV的抗性增强,即BmSOCS2基因在抗BmNPV侵染的过程中扮演重要角色[65]。但JAK/STAT信号通路在家蚕抗病毒免疫应答反应中的具体作用还有待进一步探索。
2 DDR信号通路当病毒DNA片段被整合到宿主基因组后,宿主DNA不能恢复到其固有构象,破坏了局部染色质结构,导致宿主单链断裂(SSBs)和DNA双链断裂(DSBs),影响基因组的复制和转录,最终导致受感染细胞的生长停滞或死亡,严重威胁生物个体的生存[74]。为对抗DNA损伤带来的威胁,细胞进化出DDR机制来实时检测胞内损伤的DNA,通过启动细胞周期停滞、阻止突变DNA的复制,进而对损伤的DNA进行修复;如果损伤严重,就会触发细胞凋亡或者衰老,对宿主起到保护作用。简单地说,至少在某种程度上,这可能是一种抗病毒反应,可直接用于对抗病原体感染[75]。面对不同类型的损伤,真核生物的DNA修复机制主要有4种类型:碱基切除修复(BER)、错配修复(MMR)、核苷酸切除修复(NER)和双链断裂修复(DSBR)[76-79]。核苷酸切除修复可切除大片段的DNA损伤、碱基切除修复可修复个别碱基的损伤、错配修复主要用于修复错配的碱基[80-81]。这些修复可能会涉及DNA合成、染色质重塑等过程。通过对果蝇基因组分析表明,碱基切除修复、核苷酸切除修复以及双链断裂修复途径及其组分在哺乳动物和果蝇中都是保守的[82]。
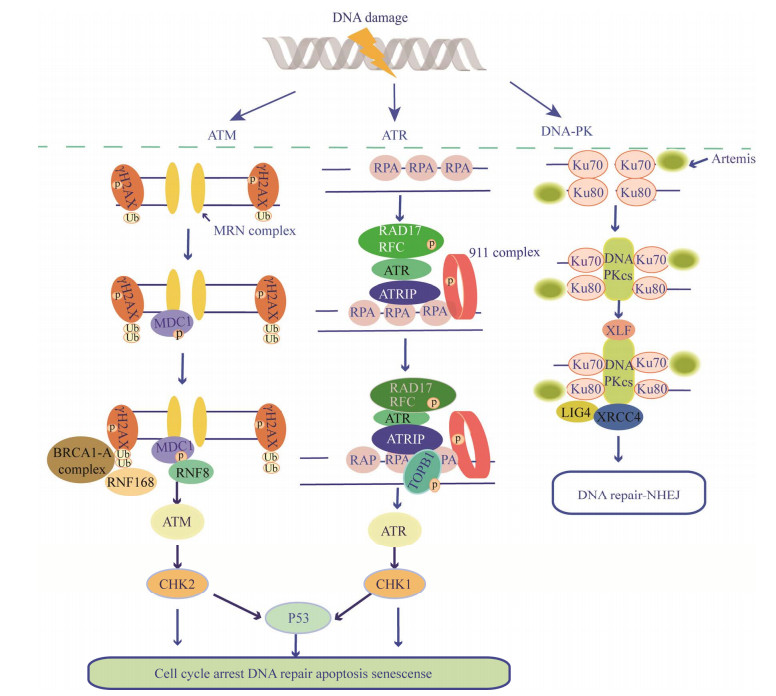
2.1 DDR途径的组件和激活机制DDR信号通路主要包括DNA损伤感受器、信号转导和效应蛋白,由磷脂酰肌醇-3激酶相关家族蛋白激酶(phosphoinositide 3-kinase related kinases, PIKKs)启动的毛细血管扩张性共济失调症突变激酶(ataxia telangiectasia-mutated, ATM)、Rad3相关激酶(ataxia telangiectasia and Rad3-related, ATR)以及DNA依赖性蛋白激酶(DNA-dependent protein kinase, DNA-PK) 3种信号分子进行调控(图 2);其中ATM和DNA-PK主要对DNA的双链断裂做出反应,而ATR主要对单链断裂做出应激反应[83-84]。转录因子p53是该反应重要底物之一,它调节这3个过程中众多基因的表达,并在DNA修复或者在损伤严重的情况下诱导细胞凋亡,从而对细胞毒性做出应激反应[85-87]。组蛋白H2A变异体(histone family 2A variant, H2AX)是DDR的关键调节因子,γH2AX是DNA损伤标志,负责识别损伤位点[88]。细胞周期节点激酶CHK1和CHK2分别作用于ATM和ATR的下游,促进DDR发生[89-90]。Song等[91]对黑腹果蝇的研究表明,DNA损伤反应中包括ATM、ATR和p53的作用,在昆虫和哺乳动物中有许多相似之处。
|
| 图 2 ATM、ATR和DNA-PK信号通路示意图 Figure 2 Signal pathway of ATM, ATR and DNA-PK involved with DNA damage response. ATM: Ataxia telangiectasia-mutated; ATR: Ataxia telangiectasia and Rad3-relate; DNA-PK: DNA-dependent protein kinase; MRN complex: Mre11, Rad50, Nbs1 complex; H2AX: Histone family 2A variant; MDC1: Mediator of DNA damage checkpoint1; BRCA1-A: Breast cancer gene 1-A; RNF168: E3 ubiquitin ligases; Chk1, Chk2: Cell cycle checkpoint kinase; RPA: replication protein A; ATRIP: ATR-interacting protein; 911 complex: Rad9-Rad1-Hus1 complex; TopBP1: Topoisomerase Ⅱ β-binding protein 1; Ku70-Ku80: Hetero-dimer complex; Artemis: Exonuclease; TopBP1: Topoisomerase Ⅱ Exonuclease; DNA-PKcs: DNA-dependent protein kinase catalytic subunit; XLF: XRCC4 like factor; XRCC4: X-ray cross complementing 4; LIG4: Ligase Ⅳ. |
DNA双链发生断裂时,MRN复合物(MRE11-RAD50-NBS1)首先识别损伤部位,随后γH2AX和DNA损伤检测点介导子1 (mediator of DNA damage checkpoint1, MDC1)产生一个信号平台来招募额外的修复因子,包括E3泛素连接酶RNF8和RNF168,其中RNF8负责组蛋白H2AX的初始泛素化,然后E3泛素连接酶RNF168在进行多泛素化,这种泛素化修饰有助于乳腺癌1号基因(breast cancer gene 1-A, BRCA1-A)复合物招募到损伤位点,并激活Chk2和p53来调节细胞周期检查点,造成细胞周期阻滞,从而诱导DNA修复或细胞凋亡[92-95]。
而DNA单链断裂发生后,复制蛋白A (replicationprotein A, RPA)首先将断裂部位保护起来,随后911复合物(Rad9-Rad1-Hus1 complex)、ATR以及ATR结合蛋白(ATR-interacting protein, ATRIP)被招募到DNA损伤位点处识别RPA包裹的单链DNA,激活ATR并招募DNA拓扑异构酶Ⅱβ结合蛋白1 (TopBP1)。激活的ATR能够活化其底物蛋白Chk1、p53和H2AX等,最终造成细胞周期阻滞,从而诱导DNA修复或凋亡[84, 96]。
DNA-PK主要通过非同源末端连接来组织修复,当发生双链断裂发生后,Ku异二聚复合体(Ku70-Ku80 hetero-dimer complex)蛋白识别断裂部位,形成环状结构,保护DNA末端以免DNA酶降解,并招募DNA依赖蛋白激酶催化亚基(DNA-dependent protein kinase catalytic subunit, DNA-PKcs),在DNA双链断裂末端形成多蛋白复合物,相互作用并对齐断裂部位,激活核酸内切酶Artemis,帮助处理断裂的末端,并形成具有招募作用的平台,最终招募X射线交叉互补基因4样因子(XRCC4 like factor, XLF)、X射线交叉互补基因4 (X-ray cross complementing 4, XRCC4)和DNA连接酶Ⅳ (ligase Ⅳ, LIG4)使断裂的末端重连从而完成双链的修复[83, 97]。总之,当DNA病毒入侵宿主细胞后,ATM、ATR以及DNA-PK途径被激活,触发宿主DDR发生,一些效应蛋白如Chk1、Chk2、p53和H2AX等蛋白也聚集于损伤位点,发生一系列磷酸化,随后其他一些宿主因子也被招募,并介导DNA修复、放大DDR信号,导致细胞周期停滞、DNA修复或凋亡(图 2)。
2.2 昆虫DDR抗病毒侵染病毒可通过多种机制改变宿主细胞的环境,损害其细胞功能,促进病毒自身传播,最终诱导宿主发病。宿主细胞也拥有一些内在的途径,如DDR,可以对抗病毒感染。DDR能够检测进入或复制的病毒DNA,并激活有效的抗病毒防御机制[98]。然而,某些DNA病毒,如哺乳动物乳头瘤病毒以及一些昆虫杆状病毒,通过激活宿主DDR来提高病毒增殖效率,并促进宿主发病机制[22, 99]。因此,病毒与宿主DDR之间存在复杂的相互作用。
目前有关DDR抗病毒的研究大多集中在人类病毒方面,如单纯疱疹病毒(HSV-1)、腺病毒(Ad)和人类乳头瘤病毒(HPV)中,在昆虫病毒中的研究相对较少[100-102]。Huang等[22]的研究发现,杆状病毒苜蓿银纹夜蛾核型多角体病毒(AcMNPV)感染Sf9细胞系(源自鳞翅目草地贪夜蛾细胞),可导致草地贪夜蛾P53蛋白(S.frugiperda P53 protein, SfP53)的表达和γH2AX上调,即病毒DNA的复制刺激了DDR的发生;然而,当DDR中ATM和ATR信号受到抑制时,SfP53积累和H2AX磷酸化减少,也降低了子代病毒的产量,同时病毒DNA复制以及晚期基因表达也降低,这表明该病毒的有效复制又依赖于DDR。DDR如同一把双刃剑,在有效抑制病毒增殖的同时,又被病毒进化出的机制操纵以实现病毒最佳复制和增殖。Mitchell等[103]研究报道LEF-7是一种核蛋白,能与宿主S期相关蛋白1 (Skp1)发生相互作用,Skp1是Skp1/cullin/F-box (SCF)复合体的一个组成部分,它介导靶蛋白的选择性泛素化,而杆状病毒AcMNPV可通过LEF-7来劫持宿主DDR,即在病毒DNA复制高峰期间,LEF-7利用靶向的多泛素化选择性操纵一种或多种宿主DDR因子,包括γH2AX的功能来促进病毒的复制和增殖。若敲除AcMNPV基因组中的Lef-7基因,将会导致病毒DNA合成过程中γH2AX累积,抑制病毒晚期基因表达和子代病毒粒子的产生。表明Lef-7对于杆状病毒的有效复制是必不可少的。在α-杆状病毒中,所有的Ⅰ型和部分Ⅱ型杆状病毒及至少2种β-杆状病毒中都发现了Lef-7同源物,该序列的保守性表明Lef-7在病毒增殖过程中具有重要作用[104]。因此,若敲除杆状病毒中复制因子LEF-7,或者构建可拮抗LEF-7功能的转基因昆虫,或许可抑制病毒对宿主DDR的调控作用,减少病毒的增殖并提高昆虫的存活率。然而,目前DDR在病毒生活周期中的具体作用机制仍不甚清楚,因此,在后续研究中有待进一步去探索其中的奥秘。
3 结语与展望昆虫抗病毒免疫机制的研究不仅有助于一些病毒逃逸机制的阐明,也可为经济昆虫抗病毒品种的分子培育奠定基础。在本文中,我们主要对JAK-STAT和DDR在昆虫中抗病毒分子机制进行了综述。昆虫JAK-STAT信号途径具有进化保守性,与哺乳动物的干扰素系统在功能方面相近,可抑制病毒的增殖并阻断病毒的传播[42, 105];且对不同类型的病毒产生的免疫反应存在差异,如BmNPV和BmBDV侵染可激活家蚕体内JAK-STAT信号通路,导致BmSTAT基因表达水平显著上调;而BmCPV感染不能激活该信号通路[18]。此外,JAK-STAT途径介导的免疫反应还具有病毒特异性,如埃及伊蚊中该通路激活对登革热病毒的侵染有较强的抵抗力,而对另外2种虫媒病毒——寨卡病毒和基孔肯雅尼亚病毒的侵染却没有抵抗力;即JAK-STAT通路与不同病毒之间可能存在不同的作用,从而使得该途径在昆虫抗病毒入侵中的功能多样化。然而,JAK-STAT在抗病毒中的具体作用机制尚不清楚,未来还有待深入挖掘。DDR受PIKKs途径中的3种功能相关蛋白激酶ATM、ATR和DNA-PK调控,用于保护细胞基因组免受点突变、缺失、插入或其他形式引起的损害,在一定程度上可抑制病毒的增殖[106-107]。目前对DDR抗病毒相关研究主要集中在人类病毒,如腺病毒、疱疹病毒和乳头瘤病毒中[101, 108-109],在昆虫抗病毒中的研究较少,未来值得进一步探索。
虽然昆虫体内存在一些抗病毒防御机制[20, 106, 110],但仍有一些病毒能够逃逸宿主对病毒的监控,从而有利于病毒自身的复制和增殖[100, 103]。近年来有关转基因和RNA干扰方面研究促进了人们对昆虫先天免疫分子机制的了解,但目前对于与昆虫免疫调控具体机制及相关基因的功能仍不清楚。因此,关于昆虫抗病毒机制及昆虫与病毒之间的相互作用仍有待深入研究。未来或许我们可以从以下几个方面展开一些相关研究:(1) 使用抑制剂靶向作用于这些被病毒劫持的途径,揭示病毒的逃逸分子机制,为抗病毒策略的研发提供新思路;(2) 利用RNA干扰技术或基因编辑技术,深入挖掘特定基因的功能,明确其所属的免疫信号通路,揭示各基因在抗病毒免疫中的具体作用,阐明昆虫抗病毒免疫反应的分子机制;(3) 对果蝇、家蚕和蚊子等模式昆虫的基因组进行测序和分析,进一步探究具有抗病毒功能的基因以及新的昆虫抗病毒途径。总之,聚焦昆虫抗病毒研究是一个非常有科学意义的研究工作,不仅有可能发现新的抗病毒分子机制,也为一些具有抗病毒能力的经济昆虫如家蚕和蜜蜂的分子培育提供理论基础,为经济昆虫的生物繁衍保驾护航,也可进一步利用抗病毒分子机制为造福人类健康提供理论依据。
| [1] | HILLYER JF. Insect immunology and hematopoiesis. Developmental & Comparative Immunology, 2016, 58: 102-118. |
| [2] |
ZHANG HL, ZHOU ZX. Research progress of innate immunity of Lepidoptera insects. Biological Disaster Science, 2016, 39(2): 136-138.
(in Chinese) 张海玲, 周正湘. 鳞翅目昆虫的先天免疫研究进展. 生物灾害科学, 2016, 39(2): 136-138. DOI:10.3969/j.issn.2095-3704.2016.02.028 |
| [3] | WEN YY, HE Z, XU T, JIAO Y, LIU XS, WANG YF, YU XQ. Ingestion of killed bacteria activates antimicrobial peptide genes in Drosophila melanogaster and protects flies from septic infection. Developmental & Comparative Immunology, 2019, 95: 10-18. |
| [4] | KLEINO A, SILVERMAN N. Regulation of the Drosophila imd pathway by signaling amyloids. Insect Biochemistry and Molecular Biology, 2019, 108: 16-23. DOI:10.1016/j.ibmb.2019.03.003 |
| [5] | TANJI T, HU XD, WEBER ANR, IP YT. Toll and IMD pathways synergistically activate an innate immune response in Drosophila melanogaster. Molecular and Cellular Biology, 2007, 27(12): 4578-4588. DOI:10.1128/MCB.01814-06 |
| [6] | ZHANG LQ, XU W, GAO XL, LI WJ, QI SS, GUO DY, AJAYI OE, DING SW, WU QF. lncRNA sensing of a viral suppressor of RNAi activates non-canonical innate immune signaling in Drosophila. Cell Host & Microbe, 2020, 27(1): 115-128.e8. |
| [7] | NISHIDE Y, KAGEYAMA D, YOKOI K, JOURAKU A, TANAKA H, FUTAHASHI R, FUKATSU T. Functional crosstalk across IMD and Toll pathways: insight into the evolution of incomplete immune cascades. Proceedings Biological Sciences, 2019, 286(1897): 20182207. |
| [8] | TRAMMELL CE, GOODMAN AG. Emerging mechanisms of insulin-mediated antiviral immunity in Drosophila melanogaster. Frontiers in Immunology, 2019, 10: 2973. DOI:10.3389/fimmu.2019.02973 |
| [9] | JUPATANAKUL N, SIM S, ANGLERÓ-RODRÍGUEZ YI, SOUZA-NETO J, DAS S, POTI KE, ROSSI SL, BERGREN N, VASILAKIS N, DIMOPOULOS G. Engineered Aedes aegypti JAK/STAT pathway-mediated immunity to dengue virus. PLoS Neglected Tropical Diseases, 2017, 11(1): e0005187. DOI:10.1371/journal.pntd.0005187 |
| [10] | MARQUES JT, IMLER JL. The diversity of insect antiviral immunity: insights from viruses. Current Opinion in Microbiology, 2016, 32: 71-76. DOI:10.1016/j.mib.2016.05.002 |
| [11] | BRONKHORST AW, van RIJ RP. The long and short of antiviral defense: small RNA-based immunity in insects. Current Opinion in Virology, 2014, 7: 19-28. DOI:10.1016/j.coviro.2014.03.010 |
| [12] | HUANG CQ, XU R, LIÉGEOIS S, CHEN D, LI Z, FERRANDON D. Differential requirements for mediator complex subunits in Drosophila melanogaster host defense against fungal and bacterial pathogens. Frontiers in Immunology, 2021, 11: 478958. DOI:10.3389/fimmu.2020.478958 |
| [13] | LI ZJ, WU CX, DING X, LI WZ, XUE L. Toll signaling promotes JNK-dependent apoptosis in Drosophila. Cell Division, 2020, 15: 7. DOI:10.1186/s13008-020-00062-5 |
| [14] | ANGLERÓ-RODRÍGUEZ YI, TIKHE CV, KANG S, DIMOPOULOS G. Aedes aegypti Toll pathway is induced through dsRNA sensing in endosomes. Developmental & Comparative Immunology, 2021, 122: 104138. |
| [15] | YU B, SANG Q, PAN GQ, LI CF, ZHOU ZY. A toll-spätzle pathway in the immune response of Bombyx mori. Insects, 2020, 11(9): 586. DOI:10.3390/insects11090586 |
| [16] | MYLLYMäKI H, VALANNE S, RäMET M. The DrosophilaImd signaling pathway. The Journal of Immunology, 2014, 192(8): 3455-3462. DOI:10.4049/jimmunol.1303309 |
| [17] | LAMIABLE O, KELLENBERGER C, KEMP C, TROXLER L, PELTE N, BOUTROS M, MARQUES JT, DAEFFLER L, HOFFMANN JA, ROUSSEL A, IMLER JL. Cytokine Diedel and a viral homologue suppress the IMD pathway in Drosophila. Proceedings of the National Academy of Sciences of the United States of America, 2016, 113(3): 698-703. DOI:10.1073/pnas.1516122113 |
| [18] | LIU W, LIU JB, LU YH, GONG YC, ZHU M, CHEN F, LIANG Z, ZHU LY, KUANG SL, HU XL, CAO GL, XUE RY, GONG CL. Immune signaling pathways activated in response to different pathogenic micro-organisms in Bombyx mori. Molecular Immunology, 2015, 65(2): 391-397. DOI:10.1016/j.molimm.2015.02.018 |
| [19] | KINGSOLVER MB, HUANG ZJ, HARDY RW. Insect antiviral innate immunity: pathways, effectors, and connections. Journal of Molecular Biology, 2013, 425(24): 4921-4936. DOI:10.1016/j.jmb.2013.10.006 |
| [20] | DOSTERT C, JOUANGUY E, IRVING P, TROXLER L, GALIANA-ARNOUX D, HETRU C, HOFFMANN JA, IMLER JL. The Jak-STAT signaling pathway is required but not sufficient for the antiviral response of drosophila. Nature Immunology, 2005, 6(9): 946-953. DOI:10.1038/ni1237 |
| [21] | WU Y, WU YJ, HUI T, WU HL, WU Y, WANG WB. Reaper homologue IBM1 in silkworm Bombyx mori induces apoptosis upon baculovirus infection. FEBS Letters, 2013, 587(6): 600-606. DOI:10.1016/j.febslet.2013.01.072 |
| [22] | HUANG N, WU WB, YANG K, PASSARELLI AL, ROHRMANN GF, CLEM RJ. Baculovirus infection induces a DNA damage response that is required for efficient viral replication. Journal of Virology, 2011, 85(23): 12547-12556. DOI:10.1128/JVI.05766-11 |
| [23] | FADEEL B, ORRENIUS S. Apoptosis: a basic biological phenomenon with wide-ranging implications in human disease. Journal of Internal Medicine, 2005, 258(6): 479-517. DOI:10.1111/j.1365-2796.2005.01570.x |
| [24] | BRYANT B, CLEM RJ. Caspase inhibitor P35 is required for the production of robust baculovirus virions in Trichoplusia ni TN-368 cells. The Journal of General Virology, 2009, 90(Pt 3): 654-661. |
| [25] | MILKMAN R. The genetic basis of natural variation in drosophila melanogaster. Advances in Genetics, 1970, 15(1): 55-114. |
| [26] | DARNELL JE Jr, KERR IM, STARK GR. JAK-STAT pathways and transcriptional activation in response to IFNs and other extracellular signaling proteins. Science, 1994, 264(5164): 1415-1421. DOI:10.1126/science.8197455 |
| [27] | HOMBRı́A JCG, BROWN S. The fertile field of Drosophila JAK/STAT signalling. Current Biology, 2002, 12(16): R569-R575. DOI:10.1016/S0960-9822(02)01057-6 |
| [28] | STARK GR, DARNELL JE Jr. The JAK-STAT pathway at twenty. Immunity, 2012, 36(4): 503-514. DOI:10.1016/j.immuni.2012.03.013 |
| [29] | WRIGHT VM, VOGT KL, SMYTHE E, ZEIDLER MP. Differential activities of the Drosophila JAK/STAT pathway ligands Upd, Upd2 and Upd3. Cellular Signalling, 2011, 23(5): 920-927. DOI:10.1016/j.cellsig.2011.01.020 |
| [30] | BROWN S, HU N, HOMBRı́A JCG. Identification of the first invertebrate interleukin JAK/STAT receptor, the Drosophila gene domeless. Current Biology, 2001, 11(21): 1700-1705. DOI:10.1016/S0960-9822(01)00524-3 |
| [31] | MAURYA B, SURABHI S, DAS R, PANDEY P, MUKHERJEE A, MUTSUDDI M. Maheshvara regulates JAK/STAT signaling by interacting and stabilizing hopscotch transcripts which leads to apoptosis in Drosophila melanogaster. Cell Death & Disease, 2021, 12: 363. |
| [32] | DUAN ML, DU XM, REN G, ZHANG YD, ZHENG Y, SUN SP, ZHANG J. Obovatol inhibits the growth and aggressiveness of tongue squamous cell carcinoma through regulation of the EGF-mediated JAK-STAT signaling pathway. Molecular Medicine Reports, 2018, 18(2): 1651-1659. |
| [33] | DARNELL JE Jr. STATs and gene regulation. Science, 1997, 277(5332): 1630-1635. DOI:10.1126/science.277.5332.1630 |
| [34] | HOU XS, MELNICK MB, PERRIMON N. Marelle acts downstream of the Drosophila HOP/JAK kinase and encodes a protein similar to the mammalian STATs. Cell, 1996, 84(3): 411-419. DOI:10.1016/S0092-8674(00)81286-6 |
| [35] | LIAU NPD, LAKTYUSHIN A, LUCET IS, MURPHY JM, YAO SG, WHITLOCK E, CALLAGHAN K, NICOLA NA, KERSHAW NJ, BABON JJ. The molecular basis of JAK/STAT inhibition by SOCS1. Nature Communications, 2018, 9: 1558. DOI:10.1038/s41467-018-04013-1 |
| [36] | BINARI R, PERRIMON N. Stripe-specific regulation of pair-rule genes by hopscotch, a putative Jak family tyrosine kinase in Drosophila. Genes & Development, 1994, 8(3): 300-312. |
| [37] | YAN RQ, SMALL S, DESPLAN C, DEAROLF CR, DARNELL JE Jr. Identification of a stat gene that functions in Drosophila development. Cell, 1996, 84(3): 421-430. DOI:10.1016/S0092-8674(00)81287-8 |
| [38] | HARRISON DA, MCCOON PE, BINARI R, GILMAN M, PERRIMON N. Drosophila unpaired encodes a secreted protein that activates the JAK signaling pathway. Genes & Development, 1998, 12(20): 3252-3263. |
| [39] | HOMBRÍA JCG, BROWN S, HäDER S, ZEIDLER MP. Characterisation of Upd2, a Drosophila JAK/STAT pathway ligand. Developmental Biology, 2005, 288(2): 420-433. DOI:10.1016/j.ydbio.2005.09.040 |
| [40] | FISHER KH, STEC W, BROWN S, ZEIDLER MP. Mechanisms of JAK/STAT pathway negative regulation by the short coreceptor Eye Transformer/Latran. Molecular Biology of the Cell, 2016, 27(3): 434-441. DOI:10.1091/mbc.e15-07-0546 |
| [41] | MONAHAN AJ, STARZ-GAIANO M. Socs36E limits STAT signaling via Cullin2 and a SOCS-box independent mechanism in the Drosophila egg chamber. Mechanisms of Development, 2015, 138: 313-327. DOI:10.1016/j.mod.2015.08.003 |
| [42] | PARADKAR PN, TRINIDAD L, VOYSEY R, DUCHEMIN JB, WALKER PJ. Secreted Vago restricts West Nile virus infection in Culex mosquito cells by activating the Jak-STAT pathway. Proceedings of the National Academy of Sciences of the United States of America, 2012, 109(46): 18915-18920. DOI:10.1073/pnas.1205231109 |
| [43] | DEDDOUCHE S, MATT N, BUDD A, MUELLER S, KEMP C, GALIANA-ARNOUX D, DOSTERT C, ANTONIEWSKI C, HOFFMANN JA, IMLER JL. The DExD/H-box helicase Dicer-2 mediates the induction of antiviral activity in drosophila. Nature Immunology, 2008, 9(12): 1425-1432. DOI:10.1038/ni.1664 |
| [44] | KEMP C, MUELLER S, GOTO A, BARBIER V, PARO S, BONNAY F, DOSTERT C, TROXLER L, HETRU C, MEIGNIN C, PFEFFER S, HOFFMANN JA, IMLER JL. Broad RNA interference-mediated antiviral immunity and virus-specific inducible responses in Drosophila. Journal of Immunology: Baltimore, Md: 1950, 2013, 190(2): 650-658. |
| [45] | KRAEMER MUG, REINER RC JR, BRADY OJ, MESSINA JP, GILBERT M, PIGOTT DM, YI DD, JOHNSON K, EARL L, MARCZAK LB, SHIRUDE S, WEAVER ND, BISANZIO D, PERKINS TA, LAI SJ, LU X, JONES P, COELHO GE, CARVALHO RG, van BORTEL W, et al. Golding N. Past and future spread of the arbovirus vectors Aedes aegypti and Aedes albopictus[J]. Nature Microbiology, 2019, 4(5): 854-863. |
| [46] | CHANG C, ORTIZ K, ANSARI A, GERSHWIN ME. The Zika outbreak of the 21st century. Journal of Autoimmunity, 2016, 68: 1-13. DOI:10.1016/j.jaut.2016.02.006 |
| [47] | POWELL JR. Mosquito-borne human viral diseases: why Aedes aegypti?. The American Journal of Tropical Medicine and Hygiene, 2018, 98(6): 1563-1565. DOI:10.4269/ajtmh.17-0866 |
| [48] | WATERHOUSE RM, KRIVENTSEVA EV, MEISTER S, XI ZY, ALVAREZ KS, BARTHOLOMAY LC, BARILLAS-MURY C, BIAN GW, BLANDIN S, CHRISTENSEN BM, DONG YM, JIANG HB, KANOST MR, KOUTSOS AC, LEVASHINA EA, LI JY, LIGOXYGAKIS P, MACCALLUM RM, MAYHEW GF, MENDES A, et al. Evolutionary dynamics of immune-related genes and pathways in disease-vector mosquitoes. Science, 2007, 316(5832): 1738-1743. DOI:10.1126/science.1139862 |
| [49] | BARILLAS-MURY C, HAN YS, SEELEY D, KAFATOS FC. Anopheles gambiae Ag-STAT, a new insect member of the STAT family, is activated in response to bacterial infection. The EMBO Journal, 1999, 18(4): 959-967. DOI:10.1093/emboj/18.4.959 |
| [50] | ROY SK, BHATTACHARJEE S. Dengue virus: epidemiology, biology, and disease aetiology. Canadian Journal of Microbiology, 2021, 67(10): 687-702. DOI:10.1139/cjm-2020-0572 |
| [51] | SOUZA-NETO JA, SIM S, DIMOPOULOS G. An evolutionary conserved function of the JAK-STAT pathway in anti-dengue defense. Proceedings of the National Academy of Sciences of the United States of America, 2009, 106(42): 17841-17846. DOI:10.1073/pnas.0905006106 |
| [52] | RAQUIN V, LAMBRECHTS L. Dengue virus replicates and accumulates in Aedes aegypti salivary glands. Virology, 2017, 507: 75-81. DOI:10.1016/j.virol.2017.04.009 |
| [53] | VARGAS V, CIME-CASTILLO J, LANZ-MENDOZA H. Immune priming with inactive dengue virus during the larval stage of Aedes aegypti protects against the infection in adult mosquitoes. Scientific Reports, 2020, 10: 6723. DOI:10.1038/s41598-020-63402-z |
| [54] | AHLERS LRH, TRAMMELL CE, CARRELL GF, MACKINNON S, TORREVILLAS BK, CHOW CY, LUCKHART S, GOODMAN AG. Insulin potentiates JAK/STAT signaling to broadly inhibit Flavivirus replication in insect vectors. Cell Reports, 2019, 29(7): 1946-1960.e5. DOI:10.1016/j.celrep.2019.10.029 |
| [55] | CARISSIMO G, PONDEVILLE E, MCFARLANE M, DIETRICH I, MITRI C, BISCHOFF E, ANTONIEWSKI C, BOURGOUIN C, FAILLOUX AB, KOHL A, VERNICK KD. Antiviral immunity of Anopheles gambiae is highly compartmentalized, with distinct roles for RNA interference and gut microbiota. Proceedings of the National Academy of Sciences of the United States of America, 2015, 112(2): E176-85. |
| [56] | JIANG L, XIA QY. The progress and future of enhancing antiviral capacity by transgenic technology in the silkworm Bombyx mori. Insect Biochemistry and Molecular Biology, 2014, 48: 1-7. DOI:10.1016/j.ibmb.2014.02.003 |
| [57] | JIANG L, WANG GH, CHENG TC, YANG Q, JIN SK, LU G, WU FQ, XIAO Y, XU HF, XIA QY. Resistance to Bombyx mori nucleopolyhedrovirus via overexpression of an endogenous antiviral gene in transgenic silkworms. Archives of Virology, 2012, 157(7): 1323-1328. DOI:10.1007/s00705-012-1309-8 |
| [58] | BLISSARD GW, Theilmann DA. Baculovirus entry and egress from insect cells. Annual Review of Virology, 2018, 5(1): 113-139. DOI:10.1146/annurev-virology-092917-043356 |
| [59] | QIN FJ, XU CR, LEI CF, HU J, SUN XL. Autographa californica multiple nucleopolyhedrovirus enters host cells via clathrin-mediated endocytosis and direct fusion with the plasma membrane. Viruses, 2018, 10(11): 632. DOI:10.3390/v10110632 |
| [60] | SAJJAN DB, HINCHIGERI SB. Structural organization of baculovirus occlusion bodies and protective role of multilayered polyhedron envelope protein. Food and Environmental Virology, 2016, 8(1): 86-100. DOI:10.1007/s12560-016-9227-7 |
| [61] | JIANG L, CHENG TC, ZHAO P, YANG Q, WANG GH, JIN SK, LIN P, XIAO Y, XIA QY. Resistance to BmNPV via overexpression of an exogenous gene controlled by an inducible promoter and enhancer in transgenic silkworm, Bombyx mori. PLoS One, 2012, 7(8): e41838. DOI:10.1371/journal.pone.0041838 |
| [62] | CHEN SQ, HOU CX, BI HL, WANG YQ, XU J, LI MW, JAMES AA, HUANG YP, TAN AJ. Transgenic clustered regularly interspaced short palindromic repeat/Cas9-mediated viral gene targeting for antiviral therapy of Bombyx mori nucleopolyhedrovirus. Journal of Virology, 2017, 91(8): e02465-16. |
| [63] | ZHOU Y, GAO L, SHI HF, XIA HC, GAO L, LIAN CQ, CHEN L, YAO Q, CHEN KP, LIU XY. Microarray analysis of gene expression profile in resistant and susceptible Bombyx mori strains reveals resistance-related genes to nucleopolyhedrovirus. Genomics, 2013, 101(4): 256-262. DOI:10.1016/j.ygeno.2013.02.004 |
| [64] | CHEN HQ, YAO Q, BAO F, CHEN KP, LIU XY, LI J, WANG L. Comparative proteome analysis of silkworm in its susceptibility and resistance responses to Bombyx mori densonucleosis virus. Intervirology, 2012, 55(1): 21-28. DOI:10.1159/000322381 |
| [65] |
KONG M. Response of silkworm immune signal pathway against BmNPV and BmBDV infection[D]. Zhenjiang: Master's Thesis of Jiangsu University, 2018 (in Chinese). 孔鸣. 家蚕免疫信号通路对BmNPV和BmBDV两种病毒感染的应答[D]. 镇江: 江苏大学硕士学位论文, 2018. |
| [66] | WU YL, CHEN JF, JIANG LY, WU XL, LIU YH, GAO CJ, WU Y, YI XQ, SU ZR, CAI J, CHEN JN, et al. The extract of Sonneratia apetala leaves and branches ameliorates hyperuricemia in mice by regulating renal uric acid transporters and suppressing the activation of the JAK/STAT signaling pathway. Frontiers in Pharmacology, 2021, 12: 698219. DOI:10.3389/fphar.2021.698219 |
| [67] | LI GH, ZHOU Q, QIU LP, YAO Q, CHEN KP, TANG Q, HU ZY. Serine protease Bm-SP142 was differentially expressed in resistant and susceptible Bombyx mori strains, involving in the defence response to viral infection. PLoS One, 2017, 12(4): e0175518. DOI:10.1371/journal.pone.0175518 |
| [68] | LÜ P, XIA HC, GAO L, PAN Y, WANG Y, CHENG X, LÜ H, LIN F, CHEN L, YAO Q. V-ATPase is involved in silkworm defense response against Bombyx mori nucleopolyhedrovirus. PLoS One, 2013, 8(6): e64962. DOI:10.1371/journal.pone.0064962 |
| [69] | LI JH, XIA F, LI WX. Coactivation of STAT and Ras is required for germ cell proliferation and invasive migration in Drosophila. Developmental Cell, 2003, 5(5): 787-798. DOI:10.1016/S1534-5807(03)00328-9 |
| [70] | WU S, ZHANG XF, CHEN XM, CAO PS, BEERNTSEN BT, LING EJ. BmToll9, an Arthropod conservative Toll, is likely involved in the local gut immune response in the silkworm, Bombyx mori. Developmental & Comparative Immunology, 2010, 34(2): 93-96. |
| [71] | ARBOUZOVA NI, ZEIDLER MP. JAK/STAT signalling in Drosophila: insights into conserved regulatory and cellular functions. Development: Cambridge, England, 2006, 133(14): 2605-2616. DOI:10.1242/dev.02411 |
| [72] | GENG T, LV DD, HUANG YX, HOU CX, QIN GX, GUO XJ. JAK/STAT signaling pathway-mediated immune response in silkworm (Bombyx mori) challenged by Beauveria bassiana. Gene, 2016, 595(1): 69-76. DOI:10.1016/j.gene.2016.09.043 |
| [73] | ZHANG XL, GUO R, KUMAR D, MA HY, LIU JB, HU XL, CAO GL, XUE RY, GONG CL. Identification, gene expression and immune function of the novel Bm-STAT gene in virus-infected Bombyx mori. Gene, 2016, 577(1): 82-88. DOI:10.1016/j.gene.2015.11.027 |
| [74] | STETSON DB, MEDZHITOV R. Recognition of cytosolic DNA activates an IRF3-dependent innate immune response. Immunity, 2006, 24(1): 93-103. DOI:10.1016/j.immuni.2005.12.003 |
| [75] | TURNELL AS, GRAND RJ. DNA viruses and the cellular DNA-damage response. The Journal of General Virology, 2012, 93(Pt 10): 2076-2097. |
| [76] | YANG YY, HU JC, SELBY CP, LI WT, YIMIT A, JIANG YC, SANCAR A. Single-nucleotide resolution analysis of nucleotide excision repair of ribosomal DNA in humans and mice. Journal of Biological Chemistry, 2019, 294(1): 210-217. DOI:10.1074/jbc.RA118.006121 |
| [77] | STRATIGOPOULOU M, DAM TPV, GUIKEMA JEJ. Base excision repair in the immune system: small DNA lesions with big consequences. Frontiers in Immunology, 2020, 11: 1084. |
| [78] | SUZUKI O, YAMAGUCHI T, FUKUCHI M, MOCHIKI E, ARAI T, AKAGI K, ISHIDA H. Prediction model for gastric cancer with DNA mismatch repair deficiency. Anticancer Research, 2021, 41(2): 975-982. DOI:10.21873/anticanres.14851 |
| [79] | RANJHA L, HOWARD SM, CEJKA P. Main steps in DNA double-strand break repair: an introduction to homologous recombination and related processes. Chromosoma, 2018, 127(2): 187-214. |
| [80] | SCULLY R, PANDAY A, ELANGO R, WILLIS NA. DNA double-strand break repair-pathway choice in somatic mammalian cells. Nature Reviews Molecular Cell Biology, 2019, 20(11): 698-714. |
| [81] | AL-ZAIN AM, SYMINGTON LS. The dark side of homology-directed repair. DNA Repair, 2021, 106: 103181. |
| [82] | SEKELSKY J. DNA repair in drosophila: Mutagens, models, and missing genes. Genetics, 2017, 205(2): 471-490. |
| [83] | HUANG TH, SHEN ZJ, SLECKMAN BP, TYLER JK. The histone chaperone ASF1 regulates the activation of ATM and DNA-PKcs in response to DNA double-strand breaks. Cell Cycle, 2018, 17(12): 1413-1424. |
| [84] | MA M, RODRIGUEZ A, SUGIMOTO K. Activation of ATR-related protein kinase upon DNA damage recognition. Current Genetics, 2020, 66(2): 327-333. |
| [85] | RAGU S, MATOS-RODRIGUES G, LOPEZ BS. Replication stress, DNA damage, inflammatory cytokines and innate immune response. Genes, 2020, 11(4): 409. |
| [86] | WATERMAN DP, HABER JE, SMOLKA MB. Checkpoint responses to DNA double-strand breaks. Annual Review of Biochemistry, 2020, 89: 103-133. |
| [87] | WILLIAMS AB, SCHUMACHER B. p53 in the DNA-damage-repair process. Cold Spring Harbor Perspectives in Medicine, 2016, 6(5): a026070. |
| [88] | JOHANSSON P, FASTH A, EK T, HAMMARSTEN O. Validation of a flow cytometry-based detection of γ-H2AX, to measure DNA damage for clinical applications. Cytometry Part B: Clinical Cytometry, 2017, 92(6): 534-540. |
| [89] | ZANNINI L, DELIA D, BUSCEMI G. CHK2 kinase in the DNA damage response and beyond. Journal of Molecular Cell Biology, 2014, 6(6): 442-457. |
| [90] | RUNDLE S, BRADBURY A, DREW Y, CURTIN NJ. Targeting the ATR-CHK1 axis in cancer therapy. Cancers, 2017, 9(5): 41. |
| [91] | SONG YH. Drosophila melanogaster: a model for the study of DNA damage checkpoint response. Molecules and Cells, 2005, 19(2): 167-179. |
| [92] | LEE JH, PAULL TT. Direct activation of the ATM protein kinase by the Mre11/Rad50/Nbs1 complex. Science, 2004, 304(5667): 93-96. |
| [93] | LEE JH, PARK SJ, HARIHARASUDHAN G, KIM MJ, JUNG SM, JEONG SY, CHANG IY, KIM C, KIM E, YU J. Author Correction: ID3 regulates the MDC1-mediated DNA damage response in order to maintain genome stability. Nature Communications, 2018, 9: 2284. |
| [94] | NOWSHEEN S, LOU ZK. Calling RNF168 to action. Cell Stress, 2018, 2(5): 113-114. |
| [95] | SANTOS JC, GAMBELONI RZ, ROQUE AT, OECK S, RIBEIRO ML. Epigenetic mechanisms of ATM activation after Helicobacter pylori infection. The American Journal of Pathology, 2018, 188(2): 329-335. |
| [96] | LEWIS CW, JIN ZG, MACDONALD D, WEI WY, QIAN XJ, CHOI WS, HE RC, SUN XJ, CHAN G. Prolonged mitotic arrest induced by Wee1 inhibition sensitizes breast cancer cells to paclitaxel. Oncotarget, 2017, 8(43): 73705-73722. |
| [97] | YANG HT, YAO F, MARTI TM, SCHMID RA, PENG RW. Beyond DNA repair: DNA-PKcs in tumor metastasis, metabolism and immunity. Cancers, 2020, 12(11): 3389. |
| [98] | WEITZMAN MD, LILLEY CE, CHAURUSHIYA MS. Genomes in conflict: maintaining genome integrity during virus infection. Annual Review of Microbiology, 2010, 64: 61-81. |
| [99] | MOODY CA, LAIMINS LA. Human papillomaviruses activate the ATM DNA damage pathway for viral genome amplification upon differentiation. PLoS Pathogens, 2009, 5(10): e1000605. |
| [100] | BRESTOVITSKY A, NEBENZAHL-SHARON K, KECHKER P, SHARF R, KLEINBERGER T. The adenovirus E4orf4 protein provides a novel mechanism for inhibition of the DNA damage response. PLoS Pathogens, 2016, 12(2): e1005420. |
| [101] | MERTENS ME, KNIPE DM. Herpes simplex virus 1 manipulates host cell antiviral and proviral DNA damage responses. mBio, 2021, 12(1): e03552-20. |
| [102] | LUO Y, HONG SY. The role of Ataxia telangiectasia mutant and Rad3-related DNA damage response in pathogenesis of human papillomavirus. Pathogens: Basel, Switzerland, 2020, 9(6): 506. |
| [103] | MITCHELL JK, BYERS NM, FRIESEN PD. Baculovirus F-box protein LEF-7 modifies the host DNA damage response to enhance virus multiplication. Journal of Virology, 2013, 87(23): 12592-12599. |
| [104] | BLISSARD GW, ROHRMANN GF. Baculovirus diversity and molecular biology. Annual Review of Entomology, 1990, 35: 127-155. |
| [105] | HORVATH CM, DARNELL JE JR. The state of the STATs: recent developments in the study of signal transduction to the nucleus. Current Opinion in Cell Biology, 1997, 9(2): 233-239. |
| [106] | GOLDSTEIN M, KASTAN MB. The DNA damage response: Implications for tumor responses to radiation and chemotherapy. Annual Review of Medicine, 2015, 66: 129-143. |
| [107] | BARTEK J, LUKAS J. Mammalian G1- and S-phase checkpoints in response to DNA damage. Current Opinion in Cell Biology, 2001, 13(6): 738-747. |
| [108] | STRACKER TH, CARSON CT, WEITZMAN MD. Adenovirus oncoproteins inactivate the Mre11-Rad50-NBS1 DNA repair complex. Nature, 2002, 418(6895): 348-352. |
| [109] | ANACKER DC, GAUTAM D, GILLESPIE KA, CHAPPELL WH, MOODY CA. Productive replication of human papillomavirus 31 requires DNA repair factor Nbs1. Journal of Virology, 2014, 88(15): 8528-8544. |
| [110] | HUANG L, DONG ZQ, DONG FF, YU XB, HU ZG, LIAO NC, CHEN P, LU C, PAN MH. Gene editing the BmNPV inhibitor of apoptosis protein 2 (iap2) as an antiviral strategy in transgenic silkworm. International Journal of Biological Macromolecules, 2021, 166: 529-537. |
 2023, Vol. 63
2023, Vol. 63




