
中国科学院微生物研究所,中国微生物学会
文章信息
- 林若钦, 张颖, 李婧怡, 梁馨文, 程健恒, 胡文艳, 吴清平, 陈谋通, 张菊梅. 2023
- LIN Ruoqin, ZHANG Ying, LI Jingyi, LIANG Xinwen, CHENG Jianheng, HU Wenyan, WU Qingping, CHEN Moutong, ZHANG Jumei.
- 发酵乳杆菌CSC-19胞外粗多糖提取物抑制单核细胞增生李斯特菌生物被膜形成能力的研究
- Extracellular crude polysaccharide of Limosilactobacillus fermentum CSC-19 inhibits the biofilm formation of Listeria monocytogenes
- 微生物学报, 63(1): 376-386
- Acta Microbiologica Sinica, 63(1): 376-386
-
文章历史
- 收稿日期:2022-05-06
- 网络出版日期:2022-08-04
2. 广东省科学院微生物研究所 华南应用微生物国家重点实验室 广东省微生物安全与健康重点实验室 农业农村部农业微生物组学与精准应用重点实验室,广东 广州 510070
2. Key Laboratory of Agricultural Microbiomics and Precision Application, Ministry of Agriculture and Rural Affairs, Guangdong Provincial Key Laboratory of Microbial Safety and Health, State Key Laboratory of Applied Microbiology Southern China, Institute of Microbiology, Guangdong Academy of Sciences, Guangzhou 510070, Guangdong, China
单核细胞增生李斯特菌(Listeria monocytogenes, LM)是一种重要的革兰氏阳性无芽孢食源性致病菌,广泛存在于食品、土壤、水体、饲料、粪便等环境中。“粪-口”是LM的主要传播途径,可引起脑膜炎、败血症、流产等临床症状[1]。虽然其发病率较低但致死率高达20%−30%,被世界卫生组织(World Health Organization, WHO)列为全球四大食源性致病菌之一[2]。
生物被膜(biofilm)通常是指细菌分泌胞外聚合物将其包裹并形成一定结构的细胞集合体,能帮助细菌抵制不利的外界因素[3-4]。前期研究表明,生物被膜是导致LM持续污染食品生产过程的主要因素之一[5]。生物被膜的形成增加了LM对环境胁迫的抵抗力和在食品加工生产环境中持续污染的风险,能使LM在食品加工环境中下持续存在数月[6-7]。LM不仅可在不同材质(不锈钢、玻璃、聚苯乙烯等)表面形成生物被膜,在低温下也具备形成生物被膜的能力[8]。食品加工设备不卫生和场所设计不合理,将导致日常的清洁和消毒难以彻底清除LM,而早期的清洁和消毒的杀灭效果最佳,一旦错过最佳时期将会极大增加清除的难度[9]。
近年来,乳酸菌及其代谢产物因功能多样而备受关注。乳酸菌代谢产物(有机酸、细菌素、胞外多糖等)可以改善发酵食品风味、增加营养、延长保质期等,被广泛应用于食品工业[10]。其中,因胞外多糖(extracellular polysaccharide, EPS)具备抗菌、抗氧化、抗肿瘤和免疫调节等作用,逐渐受到研究者的青睐[11-12]。目前,乳酸菌胞外多糖的研究大多聚焦在益生作用方面,鲜有抑制生物被膜形成活性方面的研究报道。本研究旨在筛选具有抑制LM生物被膜形成作用的乳酸菌菌株,并对其活性物质及抑制作用进行探究,为寻找高效防控生物被膜污染的食品级材料提供数据基础。
1 材料与方法 1.1 主要材料和仪器 1.1.1 菌株来源实验所用LM菌株为本实验室前期从食品样品中分离所得,详细信息如表 1所示,均已进行多位点序列分型(multilocus sequence typing),分别代表 7种不同序列型(sequence types, STs)和克隆复合群(clonal complexes, CCs)。乳酸菌菌株来源信息如表 2所示,通过基质辅助激光解吸电离飞行时间质谱仪(microflexTM LT/SH MALDI-TOF system)鉴定其种属。
| Strains | Species | Sources |
| SG-10 | Lactobacillus plantarum | Agaricus blazei |
| SG-22 | Lactobacillus plantarum | Agaricus blazei |
| YD-9 | Lactobacillus plantarum | Flammulina velutipes |
| YD-19 | Lactobacillus plantarum | Humus-rich soil |
| FS-18 | Lactobacillus plantarum | Humus-rich soil |
| FS-35 | Lactobacillus plantarum | Humus-rich soil |
| CSC-6 | Lactobacillus plantarum | Sour bamboo shoot |
| CSC-19 | Limosilactobacillus fermentum | Pickled cowpea |
| CSC-56 | Lactobacillus pentosus | Fermented black beans |
| 63-4 | Lactobacillus plantarum | Rice noodle rolls |
| CD7-3 | Lactobacillus plantarum | Pickled chicken feet |
| CD8-4 | Lactobacillus plantarum | Pickled radish |
| CD9-5 | Lactobacillus plantarum | Pickled radish |
| CD10-2 | Lactobacillus plantarum | Pickled cabbage |
| CD11-1 | Lactobacillus plantarum | Pickled cauliflower |
| CD12-1 | Lactobacillus plantarum | Pickled radish |
| CD13-5 | Lactobacillus plantarum | Pickled potato |
1.1.2 主要试剂
TSB肉汤、MRS肉汤、95%乙醇、无水乙醇、PBS缓冲液、0.22 μm针式过滤器购自广东环凯微生物科技有限公司;结晶紫染料、NaOH、苯酚购自广州化学试剂厂;蛋白酶K购自生工生物工程(上海)股份有限公司;胃蛋白酶购自Sigma公司;胰蛋白酶、木瓜蛋白酶购自上海麦克林生化科技有限公司;三氯乙酸、HCl、浓硫酸购自上海国药集团化学试剂有限公司;96孔板购自Costar公司;8 000−14 000 Da透析袋购自上海吉至生化科技有限公司;细胞爬片(Φ=8 mm, Φ=14 mm)购自上海卧宏生物科技有限公司;pH试纸(pH 5.5−9.0)购自上海三爱思试剂有限公司;LIVE/DEAD BacLightTM细菌活力检测试剂盒购自英潍捷基(上海)贸易有限公司;Bradford蛋白浓度测定试剂盒(产品编号:P0006)购自上海碧云天生物技术有限公司。
1.1.3 主要仪器全自动酶标仪,伯腾仪器有限公司;全波长酶标仪,Thermo, Multiskan Sky;冷冻离心机,Beckman Coulter公司(Avanti J-26S XP);台式冻干机,Labconco Free Zone, 6L);扫描电子显微镜,Hitachi, S-3000N);激光共聚焦扫描显微镜,ZEISS公司,LSM700);小型高速冷冻离心机,Beckman Coulter, Microfuge 20R);生化培养箱,广东环凯微生物科技有限公司,SHP-250)、电热恒温鼓风干燥箱,广东环凯微生物科技有限公司,DHG-9076A);旋转蒸发器,上海亚荣生化仪器厂,RE-6000);台式pH计,Mettler-Toledo, SevenCompact);电热恒温水浴锅,广东环凯微生物科技有限公司,DK-S22)。
1.2 乳酸菌无菌发酵上清液的制备将17株乳酸菌分别接种于MRS平板37 ℃培养得到单菌落,挑取单菌落接种至10 mL MRS肉汤中37 ℃静置培养过夜,接着按2% (体积分数)接种量接至MRS肉汤中继续培养48 h,4 ℃、13 000×g离心10 min取上清,用0.22 μm滤菌器过滤除菌,得到无菌发酵上清(CFS),最后用5 moL/L NaOH调节pH至6.5,得到中和发酵上清(N-CFS)后,4 ℃保存备用。
1.3 抑制生物被膜形成菌株筛选及活性物质探究 1.3.1 菌株筛选选取强成膜能力菌株1516-2LM作为筛选具有抑制生物被膜作用乳酸菌的指示菌株。采用结晶紫染色法测定生物被膜形成量[15-16]:挑取1516-2LM单菌落接种至10 mL TSB肉汤中,37 ℃培养过夜至OD600值为0.6,按1% (体积分数)接种量接至TSB肉汤,吸取100 μL 1516-2LM稀释液加入96孔板中,再加入100 μL N-CFS或同等体积的TSB作为实验组和阴性对照组中,空白对照组加入100 μL MRS肉汤和100 μL TSB肉汤,37 ℃静置培养24 h。去除浮游菌并用PBS 200 μL清洗3次,拍干后放入65 ℃烘箱烘干固定1 h,随后加入150 μL 0.1% (质量体积分数)的结晶紫溶液(crystal violet, CV),37 ℃静置30 min,再用蒸馏水充分清洗未附着的CV,最后加入200 μL 95%乙醇4 ℃静置20 min,充分溶解结合在生物被膜上的CV,在595 nm处测定吸光度。每组设置6个平行。N-CFS对LM生物被膜形成的抑制率按照公式(1)计算。

|
公式(1) |
将发酵乳杆菌CSC-19的N-CFS在100 ℃下分别处理10、20、30、40、50、60 min,以未经热处理的MRS肉汤和N-CFS作为阴性对照组和阳性对照组,空白对照组加入100 μL MRS肉汤和100 μL TSB肉汤,按照1.3.1的方法测定抑制生物被膜形成活性(实验3次生物学重复)。
1.3.3 蛋白酶处理对发酵液抑制生物被膜形成活性的影响用5 mol/L的HCl将发酵乳杆菌CSC-19的CFS的pH分别调整为3.0、6.0、8.0、8.0,依次加入终浓度为1.0 mg/mL的胃蛋白酶(pH 3.0)、木瓜蛋白酶(pH 6.0)、胰蛋白酶(pH 8.0)和蛋白酶K (pH 8.0),37 ℃恒温水浴2 h,沸水浴10 min使蛋白酶失活;再将pH调整为6.5,以未经蛋白酶处理的MRS肉汤和N-CFS作为阴性对照组和阳性对照组,空白对照组加入100 μL MRS肉汤和100 μL TSB肉汤,按照1.3.1的方法测定生物被膜抑制活性(实验3次生物学重复)。
1.3.4 胞外粗多糖的制备参考Jiang等[17]报道的方法并稍作修改,将CFS旋蒸浓缩至原体积的1/3,加入终浓度为10% (质量体积分数)的三氯乙酸4 ℃静置过夜以沉淀蛋白,然后4 ℃、13 000×g离心15 min取上清,缓慢加入3倍体积的冷无水乙醇,4 ℃静置24 h以沉淀多糖,再4 ℃、13 000×g离心15 min收集沉淀,用适量蒸馏水复溶,最后用8−14 kDa透析袋透析48 h (4 ℃,每8 h换一次水),真空冷冻干燥,获得胞外粗多糖(extracellular crude polysaccharide, ECP)提取物样品。
1.3.5 总糖含量、蛋白质含量的测定以葡萄糖为标准,采用苯酚-硫酸法测定ECP中的总糖含量,按Huang等[18]的方法稍加修改进行测定。蛋白含量的测定根据Bradford蛋白浓度测定试剂盒(Bradford Protein Assay Kit)使用说明进行。
1.3.6 ECP对生物被膜形成和细菌生长的作用配制含ECP终质量浓度为31.25、62.5 μg/mL和0.125、0.25、0.5、1.0 mg/mL的TSB肉汤。挑取1516-2LM单菌落至10 mL TSB肉汤中,37 ℃过夜培养至OD600为0.6;然后按1% (体积分数)接种量分别加入含不同浓度ECP的TSB肉汤作为初始培养液,200 μL/孔的体积加入96孔板中,以200 μL TSB肉汤为空白对照组,采用结晶紫染色法测定生物被膜的形成量。同时,按照相同的方法测定7株LM菌株(1516-2LM、1132-3LM、3718-1LM、2919-1LM、819-3LM、869-1LM、948-1LM)在1.0 mg/mL ECP作用下生物被膜的形成量(实验3次生物学重复)。
取含有1.0 mg/mL ECP的1516-2LM初始培养液200 μL加入96孔板中,以不含ECP的TSB肉汤作为阴性对照,使用全波长酶标仪测定24 h生长曲线,分析ECP对LM生长的影响。
1.4 ECP抑制生物被膜形成的表征 1.4.1 激光共聚焦扫描显微镜采用激光共聚焦扫描显微镜(laser confocal scanning microscopy, LCSM)观察LM生物被膜形成情况。参照Wang等[19]的方法并略作修改,挑取1516-2LM单菌落于10 mL TSB肉汤中培养过夜至OD600为0.6,按1% (体积分数)接种量分别加入含0.25 mg/mL和0.125 mg/mL ECP的TSB肉汤作为初始培养液,先将无菌细胞爬片(Φ=14 mm)放入24孔板中,再加入1.5 mL初始培养液,37 ℃培养24 h。去除上清液,用PBS清洗爬片3次并转移至新的24孔板,分别吸取7.2 μL SYTO 9染液和7.2 μL PI染液于4.8 mL PBS中形成混合染液,并取800 μL混合染液加入24孔板中,室温避光染色25 min,最后用PBS洗去多余染料,利用激光共聚焦扫描显微镜观察并采集生物被膜图像。
1.4.2 扫描电子显微镜采用扫描电子显微镜(scanning electron microscopy, SEM)观察LM生物被膜形成情况:参照朱洪日[20]的方法并做相应修改,细胞爬片选用(Φ=8 mm),按照1.4.1的方法培养生物被膜。首先去除浮游菌,用PBS清洗爬片3次并转移至新的24孔板,2.5%戊二醛4 ℃固定过夜,然后用PBS间隔清洗细胞爬片6次,再用不同浓度的乙醇(30%、50%、70%、90%、100%)进行梯度脱水,最后经叔丁醇置换后进行冷冻干燥、喷金,在扫描电子显微镜下观察生物被膜的细胞形态和结构。
1.5 数据分析试验数据采用GraphPad Prism 8.0.1、IBM SPSS STATISTICS 22和Excel 2016进行统计分析和图标制作,多组间比较用单因素方差分析,P≤0.05表示差异具有统计学意义。
2 结果与分析 2.1 抑制生物被膜形成乳酸菌的筛选本研究以强成膜能力的菌株1516-2LM作为指示菌进行具有抑制生物被膜形成活性的乳酸菌初筛,通过结晶紫染色法测定17株乳酸菌N-CFS的生物被膜抑制能力,结果所有乳酸菌均表现出一定的生物被膜抑制活性(图 1)。其中以发酵乳杆菌CSC-19的抑制效果最为显著(81.7%),其余16株乳酸菌对生物被膜的抑制率为16.7%−62.9%。因此,选择发酵乳杆菌CSC-19作为研究对象进行下一步研究。
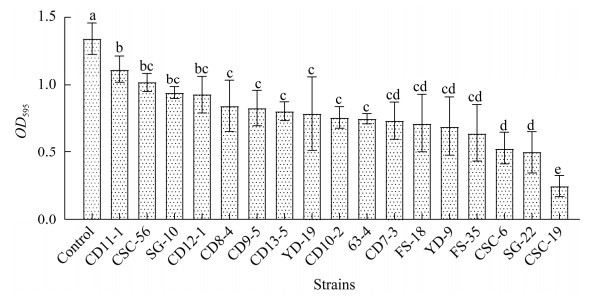
|
| 图 1 乳酸菌N-CFS对菌株1516-2LM生物被膜的抑制作用 Figure 1 The inhibition of the N-CFS of lactic acid bacteria on the biofilm formation of strain 1516-2LM. Values with different lowercase letters mean significant difference (P≤0.05), while with the same lowercase letters mean no significant difference (P > 0.05). |
2.2 抑制生物被膜形成活性物质的性质分析
发酵乳杆菌CSC-19菌株的N-CFS在经过100 ℃处理1 h后,与未经热处理的N-CFS相比,抑制生物被膜作用没有发生显著变化(P > 0.05),表明高温无法使N-CFS中的抑制生物被膜活性物质失去作用,该活性物质具有良好的热稳定性(图 2A)。如图 2B所示,经过1.0 mg/mL的胃蛋白酶、胰蛋白酶、蛋白酶K和木瓜蛋白酶处理后发现,与加入MRS肉汤的对照组相比,酶处理后的N-CFS仍具有显著的生物被膜抑制活性(P≤0.05);与未经酶处理的N-CFS对照组相比,酶处理后N-CFS的生物被膜抑制活性没有发生显著变化(P > 0.05),说明蛋白酶处理无法使抑制生物被膜活性物质失活,表明N-CFS中的活性成分可能不属于蛋白质类物质。

|
| 图 2 热处理(A)和蛋白酶处理(B)对N-CFS抑制生物被膜形成活性的影响 Figure 2 Effects of heat treatment (A) and protease treatment (B) on anti-biofilm activity of N-CFS. Values with different lowercase letters mean significant difference (P≤0.05), while with the same lowercase letters mean no significant difference (P > 0.05). |
2.3 ECP多糖含量及蛋白含量测定
在ECP总糖含量的测定中,葡萄糖标准曲线回归方程为y=4.869 1x+0.060 8,R2=0.995 9,具有良好的线性关系,测得总糖含量为68.6%。在蛋白含量测定中,蛋白标准曲线为y=0.478 9x+0.563 4,R2=0.993 9,具有良好的线性关系,测得蛋白含量为0.3%,说明ECP中不含或只含有极少量的蛋白质。
2.4 ECP对生物被膜形成和细菌生长的作用结果如图 3所示,提取发酵乳杆菌CSC-19的ECP进行冻干定量分析,用不同浓度的ECP抑制LM生物被膜的形成。结果发现,62.5 μg/mL的ECP就能显著抑制生物被膜的形成(P≤0.05),随着ECP浓度的增加,抑制作用也随之增强,说明ECP对生物被膜的抑制作用具有浓度依赖性。发酵乳杆菌CSC-19 ECP对7株不同ST型的LM菌株生物被膜的形成均具有抑制作用,在1.0 mg/mL ECP的作用下,生物被膜的形成均受到极显著的抑制(P≤0.000 1),说明ECP抑制LM生物被膜形成具有广谱性(图 4A)。如图 4B所示,根据1.0 mg/mL ECP对菌株1516-2LM生长曲线的影响分析可知,在开始10 h内,实验组和对照组都由停滞期到对数生长期末期,在培养10 h后,对照组的OD值出现下降趋势,可能是由于菌体在96孔板底部聚集,形成生物被膜所致。16 h后实验组OD值开始高于对照组,表明ECP可能对LM的生长有一定的促进作用。综上所述,ECP并不抑制菌株1516-2LM的生长,说明ECP不是通过抑制生长而影响生物被膜的形成。

|
| 图 3 不同浓度ECP对菌株1516-2LM生物被膜形成的抑制效果 Figure 3 Inhibitory effect of ECP at different concentrations on strain 1516-2LM biofilm. Values with different lowercase letters mean significant difference (P≤0.05), while with the same lowercase letters mean no significant difference (P > 0.05). [l3] |

|
| 图 4 ECP对不同ST型单增李斯特菌生物被膜形成及菌株1516LM生长的影响 Figure 4 Effects of ECP on biofilm formation of different Listeria monocytogenes STs isolates (A) and on the growth of strain 1516LM (B). *: P≤0.05; **: P≤0.01; ***: P≤0.001; ****: P≤0.000 1. [t4] |
2.5 激光共聚焦扫描显微镜和扫描电子显微镜观察结果
通过激光共聚焦扫描显微镜观察对比ECP干预前后生物被膜的变化,生物被膜细胞经PI/SYTO 9染色后,活细胞呈绿色,死细胞呈红色。在对照组中,LM生物被膜结构致密,表现出蜂窝状结构,大部分为活菌。经ECP处理后生物被膜数量明显减少,结构变得稀疏,死菌的数量明显增加,ECP浓度越高,变化越明显(图 5A)。LM在扫描电镜下呈短杆状或球杆状,对照组出现堆状的微菌落,细菌在细胞爬片上的数量明显多于实验组。在0.125 mg/mL ECP作用下,附着在细胞爬片上的细菌数量明显减少,呈单一分布,在0.25 mg/mL ECP的作用下,在玻璃爬片上只能观察到零星分布的LM,这一结果与激光共聚焦扫描显微镜观察的结果一致(图 5B)。以上结果表明,ECP对LM生物被膜的形成具有抑制作用且与浓度相关。

|
| 图 5 激光共聚焦扫描电子显微镜(A)和扫描电子显微镜(B)观察ECP作用下生物被膜的变化 Figure 5 The effects of ECP on the changes of biofilm formation characterized by confocal laser scanning microscopy (A) and scanning electron microscopy (B). [林5] |
3 讨论与结论
许多细菌能够形成复杂结构的生物被膜抵抗外界压力,对细菌的生存有重要意义。近年来,细菌耐受消毒剂、抗生素的问题愈发严重,而生物被膜能为细菌抵抗逆性环境提供良好的保护屏障,加剧了问题的严重性[21]。已有研究表明,部分乳酸菌分泌的胞外多糖具有抑制生物被膜形成的作用。宋莹龙等[22-23]发现一株L. plantarum-12的胞外多糖粗提物在2 mg/mL浓度下对Shigella flexneri生物被膜的抑制率达到了53.77%,通过进一步分离纯化,得到了两种有效抑制生物被膜形成的胞外多糖组分。此外,Kim等[24]发现L. acidophilus A4产生了能够抑制大肠杆菌生物膜形成的胞外多糖,在1 mg/mL浓度下,肠出血性大肠杆菌在聚苯乙烯和聚氯乙烯表面上的生物被膜分别减少87%和94%,说明乳酸菌可以产生有效抑制生物膜形成活性的胞外多糖。
本研究通过对17株乳酸菌CFS进行酸中和(排除有机酸对细菌生长和生物被膜形成的影响)后发现,所有N-CFS均对LM生物被膜的形成能力有不同程度的抑制作用;其中发酵乳杆菌CSC-19的N-CFS抑制率为81.7%,抑制效果最佳。采用热处理(100 ℃)和蛋白酶处理后N-CFS的抑制生物被膜的活性没有显著变化,表明其中的活性物质对蛋白酶和热处理不敏感,推测其中的活性成分可能为多糖类物质[25]。故进一步采用乙醇沉淀法对胞外多糖进行粗提取,同时测定其抑制生物被膜形成能力,发现ECP能有效抑制生物被膜形成且具有浓度依赖性。在ECP中总糖含量为68.6%,略高于丁莉[26]所提取的胞外粗多糖中的总糖含量(63.4%),胞外多糖粗提物中的总糖含量可能因菌株和提取方法的不同而有较大的差异。而ECP中蛋白含量只有0.3%,表明蛋白并非是ECP起到主要作用的活性物质。为研究在ECP作用下生物被膜形态的具体变化,通过激光共聚焦扫描显微镜和扫描电子显微镜表征生物被膜形成能力,结果发现ECP处理后附着在爬片上的细菌数量减少,结构松散,说明ECP抑制了LM生物被膜的形成,该结果与Jiang等[17]的研究结果一致。目前研究报道的大多数抑制生物被膜形成物质均具有一定抑菌活性,为验证ECP是否通过抑制LM的生长抑制生物被膜的形成,探究了在1.0 mg/mL ECP作用下LM生长曲线的变化,结果表明LM生长不但没有受到抑制,反而有轻微的促生长作用,可能是LM可以降解加入的ECP为细菌的生长提供额外的碳源,从而促进细菌生长。该结果表明ECP并非通过抑菌作用对生物被膜产生抑制,这一结果和刘姝灵等[27]的研究结果相似。研究还发现ECP对不同ST型LM的生物被膜形成具有抑制活性,能抑制不同成膜能力的菌株形成生物被膜,表明发酵乳杆菌CSC-19的ECP抑制LM生物被膜形成具有广谱性。ECP可能是通过降低LM的自聚集和细胞表面疏水性抑制细菌粘附、减少胞外聚合物的产量、下调生物被膜相关基因的表达等作用影响生物被膜形成能力[28]。
综上所述,本研究通过筛选获得了一株能抑制LM生物被膜形成的发酵乳杆菌CSC-19,所分泌的ECP具有良好的抑制LM生物被膜形成活性。但ECP中含有部分杂质,还需进行活性组分的分离纯化和结构解析,进一步探究其抑制LM生物被膜形成的分子机制。
| [1] | CAMARGO AC, MOURA A, AVILLAN J, HERMAN N, MCFARLAND AP, SREEVATSAN S, CALL DR, WOODWARD JJ, LECUIT M, NERO LA. Whole-genome sequencing reveals Listeria monocytogenes diversity and allows identification of long-term persistent strains in Brazil. Environmental Microbiology, 2019, 21(12): 4478-4487. DOI:10.1111/1462-2920.14726 |
| [2] |
YAN J. Research of virulence and comparative genomics of Listeria monocytogene from market-sold food in Beijing city[D]. Daqing: Master's Thesis of Heilongjiang Bayi Agricultural University, 2018 (in Chinese) 闫军. 北京市售食品中单增李斯特菌致病力及比较基因组学研究[D]. 大庆: 黑龙江八一农垦大学硕士学位论文, 2018. |
| [3] | BHINU VS. Insight into biofilm-associated microbial life. Journal of Molecular Microbiology and Biotechnology, 2005, 10(1): 15-21. |
| [4] | DONLAN RM. Biofilms: microbial life on surfaces. Emerging Infectious Diseases, 2002, 8(9): 881-890. DOI:10.3201/eid0809.020063 |
| [5] | van HOUDT R, MICHIELS CW. Biofilm formation and the food industry, a focus on the bacterial outer surface. Journal of Applied Microbiology, 2010, 109(4): 1117-1131. DOI:10.1111/j.1365-2672.2010.04756.x |
| [6] | SREY S, JAHID IK, HA SD. Biofilm formation in food industries: a food safety concern. Food Control, 2013, 31(2): 572-585. DOI:10.1016/j.foodcont.2012.12.001 |
| [7] | RODRíGUEZ-LóPEZ P, RODRíGUEZ-HERRERA JJ, VáZQUEZ-SáNCHEZ D, LóPEZ CABO M. Current knowledge on Listeria monocytogenes biofilms in food-related environments: incidence, resistance to biocides, ecology and biocontrol. Foods: Basel, Switzerland, 2018, 7(6): 85. |
| [8] | Bonsaglia ECR, SILVA NCC, FERNADES A Jr, ARAúJO JP Jr, TSUNEMI MH, RALL VLM. Production of biofilm by Listeria monocytogenes in different materials and temperatures. Food Control, 2014, 35(1): 386-391. DOI:10.1016/j.foodcont.2013.07.023 |
| [9] | CARPENTIER B, CERF O. Review: persistence of Listeria monocytogenes in food industry equipment and premises. International Journal of Food Microbiology, 2011, 145(1): 1-8. DOI:10.1016/j.ijfoodmicro.2011.01.005 |
| [10] | WANG YQ, WU JT, LV MX, SHAO Z, HUNGWE M, WANG JJ, BAI XJ, XIE JL, WANG YP, GENG WT. Metabolism characteristics of lactic acid bacteria and the expanding applications in food industry. Frontiers in Bioengineering and Biotechnology, 2021, 9: 612285. DOI:10.3389/fbioe.2021.612285 |
| [11] | SALAZAR N, GUEIMONDE M, de los REYES-GAVILáN CG, RUAS-MADIEDO P. Exopolysaccharides produced by lactic acid bacteria and bifidobacteria as fermentable substrates by the intestinal microbiota. Critical Reviews in Food Science and Nutrition, 2016, 56(9): 1440-1453. DOI:10.1080/10408398.2013.770728 |
| [12] |
ZHAO X, WANG RY. Progress of bioactivities for bacterial exopolysaccharides. Progress in Microbiology and Immunology, 2016, 44(3): 67-71.
(in Chinese) 赵霞, 王若愚. 细菌胞外多糖生物活性的研究进展. 微生物学免疫学进展, 2016, 44(3): 67-71. |
| [13] | CHEN MT, CHENG JH, ZHANG JM, CHEN YT, ZENG HY, XUE L, LEI T, PANG R, WU S, WU HM, ZHANG SH, WEI XH, ZHANG YX, DING Y, WU QP. Isolation, potential virulence, and population diversity of Listeria monocytogenes from meat and meat products in China. Frontiers in Microbiology, 2019, 10: 946. DOI:10.3389/fmicb.2019.00946 |
| [14] | CHEN MT, CHENG JH, WU QP, ZHANG JM, CHEN YT, ZENG HY, YE QH, WU S, CAI SZ, WANG J, DING Y. Prevalence, potential virulence, and genetic diversity of Listeria monocytogenes isolates from edible mushrooms in Chinese markets. Frontiers in Microbiology, 2018, 9: 1711. DOI:10.3389/fmicb.2018.01711 |
| [15] | XU ZB, LIANG YR, LIN SQ, CHEN DQ, LI B, LI L, DENG Y. Crystal violet and XTT assays on Staphylococcus aureus biofilm quantification. Current Microbiology, 2016, 73(4): 474-482. DOI:10.1007/s00284-016-1081-1 |
| [16] | SAKR EAE, MASSOUD MI. Impact of prebiotic potential of stevia sweeteners-sugar used as synbiotic preparation on antimicrobial, antibiofilm, and antioxidant activities. LWT, 2021, 144: 111260. DOI:10.1016/j.lwt.2021.111260 |
| [17] | JIANG P, LI JB, HAN F, DUAN GF, LU XZ, GU YC, YU WG. Antibiofilm activity of an exopolysaccharide from marine bacterium Vibrio sp. QY101. PLoS One, 2011, 6(4): e18514. DOI:10.1371/journal.pone.0018514 |
| [18] |
HUANG CM, XIAO Q, WANG RR, LIU CG, YAO H, ZHOU H. Isolation and identification of a lactic acid bacteria with high-yield extracellular polysaccharide and their production of extracellular polysaccharide. China Brewing, 2019, 38(1): 80-83.
(in Chinese) 黄承敏, 肖茜, 王蓉蓉, 刘成国, 姚慧, 周辉. 一株高产胞外多糖乳酸菌的分离鉴定及其产胞外多糖的研究. 中国酿造, 2019, 38(1): 80-83. |
| [19] |
WANG FT, JIN PP, LIU F, SUN ZL, WANG DY, ZHANG F, XU XX, XU WM. Biofilm formation ability of a food-borne Enterobacter cloacae. Jiangsu Journal of Agricultural Sciences, 2018, 34(4): 943-948.
(in Chinese) 王凤婷, 靳盼盼, 刘芳, 孙芝兰, 王道营, 张芳, 许晓曦, 徐为民. 食源性阴沟肠杆菌生物膜形成能力. 江苏农业学报, 2018, 34(4): 943-948. |
| [20] |
ZHU HR. The formation characteristics of the biofilm of Vibrio parahaemolyticus and the scavenging effect of disinfectants[D]. Dalian: Master's Thesis of Dalian Polytechnic University, 2018 (in Chinese) 朱洪日. 副溶血弧菌生物膜的形成特性及消毒剂的清除作用[D]. 大连: 大连工业大学硕士学位论文, 2018. |
| [21] |
SONG XY, LIU ZH, XIE CP, LIU YY, YANG YY, LIU JH. Regulation mechanism and elimination method of bacterial biofilm formation. Progress in Veterinary Medicine, 2022, 43(3): 112-115.
(in Chinese) 宋雪艳, 刘志欢, 谢翠萍, 刘营营, 杨永亚, 刘建华. 细菌生物被膜形成的调控机制与消除方法. 动物医学进展, 2022, 43(3): 112-115. |
| [22] |
SONG YL, LIANG X, SONG X, MU GQ, TUO YF, JIANG SJ, QIAN F, FENG L. The study on the inhibition of Shigella biofilm formation by the exopolysaccharides of Lactobacillus plantarum-12. Food Research and Development, 2018, 39(8): 144-151.
(in Chinese) 宋莹龙, 梁雪, 宋杏, 牟光庆, 妥彦峰, 姜淑娟, 钱方, 冯璐. Lactobacillus plantarum-12胞外多糖抑制志贺氏菌生物膜形成的研究. 食品研究与开发, 2018, 39(8): 144-151. |
| [23] | SONG YL, SUN MY, FENG L, LIANG X, SONG X, MU GQ, TUO YF, JIANG SJ, QIAN F. Antibiofilm activity of Lactobacillus plantarum 12 exopolysaccharides against Shigella flexneri. Applied and Environmental Microbiology, 2020, 86(15): e00694-20. |
| [24] | KIM Y, OH S, KIM SH. Released exopolysaccharide (r-EPS) produced from probiotic bacteria reduce biofilm formation of enterohemorrhagic Escherichia coli O157:H7. Biochemical and Biophysical Research Communications, 2009, 379(2): 324-329. |
| [25] | RENDUELES O, TRAVIER L, LATOUR-LAMBERT P, FONTAINE T, MAGNUS J, DENAMUR E, GHIGO JM. Screening of Escherichia coli species biodiversity reveals new biofilm-associated antiadhesion polysaccharides. mBio, 2011, 2(3): e00043-e00011. |
| [26] |
DING L. Isolation, purification and antioxidant activity of exopolysaccharides from a bacterial strain[D]. Xi'an: Master's Thesis of Northwest University, 2021 (in Chinese) 丁莉. 一株细菌胞外多糖的分离纯化及其抗氧化活性研究[D]. 西安: 西北大学硕士学位论文, 2021. |
| [27] |
LIU SL, SHUI J, MA XH, PAN JH, SHI GM, YU R, ZHOU QX, LONG JW, YI YH, XIANG YG. Anti-biofilm activity of Klebsiella pneumoniae extracellular polysaccharide. Chinese Journal of Infection and Chemotherapy, 2021, 21(3): 303-308.
(in Chinese) 刘姝灵, 税剑, 马小华, 潘建华, 石国民, 喻容, 周前选, 龙江文, 易一行, 向延根. 肺炎克雷伯菌胞外多糖抗生物膜活性研究. 中国感染与化疗杂志, 2021, 21(3): 303-308. |
| [28] | KIM YJ, YU HH, SONG YJ, PARK YJ, LEE NK, PAIK HD. Anti-biofilm effect of the cell-free supernatant of probiotic Saccharomyces cerevisiae against Listeria monocytogenes. Food Control, 2021, 121: 107667. |
 2023, Vol. 63
2023, Vol. 63




