中国科学院微生物研究所,中国微生物学会
文章信息
- 杨华, 黄建颖, 修丽丽. 2023
- YANG Hua, HUANG Jianying, XIU Lili.
- 柱[5]芳烃衍生物对细菌抗菌活性及生物被膜抑制的研究进展
- Research progress in antibacterial activity and biofilm inhibition of pillar[5]arene derivatives
- 微生物学报, 63(3): 963-976
- Acta Microbiologica Sinica, 63(3): 963-976
-
文章历史
- 收稿日期:2022-07-23
- 网络出版日期:2022-09-30
2. 广东海洋大学食品科学与工程学院, 广东 阳江 529500
2. School of Food Science and Engineering, Guangdong Ocean University, Yangjiang 529500, Guangdong, China
因长期不科学滥用及过度使用抗生素导致多重耐药(multidrug-resistant, MDR)细菌的问题在当今社会日益突出。细菌耐药性问题正向全球蔓延,其引起的感染数量不断增加,对人类健康造成极大威胁,这已成为一个主要的公共卫生问题[1]。2014年至2016年期间,约有100万人死于抗生素耐药性(antimicrobial resistance, AMR)感染[2];近几年全球每年约有70万人死于AMR感染[3]。据专家预测,到2050年,AMR感染将成为死亡的主要原因,预估每年将夺走约1 000万人的生命——这一数字超过了现今癌症导致的死亡人数[4]。细菌生物被膜(biofilm, BF)对抗生素治疗具有顽强的抗性,且抗生素在一定条件下还可诱导BF的形成[5]。BF为病原菌提供了抵抗抗生素的合适环境,许多具有BF形成特性的耐药性菌株会使得治疗变得更加的复杂;其不仅导致疾病的反复发作,还延长了疾病的状态和康复进程,增加了死亡的风险。根据美国国立卫生研究院报告,人类细菌性感染的疾病65%都与BF形成相关[6]。由于BF对不同种类的抗生素具有明显的抗性和适应性,运用传统的物理或化学方法去除和杀灭会导致细菌病原体持续存活或造成食品交叉污染[7-9]。因此,开发一种新型的抗菌剂和杀菌剂是迫切需要的。
柱芳烃(pillararenes)是一类新型大环化合物,由于其在构建功能化和生物活性材料开发中的潜在应用而引起人们的广泛关注[10]。尽管柱芳烃从很早就受到化学界研究者们的青睐,但对于其生物学活性上的应用研究才刚刚开始拉开序幕[11-14];尤其是柱[5]芳烃衍生物在细菌抗菌活性方面展现出巨大潜力。本文综述柱[5]芳烃化合物及其衍生物对细菌病原菌的抗菌活性、抑菌机制及其在BF形成中的抑制作用,以期为今后更好地开发运用柱芳烃衍生物及潜在的抑菌性能提供参考价值,同时为抑制细菌BF感染及其他相关的研究提供理论依据。
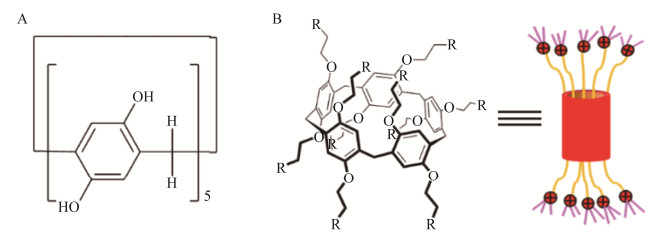
1 柱[n]芳烃柱芳烃于2008年首次被合成并命名[15]。自此以后这些具有巨大应用潜力的大环化合物迅速发展,发现一种新的合成路线,并成功制备出第一个柱[5]芳烃分子传感器[16]。柱[5]芳烃及其衍生物的结构(图 1)是一种具有相对较大空腔和高度对称的圆柱状结构的新型超分子化合物。它是由对苯二酚单元通过亚甲基桥在苯环的对位上连接而成的一类大环[18];因其富含π-电子空腔和双环上氧原子的冠醚状排列而具有独特的主客体性质[19-20]。“柱[n]芳烃”中的“n”表示对苯二酚单元的数目(n=5‒15)[18, 21]。目前柱芳烃尤其是柱[5, 6]芳烃已被较多用于构建超分子聚合物、互锁分子和生物分子杂化材料[22-23]。迄今为止,几乎所有基于柱[n]芳烃的超分子组装体都是使用柱[5, 6]支架构建的[24];基于柱芳烃的研究已经运用到多个领域,如催化[25]、分子识别[26]、生物传感[27]、锂电池[28]、重金属离子检测[29]、药物控释[30]、病毒抑制[31]等方面。但,基于柱芳烃的应用研究并不局限于这些。
柱芳烃作为一种新型的易官能化的主体分子,独特的结构,有趣的主客体特性及原始的超分子组装等特性,在电化学、生物医学材料及超分子化学等应用方面已渐渐显示出无穷的魅力[32]。柱芳烃领域的潜在意义深远,通过对柱芳烃骨架进行化学修饰能够创建具有预期的化学或物理性质的功能化主体并在多个领域掀起一股研究热潮,展现出重要的应用价值和广阔的开发前景。
2 细菌感染概述 2.1 细菌的特点及危害近年来,柱芳烃衍生物的生物学活性特性开始逐渐被发现。例如,连接有铵基或鏻基团的柱[5]芳烃[11, 33]、胍基柱[5]芳烃[34]和两性离子柱[5]芳烃[10]均已被证明对细菌具有有效的抗菌活性。在2017年,世界卫生组织(Word Health Organization, WHO)公布了12种(如:耐甲氧西林耐万古霉素金黄色葡萄球菌、碳青霉烯耐药肠杆菌、碳青霉烯类耐药铜绿假单胞菌等)耐药的超级细菌。细菌包括革兰氏阳性菌和革兰氏阴性菌,革兰氏阳性菌包括金黄色葡萄球菌、肠球菌和链球菌等不同种类。金黄色葡萄球菌(Staphylococcus aureus)是引起细菌性食物中毒的重要病原菌之一,在自然界中分布广泛。在食物中毒事件中,S. aureus产生的肠毒素作为罪魁祸首会导致与人类感染相关的多种疾病,如感染性心内膜炎。MDR-S. aureus对目前大多数抗生素耐药,延迟伤口愈合并导致反复感染,已对全人类的健康构成极大威胁[35]。革兰氏阴性菌包括大肠杆菌和铜绿假单胞菌等,其中大肠杆菌(Escherichia coli)在环境中普遍存在,作为食源性污染的主要病原体,极易污染环境、水和食品,造成日常食品的腐败和变质[36]。铜绿假单胞菌(Pseudomonas aeruginosa)是人类感染的前三大病原菌之一,引起呼吸道感染、尿路感染、胃肠道感染、角膜炎、中耳炎及败血症等疾病。其作为囊性纤维化患者肺部的主要病原体,可造成病人严重和持续性感染[37-39]。革兰氏阳性菌和阴性菌在细胞壁结构上具有差异性,革兰氏阳性细菌的细胞质膜被一层磷脂双层包围,该膜与厚厚的肽聚糖和表面磷壁酸交织在一起;然而,革兰氏阴性细菌的细胞质膜被一个周质空间包裹,该周质空间连接一个外膜层,由脂多糖、脂蛋白等组成,与革兰氏阳性菌不同的是它具有薄的肽聚糖层[4, 40]。而且,已经有证据证明有机化合物可以穿过细胞壁并在细胞质膜中积累,干扰细胞膜之间的相互作用,并破坏脂质双层的秩序。因细胞壁固有的这些不同性质导致细菌会有不同的耐药性机制。
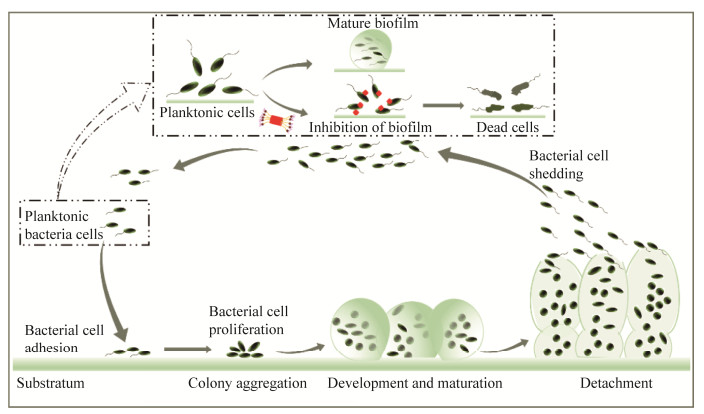
2.2 细菌生物被膜的形成过程及危害细菌的耐药性形成有时与BF的生长相关。当细菌受到各种压力(如高渗透压、低pH、抗生素等)后,大量的细菌为了对抗外界不利的环境,于是自身合成聚合物黏附在介质表面进行生长,并聚集成大量微生物群落从而形成BF[41]。这个过程是动态变化的(图 2),主要涉及黏附期、生长期、成熟期和脱落期等阶段,脱落期中的部分细菌会从中游离出来参与到下一个BF形成的循环之中。细菌在形成BF前需要通过分泌多糖胞间黏附因子进行黏附[42],细菌会在接触表面形成一层薄薄的膜,此阶段称为BF的早期。在成熟的过程之中会分泌出大量的胞外多糖,从而使得BF更加强壮。如,P. aeruginosa的BF形成能力和对抗生素的高度耐药性,使其很难被彻底根除[43-45]。
|
| 图 2 细菌生物被膜形成和抑制 Figure 2 Bacterial biofilm formation and inhibition. |
细菌BF的形成和对抑菌剂的固有抗性则是许多持续性和慢性细菌感染的根源。对于包裹在内的细菌来说起到一个屏障作用,阻碍抑菌物质与BF内的细菌进行接触,抑菌物质便很难渗透到细菌内部,因此起到耐药性。浮游细菌因其表面没有BF的保护则更易被直接杀死。相反,与浮游细菌相比,含有BF的细菌对抑菌物质的抵抗力高达1 000倍[6]。事实上,由于BF在形成、生长和成熟、释放细菌细胞并脱落的过程中,还会引发其他免疫反应,使其对机体造成的感染更加复杂化。因此,制定抑制细菌黏附的策略或通过灭活黏附细菌来阻止细菌发展成为BF是至关重要的。
3 柱[5]芳烃衍生物的抗菌活性及其抑菌机制 3.1 柱[5]芳烃衍生物对细菌的抗菌活性及其生物被膜抑制据文献报道,许多细菌感染都伴随着BF的形成,并且它们对宿主的抵御能力具有固有的耐受性[11]。现已证实在BF “保护”内的细菌会具有高度的耐药性,大多数的抗生素却很难将其杀死。近年来,柱芳烃因其独特的刚性柱状结构和在制备不同领域的功能组装体方面的潜力而备受关注。由于BF形成会增强细菌的抗逆性,而预防细菌危害的重点是如何预防BF形成。目前,对BF的防治重点是一开始就抑制初始阶段BF的形成。因此,对于BF的抑制主要集中在两个方面(图 2),包括抑制新生BF的形成以及破坏和根除已经形成的BF。柱芳烃及其衍生物的抑菌或抗BF形成活性研究陆续开展,研究发现柱[5]芳烃衍生物对细菌具有良好的抗菌活性和BF形成抑制能力(表 1)。
| Pillararene derivatives | Application example | Antibacterial activity | References | |
| Pillar[5]arenes | Sugar functionalized pillar[5]arenes | Escherichia coli | Aggregation of light-emitting bacteria cells | [46] |
| Mannosylated pillar[5]arene derivatives | Escherichia coli | Effectively prevent pathogenic E. coli from sticking | [13] | |
| Peptides pillar[5]arenes |
Staphylococcus epidermidis, Staphylococcus aureus, Bacillus subtilis |
IC50, 0.30–7.50 μmol/L | [47] | |
| Phosphonium pillar[5]arenes | Staphylococcus aureus (ATCC 33592), Enterococcus faecalis (ATCC 29212) |
MBIC50, 0.67–1.66 μg/mL | [33] | |
| Zwitterionic pillar[5]arene nanoaggregates | Escherichia coli (DH5α), Staphylococcus aureus (SH1000) |
MBIC50, 80.00 μmol/L (Escherichia coli) | [10] | |
| Polyaspartamides and pillar[5]arene derivatives | Staphylococcus aureus, Methicillin-resistant staphylococcus aureus (MRSA), Escherichia coli |
MIC, 1.50 μg/mL (Staphylococcus aureus); MIC, 2.70 μg/mL (MRSA); MIC > 1 000.00 μg/mL (Escherichia coli) |
[48] | |
| Guanidinium- pillar[5]arene (GP5) |
Staphylococcus aureus (ATCC 25904), Escherichia coli (BH101) |
MIC, 6.30 μmol/L (Staphylococcus aureus); MIC, 12.50 μmol/L (Escherichia coli); MBEC, 100.00 μmol/L (Escherichia coli) |
[34] | |
| Trimethylammonium- based pillar[5]arene (TP5) |
Staphylococcus aureus (ATCC 6338), Escherichia coli (DH5α) |
MIC, 0.06 mmol/L; MBC, 0.44 mmol/L (Staphylococcus aureus); MIC, 0.11 mmol/L; MBC, 0.88 mmol/L (Escherichia coli) |
[49] | |
| Pyridinium-based pillar[5]arene (PP5) | Pseudomonas aeruginosa PAO1 | MIC, 0.05 mmol/L; MBC, 0.41 mmol/L |
[50] | |
| Pillar[n]arenes |
Pillar[5, 6]arene derivatives |
Staphylococcus aureus subsp. aureus (ATCC 33592) Staphylococcus aureus (ATCC 29213, BAA/043) Enterococcus faecalis (ATCC 29212) Staphylococcus epidermidis (RP62A) Streptococcus mutans (ATCC 700610) |
MBIC50, 0.40–8.80 μmol/L (Cationic pillar[5]arene); MBIC50 > 23.00 μmol/L (Anionic pillar[5]arene); MBIC50, 0.40–2.90 μmol/L (Cationic pillar[6]arene) |
[11] |
| Cationic pillar[5, 6]arene derivatives | Staphylococcus aureus (ATCC 33592) Enterococcus faecalis (ATCC 29212) |
MBIC50, 0.18–14.94 μmol/L | [17] | |
| IC50 represents the concentrations required to inhibit 50% bacteria growth; MBIC50 represents the 50% minimum biofilm inhibitory concentration; MIC stands for minimum inhibitory concentration; MBEC represents the minimum biofilm eradication concentration; MBC stands for minimum bactericidal concentration. | ||||
近年来,研究者开始对柱[5]芳烃衍生物的抗菌及抑制BF活性进行研究。柱芳烃本身不溶于水,在一定程度上限制了其更广泛的应用。修饰后的柱[5]芳烃通过引入亲水基团使得脂溶性的柱[5]芳烃就具有了水溶性。因此,以柱[5]芳烃为支架的化合物陆续被合成出来,对细菌展示出抗菌活性。Yu等[46]在2013年首次报道了可使细菌细胞聚集的两亲性柱[5]芳烃(一端有烷基链,另一端接有糖基),具有开创性的意义,因为这是首次将柱[5]芳烃衍生物应用于与生物相关领域的实例。有研究者合成了甘露糖基功能化的柱[5]芳烃衍生物,显示出对尿路致病性Escherichia coli的抗黏合活性[13]。通过了解细菌细胞聚集和黏合的作用将有助于降低细菌细胞运动和监测病原体。
Joseph等[11]合成了一类基于柱[5, 6]芳烃的衍生物(如:季铵盐、溴、咪唑、三甲胺等)。作为一种新型的阳离子抗菌剂,它对革兰氏阳性菌株,像金黄色葡萄球菌亚种(S. aureus subsp. aureus ATCC 33592),S. aureus (ATCC 29213),S. aureus (BAA/043),粪肠球菌(Enterococcus faecalis, ATCC 29212),表皮葡萄球菌(Staphylococcus epidermidis, RP62A)和变形链球菌(Streptococcus mutans, ATCC 700610)具有良好的BF抑制活性。它们抑制50% BF的最低浓度(the 50% minimum biofilm inhibitory concentration, MBIC50)范围为0.40–8.80 μmol/L。阳离子柱[5]芳烃衍生物对革兰氏阳性菌株具有选择性,而对革兰氏阴性菌株如E. coli (ATCC 25922)和P. aeruginosa没有抑制作用。革兰氏阳性菌BF基质中富含相对电子的空腔被认为是一类缺电子疏水化合物(如季铵盐)的宿主。因此,阳离子抑制剂可与细菌细胞膜通过静电作用相结合,由于革兰氏阳性和阴性细菌细胞膜的组成成分不同,其对革兰氏阳性细菌显示出更高的细菌细胞选择性和更强的抗菌活性。
此外,据文献报道,带有鏻装饰的柱[5]芳烃与正电荷相结合,对S. aureus (ATCC 33592)和E. faecalis (ATCC 29212)的BF形成具有明显抑制作用(MBIC50, 0.67–1.66 μg/mL)[33]。Gao等[10]合成的基于两性离子柱[5]芳烃的纳米聚集体,发现可对E. coli DH5α (20.00 µmol/L)和S. aureus表现出抗菌活性;且对E. coli DH5α的BF也展现出较强抗性(MBIC50, 80.00 μmol/L)。Guo等[34]合成的一种功能化的新型胍基柱[5]芳烃(GP5),对S. aureus (ATCC 25904)和E. coli (BH101)的最低抑菌浓度(minimum inhibitory concentration, MIC)分别为6.30 μmol/L和12.50 μmol/L,证明GP5对其具有较高的抗菌能力;GP5可有效地破坏E. coli (BH101)预先存在的BF,其最低BF清除浓度(minimum biofilm eradication concentration, MBEC)为100.00 μmol/L;GP5与头孢唑啉钠(一种抗生素)联合使用时,其抗菌活性提高,证明GP5可协同头孢唑啉钠增强抑菌效果(MBEC, 25.00 μmol/L)。Kaizerman-Kane等[17]也发现阳离子柱[5, 6]芳烃衍生物可有效抑制S. aureus (ATCC 33592)和E. faecalis (ATCC 29212)的BF形成(MBIC50, 0.18–14.94 μmol/L)。Yan等[48]通过分子的自主组装模式,柱[5]芳烃与聚天冬酰胺结合设计做成材料,得到可降解的超分子生物材料,对S. aureus和耐甲氧西林金黄色葡萄球菌(methicillin-resistant Staphylococcus aureus)均展现出了较强的抗菌活性;其对S. aureus的MIC值为1.50 μg/mL,即使在2.70 μg/mL的超低剂量下,聚天冬酰胺和柱[5]芳烃衍生物也能很好地抑制MRSA的生长;但在 > 1 000.00 μg/mL的高剂量下,它也不能够抑制E. coli的生长。在Zhang等[47]的研究下,设计得到一种具有多肽柱[5]芳烃的单分子跨膜通道,它可以插入到革兰氏阳性菌的磷脂双分子层中,对S. epidermidis、S. aureus和枯草芽孢杆菌(Bacillus subtilis)具有良好的抗菌活性(IC50, 0.30–7.50 μmol/L)。鉴于柱[5]芳烃不可估量的应用潜力,研究人员正不断地致力于设计和合成高效的基于柱[5]芳烃的新的抗菌剂和抑菌材料。目前,所发表的可用于抗菌目的柱芳烃仍然很有限,尤其是他们都没有发现柱芳烃能够对P. aeruginosa的BF产生明显的抗菌作用。而本课题组设计并合成的一种新型水溶性阳离子柱[5]芳烃衍生物[50],即吡啶柱[5]芳烃(PP5),以三甲胺柱[5]芳烃(TP5)为对照。经研究发现[49-50],TP5对S. aureus (ATCC 6538)的MIC和最低杀菌浓度(minimum bactericidal concentration, MBC)值分别为0.06 mmol/L和0.44 mmol/L、对E. coli (DH5α)的MIC和MBC值分别为0.11 mmol/L和0.88 mmol/L;而PP5对P. aeruginosa PAO1显示出良好的抗菌活性(MIC, 0.05 mmol/L),MBC为0.41 mmol/L。更为重要的是,我们发现PP5对P. aeruginosa PAO1的抗菌活性即使在连续传递18 d后,耐药性也可以忽略不计,且对其BF的形成表现出优异的抑制活性,1 MIC浓度下抑制率高达79.80%。但,却未发现TP5对其有明显的抑菌和抗BF形成活性,这与Joseph等[11]的结论相一致,柱[5]芳烃骨架上官能团的类型对其抗菌效果至关重要。可见,关于柱芳烃衍生物的抗菌活性可能是来自于接入的不同阳离子基团和正电荷的协同作用。此外,在被考虑作为任何生物应用的申请之前,评估该合成化合物的细胞毒性是极其重要的。用3-(4, 5)-二甲基-2-噻唑-(2, 5)-苯基溴化四氮唑蓝[3-(4, 5-dimethyl-2-thiazolyl)-2, 5-diphenyl tetrazolium bromide, MTT]比色法来测定动物或细菌细胞活力,其作为最简便的方法之一,与传统方法相比具有极大优势[51]。我们的实验结果表明MIC值范围内TP5 (HeLa和MCF7细胞)无毒[49]。根据Joseph等[11]的报道,阳离子柱芳烃对培养中的老鼠红细胞未检测出可检测的膜损伤或对人体细胞产生毒性。而在其另一篇文章中也得到了相似的结果,即他们合成的水溶性阳离子柱[5]芳烃,它们能够在sub-μmol/L浓度下抑制BF的形成,而不影响细菌细胞和哺乳动物细胞的生存力[33]。Guo等[34]的研究表明,在低于25.00 μmol/L时,GP5对哺乳动物细胞表现出相对较低的溶血活性(老鼠红细胞)和细胞毒性(A549和293T细胞系),表明其具有良好的生物相容性。
因此,对柱[5]芳烃衍生物抗菌活性的研究极大地丰富了使用其作为有效支架的超分子物质,如:柱[5]芳烃可与甘露糖、多肽、阳离子(铵基、咪唑、鏻、胍基、吡啶鎓)等相结合,为其在细菌的抗菌活性和BF的抑制中开启新的研究方向。它们具有非常大的可应用于新型食品防腐剂或抑菌药物的潜力,并将在未来提供更多的可能性。
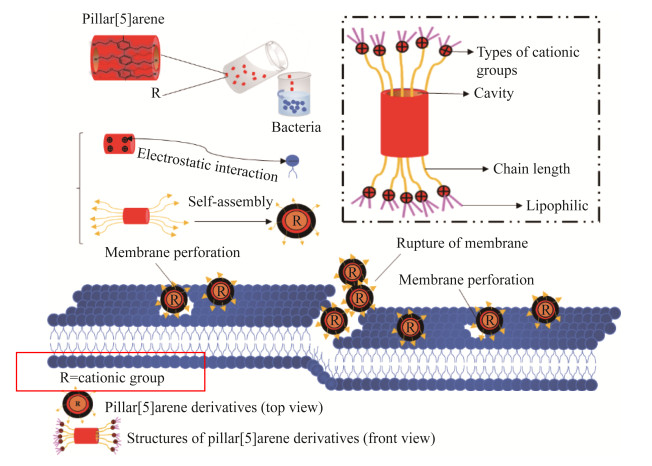
3.2 柱[5]芳烃衍生物的抑菌机制长期以来,细菌细胞膜是抑菌剂的重要靶点。抑菌剂会与细菌细胞膜的脂质双层、膜蛋白等发生作用使细胞膜受到损坏(如膜穿孔)。因此我们可以推测柱[5]芳烃在接入季铵盐、吡啶等阳离子基团后作用靶点很可能位于细胞膜上。与细菌细胞膜通过产生静电相互作用,最终导致细胞膜成分的改变。柱[5]芳烃衍生物的抗菌活性主要表现在以疏水性柱[5]骨架作为有效支架、通过接入的官能团进行分析、与骨架上附加的烷基链的长度等3个方面(图 3)。因柱芳烃本身不溶于水,通过引入亲水基团使得亲脂性的柱[5]芳烃具有亲水性对抑菌作用是很有必要的。通过化学结构的设计使柱[5]芳烃衍生物作用于细菌BF、细菌细胞膜,以便为改进抗菌功能提供新见解。柱[5]芳烃不仅能与铵基、溴、咪唑、三甲胺等相结合[11];还能与多肽[47],鏻[33],两性离子柱芳烃的纳米聚集体[10],聚天冬酰胺[48],胍基[34],吡啶鎓[50]等相结合。Minbiole等[52]发现用吡啶基团取代三甲胺基团可增强其抗菌活性,由此证明接于柱[5]芳烃骨架上的阳离子基团对其抗菌能力至关重要,取代基的不同将会导致不同的抑菌效果。此外,Kaizerman-Kane等[17]认为虽然柱[n]芳烃为核心的大环结构有助于正电荷的聚集,但空腔对于观察到的抗生物被膜活性并不是必不可少的。带正电荷的阳离子可能会通过增加静电相互作用来破坏阴离子细菌膜的表面,可见正电荷是柱[5]芳烃衍生物对抗BF活性的关键。
|
| 图 3 柱[5]芳烃衍生物的抑菌机制[A2] [A3] Figure 3 Antibacterial mechanism of pillar[5]arene derivatives. |
柱[5]芳烃衍生物对细菌细胞膜层面的探究对了解其抑菌机制至关重要。细胞形态的变化是细胞分裂受损的结果,细胞膜的损伤将导致细胞内容物的渗漏、膜渗透性被破坏将会导致渗透调节能力的减弱[53]。通过观察细菌细胞形态的改变可以进一步揭示其抑菌机制。Gao等[10]发现两性离子柱[5]芳烃的纳米聚集体能对S. aureus (SH1000)、E. coli (DH5α)表现出抗菌活性,其与带弱正电荷的纳米聚集体有关,通过低温透射电镜(cryogenic transmission electron microscopy, Cryo-TEM)观察到这种纳米聚集体能与E. coli的细胞相互作用,可以清晰地看到大肠杆菌细胞膜变形,且随着时间的延长,最终导致细胞死亡。Yan等[48]制备出的阳离子聚天冬酰胺和柱[5]芳烃衍生物可生物降解的超分子材料,对MRSA和S. aureus产生的较强抗菌活性与阳离子聚合物的碳链长度及正电荷密切相关;通过扫描电子显微镜(scanning electron microscope, SEM)即可观察到细菌细胞经阳离子聚合物处理后细胞膜明显出现严重的塌陷和变形。Guo等[34]合成的GP5处理细菌4 h后,通过SEM可观察到S. aureus ATCC 25904和E. coli BH101的细胞均显示出部分或完全的膜溶解现象。我们的研究与其显示出相似的效果,透射电镜(transmission electron microscopy, TEM)结果表明,TP5处理后的S. aureus ATCC 6538和E. coli DH5α的细胞壁和膜遭到损伤[49];然而PP5通过π-π堆积作用在细胞表面,破坏细胞膜的完整性,从而使铜绿假单胞菌PAO1的细胞膜破裂或穿孔,导致大量细胞内容物丢失,最终造成细菌死亡[50]。由此推断,TP5和PP5对细菌的抗菌作用模式与细胞壁和细胞膜结构的改变以及细胞裂解有关;通过破坏菌体外部,进而渗透到菌体内部,这可能是导致细胞活力丧失的一个重要原因。因此,可以得出一个关键点,即带有不同阳离子部分的柱[5]芳烃对病原菌表现出截然不同的抗菌活性。这和阳离子抑制剂可与细菌表面结合的理论相关联[11, 33-34, 47, 54]。正如Wei等[55]所描述的,细菌膜中的脂多糖和磷脂中的阴离子成分可能通过多个盐桥与抗菌剂相结合。因此,许多具有抗菌和抗生物膜活性的抑菌剂更容易渗透到革兰氏阳性菌的细菌膜上,它们对穿透革兰氏阳性菌双分子层诱导了受试菌的抑制作用,导致细胞分化,具有细菌细胞选择性。阳离子柱[5]芳烃衍生物可以作用于细胞膜造成物理性的破坏。因而可进一步推测柱[5]芳烃衍生物可通过物理破坏病原体的细胞膜致使细胞质成分泄漏。根据上述结果,我们认为不同柱[5]芳烃衍生物的抗菌机制可能是不同的,或许是因为细菌具有不断进化和逐渐适应的能力,并获得对化合物的抵抗能力。但还需进一步确定化合物对细菌的作用模式,以及确定作用机制中涉及的抗菌与化合物之间的关系。
此外,结合共聚焦激光扫描显微镜(confocal laser scanning microscopy, CLSM)研究,可进一步提供柱[5]芳烃衍生物抑制生物被膜形成的证据。通过比较绿色(细胞膜完整的细菌)和红色(细胞膜受损的细菌)的荧光,发现细胞生存率和密度显著降低,表明两性离子柱[5]芳烃的纳米聚集体[10] (E. coli)和聚天冬酰胺和柱[5]芳烃衍生物[48] (S. aureus),GP5[34] (E. coli)对受试菌株的生物被膜均具有显著的抑制效果。最近,本课题研究发现[50]完全用吡啶鎓取代的柱[5]芳烃(PP5)对P. aeruginosa PAO1具有优异的生物被膜抑制能力。从TEM和CLSM的结果可以得出结论,PP5的杀菌活性是由于病原体细胞膜的物理破坏和随后细胞质成分的泄漏,这可以大大降低耐药性的快速产生。这些结果再次印证,利用CLSM观察可进一步对柱[5]芳烃衍生物的抑菌机制提供洞察力。另外,对细胞膜造成的不同损伤,可以解释为细菌之间细胞壁的差异性导致暴露于阳离子柱[5]芳烃衍生物后具有不同的细胞损伤程度。
总之,正电荷作为柱[5]芳烃衍生物抑菌和抗BF活性的关键,主要在于它更容易与细菌细胞膜磷脂分子的负电荷之间的静电吸引而结合在细胞膜上。因此,革兰氏阳性细菌由于其典型的带负电荷的磷壁酸和厚肽聚糖的结构,被认为更有可能与阳离子柱芳烃相结合,而革兰氏阴性细菌的脂多糖层在细胞膜周围起到了保护作用[56-57]。当S. aureus和E. coli等暴露于柱[5]芳烃衍生物后的反应差异可能是由于革兰氏阳性菌和革兰氏阴性菌细胞壁结构不同所造成的;革兰氏阴性细菌具有较低的渗透性外膜,可以有效地阻止疏水物质进入细胞质膜,但革兰氏阳性细菌与之相比它没有外膜。因此,阳离子柱[5]芳烃衍生物对革兰氏阴性细菌比革兰氏阳性细菌展现出更强的抗性,这或许归因于复杂的外膜结构减缓了化合物的抑制效果。因此,我们认为柱[5]芳烃衍生物在细菌的细胞死亡过程中具有积极的作用,而这种作用有可能导致了革兰氏阳性细菌在胁迫条件下使得大多数细菌的死亡,少数的革兰氏阴性细菌在复杂的外膜结构保护下得以存活,这种机制也有可能与抗生素的耐药机制相关。在发现阳离子柱[5]芳烃衍生物能产生抗菌活性后,研究人员对该柱[5]芳烃作用的条件进行了试验,阐述了不同的影响因素(如:接入的官能团、烷基链的长度等)引起柱[5]芳烃衍生物发挥效用而导致细菌死亡的现象。
总的来说,虽然以柱[5]芳烃为骨架的阳离子柱芳烃化合物在细菌抗菌活性上的应用前景较广,但随着柱状芳烃的快速发展,现有的可以用于抗菌目的的柱芳烃仍然很有限,我们仍需进一步深入探究其抑菌的作用机制,再结合复杂的环境因素,并且化合物对细菌结构和生理所产生的影响不能假定都是由于单一的普遍机制。更需要我们针对细菌病原体的机制及可能的细胞内靶向行为进行更深入的研究。只有充分了解它们在抗菌及抑制BF形成中的作用,方才可以设计出基于柱[5]芳烃的更有效的抑菌剂。
4 总结与展望BF的形成是一个复杂的过程。作为一种屏障,BF在细菌表面形成“保护”,抑菌物质便很难渗入进细胞内部。根据目前生物学活性研究中发现的一类大环柱芳烃化合物——柱[5]芳烃衍生物,在抑菌和抗BF形成中发挥着重要作用,其抑菌机制的主要影响因素包括:(1) 柱[n]芳烃大环结构;(2) 正电荷在柱[5]芳烃骨架上的聚集;(3) 阳离子等官能团;(4) 柱[5]芳烃所接入的侧链长度;(5) 空腔的结构。
就目前而言,现有的以抗菌为目的的柱[5]芳烃衍生物还少之又少,具有一定局限性,我们仍需要对其作为有效支架进行进一步的优化改造以及发现更多优秀的官能团,使其具有更加优异的抗菌活性。在自然界当中细菌很少表现为独立的生物个体,它们之间经常存在个体之间的沟通交流与群体行为。目前,柱[5]芳烃衍生物作为抑菌剂通过何种方式进入到细胞内部、并启动群体感应系统介导的细胞死亡机制还尚不清楚,有待进一步的阐明。以柱[5]芳烃为骨架的开发设计,在未来能否联合其他抗生素一起使用?作为药物的载体在药物控释方面能否实现更好地传递?是否还具有其他作用靶点?这些问题都需要我们进行进一步的探究。而深入探究细菌BF形成与其调控的分子机制,在未来对寻找特异性的干预靶点也具有重大意义。此外,对于柱[5]芳烃衍生物的抑菌机制探索仍需要合成更多新的柱[5]芳烃衍生物,或许未来还可以考虑以其他柱芳烃为支架,旨在于为新抑菌剂的开发提供更多的可能性。尽管目前对于它们的研究是小荷才露尖尖角的状态,我相信在未来它们必将进入到一个崭新的阶段,这必将对细菌的抗菌活性及BF耐药性的抑制做出新的贡献,而继续合理开发设计新的柱芳烃衍生物也将成为热门的研究方向。据此,可以预见,合成的基于柱芳烃的水溶性和两亲性柱芳烃主体由于其良好的生物相容性,有效的抑菌和抗BF活性及低毒性,表明其在食品防腐、生物医药学等方面的应用提供了更多的可能。它正从一种知识储备逐渐转变到应用于实际生活的巨大潜力。
| [1] | CANIÇA M, MANAGEIRO V, ABRIOUEL H, MORAN-GILAD J, FRANZ CMAP. Antibiotic resistance in foodborne bacteria. Trends in Food Science & Technology, 2019, 84: 41-44. |
| [2] | VIKESLAND P, GARNER E, GUPTA S, KANG SJ, MAILE-MOSKOWITZ A, ZHU N. Differential drivers of antimicrobial resistance across the world. Accounts of Chemical Research, 2019, 52(4): 916-924. DOI:10.1021/acs.accounts.8b00643 |
| [3] |
LIU CX, WANG YL, YI XL. Development of anti-infective drugs in post-epidemic era of COVID-19. Chinese Journal of Antibiotics, 2021, 46(1): 1-10.
(in Chinese) 刘昌孝, 王玉丽, 伊秀林. 后疫情时代抗感染药物的发展. 中国抗生素杂志, 2021, 46(1): 1-10. DOI:10.13461/j.cnki.cja.007093 |
| [4] | LAM AK, PANLILIO H, PUSAVAT J, WOUTERS CL, MOEN EL, BRENNAN RE, RICE CV. Expanding the spectrum of antibiotics capable of killing multidrug-resistant Staphylococcus aureus and Pseudomonas aeruginosa. ChemMedChem, 2020, 15(15): 1421-1428. DOI:10.1002/cmdc.202000239 |
| [5] | HOFFMAN LR, D՚ARGENIO DA, MACCOSS MJ, ZHANG ZY, JONES RA, MILLER SI. Aminoglycoside antibiotics induce bacterial biofilm formation. Nature, 2005, 436(7054): 1171-1175. DOI:10.1038/nature03912 |
| [6] | COSTERTON JW, STEWART PS, GREENBERG EP. Bacterial biofilms: a common cause of persistent infections. Science, 1999, 284(5418): 1318-1322. DOI:10.1126/science.284.5418.1318 |
| [7] | BRIDIER A, SANCHEZ-VIZUETE P, GUILBAUD M, PIARD JC, NAÏTALI M, BRIANDET R. Biofilm-associated persistence of food-borne pathogens. Food Microbiology, 2015, 45: 167-178. DOI:10.1016/j.fm.2014.04.015 |
| [8] | SCHMELCHER M, LOESSNER MJ. Bacteriophage endolysins: applications for food safety. Current Opinion in Biotechnology, 2016, 37: 76-87. DOI:10.1016/j.copbio.2015.10.005 |
| [9] | HARRISON JJ, TURNER RJ, JOO DA, STAN MA, CHAN CS, ALLAN ND, VRIONIS HA, OLSON ME, CERI H. Copper and quaternary ammonium cations exert synergistic bactericidal and antibiofilm activity against Pseudomonas aeruginosa. Antimicrobial Agents and Chemotherapy, 2008, 52(8): 2870-2881. DOI:10.1128/AAC.00203-08 |
| [10] | GAO LY, LI MJ, EHRMANN S, TU ZX, HAAG R. Positively charged nanoaggregates based on zwitterionic pillar[5]arene that combat planktonic bacteria and disrupt biofilms. Angewandte Chemie: International Ed in English, 2019, 58(11): 3645-3649. DOI:10.1002/anie.201810314 |
| [11] | JOSEPH R, NAUGOLNY A, FELDMAN M, HERZOG IM, FRIDMAN M, COHEN Y. Cationic pillararenes potently inhibit biofilm formation without affecting bacterial growth and viability. Journal of the American Chemical Society, 2016, 138(3): 754-757. DOI:10.1021/jacs.5b11834 |
| [12] | CHEN RE, JIANG HJ, GU HN, ZHOU QZ, ZHANG Z, WU JS, JIN ZN. Tubular structures self-assembled from a bola-amphiphilic pillar[5]arene in water and applied as a microreactor. Organic Letters, 2015, 17(17): 4160-4163. DOI:10.1021/acs.orglett.5b01910 |
| [13] | NIERENGARTEN I, BUFFET K, HOLLER M, VINCENT SP, NIERENGARTEN JF. A mannosylated pillar[5]arene derivative: chiral information transfer and antiadhesive properties against uropathogenic bacteria. Tetrahedron Letters, 2013, 54(19): 2398-2402. DOI:10.1016/j.tetlet.2013.02.100 |
| [14] | VINCENT SP, BUFFET K, NIERENGARTEN I, IMBERTY A, NIERENGARTEN JF. Biologically active heteroglycoclusters constructed on a pillar[5]arene-containing[2]rotaxane scaffold. Chemistry-A European Journal, 2016, 22(1): 88-92. DOI:10.1002/chem.201504110 |
| [15] | OGOSHI T, KANAI S, FUJINAMI S, YAMAGISHI TA, NAKAMOTO Y. Para-bridged symmetrical pillar[5]arenes: their Lewis acid catalyzed synthesis and host-guest property. Journal of the American Chemical Society, 2008, 130(15): 5022-5023. DOI:10.1021/ja711260m |
| [16] | CRAGG PJ, SHARMA K. Pillar[5]arenes: fascinating cyclophanes with a bright future. Chemical Society Reviews, 2012, 41(2): 597-607. DOI:10.1039/C1CS15164A |
| [17] | KAIZERMAN-KANE D, HADAR M, JOSEPH R, LOGVINIUK D, ZAFRANI Y, FRIDMAN M, COHEN Y. Design guidelines for cationic pillar[n]arenes that prevent biofilm formation by Gram-positive pathogens. ACS Infectious Diseases, 2021, 7(3): 579-585. DOI:10.1021/acsinfecdis.0c00662 |
| [18] | XUE M, YANG Y, CHI XD, ZHANG ZB, HUANG FH. Pillararenes, a new class of macrocycles for supramolecular chemistry. Accounts of Chemical Research, 2012, 45(8): 1294-1308. DOI:10.1021/ar2003418 |
| [19] | SONG N, KAKUTA T, YAMAGISHI TA, YANG YW, OGOSHI T. Molecular-scale porous materials based on pillar[n]arenes. Chem, 2018, 4(9): 2029-2053. DOI:10.1016/j.chempr.2018.05.015 |
| [20] | STRUTT NL, ZHANG HC, SCHNEEBELI ST, STODDART JF. Functionalizing pillar[n]arenes. Accounts of Chemical Research, 2014, 47(8): 2631-2642. DOI:10.1021/ar500177d |
| [21] |
XIA MC, YANG YW. Organic functional materials based on pillarenes. Progress in Chemistry, 2015, 27(6): 655-665.
(in Chinese) 夏梦婵, 杨英威. 基于柱芳烃的有机功能材料. 化学进展, 2015, 27(6): 655-665. |
| [22] | OGOSHI T, AKUTSU T, SHIMADA Y, YAMAGISHI TA. Redox-responsive host-guest system using redox-active pillar[5]arene containing one benzoquinone unit. Chemical Communications: Cambridge, England, 2016, 52(38): 6479-6481. DOI:10.1039/C6CC02777F |
| [23] | MA YJ, CHEN L, LI C, MÜLLEN K. A fishing rod-like conjugated polymer bearing pillar[5]arenes. Chemical Communications: Cambridge, England, 2016, 52(40): 6662-6664. DOI:10.1039/C6CC02059C |
| [24] | OGOSHI T, YAMAGISHI T. Pillar[5]- and pillar[6]arene-based supramolecular assemblies built by using their cavity-size-dependent host-guest interactions. Chemical Communications: Cambridge, England, 2014, 50(37): 4776-4787. DOI:10.1039/C4CC00738G |
| [25] | LIZ DG, MANFREDI AM, MEDEIROS M, MONTECINOS R, GÓMEZ-GONZÁLEZ B, GARCIA-RIO L, NOME F. Supramolecular phosphate transfer catalysis by pillar[5]arene. Chemical Communications: Cambridge, England, 2016, 52(15): 3167-3170. DOI:10.1039/C5CC10214F |
| [26] | OGOSHI T, TAKASHIMA S, YAMAGISHI TA. Molecular recognition with microporous multilayer films prepared by layer-by-layer assembly of pillar[5]arenes. Journal of the American Chemical Society, 2015, 137(34): 10962-10964. DOI:10.1021/jacs.5b07415 |
| [27] | ADIRI T, MARCIANO D, COHEN Y. Potential 129Xe-NMR biosensors based on secondary and tertiary complexes of a water-soluble pillar[5]arene derivative. Chemical Communications: Cambridge, England, 2013, 49(63): 7082-7084. DOI:10.1039/c3cc43253j |
| [28] | ZHU ZQ, HONG ML, GUO DS, SHI JF, TAO ZL, CHEN J. All-solid-state lithium organic battery with composite polymer electrolyte and pillar[5]quinone cathode. Journal of the American Chemical Society, 2014, 136(47): 16461-16464. DOI:10.1021/ja507852t |
| [29] | CHENG HB, LI ZY, HUANG YD, LIU L, WU HC. Pillararene-based aggregation-induced-emission-active supramolecular system for simultaneous detection and removal of mercury(Ⅱ) in water. ACS Applied Materials & Interfaces, 2017, 9(13): 11889-11894. |
| [30] | HUANG X, WU SS, KE XK, LI XY, DU XZ. Phosphonated pillar[5]arene-valved mesoporous silica drug delivery systems. ACS Applied Materials & Interfaces, 2017, 9(23): 19638-19645. |
| [31] | ZHENG DD, FU DY, WU YQ, SUN YL, TAN LL, ZHOU T, MA SQ, ZHA X, YANG YW. Efficient inhibition of human papillomavirus 16 L1 pentamer formation by a carboxylatopillarene and a p-sulfonatocalixarene. Chemical Communications: Cambridge, England, 2014, 50(24): 3201-3203. DOI:10.1039/c3cc49789e |
| [32] | OGOSHI T, YAMAGISHI TA, NAKAMOTO Y. Pillar-shaped macrocyclic hosts pillar[n]arenes: new key players for supramolecular chemistry. Chemical Reviews, 2016, 116(14): 7937-8002. DOI:10.1021/acs.chemrev.5b00765 |
| [33] | JOSEPH R, KAIZERMAN D, HERZOG IM, HADAR M, FELDMAN M, FRIDMAN M, COHEN Y. Phosphonium pillar[5]arenes as a new class of efficient biofilm inhibitors: importance of charge cooperativity and the pillar platform. Chemical Communications: Cambridge, England, 2016, 52(70): 10656-10659. DOI:10.1039/C6CC05170G |
| [34] | GUO SW, HUANG QX, CHEN Y, WEI JW, ZHENG J, WANG LY, WANG YT, WANG RB. Synthesis and bioactivity of guanidinium-functionalized pillar[5]arene as a biofilm disruptor. Angewandte Chemie: International Ed in English, 2021, 60(2): 618-623. DOI:10.1002/anie.202013975 |
| [35] | LE P, KUNOLD E, MACSICS R, ROX K, JENNINGS MC, UGUR I, REINECKE M, CHAVES-MORENO D, HACKL MW, FETZER C, MANDL FAM, LEHMANN J, KOROTKOV VS, HACKER SM, KUSTER B, ANTES I, PIEPER DH, ROHDE M, WUEST WM, MEDINA E, et al. Repurposing human kinase inhibitors to create an antibiotic active against drug-resistant Staphylococcus aureus, persisters and biofilms. Nature Chemistry, 2020, 12(2): 145-158. DOI:10.1038/s41557-019-0378-7 |
| [36] | YIN MM, LIU CW, GE R, FANG Y, WEI J, CHEN X, CHEN QS, CHEN XM. Paper-supported near-infrared-light-triggered photoelectrochemical platform for monitoring Escherichia coli O157: H7 based on silver nanoparticles-sensitized-upconversion nanophosphors. Biosensors and Bioelectronics, 2022, 203: 114022. DOI:10.1016/j.bios.2022.114022 |
| [37] | JACKSON KD, STARKEY M, KREMER S, PARSEK MR, WOZNIAK DJ. Identification of psl, a locus encoding a potential exopolysaccharide that is essential for Pseudomonas aeruginosa PAO1 biofilm formation. Journal of Bacteriology, 2004, 186(14): 4466-4475. DOI:10.1128/JB.186.14.4466-4475.2004 |
| [38] | WAGNER VE, IGLEWSKI BHP. Pseudomonas aeruginosa biofilms in CF infection. Clinical Reviews in Allergy & Immunology, 2008, 35(3): 124-134. |
| [39] | SINGH PK, SCHAEFER AL, PARSEK MR, MONINGER TO, WELSH MJ, GREENBERG EP. Quorum-sensing signals indicate that cystic fibrosis lungs are infected with bacterial biofilms. Nature, 2000, 407(6805): 762-764. DOI:10.1038/35037627 |
| [40] | WANG LH, ZENG XN, WANG MS, BRENNAN CS, GONG DM. Modification of membrane properties and fatty acids biosynthesis-related genes in Escherichia coli and Staphylococcus aureus: implications for the antibacterial mechanism of naringenin. Biochimica et Biophysica Acta: BBA-Biomembranes, 2018, 1860(2): 481-490. DOI:10.1016/j.bbamem.2017.11.007 |
| [41] |
LIU YH. The inhibiting effects of sulfonated chitosan on bacteria and its biofilm[D]. Hangzhou: Master՚s Thesis of Zhejiang Gongshang University, 2019 (in Chinese). 刘玉红. 磺化壳聚糖对细菌及其生物被膜抑制作用的研究[D]. 杭州: 浙江工商大学硕士学位论文, 2019. |
| [42] | O՚GARA JP. Ica and beyond: biofilm mechanisms and regulation in Staphylococcus epidermidis and Staphylococcus aureus. FEMS Microbiology Letters, 2007, 270(2): 179-188. DOI:10.1111/j.1574-6968.2007.00688.x |
| [43] | IBRAHIM D, JABBOUR JF, KANJ SS. Current choices of antibiotic treatment for Pseudomonas aeruginosa infections. Current Opinion in Infectious Diseases, 2020, 33(6): 464-473. DOI:10.1097/QCO.0000000000000677 |
| [44] | CHELLAT M F, RAGUŽ L, RIEDL R. Targeting antibiotic resistance. Angewandte Chemie: International Ed in English, 2016, 55(23): 6600-6626. DOI:10.1002/anie.201506818 |
| [45] | LIU YH, JIANG Y, ZHU JL, HUANG JY, ZHANG HJ. Inhibition of bacterial adhesion and biofilm formation of sulfonated chitosan against Pseudomonas aeruginosa. Carbohydrate Polymers, 2019, 206: 412-419. DOI:10.1016/j.carbpol.2018.11.015 |
| [46] | YU GC, MA YJ, HAN CY, YAO Y, TANG GP, MAO ZW, GAO CY, HUANG FH. A sugar-functionalized amphiphilic pillar[5]arene: synthesis, self-assembly in water, and application in bacterial cell agglutination. Journal of the American Chemical Society, 2013, 135(28): 10310-10313. DOI:10.1021/ja405237q |
| [47] | ZHANG M, ZHU PP, XIN PY, SI W, LI ZT, HOU JL. Synthetic channel specifically inserts into the lipid bilayer of Gram-positive bacteria but not that of mammalian erythrocytes. Angewandte Chemie: International Ed in English, 2017, 56(11): 2999-3003. DOI:10.1002/anie.201612093 |
| [48] | YAN SZ, CHEN S, GOU XB, YANG J, AN JX, JIN XY, YANG YW, CHEN L, GAO H. Biodegradable supramolecular materials based on cationic polyaspartamides and pillar[5]arene for targeting Gram‐positive bacteria and mitigating antimicrobial resistance. Advanced Functional Materials, 2019, 29(38): 1904683. DOI:10.1002/adfm.201904683 |
| [49] |
WU HX, YANG H, ZHAO DQ, HUANG JY, YANG LJ. Synthesis of trimethylamine based cationic pillar[5]arene and study on antibacterial properties. Food Science, 2023, 44(1): 46-52.
(in Chinese) 吴惠香, 杨华, 赵登奇, 黄建颖, 杨利军. 三甲胺柱[5]芳烃的合成及其抑菌性能. 食品科学, 2023, 44(1): 46-52. |
| [50] | YANG H, JIN LQ, ZHAO DQ, LIAN ZF, APPU M, HUANG JY, ZHANG ZB. Antibacterial and antibiofilm formation activities of pyridinium-based cationic pillar[5]arene against Pseudomonas aeruginosa. Journal of Agricultural and Food Chemistry, 2021, 69(14): 4276-4283. DOI:10.1021/acs.jafc.1c01032 |
| [51] | WANG HW, WANG FQ, TAO XY, CHENG HR. Ammonia-containing dimethyl sulfoxide: an improved solvent for the dissolution of formazan crystals in the 3-(4, 5-dimethylthiazol-2-yl)-2, 5-diphenyl tetrazolium bromide (MTT) assay. Analytical Biochemistry, 2012, 421(1): 324-326. DOI:10.1016/j.ab.2011.10.043 |
| [52] | MINBIOLE KPC, JENNINGS MC, ATOR LE, BLACK JW, GRENIER MC, LADOW JE, CARAN KL, SEIFERT K, WUEST WM. From antimicrobial activity to mechanism of resistance: the multifaceted role of simple quaternary ammonium compounds in bacterial eradication. Tetrahedron, 2016, 72(25): 3559-3566. DOI:10.1016/j.tet.2016.01.014 |
| [53] | SUO B, YANG H, WANG YX, LV HP, LI Z, XU C, AI ZL. Comparative proteomic and morphological change analyses of Staphylococcus aureus during resuscitation from prolonged freezing. Frontiers in Microbiology, 2018, 9: 866. DOI:10.3389/fmicb.2018.00866 |
| [54] | BENHAMOU RI, SHAUL P, HERZOG IM, FRIDMAN M. Di-N-methylation of anti-Gram-positive aminoglycoside-derived membrane disruptors improves antimicrobial potency and broadens spectrum to Gram-negative bacteria. Angewandte Chemie: International Ed in English, 2015, 54(46): 13617-13621. DOI:10.1002/anie.201506814 |
| [55] | WEI XL, RAN DN, CAMPEAU A, XIAO C, ZHOU JR, DEHAINI D, JIANG Y, KROLL AV, ZHANG QZ, GAO WW, GONZALEZ DJ, FANG RH, ZHANG LF. Multiantigenic nanotoxoids for antivirulence vaccination against antibiotic-resistant Gram-negative bacteria. Nano Letters, 2019, 19(7): 4760-4769. DOI:10.1021/acs.nanolett.9b01844 |
| [56] | KANG HK, SEO CH, LUCHIAN T, PARK Y. Pse-T2, an antimicrobial peptide with high-level, broad-spectrum antimicrobial potency and skin biocompatibility against multidrug-resistant Pseudomonas aeruginosa infection. Antimicrobial Agents and Chemotherapy, 2018, 62(12): e01493-e01418. |
| [57] | SI FW, LE TREUT G, SAULS JT, VADIA S, LEVIN PA, JUN S. Mechanistic origin of cell-size control and homeostasis in bacteria. Current Biology, 2019, 29(11): 1760-1770.e7. DOI:10.1016/j.cub.2019.04.062 |
 2023, Vol. 63
2023, Vol. 63