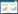中国科学院微生物研究所,中国微生物学会
文章信息
- 王薪雅, 彭钊, 刘盖, 黄开耀. 2023
- WANG Xinya, PENG Zhao, LIU Gai, HUANG Kaiyao.
- 雪衣藻Chlamydomonas nivalis适应温度周期性变化的生理响应和分子机制
- Physiological responses of Chlamydomonas nivalis to cyclic temperature fluctuation and the adaptation mechanism
- 微生物学报, 63(3): 1185-1203
- Acta Microbiologica Sinica, 63(3): 1185-1203
-
文章历史
- 收稿日期:2022-07-20
- 网络出版日期:2022-09-28
2. 中国科学院大学, 北京 100049;
3. 华中师范大学生命科学学院, 湖北 武汉 430072
2. University of Chinese Academy of Sciences, Beijing 100049, China;
3. School of Life Sciences, Central China Normal University, Wuhan 430072, Hubei, China
雪藻(snow algae)群落分布在高纬度和高海拔等地球极端低温环境中。雪藻主要由不同门类的单细胞藻组成[1],其是极地生态系统中重要的初级生产者,通过光合作用固定二氧化碳,在极地碳循环中起到重要作用[2]。在冰雪融化时节,雪藻会产生各种颜色雪地藻华(snow algal bloom)。Hisakawa等[3]研究发现,冰雪表面覆盖雪藻群落的趋势与极地冰雪面积消长显著相关,雪藻能降低光的反照率,促进冰雪融化。因此,雪藻群落具有重要的生态价值。
雪藻群落主要由绿藻纲(Chlorophyceae)中团藻目(Volvocales)或衣藻目(Chlamydomonadales)[4]的绿藻藻株组成。近年来,已经开展研究的雪藻藻株有Chlamydomonas nivalis[5]、Chloromonas reticulate[6]、Sanguina nivaloids和Sanguina aurantia[7],其中关于C. nivalis的研究较多。
有关C. nivalis的细胞学研究显示,其分为运动细胞和不动细胞两个状态。在有利条件下C. nivalis是运动的,具有两根鞭毛[8];而野外采集样品中看到的C. nivalis往往是球形或者近球形的红色静息细胞[9]。近年来,有关C. nivalis生理和生化的研究显示,其可以耐受低温和高辐射等极端环境条件,并且可以合成游离脯氨酸、脂类、酚类和胞外多糖等特殊细胞成分[1]。并且,雪衣藻C. nivalis能重组光合作用系统的色素组成和调整能量代谢转化过程,以减少温度骤降给光合作用系统带来的损伤[10]。除生理生化方面的研究外,目前还有关于C. nivalis的组学研究。有关C. nivalis转录组的研究聚焦于其低温胁迫短期内(1 h)的响应机制,研究发现C. nivalis中与RNA事件、氮代谢、胞外多糖合成以及冰结合蛋白相关的编码基因,在低温胁迫短期内表达上调[11]。
但是,C. nivalis作为一种兼性嗜冷绿藻,并未有相关研究阐明其在温度周期性变化下的适应转变过程。因此,本研究重点探索C. nivalis响应温度周期性变化的过程,旨在揭示雪衣藻响应极地温度周期变化的分子机制,丰富生物抗逆基因资源库。
1 材料与方法 1.1 实验材料雪衣藻C. nivalis株系UTEX 2765和UTEX 2824,均来自美国德克萨斯大学藻种库(The Culture Collection of Algae at The University of Texas at Austin, UTEX),培养于Bold 1NV (B1NV)培养基中(配方由UTEX提供)。
1.2 实验设计为探索C. nivalis作为兼性嗜冷绿藻适应温度变化的机制,我们设计了温度周期性变化的实验,温度设置采用22 ℃和4 ℃。首先以105 cells/mL的初始浓度将雪衣藻接种到22 ℃环境中,生长至平台期初期;后将22 ℃下生长的雪衣藻稀释至105 cells/mL的初始浓度,转移到4 ℃低温下生长;待雪衣藻适应低温4 ℃环境并生长到平台期之后,再以105 cells/mL的初始浓度转移回22 ℃下继续生长。全程检测2个藻株生理指标的变化,以探索温度变化下雪衣藻生理和代谢特征的转变。光照培养箱(SANTN公司)光照强度为70 μE,光暗比为12 h/12 h,摇床转速为120 r/min。
1.3 生理指标检测使用细胞计数仪Z2 COULTER (Beckman)计数大小在5.0−19.6 μm之间的颗粒,获得细胞浓度(单位:cells/mL),采用PHYTO-PAM (Walz)测光系统Ⅱ最大光化学量子产量(maximal quantum yield of photosystem Ⅱ, Fv/Fm),并测量叶绿素和类胡萝卜素含量,方法参照文献[12]。
1.4 转录组测序UTEX 2824作为转录组取样藻株,据生理指标的变化选择10个时间点提取RNA进行转录组建库测序,这10个时间点分别是:22 ℃常温下接藻初期、对数生长期和平台期;温度骤降到4 ℃后1 h、生长停滞期、对数生长期和平台期;温度由4 ℃骤升到22 ℃后1 h、对数生长期和平台期,每个时间点4个生物学重复。收集藻细胞(5 000×g, 5 min)后,液氮速冻,置于−80 ℃冰箱备用。液氮研磨后采用Plant RNA Kit试剂盒(Omega)提取RNA。40个样本由中科院水生生物研究所分析测试中心完成建库和测序。应用Illumina平台获取双端PE150测序数据。使用fastp-v0.12.4软件对下机数据进行质控,去除接头序列和低质量序列。使用HISAT2-v2.2.1软件将质控后的转录组数据与UTEX 2824参考基因组比对,进行转录本定量。基因表达量采用FPKM (fragments per kilobase million)方法计算。转录组数据上传至NCBI数据库,项目编号为PRJNA859655。
1.5 数据分析方法加权基因共表达网络分析(weighted gene co-expression network analysis, WGCNA)[13]是一种系统生物学分析方法,依据基因表达模式鉴定协同表达的基因模块,并挖掘其中的关键基因。使用软阈值β=9作为权重值,最小划定为模块的基因数设置为30个,相似模块的合并阈值设置为0.25,其余参数使用默认值。利用Cytoscape软件构建核心基因互作网络[14]。使用基于负二项分布模型开发的DESeq2 R语言包[15]进行两两时间点之间的转录组数据差异表达分析,筛选差异倍数对数绝对值|log2 (fold change)| > 1,差异显著性FDR < 0.05的基因,作为显著差异表达的基因。使用KEGG数据库(https://www.genome.jp/kegg/)[16]的GhostKOALA, eggNOG-mapper (http://eggnogdb.embl.de/#/app/emapper)[17],Mapman网页(https://mapman.gabipd.org/)在线提供的功能注释流程Mercator进行功能注释[18]。使用clusterProfiler R包[19]中的enricher函数进行富集分析,FDR < 0.05的通路被认为显著富集。
2 结果与分析 2.1 温度变化下C. nivalis的生理响应为了探索温度周期变化下C. nivalis的生理响应规律,我们选择了UTEX 2765和UTEX 2824两个藻株作为研究对象。图 1A展示了温度变化下C. nivalis的生长曲线。2个藻株均以105 cell/mL的初始浓度接种在22 ℃环境中,约5 d后达到平台期。之后将2个藻株以105 cell/mL的浓度转移到4 ℃环境中,2个藻株均存在为期5 d的生长停滞期,然后进入对数生长状态。4 ℃低温下,UTEX 2765藻株所能达到的细胞浓度略高于UTEX 2824藻株。但是,适应4 ℃低温的两个藻株转移回22 ℃环境中,却可快速进入对数生长期,似乎不存在适应转变过程。图 1B展示了温度变化下两个藻株的生长速率,22 ℃环境下两个藻株生长速度相似,但在4 ℃低温环境下,UTEX 2765藻株的生长速率高于UTEX 2824藻株。
|
| 图 1 温度周期性变化下雪衣藻的生理响应 Figure 1 Physiological responses of Chlamydomonas nivalis to cyclic temperature fluctuation. A: Growth curves of C. nivalis. B: Growth rate of C. nivalis. C: The maximum quantum yield of PSⅡ chemistry of C. nivalis. D: The Chlorophyll a/b ratios of C. nivalis. E: The carotenoids contents (μg/cell) of C. nivalis. F: Comparison between culture states of C. nivalis at 4 ℃ and 22 ℃. Values: Mean±SD (n=3). |
图 1C展示了温度周期性变化下两个藻株Fv/Fm的变化,该值是反映植物光合作用系统是否稳定的首要衡量指标[20-21]。在22 ℃环境下的对数生长期时,两个藻株的Fv/Fm值均能达到0.7左右;但是一旦进入平台期,该值就会下降到0.6左右。温度骤降到4 ℃时,两个藻株的Fv/Fm值均降至0.5左右,说明低温胁迫会损伤雪衣藻的光合作用系统。经历生长停滞期的适应转变后,该值逐渐上升至0.7,并且在低温下平台期两个藻株依旧维持较强的光合作用潜力。值得注意的是,雪衣藻在22 ℃下Fv/Fm所能达到的最大值约为0.7,而其在4 ℃下所能达到的Fv/Fm最大值约为0.73,说明雪衣藻在低温下调整了光合作用系统Ⅱ反应中心。由4 ℃转移到22 ℃的环境中时,两个藻株的Fv/Fm值依旧维持在近0.7的水平,说明温度骤升到常温并未损伤到雪衣藻的光合作用系统。
图 1D与图 1E展示温度变化下雪衣藻色素组成变化。如图 1D所示,4 ℃下2株雪衣藻中叶绿素a/b的比值均上升,推测雪衣藻可能减少细胞内捕光复合物以减少光能进入光合作用系统,转移到常温下叶绿素a/b比值逐渐下降并恢复到正常值。如图 1E所示,两株雪衣藻中单细胞类胡萝卜素含量在4 ℃生长停滞期急剧上升,而低温下对数生长期和平台期恢复了正常水平,4 ℃下两藻株的藻液相比于22 ℃下明显变黄(图 1F)。鉴于UTEX 2765和UTEX 2824两个藻株在温度变化下的生理指标变化趋势相近,且UTEX 2824藻株有拼接注释完整的参考基因组,因此选择UTEX 2824藻株进行转录组取样和测序。
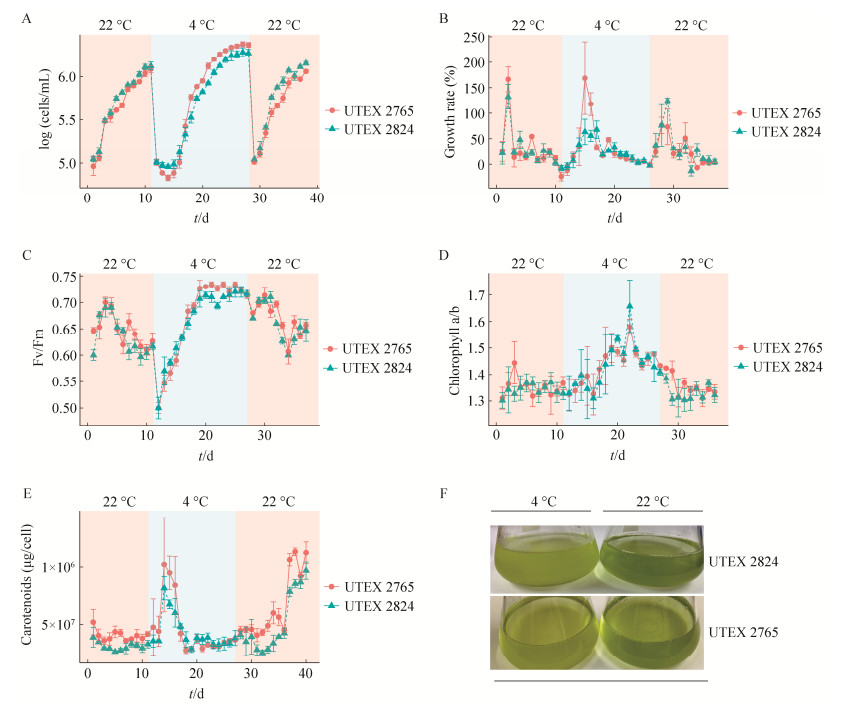
2.2 转录组取样与数据质控分析每个样本的原始数据量均≥7 Gb,Q30 (99.9%的碱基准确率)≥95%,单一比对率(uniquely alignment rate)≥90%,说明本次转录组测序数据质量可信度较高,可用于下游分析。根据温度周期变化下雪衣藻的生理响应规律,我们共选择了10个时间点进行转录组取样,每个时间点4个生物学重复。图 2A展示了温度周期变化下雪衣藻的取样时间点,分别是:22 ℃接种初期(1)、对数生长期(2)和平台期(3);温度骤降到4 ℃下1 h (4)、低温下生长停滞期(5)、低温下对数生长期(6)和平台期(7);雪衣藻由4 ℃转移回22 ℃后1 h (8),对数生长期(9)和平台期(10)。图 2B展示了40个样本的主成分分析(principal component analysis, PCA)结果,可以看到22 ℃条件下不同取样时间点的雪衣藻样本距离较近,说明22 ℃下不同时期雪衣藻转录组样本的特征相似;4 ℃低温下不同取样时间点雪衣藻转录组样本距离较远,说明低温下不同取样点雪衣藻的转录组特征差异显著。并且,同一个取样时间点的转录组样本聚集成簇,说明数据重复性较强,数据可靠,可用于后续分析。图 2C具体展示了40个样本中基因的表达图谱,通过颜色的分布可以直观地看到雪衣藻C. nivalis的转录组受温度变化影响较大。
|
| 图 2 温度周期变化下的雪衣藻转录组 Figure 2 Transcriptome of Chlamydomonas nivalis under cyclic temperature fluctuation. A: Schematic of sampling for RNA-seq. B: Principal component analysis of transcriptomes. C: Gene expression heatmap. 1: Initial phase at 22 ℃; 2: Log phase at 22 ℃; 3: Stationary phase at 22 ℃; 4: After 1 h at 4 ℃; 5: Latent phase at 4 ℃; 6: Log phase at 4 ℃; 7: Stationary phase at 4 ℃; 8: After 1 h at 22 ℃; 9: Log phase at 22 ℃; 10: Stationary phase at 22 ℃. |
2.3 C. nivalis中糖代谢通路和活性氧清除通路响应温度周期变化
Peng等[11]研究发现,4 ℃下雪衣藻细胞粘附性增强,通过提取并检测胞外多糖,发现低温下雪衣藻胞外多糖含量上升,说明雪衣藻中糖代谢过程响应温度变化。此外,Zheng等[10]发现,相比于常温绿藻莱茵衣藻,低温下雪衣藻中丙二醛和脂质过氧化水平保持稳定,说明活性氧清除机制在雪衣藻响应温度胁迫中起到重要作用,该研究通过检测酶活性,证明低温下雪衣藻中活性氧清除的关键酶,如过氧化氢酶(catalase, CAT)、超氧化物歧化酶(superoxide dismutase, SOD)和过氧化物酶(peroxidas, POD)的酶活性上升。鉴于生物体内活性氧清除系统组成复杂,我们在这里关注活性氧清除相关小分子化合物合成代谢基因的表达变化情况。活性氧清除相关小分子化合物种类繁多,如抗坏血酸、醛酸及谷胱甘肽。
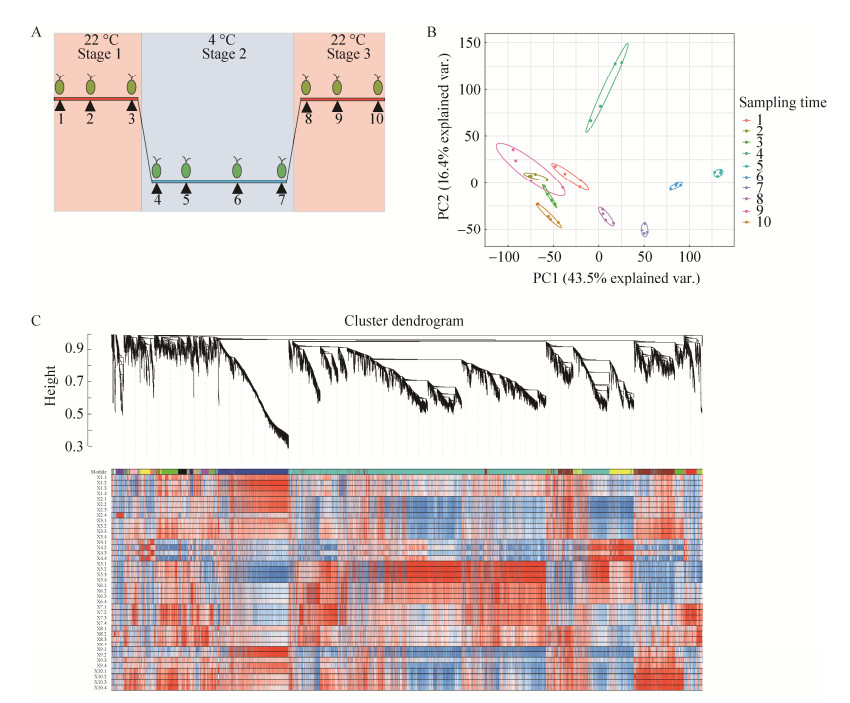
本研究使用京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes, KEGG)数据库对雪衣藻UTEX 2824进行KEGG直系同源(KEGG orthology, KO)注释,挑选其中重要代谢通路相关的基因进行分析。温度周期变化下重要代谢通路基因表达量变化如图 3所示。
|
| 图 3 重点通路的基因表达热图 Figure 3 Genes expression heatmap of key pathways. A: Fructose and mannose metabolism pathway. B: Starch and sucrose metabolism pathway. C: Glutathione metabolism pathway. D: Ascorbate and aldarate metabolism pathway. 1: Initial phase at 22 ℃; 2: Log phase at 22 ℃; 3: Stationary phase at 22 ℃; 4: After 1 h at 4 ℃; 5: Latent phase at 4 ℃; 6: Log phase at 4 ℃; 7: Stationary phase at 4 ℃; 8: After 1 h at 22 ℃; 9: Log phase at 22 ℃; 10: Stationary phase at 22 ℃. |
糖代谢是整个生物代谢的中心,非生物胁迫往往影响到植物的糖代谢过程,导致植物细胞内可溶性糖含量升高[22]。低温胁迫下,可溶性糖类物质在生物体内承担渗透保护剂和冷冻保护剂的作用[23]。
图 3A展示了雪衣藻中果糖和甘露糖代谢通路相关基因的表达情况。甘露糖-6-磷酸异构酶(mannose-6-phosphate isonerase, MPI)将6-磷酸果糖转变为6-磷酸甘露糖,在催化GDP-甘露糖生成中具有重要作用[24]。雪衣藻中该酶对应的编码基因Scaffold021.g26080在低温阶段表达上调。甘露糖焦-1-磷酸鸟苷转移酶(mannose-1-phosphate guanylyltransferase, GMPP)和甘露糖磷酸变位酶(phosphomannomutase, PMM)均是参与甘露糖生成的关键酶。在植物中过表达PMM会增强植物抗氧化胁迫的能力[25-26]。雪衣藻中编码GMPP的基因Scaffold022.g22210,与编码PMM的基因Scaffold026.g41400和Scaffold006.g10100在低温胁迫阶段表达量也上调。果糖必须经过磷酸化之后才能进入下一步代谢,因此果糖激酶(fructokinase, FRK)在调节细胞中的果糖浓度以及有机碳在细胞中分配和流向,调节植物生长发育,响应环境胁迫中起到重要作用[27]。雪衣藻中FRK对应基因Scaffold021.g02200的表达量在低温阶段表达上调。上述的结果说明,雪衣藻中果糖和甘露糖代谢途径响应温度周期变化。
图 3B展示了雪衣藻中淀粉和蔗糖代谢通路相关基因在温度变化下的表达情况。在低温胁迫初期和适应期的样本中,淀粉合成酶(starch synthase, SS)家族均有相关的基因成员发生表达量上调。海藻糖-6-磷酸合成酶(trehalose-6-phosphate synthase, TPS)和海藻糖-6-磷酸磷酸酯酶(trehalose-6-phosphate phosphatase, TPP)是海藻糖-6-磷酸合成的关键酶,可以调控海藻糖的合成来抵御温度胁迫[28-29]。UTEX 2824中编码TPS的Scaffold014.g10000和Scaffold028.g05240基因,以及编码TPP的Scaffold002.g57250基因响应低温胁迫过程,表达上调。蔗糖磷酸合酶(sucrose phosphate synthase, SPS)是调节植物蔗糖生物合成的关键酶,植物体内SPS的活性会影响蔗糖的合成、碳分配等其他生物学过程,从而实现对非生物胁迫的响应[30]。雪衣藻中编码SPS蛋白家族的Scaffold010.g04330、Scaffold009.g01040和Scaffold001.g34220基因在低温下表达量均上调。依据雪衣藻中糖代谢相关基因表达响应温度变化,我们推测可溶性糖的生成可能在雪衣藻适应温度胁迫过程中起到关键作用。
胁迫条件下,细胞内往往产生大量自由基攻击细胞组成成分,通过级联放大效应,最终会导致细胞代谢紊乱和细胞死亡。还原型谷胱甘肽在植物细胞抵抗氧化胁迫中起到重要的作用[31]。图 3C是雪衣藻中注释到与谷胱甘肽代谢酶相关的基因。谷胱甘肽硫转移酶(glutathione-s-transferase, GST)是一个庞大的基因家族,主要通过催化还原型谷胱甘肽与广泛的疏水和亲电底物结合来解毒外源物质[32]。如图 3C所示,雪衣藻中该基因家族响应温度骤变的时间点,部分成员响应温度骤降过程上调表达,另一部分成员响应温度骤升过程上调表达。谷胱甘肽还原酶(glutathione reductase, GSR)维持细胞内还原型谷胱甘肽的含量,以持续清除细胞内的自由基,其编码基因Scaffold019.g13300的表达量也在低温下上调。由热图所示,我们推测谷胱甘肽代谢通路在雪衣藻适应温度变化的过程中起到重要作用。
抗坏血酸又称维生素C,是一种水溶性抗氧化有机小分子,近年来在植物抗衰老和抗逆境胁迫研究中引起人们的关注[33]。图 3D雪衣藻中注释到与抗坏血酸和醛酸代谢相关的酶。可以看到,抗坏血酸合成通路相关的编码基因在低温下的几个时间点整体上调表达。我们推测抗坏血酸和醛酸代谢通路在雪衣藻适应温度变化中起到重要的作用。
综上所述,雪衣藻中的果糖和甘露糖代谢通路、淀粉和蔗糖代谢通路、抗坏血酸和醛酸代谢通路以及谷胱甘肽代谢通路相关基因的表达量均响应温度变化。
2.4 基因共表达网络基因聚类和模块切割除了对上述重点的通路进行分析之外,鉴于目前普遍认为表达趋势相似的基因功能上具有相关性,依据基因在不同样本中的表达趋势对基因进行模块划分,将表达趋势相似的基因归入同一个基因模块。利用R软件中WGCNA包来构建加权基因共表达网络。为了使网络符合无尺度分布,利用R包中的pickSoftThreshold函数计算权重值。根据图 4A与图 4B迭代结果所示,在R2 > 0.8的条件下,选择软阈值β=9来构建共表达网络。表 1展示了划分模块的名称和模块内基因数目,共划分得到17个模块,其中grey模块是未归入任何模块的基因。为了确定模块划分的合理性,需要进一步对拓扑重叠矩阵进行可视化处理,随机抽取400个基因进行相关热图的绘制,图中颜色越深代表两个基因之间的表达相关性越强。如图 4C所示,对角线上基因簇的颜色显著深于周围部分,说明模块内部基因之间有较高的拓扑重叠,且模块独立性较高,进一步说明我们模块划分的合理性。
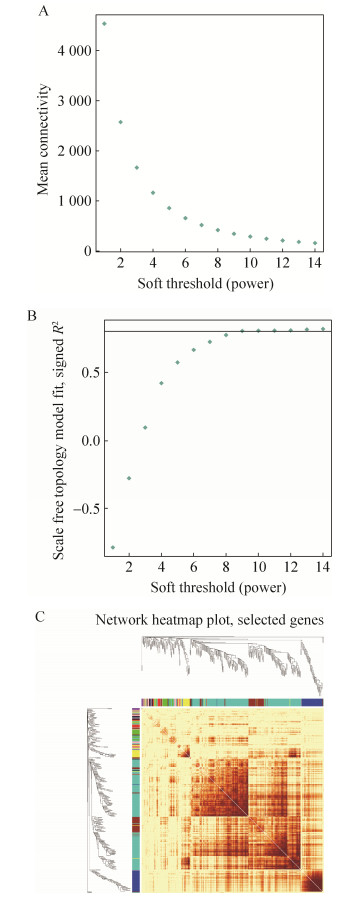
|
| 图 4 基因共表达软阈值的确定 Figure 4 Soft threshold determination of gene co-expression network. A: Network connectivity under different soft thresholds. B: Scale-free network fitting index under different soft thresholds. C: Topology overlap matrix heatmap. |
| Module | Gene number |
| Black | 164 |
| Blue | 1 291 |
| Brown | 1 213 |
| Cyan | 83 |
| Green | 573 |
| Greenyellow | 113 |
| Yellow | 863 |
| Lightcyan | 31 |
| Magenta | 154 |
| Midnightblue | 70 |
| Pink | 155 |
| Purple | 136 |
| Red | 216 |
| Salmon | 93 |
| Tan | 108 |
| Turquoise | 5 544 |
| Grey | 23 |
2.5 基因的加权共表达网络分析
为了确定模块基因集所响应的转录组取样时间点,将所获模块与样本进行关联分析。模块特征值(module eigengene, ME)是对模块中所有基因进行主成分分析所得到的主成分1 (principal component 1, PC1)的值,该值可以代表这个模块的表达模式。图 5是将模块特征值与样本进行关联分析的结果。以r > 0.7且P < 0.005为筛选阈值,选择与取样点显著正相关的模块,尤其关注与温度骤变和特殊的取样时间点显著正相关的模块。其中,与低温胁迫1 h (4)显著正相关的为salmon模块(r=0.82, P < 0.005)和yellow模块(r=0.89, P < 0.005)。与低温下生长停滞期(5)显著正相关的模块为turquoise模块(r=0.7, P < 0.005)。与4 ℃转移到22 ℃ 1 h (8)显著正相关的模块为greenyellow模块(r=0.76, P < 0.005)。因此,选择上述的模块作为重点模块,进行后续的功能注释和分析。
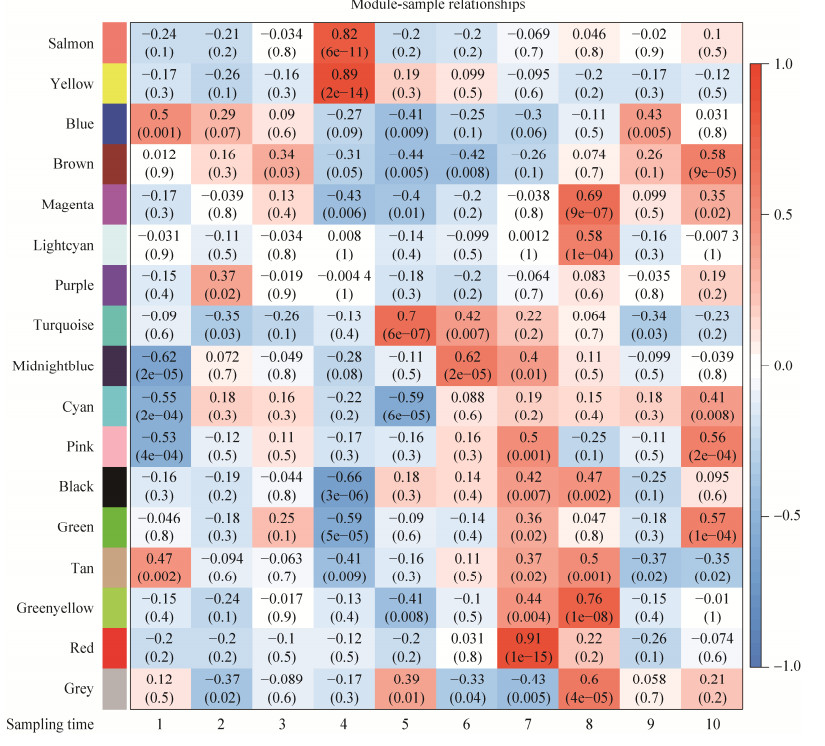
|
| 图 5 基因共表达网络模块与不同样本的关联热图 Figure 5 Correlation heatmap of gene co-expression network module and different samples. 1: Initial phase at 22 ℃; 2: Log phase at 22 ℃; 3: Stationary phase at 22 ℃; 4: After 1 h at 4 ℃; 5: Latent phase at 4 ℃; 6: Log phase at 4 ℃; 7: Stationary phase at 4 ℃; 8: After 1 h at 22 ℃; 9: Log phase at 22 ℃; 10: Stationary phase at 22 ℃. |
2.6 核心基因的筛选和功能分析
首先,关注与低温胁迫1 h显著相关的salmon模块。依据表达趋势的相似性,共有93个基因归入该模块,该模块中Scaffold022. g01180基因注释到碱性/螺旋-环-螺旋(basic/helix-loop-helix, bHLH),这是一个重要的转录因子家族,在调节植物生长发育、抵抗逆境胁迫以及信号传导等方面起着重要的作用[34]。图 6A所示,筛选连通性(weight值) > 0.2的关联节点进行共表达网络构建和核心基因挖掘,通过基因调控网络分析,在salmon模块中找到15个基因与该转录因子可能存在调控关系。通过对这些基因进行功能注释分析,看到其功能主要与生物体内磷酸化调节、第二信使环磷酸腺苷的合成以及泛素蛋白降解途径相关。此外,yellow模块的基因表达也与低温胁迫1 h的样本密切相关。模块身份(module membership, kME)依据一个基因在所有样本中的表达变化趋势与某个模块特征值的相关性,来衡量这个基因在这个模块中的身份。以kME为指标,筛选前10%的基因进行功能注释分析,结果发现这些基因主要参与RNA结合的相关事件、蛋白磷酸化调节等,这与前人的研究结果相符[11]。且其中Scaffold001.g14040基因注释到了cupin蛋白家族的成员,这是一个由6个β折叠片组成的桶状结构,结构稳定且具有耐热性,在孢子和高等植物种子里面均有发现,可以用于储藏氨基酸[35]。上述结果显示低温胁迫短期1 h内,雪衣藻中参与RNA事件、信号传导及用于储藏氨基酸蛋白等相关基因表达上调。
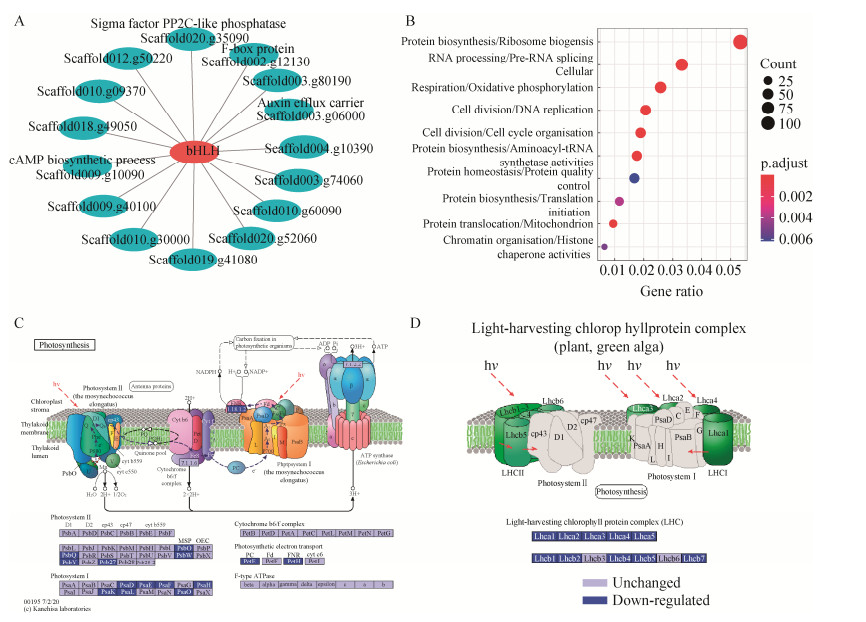
|
| 图 6 基因功能分析 Figure 6 Genes function analysis. A: Genes co-expression network of bHLH in salmon module. B: Bubble diagram for Mapman enrichment analysis of the turquoise module. C: Adjustment of photosynthesis at latent phase. D: Adjustment of light-harvesting chlorophyll protein complex at latent phase. PsbA: Photosystem Ⅱ P680 reaction center D1 protein; PsbD: Photosystem Ⅱ P680 reaction center D2 protein; PsbC: Photosystem Ⅱ CP43 chlorophyll apoprotein; PsbB: Photosystem Ⅱ CP47 chlorophyll apoprotein; PsbE: Photosystem Ⅱ cytochrome b559 subunit alpha; PsbF: Photosystem Ⅰ Ⅱ cytochrome b559 subunit beta; PsbL: Photosystem Ⅱ PsbL protein; PsbJ: Photosystem Ⅱ PsbJ protein; PsbK: Photosystem Ⅱ PsbK protein; PsbM: Photosystem Ⅱ PsbM protein; PsbH: Photosystem Ⅱ PsbH protein; PsbI: Photosystem Ⅱ PsbI protein; PsbO: Photosystem Ⅱ oxygen-evolving enhancer protein 1; PsbP: Photosystem Ⅱ oxygen-evolving enhancer protein 2; PsbQ: Photosystem Ⅱ oxygen-evolving enhancer protein 3; PsbR: Photosystem Ⅱ 10 kDa protein; PsbS: Photosystem Ⅱ 22 kDa protein; PsbT: Photosystem Ⅱ PsbT protein; PsbU: Photosystem Ⅱ PsbU protein; PsbV: Photosystem Ⅱ cytochrome c550; PsbW: Photosystem Ⅱ PsbW protein; PsbX: Photosystem Ⅱ PsbX protein; PsbY: Photosystem Ⅱ PsbY protein; PsbZ: Photosystem Ⅱ PsbZ protein; Psb27: Photosystem Ⅱ Psb27 protein; Psb28: Photosystem Ⅱ 13 kDa protein; Psb28-2: Photosystem Ⅱ Psb28-2 protein; PsaA: Photosystem Ⅰ P700 chlorophyll a apoprotein A1; PsaB: Photosystem Ⅰ P700 chlorophyll a apoprotein A2; PsaC: Photosystem Ⅰ subunit Ⅶ; PsaD: Photosystem Ⅰ subunit Ⅱ; PsaE: Photosystem Ⅰ subunit Ⅳ; PsaF: Photosystem Ⅰ subunit Ⅲ; PsaG: Photosystem Ⅰ subunit Ⅴ; PsaH: Photosystem Ⅰ subunit Ⅵ; PsaI: Photosystem Ⅰ subunit Ⅷ; PsaJ: Photosystem Ⅰ subunit Ⅸ; PsaK: Photosystem Ⅰ subunit Ⅹ; PsaL: Photosystem Ⅰ subunit Ⅺ; PsaM: Photosystem Ⅰ subunit Ⅻ; PsaN: Photosystem Ⅰ subunit PsaN; PsaO: Photosystem Ⅰ subunit PsaO; PsaX: Photosystem Ⅰ 4.8 kDa protein; PetB: Cytochrome b6; PetD: Cytochrome b6-f complex subunit 4; PetA: Apocytochrome f; PetC: Cytochrome b6-f complex iron-sulfur subunit; PetL: Cytochrome b6-f complex subunit 6; PetM: Cytochrome b6-f complex subunit 7; PetN: Cytochrome b6-f complex subunit 8; PetG: Cytochrome b6-f complex subunit 5; PetE: Plastocyanin; PetF: Ferredoxin; PetH: Ferredoxin--NADP+ reductase; PetJ: Cytochrome c6; beta: F-type H+/Na+-transporting ATPase subunit beta; alpha: F-type H+/Na+-transporting ATPase subunit alpha; gamma: F-type H+-transporting ATPase subunit gamma; delta: F-type H+-transporting ATPase subunit delta; epsilon: F-type H+-transporting ATPase subunit epsilon; c: F-type H+-transporting ATPase subunit c; a: F-type H+-transporting ATPase subunit a; b: F-type H+-transporting ATPase subunit b; Lhca1: Light-harvesting complex Ⅰ chlorophyll a/b binding protein 1; Lhca2: Light-harvesting complex Ⅰ chlorophyll a/b binding protein 2; Lhca3: Light-harvesting complex Ⅰ chlorophyll a/b binding protein 3; Lhca4: Light-harvesting complex Ⅰ chlorophyll a/b binding protein 4; Lhca5: Light-harvesting complex Ⅰ chlorophyll a/b binding protein 5; Lhcb1: Light-harvesting complex Ⅱ chlorophyll a/b binding protein 1; Lhcb2: Light-harvesting complex Ⅱ chlorophyll a/b binding protein 2; Lhcb3: Light-harvesting complex Ⅱ chlorophyll a/b binding protein 3; Lhcb4: Light-harvesting complex Ⅱ chlorophyll a/b binding protein 4; Lhcb5: Light-harvesting complex Ⅱ chlorophyll a/b binding protein 5; Lhcb6: Light-harvesting complex Ⅱ chlorophyll a/b binding protein 6; Lhcb7: Light-harvesting complex Ⅱ chlorophyll a/b binding protein 7. |
其次,由于温度骤降到4 ℃后雪衣藻存在生长停滞期用于进行代谢适应和转变,因此关注与生长停滞期(5)高度相关的基因模块,即turquoise模块。共有5 544个基因归到turquoise模块内,为了更直观地展示该模块基因的功能,对该模块中的基因使用Mapman数据库进行了功能注释并且进行富集分析。如图 6B所示,可以看到雪衣藻中与低温下生长停滞期高度相关的基因主要富集到蛋白质合成相关的通路,如核糖体生成(ribosome biogenesis)、前体RNA剪切(pre-RNA splicing)、氨酰-tRNA生成(aminoacyl-tRNA synthetase activities)、翻译起始(translation initiation)等;还注释到保证蛋白质正常折叠的质量控制系统(protein quality control);另外还注释到与细胞周期调控和染色质高级结构组织相关的通路,如DNA复制(DNA replication)、细胞周期组织(cell cycle organization)、组蛋白伴侣活性(histone chaperone activities)。
为了进一步探索雪衣藻在低温生长停滞期(5)相对于低温胁迫初期1 h (4)做出的调整,我们比对了这两个时间点转录本的差异表达情况。雪衣藻生长停滞期相比于低温胁迫1 h有5 503个基因发生了差异表达,其中2 521个基因表达量发生了上调,2 982个基因表达量发生了下调。众所周知,胁迫条件往往导致生物基因组高度不稳定[36]。因此,低温下保持遗传物质准确传递对雪衣藻而言至关重要。如表 2所示,低温下生长停滞期的雪衣藻中碱基切除修复、错配修复及同源重组等与DNA修复途径相关的基因均发生了表达上调。此外,如图 6C和6D所示(图由KEGG网站绘制),在低温下生长停滞期,雪衣藻调整了光合作用系统,下调了捕光复合体和光反应过程相关基因的表达量。同时暗反应固碳过程中的关键基因,甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase, GAPDH)在低温下潜伏期相比于低温胁迫初期表达量上调到282% (P≤0.05),景天庚酮糖-1, 7-二磷酸酶编码基因(sedoheptulose-1,7-bisphosphatase, SBPase)则表达量上调到246% (P≤0.05)。
| Gene ID | log2 (fold change) | Pathway | Function |
| Scaffold008.g26140 | 3.49 | Mismatch repair | PMS2; DNA mismatch repair protein PMS2 |
| Scaffold018.g08000 | 1.96 | Mismatch repair | MSH3; DNA mismatch repair protein MSH3 |
| Scaffold004.g34020 | 1.67 | Mismatch repair | MSH2; DNA mismatch repair protein MSH2 |
| Scaffold007.g48150 | 1.63 | Mismatch repair | MLH1; DNA mismatch repair protein MLH1 |
| Scaffold014.g58030 | 1.29 | Mismatch repair | MSH6; DNA mismatch repair protein MSH6 |
| Scaffold019.g39100 | 2.07 | Base excision repair | mutY; A/G-specific adenine glycosylase [EC: 3.2.2.31] |
| Scaffold014.g29210 | 1.32 | Base excision repair | mutM, fpg; formamidopyrimidine-DNA glycosylase [EC: 3.2.2.23 4.2.99.18] |
| Scaffold021.g07170 | 1.22 | Base excision repair | APEX2; AP endonuclease 2 [EC: 4.2.99.18] |
| Scaffold001.g92090 | 1.00 | Base excision repair | UNG, UDG; uracil-DNA glycosylase [EC: 3.2.2.27] |
| Scaffold002.g05190 | 3.47 | Homologous recombination | BARD1; BRCA1-associated RING domain protein 1 |
| Scaffold014.g34230 | 2.51 | Homologous recombination | MUS81; crossover junction endonuclease MUS81 [EC: 3.1.22.-] |
| Scaffold007.g70030 | 2.25 | Homologous recombination | RAD54B; DNA repair and recombination protein RAD54B [EC: 5.6.2.-] |
| Scaffold008.g31150 | 2.06 | Homologous recombination | BRIP1, BACH1, FANCJ; fanconi anemia group J protein [EC: 5.6.2.3] |
| Scaffold003.g26040 | 1.14 | Homologous recombination | RAD51; DNA repair protein RAD51 |
| Scaffold011.g32080 | 1.05 | Homologous recombination | rec; recombination protein RecA |
最后,我们还关注温度由4 ℃骤升到22 ℃时,雪衣藻基因表达量的变化情况。前面图 1的生理指标结果显示,雪衣藻在温度骤升过程不存在适应期。转录组的结果显示,雪衣藻在由4 ℃转移到22 ℃时,有1 605个基因发生了差异表达,其中940个基因表达量上调,665个基因表达量下调。我们挑选了其中表达量上调显著的前20个基因进行了功能注释分析。如表 3所示,这些基因主要与固碳、糖代谢、氨基酸代谢相关。
| Gene ID | log2 (fold change) | Function |
| Scaffold005.g35100 | 6.29 | Fructose-1, 6-bisphosphatase |
| Scaffold003.g25150 | 6.25 | Phosphoenolpyruvate phosphomutase |
| Scaffold013.g51060 | 6.25 | NA |
| Scaffold020.g61210 | 6.13 | Belongs to the malate synthase family |
| Scaffold013.g53090 | 5.13 | Belongs to the pirin family |
| Scaffold024.g31030 | 4.77 | Phosphoglycerate mutase |
| Scaffold006.g38210 | 4.76 | Procollagen-proline 4-dioxygenase activity |
| Scaffold015.g56000 | 4.72 | NA |
| Scaffold017.g24130 | 4.57 | Zinc finger CCCH domain-containing protein |
| Scaffold039.g00240 | 4.52 | Belongs to the multicopper oxidase family |
| Scaffold017.g15090 | 4.48 | l-threonylcarbamoyladenylate synthase |
| Scaffold013.g36170 | 4.43 | NA |
| Scaffold002.g39070 | 4.19 | NA |
| Scaffold030.g07000 | 4.07 | NA |
| Scaffold030.g07040 | 3.97 | NA |
| Scaffold030.g07020 | 3.93 | NA |
| Scaffold011.g67180 | 3.73 | NA |
| Scaffold024.g45040 | 3.56 | NA |
| Scaffold008.g27380 | 3.50 | Belongs to the Glu Leu Phe Val dehydrogenases family |
| Scaffold019.g29040 | 3.49 | Phosphoenolpyruvate carboxykinase |
| NA: Not available. | ||
3 讨论与结论
在本实验中,我们采用生理实验结合转录组分析的方法,在实验室模拟了自然极地环境中的温度变化。首先将雪衣藻培养于22 ℃的环境中,生长至平台期之后转移到4 ℃下进行生长,待雪衣藻适应4 ℃低温环境后再转移到22 ℃下进行生长。在温度转变过程中,我们探索了雪衣藻生理指标的响应规律,并选择了10个时间点进行转录组的取样。采用构建共表达网络结合差异基因分析的方法,总结得到雪衣藻适应温度变化的机制(图 7)。雪衣藻为了响应环境温度的变化,通过转录因子、RNA结合蛋白及细胞周期控制系统向下游传递温度变化信号,并且信号经cAMP第二信使和磷酸化过程级联放大,从而进一步调控了下游多个代谢过程,如糖代谢通路、活性氧清除系统、光合作用系统及蛋白质质量控制系统等。雪衣藻中,这些系统协同作用来适应温度变化。
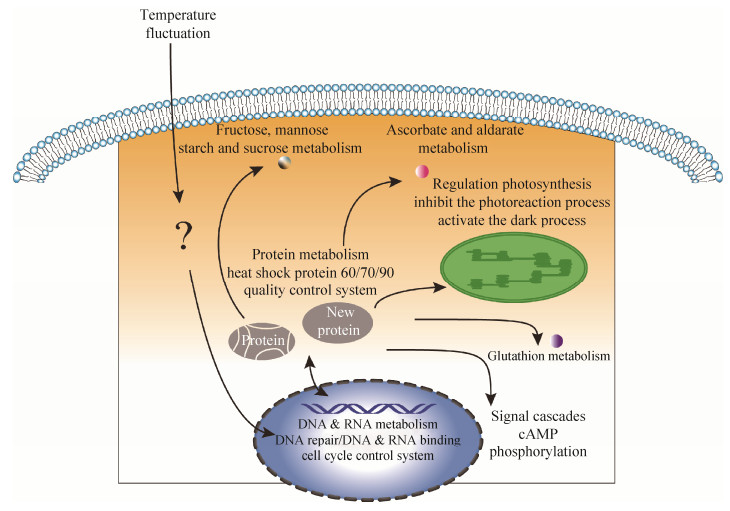
|
| 图 7 雪衣藻适应温度变化机制的概括 Figure 7 Overview of temperature fluctuation adaptation mechanism on Chlamydomonas nivalis. |
生理实验结果显示,雪衣藻在由22 ℃转移到4 ℃的时候,存在为期5 d的生长停滞期,之后才进入生长期,我们推测雪衣藻利用此阶段来调整体内的代谢过程。为了评估温度对雪衣藻光合作用系统的影响,我们测定了雪衣藻叶绿素荧光参数和色素组成的变化。叶绿素荧光参数指标显示,短期的低温胁迫会导致雪衣藻Fv/Fm值骤降,但是经过生长停滞期的适应转变,该值会逐渐恢复,且4 ℃下雪衣藻所能达到Fv/Fm的最大值高于22 ℃下所能达到的最大值。上述情况说明雪衣藻在低温下调整了光合作用系统Ⅱ的反应中心,增强了低温下光合作用潜力。但值得注意的是,转录组数据显示低温下相较于常温下,雪衣藻光合反应中心相关基因表达量保持稳定。鉴于生物的调控机制是多维度的,雪衣藻光合作用系统Ⅱ反应中心的调整还需要结合蛋白质组等其他维度的组学数据进行分析。色素组成的变化显示,低温下雪衣藻中叶绿素(chlorophyll) a/b值和类胡萝卜素含量上升,这与前人的研究结果一致[10]。并且,雪衣藻在低温下平台期依旧能够维持较高的叶绿素a/b值,而由4 ℃低温转移回22 ℃的雪衣藻该值会下降,我们推测低温下的雪衣藻通过减少捕光能力来减少低温对光合作用系统的损伤。该表型与转录组结果一致,低温下雪衣藻中光合作用系统Ⅱ捕光天线相关基因表达量下调。此外,低温下生长停滞期和生长期前期,雪衣藻中单细胞类胡萝卜素含量也上升,说明类胡萝卜素在雪衣藻适应低温胁迫初期起到重要作用。类胡萝卜素是一类重要的脂溶性色素的总称,在植物中具有抗氧化和光保护等众多生理功能[37-39]。关于绿藻门植物的相关研究显示,类胡萝卜素在绿藻光保护中起到重要作用[40]。光合作用是植物生长的主要驱动力,光合作用往往易受到逆境调节下各种不利因素的影响。从生理指标,我们推测雪衣藻通过调整代谢及重组光合作用系统来适应环境温度变化。
鉴于前人[10-11]观察到低温下雪衣藻胞外多糖增加及细胞内无明显氧化损伤的表型,我们重点关注温度变化下雪衣藻糖代谢通路和活性氧清除物质合成代谢通路相关基因的表达变化。转录组的数据分析结果显示:雪衣藻中果糖甘露糖代谢通路、淀粉蔗糖代谢通路、谷胱甘肽代谢通路和抗坏血酸醛酸盐代谢通路中关键基因的表达量响应温度变化过程。海藻糖已经被证明在耐胁迫以及提高植物的抗逆性中起到重要作用[41]。还原型谷胱甘肽和抗坏血酸等物质参与的活性氧清除系统也在植物耐受逆境胁迫中起到重要作用。植物中抗坏血酸含量与植物的抗逆性往往呈正相关[42]。谷胱甘肽也可以直接或间接清除植物中的ROS,提高植物的耐受性[43]。我们推测上述糖代谢和活性氧清除过程在雪衣藻适应温度变化的过程中起到重要作用。
通过基因共表达网络分析和基因差异表达分析结果可知:转移到4 ℃低温下短期内,雪衣藻转录因子、RNA结合蛋白等上游调控因子及磷代谢、磷酸化调节相关蛋白的编码基因响应温度骤降过程,这与Peng等11]的研究结果一致。此外我们还发现,雪衣藻中用于储存氨基酸的cupin蛋白家族成员基因表达量响应温度骤降过程。bHLH是重要的转录因子家族,在调节植物生长发育和抗逆等方面起到重要作用,于是我们进一步对其进行了共表达网络分析,结果发现与之关系紧密的基因功能多与磷酸化修饰和cAMP合成等相关。我们推测低温胁迫的初期,雪衣藻可能通过信号级联放大系统向下游传递温变信息。其次,鉴于雪衣藻在低温下存在生长停滞期,因此响应该阶段的通路被认为在雪衣藻适应低温的过程中起到重要作用,响应该阶段的基因模块富集到蛋白质合成和蛋白质质量控制系统,同时分子伴侣的编码基因表达量在该阶段上调。因此,我们推测低温下雪衣藻通过维持蛋白质结构折叠正常,来保证细胞中生理和代谢活动正常进行。此外,低温生长停滞期还富集到细胞周期调控和染色质高级结构组织相关的通路,以确保雪衣藻在低温下恢复生长增殖状态。由于胁迫条件往往导致遗传物质的高度不稳定,雪衣藻在逆境增殖过程中维持遗传物质的保真性能力至关重要。本研究发现低温下生长停滞期,雪衣藻内碱基切除修复、错配修复和同源重组等DNA纠错和修复通路均有相应的基因表达上调,DNA修复机制也在适应温度变化中起到重要作用。
综上所述,我们目前仅从转录组角度揭示了雪衣藻响应温度变化背后的分子机制。但是雪衣藻适应温度变化是一个复杂的过程。随着组学技术的发展,可以结合代谢组、蛋白质组和翻译组等多维度组学数据,全方位对雪衣藻响应温度变化背后的分子机制进行探究。鉴于目前普遍认为高等植物是由绿藻纲某一分支演化而来,随着转基因技术的发展和普及,雪衣藻响应温度胁迫的分子机制研究可以为我们提供丰富的抗逆基因资源库,从而便于我们后期进行遗传改良和分子育种。
致谢
感谢中国科学院水生生物研究所分析测试中心乔志仙和柴小翠提供转录组测序帮助。感谢郑州市儿童医院马晓翠和中国科学院水生生物研究所姚艳欣对本文提供的指导和帮助。
| [1] | HOHAM RW, DUVAL B, JONES HG, POMEROY JW, WALKER DA, HOHAM RW. Microbial Ecology of Snow and Freshwater Ice with Emphasis on Snow Algae. Cambridge: Cambridge University Press, 2001. |
| [2] | WILLIAMS WE, GORTON HL, VOGELMANN TC. Surface gas-exchange processes of snow algae. Proceedings of the National Academy of Sciences of the United States of America, 2003, 100(2): 562-566. DOI:10.1073/pnas.0235560100 |
| [3] | HISAKAWA N, QUISTAD SD, HESTER ER, MARTYNOVA D, MAUGHAN H, SALA E, GAVRILO MV, ROHWER F. Metagenomic and satellite analyses of red snow in the Russian Arctic. PeerJ, 2015, 3: e1491. DOI:10.7717/peerj.1491 |
| [4] | CVETKOVSKA M, HÜNER NPA, SMITH DR. Chilling out: the evolution and diversification of psychrophilic algae with a focus on Chlamydomonadales. Polar Biology, 2017, 40(6): 1169-1184. DOI:10.1007/s00300-016-2045-4 |
| [5] | LUKEŠ M, PROCHÁZKOVÁ L, SHMIDT V, NEDBALOVÁ L, KAFTAN D. Temperature dependence of photosynthesis and thylakoid lipid composition in the red snow alga Chlamydomonas Cf. nivalis (Chlorophyceae). FEMS Microbiology Ecology, 2014, 89(2): 303-315. DOI:10.1111/1574-6941.12299 |
| [6] | MATSUZAKI R, HARA Y, NOZAKI H. A taxonomic revision of Chloromonas reticulata (Volvocales, Chlorophyceae), the type species of the genus Chloromonas, based on multigene phylogeny and comparative light and electron microscopy. Phycologia, 2012, 51(1): 74-85. DOI:10.2216/11-18.1 |
| [7] | PROCHÁZKOVÁ L, LEYA T, KŘÍŽKOVÁ H, NEDBALOVÁ L. Sanguina nivaloides and Sanguina aurantia gen. et spp. nov. (Chlorophyta): the taxonomy, phylogeny, biogeography and ecology of two newly recognised algae causing red and orange snow. FEMS Microbiology Ecology, 2019, 95(6): fiz064. DOI:10.1093/femsec/fiz064 |
| [8] | KAWECKA B. Biology and ecology of snow algae 2. Formation of aplanospores in Chlamydomonas nivalis (Bauer) Wille (Chlorophyta, Volvocales). Acta Hydrobiologica, 1981, 23(3): 211-215. |
| [9] | MOSSER JL, MOSSER AG, BROCK TD. Photosynthesis in the snow: the alga chlamydomonas nivalis (Chlorophyceae). Journal of Phycology, 1977, 13(1): 22-27. DOI:10.1111/j.1529-8817.1977.tb02881.x |
| [10] | ZHENG YL, XUE CL, CHEN H, HE CL, WANG Q. Low-temperature adaptation of the snow alga Chlamydomonas nivalis is associated with the photosynthetic system regulatory process. Frontiers in Microbiology, 2020, 11: 1233. DOI:10.3389/fmicb.2020.01233 |
| [11] | PENG Z, LIU G, HUANG KY. Cold adaptation mechanisms of a snow alga Chlamydomonas nivalis during temperature fluctuations. Frontiers in Microbiology, 2021, 11: 611080. DOI:10.3389/fmicb.2020.611080 |
| [12] | LICHTENTHALER HK. Chlorophylls and carotenoids: pigments of photosynthetic biomembranes. Methods in Enzymology, 1987, 148: 350-382. |
| [13] | LANGFELDER P, HORVATH S. WGCNA: an R package for weighted correlation network analysis. BMC Bioinformatics, 2008, 9: 559. DOI:10.1186/1471-2105-9-559 |
| [14] | SHANNON P, MARKIEL A, OZIER O, BALIGA NS, WANG JT, RAMAGE D, AMIN ND, SCHWIKOWSKI B, IDEKER T. Cytoscape: a software environment for integrated models of biomolecular interaction networks. Genome Research, 2003, 13(11): 2498-2504. DOI:10.1101/gr.1239303 |
| [15] | LOVE MI, HUBER W, ANDERS S. Moderated estimation of fold change and dispersion for RNA-seq data with DESeq2. Genome Biology, 2014, 15(12): 550. DOI:10.1186/s13059-014-0550-8 |
| [16] | KANEHISA M, GOTO S. KEGG: Kyoto encyclopedia of genes and genomes. Nucleic Acids Research, 2000, 28(1): 27-30. DOI:10.1093/nar/28.1.27 |
| [17] | HUERTA-CEPAS J, FORSLUND K, COELHO LP, SZKLARCZYK D, JENSEN LJ, von MERING C, BORK P. Fast genome-wide functional annotation through orthology assignment by eggNOG-mapper. Molecular Biology and Evolution, 2017, 34(8): 2115-2122. DOI:10.1093/molbev/msx148 |
| [18] | THIMM O, BLÄSING O, GIBON Y, NAGEL A, MEYER S, KRÜGER P, SELBIG J, MÜLLER LA, RHEE SY, STITT M. MAPMAN: a user-driven tool to display genomics data sets onto diagrams of metabolic pathways and other biological processes. The Plant Journal: for Cell and Molecular Biology, 2004, 37(6): 914-939. DOI:10.1111/j.1365-313X.2004.02016.x |
| [19] | YU GC, WANG LG, HAN YY, HE QY. clusterProfiler: an R package for comparing biological themes among gene clusters. Omics: A Journal of Integrative Biology, 2012, 16(5): 284-287. DOI:10.1089/omi.2011.0118 |
| [20] | DEMETRIOU G, NEONAKI C, NAVAKOUDIS E, KOTZABASIS K. Salt stress impact on the molecular structure and function of the photosynthetic apparatus—the protective role of polyamines. Biochimica et Biophysica Acta: BBA-Bioenergetics, 2007, 1767(4): 272-280. DOI:10.1016/j.bbabio.2007.02.020 |
| [21] | ZHANG YM, CHEN H, HE CL, WANG Q. Nitrogen starvation induced oxidative stress in an oil-producing green alga Chlorella sorokiniana C3. PLoS One, 2013, 8(7): e69225. DOI:10.1371/journal.pone.0069225 |
| [22] | ROSA M, PRADO C, PODAZZA G, INTERDONATO R, GONZÁLEZ JA, HILAL M, PRADO FE. Soluble sugars. Plant Signaling & Behavior, 2009, 4(5): 388-393. |
| [23] | MA YY, ZHANG YL, LU J, SHAO HB. Roles of plant soluble sugars and their responses to plant cold stress. African Journal of Biotechnology, 2009, 8(10): 2004-2010. |
| [24] | ROUX C, GRESH N, PERERA LE, PIQUEMAL JP, SALMON L. Binding of 5-phospho-D-arabinonohydroxamate and 5-phospho-D-arabinonate inhibitors to zinc phosphomannose isomerase from Candida albicans studied by polarizable molecular mechanics and quantum mechanics. Journal of Computational Chemistry, 2007, 28(5): 938-957. DOI:10.1002/jcc.20586 |
| [25] | BADEJO AA, ELTELIB HA, FUKUNAGA K, FUJIKAWA Y, ESAKA M. Increase in ascorbate content of transgenic tobacco plants overexpressing the acerola (Malpighia glabra) phosphomannomutase gene. Plant and Cell Physiology, 2009, 50(2): 423-428. |
| [26] | QIAN WQ, YU CM, QIN HJ, LIU X, ZHANG AM, JOHANSEN IE, WANG DW. Molecular and functional analysis of phosphomannomutase (PMM) from higher plants and genetic evidence for the involvement of PMM in ascorbic acid biosynthesis in Arabidopsis and Nicotiana benthamiana. The Plant Journal: for Cell and Molecular Biology, 2007, 49(3): 399-413. DOI:10.1111/j.1365-313X.2006.02967.x |
| [27] | GRANOT D, KELLY G, STEIN O, DAVID-SCHWARTZ R. Substantial roles of hexokinase and fructokinase in the effects of sugars on plant physiology and development. Journal of Experimental Botany, 2013, 65(3): 809-819. |
| [28] | BLÁZQUEZ MA, SANTOS E, FLORES CL, MARTÍNEZ-ZAPATER JM, SALINAS J, GANCEDO C. Isolation and molecular characterization of the Arabidopsis TPS1 gene, encoding trehalose-6-phosphate synthase. The Plant Journal: for Cell and Molecular Biology, 1998, 13(5): 685-689. DOI:10.1046/j.1365-313X.1998.00063.x |
| [29] | VOGEL G, AESCHBACHER RA, MÜLLER J, BOLLER T, WIEMKEN A. Trehalose-6-phosphate phosphatases from Arabidopsis thaliana: identification by functional complementation of the yeast tps2 mutant. The Plant Journal: for Cell and Molecular Biology, 1998, 13(5): 673-683. DOI:10.1046/j.1365-313X.1998.00064.x |
| [30] | WANG L, CUI N, ZHANG KY, FAN HY, LI TL. Research advance of sucrose phosphate synthase (SPS) in higher plant. International Journal of Agriculture and Biology, 2013, 15(6): 1221-1226. |
| [31] | MAY MJ, VERNOUX T, LEAVER C, MONTAGU MV, INZÉ D. Glutathione homeostasis in plants: implications for environmental sensing and plant development. Journal of Experimental Botany, 1998, 49(321): 649-667. |
| [32] | GÉRARD-MONNIER D, CHAUDIERE J. Metabolism and antioxidant function of glutathione. Pathologie-biologie, 1996, 44(1): 77-85. |
| [33] | GALLIE DR. l-ascorbic acid: a multifunctional molecule supporting plant growth and development. Scientifica, 2013, 2013: 795964. |
| [34] |
WANG C, LAN HY. Research progresses on functions of plant bHLH transcription factors involved in abiotic stresses. Life Science Research, 2016, 20(4): 358-364.
(in Chinese) 王翠, 兰海燕. 植物bHLH转录因子在非生物胁迫中的功能研究进展. 生命科学研究, 2016, 20(4): 358-364. DOI:10.16605/j.cnki.1007-7847.2016.04.013 |
| [35] | SHUTOV AD, KAKHOVSKAIA IA. Evolution of seed storage globulins and cupin superfamily. Molekuliarnaia Biologiia, 2011, 45(4): 579-585. |
| [36] | ROY S. Maintenance of genome stability in plants: repairing DNA double strand breaks and chromatin structure stability. Frontiers in Plant Science, 2014, 5: 487. |
| [37] | HASHIMOTO H, URAGAMI C, COGDELL RJ. Carotenoids and photosynthesis. Sub-Cellular Biochemistry, 2016, 79: 111-139. |
| [38] | HAVAUX M. Carotenoids as membrane stabilizers in chloroplasts. Trends in Plant Science, 1998, 3(4): 147-151. DOI:10.1016/S1360-1385(98)01200-X |
| [39] | RAMEL F, BIRTIC S, GINIES C, SOUBIGOU-TACONNAT L, TRIANTAPHYLIDÈS C, HAVAUX M. Carotenoid oxidation products are stress signals that mediate gene responses to singlet oxygen in plants. PNAS, 2012, 109(14): 5535-5540. DOI:10.1073/pnas.1115982109 |
| [40] | YONG YYR, LEE YK. Do carotenoids play a photoprotective role in the cytoplasm of Haematococcus lacustris (Chlorophyta)?. Phycologia, 1991, 30(3): 257-261. DOI:10.2216/i0031-8884-30-3-257.1 |
| [41] | JANG IC, OH SJ, SEO JS, CHOI WB, SONG SI, KIM CH, KIM YS, SEO HS, CHOI YD, NAHM BH, KIM JK. Expression of a bifunctional fusion of the Escherichia coli genes for trehalose-6-phosphate synthase and trehalose-6-phosphate phosphatase in transgenic rice plants increases trehalose accumulation and abiotic stress tolerance without stunting growth. Plant Physiology, 2003, 131(2): 516-524. |
| [42] | GALLIE DR. The role of l-ascorbic acid recycling in responding to environmental stress and in promoting plant growth. Journal of Experimental Botany, 2012, 64(2): 433-443. |
| [43] | XIA ZL, XU ZW, WEI YY, WANG MP. Overexpression of the maize sulfite oxidase increases sulfate and GSH levels and enhances drought tolerance in transgenic tobacco. Frontiers in Plant Science, 2018, 9: 298. |
 2023, Vol. 63
2023, Vol. 63