
中国科学院微生物研究所,中国微生物学会
文章信息
- 花琳, 吴敏, 章纬, 刘小平, 刘涛峰, 邵菁, 汪天明, 汪长中. 2023
- HUA Lin, WU Min, ZHANG Wei, LIU Xiaoping, LIU Taofeng, SHAO Jing, WANG Tianming, WANG Changzhong.
- 荆皮癣湿酊诱导红色毛癣菌凋亡的机制研究
- Jingpixian tincture induces apoptosis of Trichophyton rubrum
- 微生物学报, 63(5): 1982-1990
- Acta Microbiologica Sinica, 63(5): 1982-1990
-
文章历史
- 收稿日期:2023-03-17
2. 安徽省中医药科学院中西医结合研究所, 安徽 合肥 230012;
3. 安徽中医药大学第一附属医院皮肤科, 安徽 合肥 230031
2. Institute of Integrated Traditional Chinese and Western Medicine, Anhui Academy of Chinese Medicine, Hefei 230012, Anhui, China;
3. Department of Dermatology, the First Affiliated Hospital of Anhui University of Chinese Medicine, Hefei 230031, Anhui, China
红色毛癣菌(Trichophyton rubrum)是导致慢性、广泛和浅部皮肤癣菌病的主要致病真菌,可通过感染身体各个部位造成体癣、头癣、甲癣和足癣等浅表真菌感染[1]。传统的抗真菌感染药物主要有唑类、烯丙胺类和多烯类。随着抗真菌药物的长期使用,致病真菌对其逐渐产生了耐药性,甚至是多重耐药[2],导致发病率和复发率逐年上升,居高不下,影响到人们的生活质量和健康,因此人们开始从中草药中寻找更加高效、安全和毒性更低的抗真菌药物。
荆皮癣湿酊(Jingpixian tincture, JPXT)是安徽中医药大学第一附属医院开发的院内制剂,由土荆皮、蛇床子、苦参和百部等中药组成,临床主要用于治疗足癣等癣病,临床治疗效果显著。本课题组之前的研究发现,JPXT对T. rubrum有较强的抗菌作用,但抗T. rubrum感染的具体机制尚不明确[3]。本研究将在课题组前期研究的基础上,进一步探讨JPXT对T. rubrum凋亡的影响,为其抗T. rubrum感染提供有力的实验依据。
1 材料与方法 1.1 菌株和药物红色毛癣菌标准菌株ATCC MYA-4438购自广东省微生物菌种保藏中心(Guangdong Microbial Culture Collection Center, GDMCC),在马铃薯葡萄糖琼脂培养基上连续转种2次,进行培养和鉴定,选取生长状态良好的菌落进行传代。
荆皮癣湿酊购自安徽中医药大学第一附属医院西药房。
1.2 试剂马铃薯葡萄糖琼脂平板购自广东环凯微生物科技有限公司;磷酸盐缓冲液(phosphate buffered solution, PBS)购自HyClone;胎牛血清(fetal bovine serum, FBS)购自Biological Industries (BI);活性氧(reactive oxygen species, ROS)检测试剂盒,线粒体膜电位检测试剂盒,胰酶购自碧云天生物科技有限公司;细胞计数试剂盒-8 (cell counting kit-8, CCK-8)购自博奥森生物科技有限公司;Annexin Ⅴ-FITC/PI凋亡试剂盒购自联科生物科技有限公司;细胞色素C氧化酶活性测定试剂盒购自南京建成科技有限公司;蜗牛酶购自PHYGENE;二硫苏糖醇(dithiothreitol, DTT)购自QASEG;无水磷酸氢二钾购自麦克林生化科技有限公司;两性霉素B (amphotericin B, AmB)购自合肥博美生物科技有限公司;氢氧化钾购自上海沪试实验室器材有限公司;FITC-VAD-FMK试剂盒购自Promega。
1.3 仪器倒置显微镜(OLYMPUS);高速冷冻离心机(Eppendorf);电热恒温培养箱(上海跃进医疗器械有限公司);低速离心机(湖南可成仪器设备有限公司);紫外可见分光光度计(Eppendorf);流式细胞仪(Beckman Counter Life Sciences);全波长酶标仪(BioTek);涡旋混合器(其林贝尔仪器制造有限公司)。
1.4 菌液的配制将T. rubrum ATCC MYA-4438接种于马铃薯葡萄糖琼脂培养基,28 ℃培养7−14 d。吸取1 mL无菌的0.9% NaCl溶液覆盖菌落,用移液器尖端或无菌拭子轻轻摩擦菌落,将菌悬液转移至无菌EP管中,振荡器振荡15 s,血细胞计数板计数,液体沙氏葡萄糖琼脂(Sabouraud dextrose agar, SDA)培养基调整菌悬液浓度为2×106 CFU/mL,备用。
1.5 T. rubrum凋亡诱导及原生质体的制备[4-5]将2 mL (浓度为2×106 CFU/mL)的菌悬液接种于24孔培养板,同时将2 mL JPXT [终浓度为1/2最低抑菌浓度(minimum inhibitory concentration, MIC)、1 MIC]分别加入孔板中,另设不加药的空白组和阳性对照药组(0.5 μg/mL AmB),28 ℃静置孵育16 h,PBS缓冲液清洗3次,然后对各组细胞进行脱壁处理,步骤如下:加入预先配好的脱壁促进剂(50 mmol/L K2HPO4, 5 mol/L EDTA, 50 mmol/L DTT),温和摇晃均匀,于28 ℃恒温培养箱中孵育30 min,PBS缓冲液清洗2次,转移至1.5%蜗牛酶溶液中,28 ℃恒温培养箱中孵育45 min,PBS缓冲液清洗2次,得到已脱壁的原生质体状态的T. rubrum。
1.6 CCK-8法检测JPXT对T. rubrum生长活力的影响[6]T. rubrum在PDA固体平板上活化后,以液体SDA培养基稀释菌悬液至2×106 CFU/mL。向菌悬液中加入JPXT (终浓度为1/2 MIC、1 MIC),置于28 ℃恒温培养箱中孵育6 d,并在不同时间点按照CCK-8检测试剂盒说明书,每孔加入10 μL CCK8溶液,继续培养3 h。用酶标仪在450 nm波长处测定各孔的吸光值。
1.7 流式细胞仪检测线粒体膜电位水平[6]T. rubrum在PDA固体平板上活化后,以液体SDA培养基稀释菌悬液至2×106 CFU/mL。向菌悬液中加入JPXT (终浓度为1/2 MIC、1 MIC),设置阳性对照组(0.5 μg/mL AmB)和不加药的空白对照组,置于28 ℃恒温培养箱中孵育4 h。按照线粒体膜电位检测试剂盒说明书,加入2.5 μg/mL JC-1染色工作液并于37 ℃、5% CO2的培养箱中孵育20 min,离心收集真菌细胞,弃上清。JC-1染色缓冲液洗涤真菌细胞2次,并以JC-1染色缓冲液重悬细胞,流式细胞仪检测线粒体膜电位(mitochondrial membrane potential, MMP)水平并分析结果。
1.8 流式细胞仪检测ROS水平[6]按照活性氧检测试剂盒说明书在脱壁后的菌悬液中加入浓度为10 μmol/L DCFH-DA试剂,37 ℃孵育30 min,期间每隔3−5 min颠倒混匀1次,使探针和细胞充分作用。再用PBS缓冲液洗涤细胞3次,以去除未进入细胞内的DCFH-DA。流式细胞仪检测DCFH-DA的荧光强度。
1.9 AnnexinV-FITC/PI染色并以流式细胞仪检测细胞凋亡率[7]收集上述经过药物干预与脱壁处理的真菌细胞,用预冷的PBS缓冲液洗涤2次,按照Annexin Ⅴ-FITC/PI凋亡试剂盒说明书,用双蒸水将5×Binding Buffer稀释为1×工作液,取500 μL 1×Binding Buffer悬浮真菌细胞,每管加入5 μL Annexin Ⅴ-FITC,轻轻混匀后,4 ℃避光孵育15 min,对细胞膜上的磷脂酰丝氨酸(phosphatidylserine, PS)进行标记。再加入10 μL碘化丙啶(propidium iodide, PI)染液,轻轻混匀后,室温避光孵育5 min,对坏死细胞进行染色,在荧光显微镜下观察真菌细胞PS外翻情况并用流式细胞仪对细胞凋亡率进行分析。
1.10 偏半胱天冬酶(metacaspase)酶活性的测定[7]收集上述经过药物干预与脱壁处理的真菌细胞,用预冷的PBS缓冲液洗涤2次,加入100 μL 10 mol/L FITC-VAD-FMK,28 ℃避光染色1 h后,均匀涂布于含有多聚赖氨酸的洁净载玻片上,置于荧光显微镜下观察并拍照。
1.11 细胞色素C氧化酶活性的测定[7]将经上述药物处理后的T. rubrum置于28 ℃恒温培养箱中孵育12 h,收集真菌细胞,严格按照细胞色素C氧化酶活性测定试剂盒说明书操作,在25 ℃条件下、550 nm波长处测得细胞色素C氧化酶活性。
1.12 统计学分析选用SPSS 23.0统计软件进行统计分析,单因素方差分析(one-way analysis of variance, one-way ANOVA)检验进行组间统计学分析,计量资料均以平均数±标准差(x±s)表示,P < 0.05为差异有统计学意义,并以GraphPad Prism 8.0软件作图。
2 结果与分析 2.1 JPXT对T. rubrum生长活力的影响为了明确JPXT对T. rubrum ATCC MYA-4438生长活力的影响,检测了不同培养时间点的细胞活力。与空白对照组相比,JPXT (1/2 MIC、1 MIC)处理后的T. rubrum细胞活力有所降低,并且表现出剂量依赖性,表明JPXT对T. rubrum的活力具有抑制效果(图 1)。

|
| 图 1 JPXT对Trichophyton rubrum生长活力的影响 Figure 1 Effects of JPXT on the growth activity of Trichophyton rubrum. Data represent mean±SEM. |
2.2 JPXT可显著降低T. rubrum线粒体膜电位
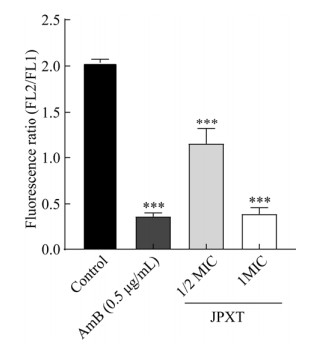
真菌细胞线粒体膜通透性增高引起膜电位水平下降是凋亡早期的典型标志之一。本研究采用JC-1作为荧光探针,在正常情况下,JC-1可以通过线粒体膜,作为聚集物存在,发出红色或橙红色荧光。但在凋亡细胞中,由于MMP的改变,JC-1被释放到细胞质中并发出绿色荧光。通过测定JC-1从红色到绿色荧光的转变(FL2/FL1)来测定MMP的变化。实验结果显示(图 2),与空白对照组FL2/FL1值(2.04)相较,0.5 μg/mL AmB可使FL2/FL1值降至为0.36,1/2 MIC、1 MIC JPXT干预后,FL2/FL1值分别降低为1.21和0.39,说明JPXT可降低T. rubrum线粒体膜电位水平,且随着JPXT浓度的升高而增强(P < 0.001)。
|
| 图 2 JPXT对Trichophyton rubrum线粒体膜电位水平的影响 Figure 2 Effects of JPXT on mitochondrial membrane potential of Trichophyton rubrum. Data represent mean±SEM. ***: P < 0.001. |
2.3 JPXT可提高T. rubrum细胞内活性氧水平的影响
与空白对照组相比,阳性药AmB组ROS水平大幅度升高,JPXT (1/2 MIC、1 MIC)干预后,T. rubrum内ROS水平表现出不同程度的上升,但低于阳性药组(图 3)。

|
| 图 3 JPXT对Trichophyton rubrum细胞内ROS水平的影响 Figure 3 Effects of JPXT on intracellular ROS levels in Trichophyton rubrum. Data represent mean±SEM. *: P < 0.05; **: P < 0.01; ***: P < 0.001. |
2.4 JPXT可诱导T. rubrum PS外翻
PS外翻作为真菌细胞凋亡早期的标志,当处于正常生理条件下时,磷脂酰丝氨酸位于细胞膜内侧,而在凋亡发生的早期,由于细胞内ATP缺乏,胞浆Ca2+浓度增加,使其可以翻转至膜表面,并与膜联蛋白(Annexin Ⅴ)发生特异性结合,因此Annexin Ⅴ能够作为检测细胞凋亡早期的指标。碘化丙啶(propidium iodide, PI)染液是一种无法透过细胞膜的红色荧光染料,可对凋亡晚期及坏死细胞染色。Annexin Ⅴ与PI的结合使用可以有效分辨早、晚期凋亡细胞。
实验结果如图 4所示,与空白对照组相比,阳性药AmB组绿色荧光细胞数量较多。经JPXT处理后的细胞中,随着药物浓度的增高,绿色荧光细胞数量增多,但少于阳性药组,表明PS已由细胞膜内侧翻转到细胞膜表面,提示JPXT能够诱导T. rubrum凋亡。

|
| 图 4 JPXT对Trichophyton rubrum磷脂酰丝氨酸外翻的影响(×200) Figure 4 Effects of JPXT on phosphatidylserine externalization in Trichophyton rubrum (×200). A: Blank control. B: 0.5 μg/mL AmB. C: 1/2 MIC. D: 1 MIC. |
2.5 JPXT可显著提高T. rubrum凋亡率
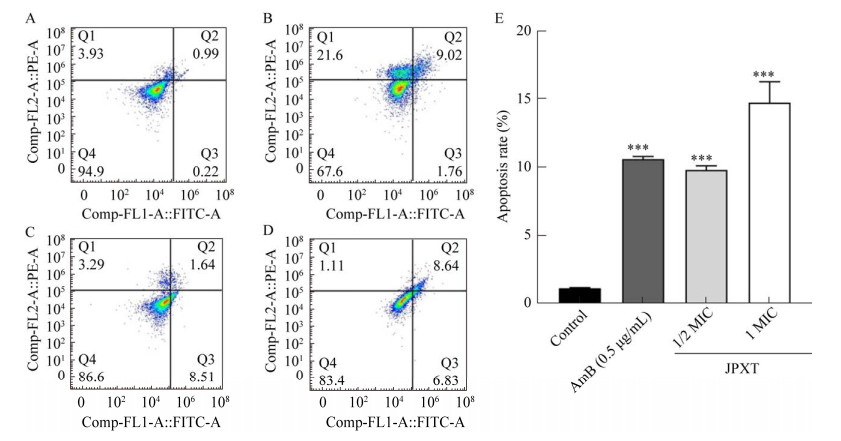
利用流式细胞仪检测JPXT对T. rubrum凋亡率的影响,结果显示(图 5),与空白对照组凋亡率(1.17%)相比较,阳性药AmB组的凋亡率为10.64%,而1/2 MIC、1 MIC JPXT的凋亡率分别为9.85%、14.77%,差异具有统计学意义(P < 0.001)。
|
| 图 5 JPXT对Trichophyton rubrum凋亡率的影响 Figure 5 Effects of JPXT on apoptosis rate in Trichophyton rubrum. Flow cytometric analysis with FITC- labeled Annexin Ⅴ staining at the early stage of apoptosis in Trichophyton rubrum. A: Control. B: 0.5 μg/mL AmB. C: 1/2 MIC. D: 1 MIC. E: Apoptosis rate of T. rubrum. Data represent mean±SEM. ***: P < 0.001. |
2.6 JPXT可激活T. rubrum metacaspase活性
Caspase是一组半胱氨酸蛋白酶,负责选择性地剪切某些蛋白。在丝状真菌中,metacaspase是caspase的同源结构类似物。过往研究表明,约有40%的真菌细胞凋亡由metacaspase介导[8]。ROS的累积可以激活metacaspase的活性,因此本研究采用FITC-VAD-FMK检测T. rubrum细胞中metacaspase的活性。
如图 6所示,与空白对照组相比,阳性药AmB组的metacaspase活性显著升高,JPXT(1/2 MIC)处理后的真菌细胞的绿色荧光较为微弱,而JPXT (1 MIC)与阳性药组显示明亮的绿色荧光,提示JPXT激活了T. rubrum细胞内的metacaspase。

|
| 图 6 JPXT对Trichophyton rubrum metacaspase酶活性的影响(×400) Figure 6 Effects of JPXT on metacaspase activity in Trichophyton rubrum (×400). A: Control. B: 0.5 μg/mL AmB. C: 1/2 MIC. D: 1 MIC. |
2.7 JPXT可降低细胞色素C氧化酶的活性
细胞色素C氧化酶(cytochrome C oxidase, COX)位于真核生物线粒体上,为线粒体电子传递链末端氧化酶,通过氧化磷酸化提供为生命活动提供所需能量。相关研究认为COX活性的降低不仅会使ATP水平下降,促进细胞凋亡,而且会导致MMP下降,膜电位通透转换孔打开,细胞色素C释放进入胞浆,启动caspase系统,最终诱导细胞凋亡。
如图 7所示,与空白对照组相比,阳性药AmB组COX活性大幅降低,JPXT也可降低COX活性,并随着JPXT浓度的升高而降低,表现为剂量依赖性,差异具有统计学意义(P < 0.001)。

|
| 图 7 JPXT对Trichophyton rubrum细胞色素C氧化酶活性的影响 Figure 7 Effects of JPXT on cytochrome C oxidase activity in Trichophyton rubrum. Data represent mean±SEM. ***: P < 0.001. |
3 讨论与结论
皮肤癣菌病是由病原真菌侵犯和感染人的角化组织如毛发、皮肤和指甲等所引起的,主要表现为局部红肿、炎症等。常见的致病真菌有表皮癣菌属、小孢子菌属和毛癣菌属。近年来耐药菌株的出现与增加,使得真菌感染复发的频率逐步升高,为皮肤癣菌病的治疗带来了新的挑战[9]。
细胞凋亡是真核生物中一种保守的程序性死亡机制,由基因调控,在清除受损或衰老细胞、维持细胞动态平衡等方面发挥重要作用。细胞凋亡可导致细胞形态学的改变,如细胞皱缩、染色体凝结和DNA裂解等[10],也表现为ROS的蓄积[11]、metacaspase的激活[12]、细胞色素C氧化酶活性及线粒体膜电位降低、细胞凋亡率的升高和细胞膜内侧PS外翻等。因诱发因素不同,凋亡过程也有所不同,通常包括线粒体通路、内质网通路及死亡受体通路等途径[13]。
T. rubrum属于丝状真菌,是一种重要的病原体,它会引起大多数皮肤癣菌病,引发全世界范围内的公共卫生问题,目前对其凋亡现象相关的研究较少。近年来研究表明,过氧化氢[14]、特比萘酚[15]和两性霉素B[16]等药物在适当浓度下均可诱导真菌细胞凋亡,表明有望通过药物干预诱导T. rubrum凋亡,成为防治T. rubrum感染的新策略。
JPXT是由土荆皮、蛇床子、苦参、百部、苯甲酸和水杨酸组成的中药复方制剂,本课题组之前的研究发现,JPXT对T. rubrum具有良好的抑制作用[3]。其中,经JPXT处理的T. rubrum表现出ROS水平的大幅提升,提示其抗真菌机制可能与诱导T. rubrum细胞凋亡有关。为了区分凋亡与其他类型的细胞死亡,本研究采用多种方法联合检测多个凋亡特征以确定JPXT对诱导T. rubrum凋亡的影响及机制。
已有研究发现线粒体在细胞凋亡中发挥重要作用[17-19]。当线粒体受到ROS的破坏时会产生氧化应激反应,诱导细胞发生凋亡,细胞因此会产生更多的ROS[20]。本研究结果发现,JPXT处理后T. rubrum的生长活力明显受到抑制,ROS水平上升,MMP水平下降,提示ROS造成的氧化损伤破坏了线粒体稳态,并导致MMP的改变。
JPXT干预后,细胞色素C氧化酶活性有所降低,导致呼吸链断裂,不仅使ATP水平降低,还会引起ROS的过度生成[21]。Metacaspase是在真菌中参与凋亡途径的半胱氨酸依赖型蛋白酶[12],caspase受体FITC-FMK-VAD可以用来检测真菌中metacaspase酶活性[22]。JPXT处理后,T. rubrum metacaspase酶也被激活。本研究进行了AnnexinV-FITC/PI染色,观察到JPXT干预后的T. rubrum细胞膜PS从细胞膜内侧翻转至表面,表明菌体凋亡。流式细胞仪检测结果也进一步证实,JPXT可提高T. rubrum细胞凋亡率。由于T. rubrum具有较厚的细胞壁,因此在进行AnnexinV-FITC/PI染色及凋亡检测时需先采用脱壁促进剂将其制成原生质体状态,再进行相关实验。
综合上述研究结果表明,JPXT可通过诱导T. rubrum凋亡来发挥抗真菌作用,为JPXT在临床上治疗T. rubrum引起的真菌感染提供了重要的实验依据,进一步丰富了中药抗真菌感染的科学理论,也为药物以诱导细胞凋亡的方式治疗真菌感染性疾病带来新的启发。
| [1] | MARTINEZ DA, OLIVER BG, GRÄSER Y, GOLDBERG JM, LI WJ, MARTINEZ-ROSSI NM, MONOD M, SHELEST E, BARTON RC, BIRCH E, BRAKHAGE AA, CHEN ZH, GURR SJ, HEIMAN D, HEITMAN J, KOSTI I, ROSSI A, SAIF S, SAMALOVA M, SAUNDERS CW, et al. Comparative genome analysis of Trichophyton rubrum and related dermatophytes reveals candidate genes involved in infection. mBio, 2012, 3(5): e00259-e00212. |
| [2] | EBERT A, MONOD M, SALAMIN K, BURMESTER A, UHRLAß S, WIEGAND C, HIPLER UC, KRÜGER C, KOCH D, WITTIG F, VERMA SB, SINGAL A, GUPTA S, VASANI R, SARASWAT A, MADHU R, PANDA S, DAS A, KURA MM, KUMAR A, et al. Alarming India-wide phenomenon of antifungal resistance in dermatophytes: a multicentre study. Mycoses, 2020, 63(7): 717-728. DOI:10.1111/myc.13091 |
| [3] |
HUA L, WU M, ZHANG W, LIU XP, LIU TF, SHAO J, WANG TM, WANG CZ. Mechanism of Jingpixian tincture against Trichophyton rubrum. Acta Microbiologica Sinica, 2023, 63(3): 1035-1046.
(in Chinese) 花琳, 吴敏, 章纬, 刘小平, 刘涛峰, 邵菁, 汪天明, 汪长中. 荆皮癣湿酊对红色毛癣菌的抗菌作用机制. 微生物学报, 2023, 63(3): 1035-1046. DOI:10.13343/j.cnki.wsxb.20220510 |
| [4] | AL-DHAHERI RS, DOUGLAS LJ. Apoptosis in Candida biofilms exposed to amphotericin B. Journal of Medical Microbiology, 2010, 59(Pt 2): 149-157. |
| [5] |
SHI GX, WANG YX, FENG X, SHAO J, WANG TM, WANG CZ. Butyl alcohol extract of Baitouweng decoction induced apoptosis in Candida albicans biofilms. Chinese Journal of Mycology, 2017, 12(1): 13-18.
(in Chinese) 施高翔, 汪云霞, 冯鑫, 邵菁, 汪天明, 汪长中. 白头翁汤正丁醇提取物诱导白念珠菌生物被膜细胞凋亡. 中国真菌学杂志, 2017, 12(1): 13-18. DOI:10.3969/j.issn.1673-3827.2017.01.004 |
| [6] | LEE J, KIM JG, LEE H, LEE TH, KIM KY, KIM H. Antifungal activity of 1, 4-dialkoxynaphthalen-2-acyl imidazolium salts by inducing apoptosis of pathogenic Candida spp.. Pharmaceutics, 2021, 13(3): 312. DOI:10.3390/pharmaceutics13030312 |
| [7] | KIM H, LEE DG. Naringin-generated ROS promotes mitochondria-mediated apoptosis in Candida albicans. IUBMB Life, 2021, 73(7): 953-967. DOI:10.1002/iub.2476 |
| [8] | HILL SM, HAO XX, LIU BD, NYSTRÖM T. Life-span extension by a metacaspase in the yeast Saccharomyces cerevisiae. Science, 2014, 344(6190): 1389-1392. DOI:10.1126/science.1252634 |
| [9] | BERKOW EL, LOCKHART SR. Fluconazole resistance in Candida species: a current perspective. Infection and Drug Resistance, 2017, 10: 237-245. DOI:10.2147/IDR.S118892 |
| [10] | DOONAN F, COTTER TG. Morphological assessment of apoptosis. Methods (San Diego, Calif), 2008, 44(3): 200-204. DOI:10.1016/j.ymeth.2007.11.006 |
| [11] | LIU P, LUO L, GUO JH, LIU HM, WANG BQ, DENG BX, LONG CA, CHENG YJ. Farnesol induces apoptosis and oxidative stress in the fungal pathogen Penicillium expansum. Mycologia, 2010, 102(2): 311-318. DOI:10.3852/09-176 |
| [12] | TSIATSIANI L, van BREUSEGEM F, GALLOIS P, ZAVIALOV A, LAM E, BOZHKOV PV. Metacaspases. Cell Death & Differentiation, 2011, 18(8): 1279-1288. |
| [13] | ELMORE S. Apoptosis: a review of programmed cell death. Toxicologic Pathology, 2007, 35(4): 495-516. DOI:10.1080/01926230701320337 |
| [14] | KWUN MS, LEE HJ, LEE DG. β-amyrin-induced apoptosis in Candida albicans triggered by calcium. Fungal Biology, 2021, 125(8): 630-636. DOI:10.1016/j.funbio.2021.03.006 |
| [15] |
ZHANG Y, ZHANG JQ, ZHEN L. The sensibility of the three kinds of outside the antifungal drugs for Trichoplhton rubrum. Modern Medicine Journal of China, 2016, 18(12): 35-37.
(in Chinese) 张颖, 张晋巧, 甄莉. 红色毛癣菌对三种抗真菌外用药敏感性的研究. 中国现代医药杂志, 2016, 18(12): 35-37. |
| [16] | AHMAD NASROLLAHI S, FATTAHI A, NAEIMIFAR A, LOTFALI E, FIROOZ A, KHAMESIPOOR A, SKANDARI SE, MIRAMIN MOHAMMADI A. The in vitro effect of nanoliposomal amphotericin B against two clinically important dermatophytes. International Journal of Dermatology, 2022, 61(4): 383-389. DOI:10.1111/ijd.15609 |
| [17] | WANG X. The expanding role of mitochondria in apoptosis. Genes & Development, 2001, 15(22): 2922-2933. |
| [18] | COLOMBINI M. Ceramide channels and their role in mitochondria-mediated apoptosis. Biochimica et Biophysica Acta, 2010, 1797(6/7): 1239-1244. |
| [19] | BRAS M, QUEENAN B, SUSIN SA. Programmed cell death via mitochondria: different modes of dying. Biochemistry (Moscow), 2005, 70(2): 231-239. DOI:10.1007/s10541-005-0105-4 |
| [20] | ZOROV DB, JUHASZOVA M, SOLLOTT SJ. Mitochondrial reactive oxygen species (ROS) and ROS-induced ROS release. Physiological Reviews, 2014, 94(3): 909-950. DOI:10.1152/physrev.00026.2013 |
| [21] | MICK DU, FOX TD, REHLING P. Inventory control: cytochrome C oxidase assembly regulates mitochondrial translation. Nature Reviews Molecular Cell Biology, 2011, 12(1): 14-20. |
| [22] | SHLEZINGER N, IRMER H, DHINGRA S, BEATTIE SR, CRAMER RA, BRAUS GH, SHARON A, HOHL TM. Sterilizing immunity in the lung relies on targeting fungal apoptosis-like programmed cell death. Science, 2017, 357(6355): 1037-1041. |
 2023, Vol. 63
2023, Vol. 63




