中国科学院微生物研究所,中国微生物学会
文章信息
- 倪新, 杨帆. 2023
- NI Xin, YANG Fan.
- CBM在多糖底物降解中的应用进展
- Application of carbohydrate-binding modules in degradation of polysaccharides
- 微生物学报, 63(6): 2330-2339
- Acta Microbiologica Sinica, 63(6): 2330-2339
-
文章历史
- 收稿日期:2022-09-17
- 网络出版日期:2023-04-04
碳水化合物结合模块(carbohydrate binding module, CBM)是一类具有与特定多糖底物结合能力的小分子结合蛋白或结构域,通过其结合作用往往能够使糖苷水解酶对相应底物的水解性能得到大幅增强(图 1)。CBM最早被发现于纤维素酶中,是酶分子中具有纤维素结合特性的结构域,因此最初将其命名为纤维素结合结构域(cellulose binding domain, CBD)[1]。而后越来越多具有多糖底物结合能力的小分子多肽或非催化模块被发现,并且通过实验证实了它们能够与除纤维素之外的包括木聚糖、甘露聚糖、淀粉和几丁质等在内的多种多糖底物相结合,因此一个包含性更强的术语碳水化合物结合模块(CBM)被用来描述这一类衍生自糖苷水解酶的没有催化能力但能与底物特异结合的蛋白类小分子结合模块[2]。CBM与多糖底物间的特异性结合作用是影响其应用的关键因素,因此本文从CBM的家族、结构与功能出发,总结了近些年有关CBM在糖苷水解酶改性过程中的应用,重点聚焦于一些能够显著改善酶的催化性能或稳定性的CBM,并对该领域当前存在的问题进行了探讨,展望了CBM的进一步开发和应用前景。
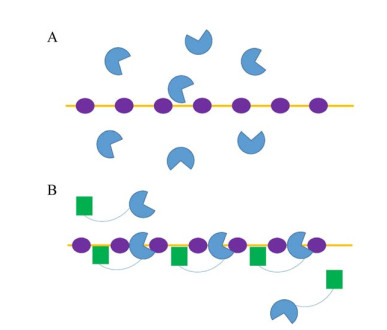
|
| 图 1 CBM在底物降解中的作用模式 Figure 1 The action mode of CBM in substrate degradation. A: Random cutting effect of hydrolase on polysaccharide chain. B: CBM helps hydrolytic enzymes efficiently and orderly cut polysaccharide chains. |
1 CBM的结构
按照结构和底物结合特异性,目前已知的CBM可分为88个家族,在88个CBM家族中共包含有24万多条的CBM序列,此外还有900多条未被分类的CBM (http://www.cazy.org/)[3]。而随着越来越多的CBM被发现及其结构、功能的解析,我们得以更好地了解CBM。从折叠类型上来看,CBM主要有4种折叠的方式,包括:β-三明治折叠、β-三叶折叠、OB折叠和肝素折叠(表 1)[4-5]。其中最常见的折叠类型是β-三明治折叠[4],其次是β-三叶折叠[5],OB折叠和肝素折叠则是CBM中不常见的2种类型[6-7]。
| Fold structure type | CBM family |
| β-sandwich fold | 2, 3, 4, 6, 9, 15, 16, 17, 22, 25, 26, 27, 28, 29, 32, 34, 36, 47, 51, 70 |
| β-trilobal fold | 13, 42 |
| OB fold | 10 |
| Hevein fold | 18 |
| Other types | 1, 5, 12, 14, 40, 87 |
从结合类型上看,可将CBM分为3种类型,包括表面结合型CBM (A型)、链式结合型CBM (B型)和小分子糖结合型CBM (C型),结构模建见图 2。从结构特点上来看,A型CBM的结合位点往往分布在一个平面上,而这种平整的结构使其能够与不溶性或结晶型的底物相结合[8],但对可溶性底物则不结合或结合较弱。B型CBM中往往含有一个凹槽或裂缝,其结合效率与底物的聚合度有关,B型CBM更易于与长的多糖链进行结合,如木聚糖、甘露聚糖、半乳聚糖以及淀粉等多种聚糖[9]。C型CBM与B型CBM的结构差异较小,同B型CBM相比,C型CBM则更易于与单糖、二糖或三糖等短链的寡糖结合,但对长的糖链结合力较差[10]。
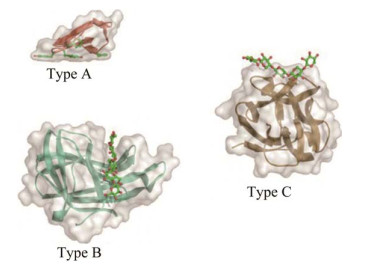
|
| 图 2 Type A–C CBMs晶体结构图 Figure 2 Crystal structures of type A–C CBMs. |
2 不同家族CBM的结合特性
由于物种来源和一级结构顺序不同,使得不同CBM的折叠类型以及结合特点等方面有所不同,不同家族的CBM在底物识别能力上也有较大的差别,同时,CBM与底物间的结合过程往往还与底物的结构特点有关。Orłowski等[11]在用分子动力学模拟探究CBM与结晶纤维素的结合作用时,发现结晶纤维素中的大量氢键促进了二者的结合过程。同结晶纤维素相比,结构更为松散的无定形纤维素,其暴露的纤维素链末端更易与CBM中的特定的氨基酸残基形成氢键结合,因此二者间的结合也更加紧密。
而从分子机制上来看,影响CBM与底物间结合作用的因素主要是CBM中的芳香族氨基酸残基和O-甘露糖基化,尤其是其与纤维素的结合[12-14]。例如,从与纤维素的结合能力上看,IrpCBM1对纤维素的吸附能力通常高于来源于毛革盖菌(Trametes hirsuta)的内切葡聚糖酶的ThCBMEG1,而在将IrpCBM1中的芳香族氨基酸残基Y52突变为丝氨酸后,IrpCBM1对纤维素的结合能力则与ThCBMEG1相似,由此再次表明了芳香族氨基酸残基Y52对于该CBM1模块维持纤维素结合性能的重要性[12]。而Chen等[13]通过自由能计算探究了来源于里氏木霉GH7家族的纤维二糖水解酶CBM1的3个糖基化位点(Ser3、Ser14和Thr1)上O-甘露糖基化的作用。结果表明CBM中的甘露糖基化不会引起CBM主要的构象变化,但糖基化位点的数量和位置会影响CBM对底物的亲和力。
按照底物结合特性对CBM家族进行归类,可以更好地推动利用CBM改善碳水化合物活性酶水解性能的研究。如表 2所示[14],在数量上,具有纤维素底物结合能力的CBM种类最多,已被证实的具有纤维素底物结合能力的CBM有20多个家族;第二位的是具有木聚糖底物结合能力的CBM家族,有14个家族之多。而部分底物如黄原胶、菊粉、岩藻糖等,目前报道的都仅有一个家族的CBM被证实具有与之结合的能力。除此之外,部分CBM家族不只具有与一种多糖底物相结合的能力,例如第6家族的CBM同时具备了与纤维素和木聚糖结合的能力,同时还具有与β-1,3-葡聚糖及β-1,3-1,4-葡聚糖结合的能力[15],这一现象表明CBM与底物间并不是完全一一对应的关系。当前对CBM家族进行分类的方式还不够细致,无法对CBM做出更为精细的分类。
| Various polysaccharide substrates | CBM family |
| Cellulose | 1, 2, 3, 6, 8, 10, 16, 17, 28, 30, 37, 44, 46, 49, 59, 63, 64, 72, 81, 85 |
| Xylan | 4, 6, 9, 13, 15, 22, 35, 36, 37, 54, 59, 60, 72, 86 |
| β-1,3-glucan | 4, 6, 22, 39, 43, 52, 56, 79, 81 |
| β-1,4-glucan | 11, 22, 78, 79, 81 |
| β-1,3-1,4-glucan | 4, 6, 11, 28, 72, 79, 85 |
| Mannan | 16, 23, 27, 29, 35, 59, 72, 76, 80, 85 |
| Chitin | 5, 12, 14, 18, 19, 37, 50, 54, 55, 73 |
| Starch | 20, 21, 26, 34, 41, 45, 53, 69, 74, 82, 83 |
| Xyloglucan | 44, 62, 65, 75, 76, 78, 80 |
| Xanthan | 84 |
| Inulin | 38 |
| Fucoidan | 47 |
3 CBM在多糖水解酶改造中的应用
多糖是自然界最丰富的生物资源之一,但大部分多糖都具有复杂的结构,因此若想对纤维素等多糖资源进行高效的降解和利用仍需做出大量的努力[16-17]。近期的一些研究表明[18-20],CBM能够增强多糖水解酶对多糖底物的结合力和水解性能,研究还发现CBM的加入经常会引起多糖水解酶的稳定性及最适作用条件等出现变化。同时,因为CBM具有独立的折叠结构,因此在酶的改造工程中,可以将异源的CBM与多糖水解酶的催化结构域进行融合表达来发挥作用。
纤维素、木聚糖、几丁质和黄原胶等都是比较重要且常见的多糖资源,开发和利用具有这些底物对应结合能力的CBM可以加速这些多糖底物的降解和利用进程,创造较大的经济价值。
3.1 CBM在纤维素酶改造中的应用纤维素是植物细胞壁的主要结构成分,是自然界中含量最多、分布最广的一种多糖,按结晶度可将其分为结晶纤维素和非结晶(无定型)纤维素[21]。在自然界中,只有部分纤维素酶如外切纤维素酶才能降解结晶纤维素,因其大多具有CBM,例如来源于白囊耙齿菌(Irpex lacteus)的外切纤维素酶EX-1[22]。除此之外,很多纤维素酶组分特别是内切纤维素酶组分难以有效地水解结晶纤维素[23],因此CBM在纤维素降解中最常见的应用就是利用其具有结晶纤维素的结合能力来提高融合酶对结晶纤维素底物的亲和力和降解效率。例如,来自热纤梭菌(Clostridium thermocellum)的一种内切纤维素酶EGE对结晶纤维素的降解效率极低,但通过将荧光假单胞菌(Pseudomonas fluorescens)的木聚糖酶A的具有结晶纤维素结合能力的CBM与EGE进行融合表达后,使得该内切纤维素酶EGE对结晶纤维素的降解效率提高了2–6倍,进而能够更加有效地降解结晶纤维素[24]。
除此之外,纤维素的酶解过程是相当复杂的,单一的酶一般不能起到良好的降解效果,往往需要多种酶协同发挥作用[25],而CBM在这个过程中发挥了重要的作用。例如,在Bae等[26-27]利用来源于褐色热裂菌(Thermobifidus fusca)的外切纤维素酶Cel6B和来源于白色瘤胃球菌(Ruminococcus albus)的内切纤维素酶Cel5对纤维素进行的协同降解的实验中,虽然反应体系中产生了大量的可溶性糖,但体系中结晶纤维素的含量并未出现显著的变化,而在利用粪梭菌(Clostridium stercorarium)来源的CBM6对Cel5进行融合改造,增强了Cel5的活性后,再次进行的协同降解实验中,反应体系中结晶纤维素的含量显著下降,下降幅度高达50%。因此,CBM的引入不仅可以增强Cel5活性,并且有助于增强不同纤维素酶间的多酶协同效应。
3.2 CBM在木聚糖酶改造中的应用木聚糖是植物半纤维素的重要组成部分,一般包被在纤维素外侧,所以当木聚糖得到有效降解时,容易暴露出更多的纤维素可降解位点,使得纤维素酶更易于与纤维素结合并对其进行降解,因此纤维素资源的利用离不开木聚糖的降解。有关利用CBM提高木聚糖酶活性的研究众多,一部分报道集中于新型木聚糖底物结合模块的挖掘,例如,Liu等[28]比较了硫曲霉(Aspergillus sulphureus)来源的木聚糖酶ASxyn10A以及截短其C端CBM得到的截短酶(ASxyn10A-dc)对碱法预处理菜籽粕的降解能力,及二者在与纤维素酶协同降解菜籽粕中发挥的作用。结果显示,与截短酶(ASxyn10A-dc)相比,全长酶(ASxyn10A)对碱预处理的菜籽粕具有更高的降解活性和结合能力,利用全长木聚糖酶与纤维素酶协同降解菜籽粕可以显著提高底物的降解率,产物中低聚木糖的含量提高了1.4倍,证实了该CBM不仅可以帮助木聚糖酶ASxyn10A更好地降解木聚糖还能帮助其与纤维素酶更好地发挥协同作用,这为今后木聚糖酶的理性设计提供了更多的选择。
此外也有学者利用已被证实功能的木聚糖结合模块改良了木聚糖酶的催化性能,例如,Liu等[29]利用来源于热线梭菌(Clostridium thermocellum)的具有木聚糖结合性能的CBM4-2对草菇(Volvariella volvacea)来源的木聚糖酶AXE1dC进行了融合改造,所获得的重组酶AXE1dC-CBM4-2对木聚糖底物的催化能力达到了原来的2倍。利用CBM改善木聚糖酶的底物亲和力和降解能力,可以在一定程度上提高其对天然木质纤维素中木聚糖的降解性能,在木质纤维素的处理过程中,提高产物中木糖的得率。
CBM的融合不仅会改变酶的催化性能,有时即使未能增强酶的催化性能,但也可能会影响酶的基本理化性质,如对酶的最适作用条件造成的改变可能也是有意义的。例如,Li等[30]将来源于海栖热袍菌(Thermotoga maritima)的CBM9-2连接到黑曲霉(Aspergillus niger)来源的木聚糖酶Xynam1上,所获得的融合酶除了对木聚糖底物的催化活性提高了3倍外,其最适反应条件和热稳定性都发生了变化。融合酶在pH 3.0–4.2区间内的相对活力显著高于Xynam1,表明融合酶获得了更高的耐酸性,除此之外,融合酶还获得了更高的温度稳定性,可以在更广泛的温度范围内发挥作用。因此,利用CBM来改变酶的最适作用条件或稳定性,可能会更有利于酶在工业生产中的应用。
3.3 CBM在几丁质酶改造中的应用几丁质是自然界中仅次于纤维素的第二大可再生碳水化合物,广泛存在于海洋中。几丁质的生物降解主要是通过几丁质降解酶系完成的,而CBM在几丁质的水解过程中也发挥了重要的作用。研究显示大多数几丁质酶都是模块化蛋白质,除了催化结构域外,往往还含有CBM等辅助结构域。CBM通过将酶锚定在底物上并破坏底物的晶体结构,形成自由链末端,从而增强酶分子对不溶性底物的活性[31]。
除几丁质酶自身的CBM外,也有学者将异源的CBM应用到几丁质酶的改造中。例如,来源于哈茨木霉(Trichoderma harzianum)的几丁质酶Chit46本身并没有CBM结构域,而Deng等[18]通过在其C端分别融合表达3个不同细菌包括枯草芽孢杆菌(Bacillus subtilis)、大肠杆菌(Escherichia coli)和枯草芽孢杆菌(Bacillus subtilis 168)糖苷水解酶来源的具有几丁质结合性能的CBM (CBM3、CBM6、CBM26),所获得的重组酶对几丁质的降解活性分别提高了2.2、1.4和1.1倍。除此之外,部分研究还证明了CBM的加入除能增强几丁质酶对几丁质的亲和力和降解活性外,还可以在一定程度上改变几丁质水解产物的聚合度,例如,Zhou等[32]将来源于类芽孢杆菌(Paenibacillus sp.) IK-5的壳聚糖酶的CBM32连接到了烟曲霉(Aspergillus fumigatus) CJ22-326来源的无CBM结构域的壳聚糖酶Csn75上,所获得的重组酶在降解壳聚糖后所得产物的聚合度发生了变化,降解产物由聚合度2–4的偶数寡糖为主改变为聚合度为3–5的奇数寡糖为主,以使其更加满足食品工业的需求。更进一步,还有学者将CBM的结合能力应用到固定化酶技术当中,通过将烟曲霉CJ22-326来源的几丁质酶Csn75与嗜碱芽孢杆菌(Bacillus halodurans)来源的具有热凝胶多糖(curdlan)结合能力的CBM (BhCBM56)进行融合表达,并在以热凝胶多糖为填料的反应器中,同步实现了几丁质酶的纯化与固定化,在降低生产成本的同时,反应器表现出了良好的稳定性和可重复使用性,大大提高了几丁寡糖的生产效率[33]。
3.4 CBM在黄原胶酶改造中的应用黄原胶是由野油菜黄单胞菌生产的微生物胞外多糖,其降解后生成的寡糖因具有抗氧化性能和抑菌活性等优良性质而具有潜在的市场价值[34]。黄原胶的主链是类纤维素结构,但其侧链较为复杂,导致能够高效降解纤维素的酶并不能很好地作用于黄原胶,这就给黄原胶的降解和黄原胶寡糖的生产造成了困扰。
在黄原胶降解酶的挖掘过程中,CBM充当了极其重要的角色。一方面是具有黄原胶底物结合能力的CBM的挖掘,例如,Yang等[35-36]从微杆菌(Microbacterium sp.) XT11中分离出了一种黄原胶内切酶MiXen,通过对MiXen的结构与功能的分析,证实了该酶的C端含有一个CBM结构域。该CBM可以辅助催化结构域通过识别和结合黄原胶的主链,辅助酶分子的催化结构域将高分子量的黄原胶降解为中等分子量的产物。另一方面,由于黄原胶独特的结构,已报道的黄原胶降解酶在切割黄原胶后,产物的成分较为复杂,这就给寡糖产物的后续分离造成了极大的困扰,因此,挖掘具有特异识别功能的CBM模块是解决该问题的关键。杨帆等[37]从微杆菌XT11中发现了一种能够特异性识别黄原胶侧链的碳水化合物结合模块CBM6B,通过与来自微杆菌XT11的黄原胶内切酶MiXen的催化结构域序列MiXen-CD进行融合表达,结果显示,CBM6B模块能够显著提高重组酶MiXenCD-6B对黄原胶底物的亲和能力和催化能力,融合酶MiXenCD-6B的酶活力达到了MiXen-CD的1.46倍,并使得产物的种类更为集中,为高效精准切割黄原胶、制备黄原胶寡糖奠定了基础。
3.5 CBM在其他多糖降解酶改造中的应用除上述多糖外,CBM在其他常见的多糖降解研究中也发挥着重要的作用。例如,褐藻酸是一种天然酸性多糖,对其进行降解可以在一定程度上改善其功能并扩展其应用[38]。已有研究证明[39-40],许多褐藻酸裂解酶自身带有CBM结构域,并且这些CBM在维持褐藻酸裂解酶的活性和稳定性等方面发挥了重要的作用。例如,Ji等[40]最近从海洋嗜热细菌(thermophilic bacteria)中挖掘出了一个新的CBM结构域(CBM96),该结构域对褐藻酸表现出很强的亲和力,并且是第一个报道的可以结合内部褐藻酸链的CBM,在维持褐藻酸裂解酶的功能方面发挥着重要作用,同时该CBM的发现为褐藻酸裂解酶的改造增加了新的功能域。此外,Hu等[19]通过将来自弧菌(Vibrio sp.) W13的褐藻酸裂解酶Aly7A的碳水化合物结合模块(7A-CBM)与褐藻酸裂解酶Aly7B的催化模块重组,成功构建了褐藻酸裂解酶Aly7C,Aly7C对聚β-D-甘露糖醛酸(PolyM)的活力可以达到Aly7B的2倍,并且Aly7C可以将褐藻酸、PolyM和聚α-L-古罗糖醛酸(PolyG)降解为聚合度为2–5的寡糖,表现出了完美的产品特异性。这项工作为褐藻寡糖及其相关CBM的研究提供了新的见解,并增强了对CBM模块功能的理解。
热凝胶多糖是一种重要的β-1,3-葡聚糖,是生产β-1,3-低聚糖的廉价原料。目前除了使用α淀粉酶可对热凝胶多糖实现降解外,只有少数β-1,3-内切葡聚糖酶可应用到其降解过程中,严重阻碍了热凝胶多糖降解的研究进程,而新型CBM的发掘,则可以更好地推动热凝胶多糖的降解进程。Jia等[41]从交替单胞菌(Saccharophagus degradans) 2-40中鉴定出的新型β-1,3-内切葡聚糖酶CBM6E,该酶具有较高的热凝胶多糖降解能力,并且其C端的CBM6模块是第一个被报道的具有热凝胶多糖结合活性的CBM。进一步研究发现,具有CBM6的全长酶对热凝胶多糖的降解活力可以达到去除CBM6的截短酶的4倍以上。该模块的发现是对CBM库的有效补充,也推动了热凝胶多糖的降解进程。
淀粉作为一种重要的多糖资源,其完全降解过程往往需要多个酶的协同作用,因此部分学者致力于研究淀粉酶中的CBM,以寻找能够提高淀粉酶活性的CBM[42]。另一方面,部分学者将具有淀粉结合能力的CBM用作重组酶的纯化标签,用于分离纯化各种重组蛋白,如在以直链淀粉为填料的树脂柱中实现了包括绿色荧光蛋白、白斑综合征病毒(VP28/WSV)的包膜病毒蛋白VP28和人类免疫缺陷病毒(GP41/HIV)的包膜糖蛋白GP41在内的3种蛋白的高效纯化,为重组酶的纯化过程提供了简单方便的解决方案[43]。
4 结语与展望CBM在多糖底物降解中的应用主要体现在具有高效底物结合能力的新型CBM的挖掘以及利用CBM来改造其相应的水解酶,以提高水解酶的催化活性。就现阶段而言,新型CBM的挖掘工作主要集中在纤维素等少数底物中,这就导致了部分底物如黄原胶等,缺乏可用于改造其水解酶的元件,阻碍了其降解和工业化应用进程。因此聚焦于黄原胶等底物进行的研究可以丰富这类底物的改造元件,推动其降解和应用进程。目前利用CBM对多糖水解酶进行的改造,更多集中于对水解酶催化性能的关注,而对CBM与底物间的结合过程以及影响这一过程因素的研究则相对较少。因此对CBM进行活性位点的预测及合理的突变设计则可以揭示CBM与底物间结合的过程,并改造出性能更优异的CBM。
工业用酶一般都要求酶分子具有良好的稳定性和适当的最适作用条件,但自然存在的酶往往达不到工业生产的要求,因此需要对其进行改造。通过与具有热稳定性的CBM模块相融合,大部分重组酶的热稳定性都会得到显著的提高,同时部分CBM的应用还可以显著改变融合酶的酶学性质,如降低或提高最适反应温度,改变最适pH等[30],以更好地适应实际生产需求,在实际生产中降低酶反应过程所需的能耗,加速酶应用于工业化的进程。同时大部分的酶反应过程都是复杂的,往往需要多个酶协同作用才能达到理想的催化效果,如纤维素的彻底降解,则需要多种类与多组分的纤维素酶共同作用。这种多酶协同反应往往需要进行大量的优化实验以寻找最佳的条件,CBM的合理利用则可以简化该过程,并提高多酶协同的效果。例如,Liu等[44]在对来源于粘质沙雷氏菌(Serratia marcescens BWL1001)的4种几丁质酶ChiA、ChiB、ChiC和CBP21进行的研究过程中发现,几丁质酶ChiB中的CBM5和ChiC中的CBM12两个模块,除可以增强ChiB和ChiC对几丁质的降解活性外,还可以提高多种几丁质酶协同降解几丁质的能力,提高酶系整体的降解效率。
迄今为止,大部分已发现并证实功能的CBM都可以被用来改善相应多糖降解酶的催化性能,除此之外,有的研究者扩展了CBM本身的底物结合功能,作用在其他方向上也可以得到许多应用。例如,利用CBM与绿色荧光蛋白进行融合,构建了荧光探针,可用来监测相应底物的预处理效果和水解程度[45]。另外,CBM一个较好的应用前景是将CBM作为亲和吸附标签,将CBM与酶或其他蛋白组分进行融合表达,通过CBM与固定相上其特定的多糖底物的吸附,可快速完成酶与蛋白组分的纯化或实现酶的固定化过程[46],这样既简化了繁琐酶的纯化或固定化步骤,另一方面加快了生产的进程。
当前对CBM的研究更多的是聚焦于纤维素等研究较热的底物,并集中于对水解酶催化性能的提高,相对于其他底物,如黄原胶、菊粉和岩藻多糖等,研究相对较少。因此在之后的工作中应当增加对纤维素外的多糖类底物的关注,并基于CBM的功能开发新的应用,以使其研究更加深入、全面。除此之外,CBM与酶的结合过程包括结合位置和连接方式也是接下来需要深入研究的一个方向。
| [1] | TOMME P, van TILBEURGH H, PETTERSSON G, van DAMME J, VANDEKERCKHOVE J, KNOWLES J, TEERI T, CLAEYSSENS M. Studies of the cellulolytic system of Trichoderma reesei QM 9414. Analysis of domain function in two cellobiohydrolases by limited proteolysis. European Journal of Biochemistry, 1988, 170(3): 575-581. DOI:10.1111/j.1432-1033.1988.tb13736.x |
| [2] | GILKES NR, WARREN RA, MILLER RC, KILBURN DG. Precise excision of the cellulose binding domains from two Cellulomonas fimi cellulases by a homologous protease and the effect on catalysis. Journal of Biological Chemistry, 1988, 263(21): 10401-10407. DOI:10.1016/S0021-9258(19)81530-2 |
| [3] | ATTIA MA, HARRY B. Characterization of a galactosyl-binding protein module from a Cellvibrio japonicus endo-xyloglucanase defines a new family of carbohydrate binding modules. Applied and Environmental Microbiology, 2020: e0263420. |
| [4] | RICHARDSON JS. The anatomy and taxonomy of protein structure. Advances in Protein Chemistry, 1981, 34: 167-339. |
| [5] | MURZIN AG, LESK AM, CHOTHIA C. Beta-trefoil fold. Patterns of structure and sequence in the Kunitz inhibitors interleukins-1 beta and 1 alpha and fibroblast growth factors. Journal of Molecular Biology, 1992, 223(2): 531-543. DOI:10.1016/0022-2836(92)90668-A |
| [6] | BORASTON AB, NURIZZO D, NOTENBOOM V, DUCROS V, ROSE DR, KILBURN DG, DAVIES GJ. Differential oligosaccharide recognition by evolutionarily-related beta-1,4 and beta-1,3 glucan-binding modules. Journal of Molecular Biology, 2002, 319(5): 1143-1156. DOI:10.1016/S0022-2836(02)00374-1 |
| [7] | SAUL FA, ROVIRA P, BOULOT G, DAMME EJ, PEUMANS WJ, TRUFFA-BACHI P, BENTLEY GA. Crystal structure of urtica dioica agglutinin, a superantigen presented by MHC molecules of class Ⅰ and class Ⅱ. Structure (London, England: 1993), 2000, 8(6): 593-603. DOI:10.1016/S0969-2126(00)00142-8 |
| [8] | SANTOS CR, PAIVA JH, SFORÇA ML, NEVES JL, NAVARRO RZ, COTA J, AKAO PK, HOFFMAM ZB, MEZA AN, SMETANA JH, NOGUEIRA ML, POLIKARPOV I, XAVIER-NETO J, SQUINA FM, WARD RJ, RULLER R, ZERI AC, MURAKAMI MT. Dissecting structure-function-stability relationships of a thermostable GH5-CBM3 cellulase from Bacillus subtilis 168. The Biochemical Journal, 2012, 441(1): 95-104. DOI:10.1042/BJ20110869 |
| [9] | CAMPOS BM, LIBERATO MV, ALVAREZ TM, ZANPHORLIN LM, EMATSU GC, BARUD H, POLIKARPOV I, RULLER R, GILBERT HJ, ZERI AC, SQUINA FM. A novel carbohydrate-binding module from sugar cane soil metagenome featuring unique structural and carbohydrate affinity properties. The Journal of Biological Chemistry, 2016, 291(45): 23734-23743. DOI:10.1074/jbc.M116.744383 |
| [10] | NOTENBOOM V, BORASTON AB, KILBURN DG, ROSE DR. Crystal structures of the family 9 carbohydrate-binding module from Thermotoga maritima xylanase 10A in native and ligand-bound forms. Biochemistry, 2001, 40(21): 6248-6256. DOI:10.1021/bi0101704 |
| [11] | ORŁOWSKI A, ARTZI L, CAZADE PA, GUNNOO M, BAYER EA, THOMPSON D. On the distinct binding modes of expansin and carbohydrate-binding module proteins on crystalline and nanofibrous cellulose: implications for cellulose degradation by designer cellulosomes. Physical Chemistry Chemical Physics: PCCP, 2018, 20(12): 8278-8293. DOI:10.1039/C7CP07764E |
| [12] | NISHIJIMA H, NOZAKI K, MIZUNO M, ARAI T, AMANO Y. Extra tyrosine in the carbohydrate-binding module of Irpex lacteus Xyn10B enhances its cellulose-binding ability. Bioscience, Biotechnology, and Biochemistry, 2015, 79(5): 738-746. DOI:10.1080/09168451.2014.996203 |
| [13] | CHEN LQ, DRAKE MR, RESCH MG, GREENE ER, HIMMEL ME, CHAFFEY PK, BECKHAM GT, TAN ZP. Specificity of O-glycosylation in enhancing the stability and cellulose binding affinity of family 1 carbohydrate-binding modules. Proceedings of the National Academy of Sciences of the United States of America, 2014, 111(21): 7612-7617. DOI:10.1073/pnas.1402518111 |
| [14] | AROLA S, LINDER MB. Binding of cellulose binding modules reveal differences between cellulose substrates. Scientific Reports, 2016, 6: 35358. DOI:10.1038/srep35358 |
| [15] | BORASTON AB, BOLAM DN, GILBERT HJ, DAVIES GJ. Carbohydrate-binding modules: fine-tuning polysaccharide recognition. The Biochemical Journal, 2004, 382(Pt 3): 769-781. |
| [16] |
CHEN L, WU H. Research advances in degradation of polysaccharides. Chinese Archives of Traditional Chinese Medicine, 2008, 26(1): 133-135.
(in Chinese) 陈蕾, 吴皓. 多糖降解方法的研究进展. 中华中医药学刊, 2008, 26(1): 133-135. DOI:10.13193/j.archtcm.2008.01.135.chenl.001 |
| [17] |
ZHANG S, ZHAO Y, CHEN GJ, YU JH, WU XY, WANG LS. High efficient degradation of biomass polysaccharides and precise customization of degrading enzymes. Progress in Biochemistry and Biophysics, 2021, 48(3): 296-308.
(in Chinese) 张舒, 赵越, 陈冠军, 余俊红, 吴秀芸, 王禄山. 生物质多糖的高效降解与降解酶(系)的精确定制. 生物化学与生物物理进展, 2021, 48(3): 296-308. DOI:10.16476/j.pibb.2020.0214 |
| [18] | DENG JJ, ZHANG MS, LI ZW, LU DL, MAO HH, ZHU MJ, LI JZ, LUO XC. One-step processing of shrimp shell waste with a chitinase fused to a carbohydrate-binding module. Green Chemistry, 2020, 22(20): 6862-6873. DOI:10.1039/D0GC02611E |
| [19] | HU F, CAO S, LI Q, ZHU B, YAO Z. Construction and biochemical characterization of a novel hybrid alginate lyase with high activity by module recombination to prepare alginate oligosaccharides. International Journal of Biological Macromolecules, 2021, 166: 1272-1279. DOI:10.1016/j.ijbiomac.2020.11.009 |
| [20] | MANJEET K, MADHUPRAKASH J, MORMANN M, MOERSCHBACHER BM, PODILE AR. A carbohydrate binding module-5 is essential for oxidative cleavage of chitin by a multi-modular lytic polysaccharide monooxygenase from Bacillus thuringiensis serovar kurstaki. International Journal of Biological Macromolecules, 2019, 127: 649-656. DOI:10.1016/j.ijbiomac.2019.01.183 |
| [21] |
NING JP, SUN RY, XU Y, ZHANG SF, ZHANG XY, LI YY. Review on cellulose degrading bacteria. The Farmers Consultant, 2021(3): 117-118.
(in Chinese) 宁俊平, 孙如玉, 徐莹, 张淑芳, 张旭阳, 李阳阳. 纤维素降解菌研究综述. 农家参谋, 2021(3): 117-118. |
| [22] | HAMADA N, KODAIRA R, NOGAWA M, SHINJI K, ITO R, AMANO Y, SHIMOSAKA M, KANDA T, OKAZAKI M. Role of cellulose-binding domain of exocellulase Ⅰ from white rot basidiomycete Irpex lacteus. Journal of Bioscience and Bioengineering, 2001, 91(4): 359-362. DOI:10.1016/S1389-1723(01)80151-1 |
| [23] | SRIVASTAVA S, JHARIYA U, PUROHIT HJ, DAFALE NA. Synergistic action of lytic polysaccharide monooxygenase with glycoside hydrolase for lignocellulosic waste valorization: a review. Biomass Conversion and Biorefinery, 2021: 1-19. DOI:10.1007/s13399-021-01736-y |
| [24] | BOLAM DN, CIRUELA A, MCQUEEN-MASON S, SIMPSON P, WILLIAMSON MP, RIXON JE, BORASTON A, HAZLEWOOD GP, GILBERT HJ. Pseudomonas cellulose-binding domains mediate their effects by increasing enzyme substrate proximity. The Biochemical Journal, 1998, 331(Pt 3): 775-781. |
| [25] |
GU FY, CHEN CY, SHI JJ, QIAN SJ. Advances in cellulase and its development tendency. Journal of Microbiology, 2008, 28(1): 83-87.
(in Chinese) 顾方媛, 陈朝银, 石家骥, 钱世钧. 纤维素酶的研究进展与发展趋势. 微生物学杂志, 2008, 28(1): 83-87. DOI:10.3969/j.issn.1005-7021.2008.01.018 |
| [26] | BAE HJ, TURCOTTE G, CHAMBERLAND H, KARITA S, VÉZINA LP. A comparative study between an endoglucanase Ⅳ and its fused protein complex Cel5-CBM6. FEMS Microbiology Letters, 2003, 227(2): 175-181. DOI:10.1016/S0378-1097(03)00593-7 |
| [27] | BAE HJ, TURCOTTE G, SOO KY, VÉZINA LP, LABERGE S. Cel6B of Thermobifidus fusca and a Cel5-CBM6 of Ruminococcus albus containing a cellulose binding site show synergistic effect on hydrolysis of native plant cellulose. FEMS Microbiology Letters, 2004, 233(2): 325-331. DOI:10.1111/j.1574-6968.2004.tb09499.x |
| [28] | LIU Y, WANG J, BAO C, DONG B, CAO Y. Characterization of a novel GH10 xylanase with a carbohydrate binding module from Aspergillus sulphureus and its synergistic hydrolysis activity with cellulase. International Journal of Biological Macromolecules, 2021, 182: 701-711. DOI:10.1016/j.ijbiomac.2021.04.065 |
| [29] | LIU SP, DING SJ. Replacement of carbohydrate binding modules improves acetyl xylan esterase activity and its synergistic hydrolysis of different substrates with xylanase. BMC Biotechnology, 2016, 16(1): 73. DOI:10.1186/s12896-016-0305-6 |
| [30] | LI Y, SONG W, YIN X, RAO S, ZHANG Q, ZHOU J, LI J, DU G, LIU S. Enhanced catalytic performance of thermophilic GH11 xylanase by fusing carbohydrate-binding module 9-2 and linker for better synergistic degradation of wheat bran. Process Biochemistry, 2022, 121: 349-359. DOI:10.1016/j.procbio.2022.07.021 |
| [31] | GUILLÉN D, SÁNCHEZ S, RODRÍGUEZ-SANOJA R. Carbohydrate-binding domains: multiplicity of biological roles. Applied Microbiology and Biotechnology, 2010, 85(5): 1241-1249. DOI:10.1007/s00253-009-2331-y |
| [32] | ZHOU JL, GU QY, SHEN Y, DAMASCENE HARINDINTWALI J, YANG WH, ZOU SL, HAN MH, MA C, YU XB, LIU XB. Enhancement of the performance of the GH75 family chitosanases by fusing a carbohydrate binding module and insights into their substrate binding mechanisms. LWT, 2022, 163: 113390. DOI:10.1016/j.lwt.2022.113390 |
| [33] | ZHOU JL, HARINDINTWALI JD, YANG WH, HAN MH, DENG B, LUAN H, ZHANG WS, LIU XB, YU XB. Engineering of a chitosanase fused to a carbohydrate-binding module for continuous production of desirable chitooligosaccharides. Carbohydrate Polymers, 2021, 273: 118609. DOI:10.1016/j.carbpol.2021.118609 |
| [34] |
HUANG CD, BAI XF, DU YG. Xanthan gum: production, properties and application. Microbiology, 2005, 32(2): 91-98.
(in Chinese) 黄成栋, 白雪芳, 杜昱光. 黄原胶(Xanthan Gum)的特性、生产及应用. 微生物学通报, 2005, 32(2): 91-98. |
| [35] | YANG F, YANG L, GUO XY, WANG X, LI LL, LIU ZC, WANG W, LI XZ. Production and purification of a novel xanthan lyase from a xanthan-degrading Microbacterium sp. strain XT11. The Scientific World Journal, 2014, 2014: 368434. |
| [36] | YANG F, LI H, SUN J, GUO XY, ZHANG XY, TAO M, CHEN XY, LI XZ. Novel endotype xanthanase from xanthan-degrading Microbacterium sp. strain XT11. Applied and Environmental Microbiology, 2019, 85(2): 1-47. |
| [37] |
YANG F, WANG XY, LI XZ. A carbohydrate binding module CBM6B protein with specific recognition of Xanthan gum side chain and its application. China: CN112481282A[P]. 2021. (in Chinese). 杨帆, 王雪妍, 李宪臻. 一种特异性识别黄原胶侧链的碳水化合物结合模块CBM6B蛋白质及应用. 中国: CN112481282A[P]. 2021. |
| [38] | ZHANG C, WANG W, ZHAO X, WANG H, YIN H. Preparation of alginate oligosaccharides and their biological activities in plants: a review. Carbohydrate Research, 2020, 494: 108056. |
| [39] | MENG Q, ZHOU L, HASSANIN HAM, JIANG B, LIU Y, CHEN J, ZHANG T. A new role of family 32 carbohydrate binding module in alginate lyase from Vibrio natriegens SK42.001 in altering its catalytic activity, thermostability and product distribution. Food Bioscience, 2021, 42: 101112. |
| [40] | JI SQ, TIAN XH, LI X, SHE QX. Identification and structural analysis of a carbohydrate-binding module specific to alginate, a representative of a new family, CBM96. Journal of Biological Chemistry, 2023, 299(2): 102854. |
| [41] | JIA XY, WANG C, DU XQ, PENG H, LIU L, XIAO YH, HE C. Specific hydrolysis of curdlan with a novel glycoside hydrolase family 128 β-1,3-endoglucanase containing a carbohydrate-binding module. Carbohydrate Polymers, 2021, 253: 117276. |
| [42] | PENG H, ZHENG Y, CHEN M, WANG Y, XIAO Y, GAO Y. A starch-binding domain identified in α-amylase (AmyP) represents a new family of carbohydrate-binding modules that contribute to enzymatic hydrolysis of soluble starch. FEBS Letters, 2014, 588(7): 1161-1167. |
| [43] | LIN SC, LIN IP, CHOU WI, HSIEH CA, LIU SH, HUANG RY, SHEU CC, DAH-TSYR CHANG M. CBM21 starch-binding domain: a new purification tag for recombinant protein engineering. Protein Expression and Purification, 2009, 65(2): 261-266. |
| [44] | LIU J, XU Q, WU Y, SUN D, ZHU J, LIU C, LIU W. Carbohydrate-binding modules of ChiB and ChiC promote the chitinolytic system of Serratia marcescens BWL1001. Enzyme and Microbial Technology, 2023, 162: 110118. |
| [45] |
WANG X, LI LL, YANG L, LI XZ, YANG F. Preparation and application of carbohydrate-binding module (CBM)-green fluorescent protein probe. Journal of Dalian Polytechnic University, 2014, 33(3): 171-174.
(in Chinese) 王雪, 李丽丽, 杨兰, 李宪臻, 杨帆. 糖结合单元-绿色荧光蛋白探针的制备及应用. 大连工业大学学报, 2014, 33(3): 171-174. |
| [46] | HAN QY, GONG WL, ZHANG ZY, WANG LS, WANG BL, CAI L, MENG QJ, LI YW, LIU QG, YANG Y, ZHENG L, MA YH. Orientated immobilization of FAD-dependent glucose dehydrogenase on electrode by carbohydrate-binding module fusion for efficient glucose assay. International Journal of Molecular Sciences, 2021, 22(11): 5529. |
 2023, Vol. 63
2023, Vol. 63




