中国科学院微生物研究所,中国微生物学会
文章信息
- 张雨心, 陈怡如, 刘彦茹, 王馨舸, 朱春凤. 2023
- ZHANG Yuxin, CHEN Yiru, LIU Yanru, WANG Xinge, ZHU Chunfeng.
- 基于益生菌治疗帕金森病的研究进展
- Progress in probiotics for Parkinson's disease
- 微生物学报, 63(9): 3455-3463
- Acta Microbiologica Sinica, 63(9): 3455-3463
-
文章历史
- 收稿日期:2023-02-09
- 网络出版日期:2023-05-08
帕金森病(Parkinson’s disease, PD)是常见的神经退行性疾病,其特征是存在于黑质中的多巴胺能神经元退化[1],进而导致运动和非运动症状的出现。据统计,我国有将近300万帕金森病患者,几乎占全球该病患者的50%,是世界上该病患者最多的国家[2]。目前治疗的药物以左旋多巴类药物为主,费用昂贵,且吸收时间长、副作用大、疗效随时间推移而降低,长期使用左旋多巴还会导致患者出现运动障碍,因此研究高效低毒的帕金森病治疗方法迫在眉睫。
对于帕金森病患者来说,胃肠道功能障碍是一个突出特征。随着肠脑轴机制的明确,研究发现肠道菌群及其代谢物,如短链脂肪酸(short chain fatty acid, SCFAs)[3]、γ-氨基丁酸(gamma-aminobutyric acid, GABA)[4]等通过自主神经系统、免疫系统、肠内固有神经系统等和大脑通信,调节机体代谢、免疫与神经系统活动,在帕金森病的发生发展中发挥着重要作用。通过肠道菌群“再平衡”可能实现对帕金森病等神经系统疾病的有效治疗,而益生菌作为常见的调节肠道菌群的方法将在治疗帕金森病方面发挥重要作用。
益生菌被定义为“当给予足够的量时对宿主的健康有益的活的微生物[5]”,具有安全性高、可产生益生作用、易于进行基因工程改造等优点,而给药途径简单、成本低的特点使其成为生物医学领域的研究热点之一。特别是可以通过使用或改造益生菌以构建良好的肠道菌群或通过肠脑轴使其代谢产物作用于大脑细胞,以实现对帕金森病的高效治疗,这相较于传统治疗方法如粪菌移植、药物治疗等具有副作用小、高效、便捷等优势,体现出其独特的应用潜力。
据此,本文将总结益生菌治疗帕金森病的研究进展,凝练益生菌治疗帕金森可能的作用机制,展望未来工程益生菌在治疗帕金森领域的潜力,为治疗帕金森等神经系统疾病提供理论依据。
1 帕金森病与肠道菌群的关系人体微生物组处于极为复杂的平衡态,肠道微生物更是在人体微生物中占据极高的比重并通过调节免疫、消化、代谢和神经功能来维持人体的稳定。肠道微生物失调可能导致肠道炎症的发生,进而引发神经系统疾病。肠道菌群可以通过多个传导途径对中枢神经系统产生致病作用,如阿尔茨海默病[6]、帕金森病[7]、亨廷顿病[8]、抑郁症[9]和焦虑症[10]等。帕金森病患者肠胃功能障碍明显,而益生菌能够保持、调节或恢复肠道微生物的平衡,故正确了解两者之间的关系,可能会开启益生菌预防或治疗帕金森病的新策略,并为其他相似的神经系统疾病的治疗提供参考。
1.1 肠道菌群通过影响α-突触核蛋白积聚影响帕金森病程虽然帕金森病发病原因并未完全明确,但越来越多的证据表明,肠道菌群失调后,肠神经系统中的α-突触核蛋白会逐渐积聚进而影响神经系统的功能,可能诱发帕金森综合征的发生及发展。
Boehme等通过粪菌移植的方法移植年轻小鼠的粪便至衰老小鼠的肠道中,发现衰老小鼠的相关系列认知行为障碍有所改善,证实了肠道菌群与神经系统疾病之间可能存在密切关系[11]。2006年Braak等提出帕金森病可能与肠道菌群失衡有关,即存在于特定条件下肠道中的病原菌可能使得α-突触核蛋白发生错误折叠和聚集,影响大脑中神经元的正常工作,从而成为帕金森病的诱因[12]。Goya等以秀丽隐杆线虫为模型喂养不同肠道细菌来观察其对于α-突触核蛋白的影响。研究发现枯草芽孢杆菌Pxn21通过鞘脂代谢途径的改变防止α-突触核蛋白团块产生,此外还可以清除已经产生的α-突触核蛋白团块,显著改善实验动物的运动症状[13]。Challis等在实验中将α-突触核蛋白的预制原纤维接种到小鼠肠道中,引起α-突触核蛋白聚集和小鼠胃肠功能障碍,最终使小鼠出现运动障碍[14]。上述研究均表明肠道菌群的组成变化或病原菌的出现可能通过影响α-突触核蛋白的折叠或积聚从而影响帕金森病病程的进行,为使用益生菌调节肠道菌群治疗帕金森病提供理论依据。
1.2 肠道菌群通过影响代谢影响帕金森病程临床已经证实帕金森病的发展与神经炎症的发生密切相关。一些研究表明,帕金森病与胶质细胞的激活和促炎细胞因子的产生有关,脑细胞的炎症反应与其他因素一起,促进多巴胺能神经元死亡,增加血脑屏障的通透性,加重脑损伤[15-16]。Unger等通过研究发现,帕金森病患者肠道微生物区系组成发生了变化,同时肠道细菌的代谢产物短链脂肪酸的相对丰度也发生了改变,具体表现为丙酸和丁酸盐的绝对浓度显著降低,而短链脂肪酸可以直接或间接作用于中枢神经系统,通过特定方式调节肠道屏障通透性和调节免疫功能[3],从而证实了肠道菌群可能通过影响机体代谢、免疫而影响帕金森病病程。Keshavarzian等对比了帕金森病患者与对照组肠道黏膜和粪便中微生物群落。帕金森病患者黏膜中促炎细胞因子产生菌如属罗氏菌门、变形菌门、肠球菌科细菌浓度增加;丁酸盐产生菌,如粪球菌属和粪杆菌属细菌浓度降低;预测宏基因组学表明,帕金森病患者粪便微生物组中大量参与代谢的基因显著降低,而参与脂多糖生物合成和Ⅲ型细菌分泌系统的基因显著升高[17]。因此,可以利用肠道微生物及其代谢产物则来调节机体的代谢系统与免疫系统,减弱脑部的炎症反应,达到改善帕金森病的效果。
2 益生菌在帕金森病中的应用 2.1 天然益生菌在帕金森病中的应用近年来使用益生菌治疗帕金森病的实验方法和结果,显现其巨大的治疗潜力,如表 1所示。2016年Barichella等进行了一项三级、随机、双盲和安慰剂对照试验,评估了益生菌和益生元对帕金森病和便秘患者的疗效,通过连续统计4周中每周排便次数,最终发现食用含有多种益生菌菌株和益生元纤维的发酵乳在改善帕金森病患者便秘方面的效果优于安慰剂[18]。2019年Tamtaji等为了评估补充益生菌对帕金森病患者运动和代谢参数的影响,进行了一项为期12周的随机、双盲、安慰剂对照试验,在帕金森病患者服用12周的益生菌后,通过运动障碍协会统一的帕金森病评定量表进行记录,发现静止性震颤、运动迟缓等症状得到明显改善[19]。2020年针对帕金森病啮齿动物模型中的海马依赖性认知,Xie等评估了益生菌治疗帕金森病大鼠模型的效果,在临床前帕金森病模型中使用了神经毒素(6-羟基多巴胺)来考察鼠李糖乳杆菌HA-114的治疗效果,他们使用新物体识别(novel object recognition)和新位置识别(novel place recognition),对非海马和海马依赖性任务的认知进行了评估。该研究最终发现益生菌作为帕金森病非运动症状的辅助治疗改善了海马依赖性认知功能障碍[20]。2021年Ai Huey Tan等进行了一项双盲、随机、安慰剂对照和单中心实验,通过记录接受多菌株益生菌胶囊的患者每周平均自发排便次数的变化与其他的次要指标,最终发现多菌株益生菌对帕金森患者的便秘症状具有明显治疗效果,同时患者的肠道中益生菌的种类和数量均有所增加[21]。同年Tsao等针对益生菌对6-羟基多巴胺诱导的帕金森病大鼠抗氧化能力的增强和肠道微生物群组成的改变展开研究,通过对神经保护作用,血清中氧化应激和炎症标志物以及微生物群组成和微生物代谢物的评估,测定了唾液乳杆菌的作用,最终发现唾液乳杆菌AP-32补充剂促进6-羟基多巴胺诱导病变的大鼠提高全身抗氧化活性,从而抑制氧化应激和炎症的发展。同时益生菌补充剂还通过富集共生菌,同时抑制一些致病菌来改变粪便微生物群的组成[22]。2022年Sun等研究益生菌联合给药对帕金森患者的有益作用,最终结果表明乳双歧杆菌Probio-M8共同给药具有改善睡眠质量、减轻焦虑和胃肠道症状的作用,增强了治疗帕金森病的临床疗效,同时改善了宿主的肠道微生物组、肠道微生物代谢潜能和血清代谢物[23]。
| Publication time | Experimental object | Intervention time | Subject distribution | Type of experiment | Experimental effect | Reference |
| 2016 | Fermented milk containing probiotics and prebiotics | 4 weeks | Placebo group (n=40) or fermented milk containing multiple probiotic strains (n=80). | Three levels, randomized, double-blind, placebo-controlled trial | Consumption of fermented milk containing probiotics and prebiotics resulted in more complete defecation per week than placebo | [18] |
| 2019 | Probiotic supplement | 12 weeks | 8×109 CFU/day probiotics or placebo group. (n=30 per group) |
Randomized, double-blind, placebo-controlled clinical trial | Probiotic consumption led to increased insulin levels and insulin resistance | [19] |
| 2020 | Lacticaseibacillus rhamnosus HA-114 | 6 weeks | Probiotic 6-OHDA group (n=10) and placebo group (n=9) | Preclinical experiment | Hippocampal dependent cognitive impairment in rats with 6-OHDA lesions is reversed by probiotics | [20] |
| 2021 | Multi-strain probiotic capsule | 4 weeks | Receive multi-strain probiotic capsules (n= 34) or the same- appear placebo (n=38) |
Double-blind, randomized, placebo-controlled, single-center trial | After probiotic treatment, the average number of spontaneous defecation per week increased | [21] |
| 2021 | Lactobacillus saliva AP-32 probiotics, probiotics (dry AP-32 medium supernatant) and probiotics/probiotics mixture | 8 weeks | PD (n=5), LD (PD treated with 8 mg levodopa, n=5), 1x (PD supplemented with 1.03 ×109CFU/ kg probiotics, n=5), MR (PD supplemented with 62 mg/kg MR, n=5) and 1XMR (n=5). |
Long-term probiotics and prebiotics supplements change intestinal ecological disorders induced by 6-OHDA by reshaping the composition of fecal microflora | [22] | |
| 2022 | Bifidobacterium lactis (Probio-M8) | 12 weeks | Randomly divided into two groups: probiotics group (n=48) and placebo (n=34) | Randomized, double-blind, placebo-controlled clinical trial | Probiotics-M8 co-administration can improve sleep quality and relieve anxiety and gastrointestinal symptoms | [23] |
通过对比不难发现,天然益生菌在缓解甚至治疗帕金森病领域具有广泛的应用潜力,但存在使用剂量不统一、治疗周期不统一、机制不明确等问题,未来仍需大量研究进行进一步阐明。
2.2 工程益生菌在帕金森病中的应用目前已有众多研究证实益生菌有助于帕金森病的治疗,但是野生型益生菌在治疗过程中存在靶向性差、特异性不佳和机制不明等缺点,工程益生菌的出现弥补了这些不足。工程益生菌是通过合成生物学、基因编辑、基因工程等技术,对现有的益生菌进行修饰和改造,获得具有特定功能的新的益生菌。相较于野生型底盘菌其具有位点特异性给药、持续性释放和机制可控等优点。可以通过选择高定殖底盘菌株提高工程益生菌定殖率,尽可能实现较长时间内的可控定殖,提高工程菌的使用灵活度和使用效果。
近年来关于工程益生菌的研究进展迅速,其在治疗炎症性肠病[24] (inflammatory bowel disease, IBD)、细菌感染[25-26] (bacterial infection)、苯丙酮尿症[27] (phenylketonuria, PKU)和高氨血症[28] (hyperammonemia)等疾病中取得了良好的成效。因此,期望通过改造特定的益生菌使得其对帕金森病有着更加优异的治疗效果。Wu等将大肠杆菌Nissle 1917 (Escherichia coli Nissle, 1917, ECN)进行改造后构建了可以分泌递送GLP-1的EcN-GLP-1益生菌株,该工程菌可以调节TJs的表达并抑制核因子κB (nuclear factor kappa-B, NF-κB)信号通路中的炎症反应,同时通过产生GLP-1治疗分子来调节肠道功能,显著改善1-甲基-4-苯基-1, 2, 3, 6-四氢吡啶(1-methyl-4- phenyl-1, 2, 3, 6-tetrahydropyridine, MPTP)诱导的帕金森病小鼠的肠道紊乱特性,并显示出有效的神经保护功能[29]。Kanthasamy等利用新开发的合成生物学和基因工程技术,使用重组的4-氢苯乙酸酯3-单加氧酶(4-hydrophenylacetate 3-monooxygenase)和FAD还原酶基因,改造肠道中的益生菌,能够利用人体产生的酪氨酸合成左旋多巴,且使用鼠李糖预激活细胞或改变药丸中的细菌数量来调整剂量[30],来达到治疗帕金森病的效果。Guo等构建了一种可定时唤醒的仿生休眠体用于帕金森病治疗,通过对自主筛选的植物乳杆菌进行智能纳米涂层修饰后,可定时控制益生菌在肠道中唤醒的时间和位置,使微生物在肠道中定时合成GABA,进而达到对帕金森病的治疗作用,相较普通益生菌具有更高的可控性和靶向性,体现出工程益生菌独特的优势[4]。Zhou等开发了一种用纳米装甲修饰单个益生菌从而提高其在肠道定殖效率的方法。通过与脂质体的简单组装,使得每个细胞表面的脂质双分子涂层起到装甲的作用,有效保护其免受肠道和胃中强酸和消化酶的攻击和破坏。结果表明,脂质体包被后的青芽孢杆菌在肠道的定殖效率显著提高。而青芽孢杆菌作为活细胞工厂,可以自我调节产生恒定浓度的GABA,在治疗帕金森方面展现出良好的应用潜力[31]。
目前,工程益生菌在治疗肠道疾病、肿瘤、神经系统疾病方面都展现出巨大的研究潜力,但在其应用过程中仍存在稳定性未知、靶向性不高等许多不确定性因素,期待未来能有更多的工程益生菌用于治疗帕金森病,为帕金森病的高效治疗提供新的思路。
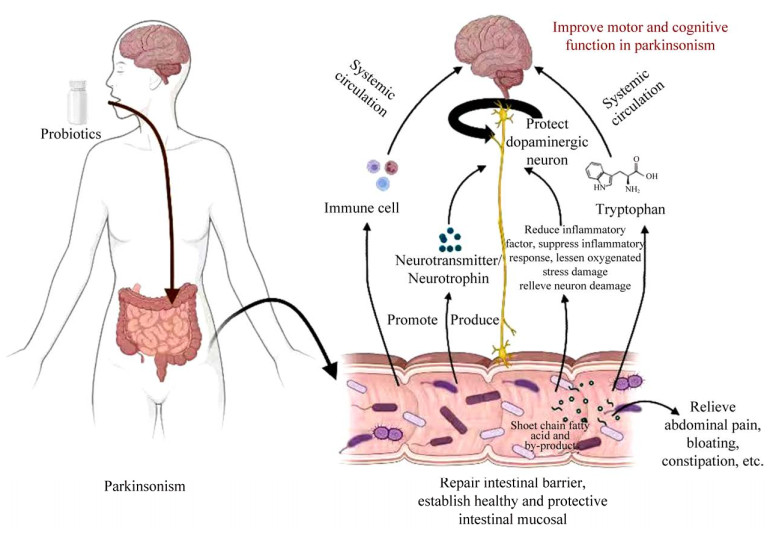
3 益生菌治疗帕金森病可能的机制益生菌治疗帕金森病的潜在机制是利用益生菌代谢产物及副产物如短链脂肪酸等与大脑进行通信,调节机体代谢、免疫与神经系统活动,最终达到改善帕金森病患者运动功能与认知功能的效果。目前认为其治疗机制主要有以下5种可能(图 1)。
|
| 图 1 益生菌治疗帕金森的潜在机制 Figure 1 Potential mechanism of probiotics in Parkinson's disease treatment. |
(1) 益生菌在调节宿主肠道菌群组成和功能方面具有积极影响,其代谢产物及副产物可以帮助宿主建立健康的肠道黏膜保护层,从而缓解帕金森患者腹痛、腹胀、便秘等症状[2]。Georgescu等研究发现使用嗜酸乳杆菌和婴儿双歧杆菌组成的联合菌剂后,老年帕金森病患者的腹痛和腹胀症状得到有效缓解,其机制可能与益生菌增加短链脂肪酸的含量有关[32]。通过利用一种或多种益生菌对帕金森患者进行干预,有望使患者肠道pH降低、肠道动力增强、肠道运输时间缩短,从而使患者便秘症状减轻,排便次数增加,生活质量提高[33]。
(2) 益生菌自身及其产生的短链脂肪酸及其他副产物可以通过肠脑轴降低帕金森小鼠炎症因子水平(尤其是唾液乳杆菌能够显著降低促炎细胞因子水平)[22],抑制氧化应激反应[34]。帕金森患者神经系统中的胶质细胞活化产生的促炎因子和细胞毒性因子是多巴胺能神经元进行性损伤的重要原因,而促炎因子介导的神经炎症使细胞处于氧化应激状态,导致脑干黑质的多巴胺合成功能紊乱,对患者的神经元造成进一步损伤。研究证实,益生菌可以参与氧化应激相关信号通路的调控[35]和神经系统中胶质细胞活化表达促炎因子的调节,其产生的短链脂肪酸等副产物可干预抑制炎症反应[36],从而减少对于多巴胺能神经元的损伤。
(3) 益生菌肠道菌群也可以促进或直接合成一些神经递质如多巴胺、去甲肾上腺素和血清素[32]以及神经营养因子如氨基丁酸和短链脂肪酸[37-38],提高多巴胺能神经元的存活。肠道是多巴胺产生的场所之一,前文中Kanthasamy等的工程益生菌直接合成的左旋多巴可在小肠部位分解为多巴胺,补充中脑多巴胺信号,已被证实具有一定疗效[30]。通过设计工程益生菌高效表达GABA等神经递质和短链脂肪酸等神经调节剂,可使上述物质通过体循环最终到达大脑,更好地维护帕金森患者神经网络的健康,改善帕金森患者运动、认知等与神经相关的功能。
(4) 益生菌产生的短链脂肪酸可以分解产生色氨酸,而色氨酸在体循环过程中又可合成人体重要神经递质5-羟色胺,有助于帕金森患者神经系统的康复[37]。高效表达短链脂肪酸的工程益生菌同样可以借助此机制治疗帕金森患者。
(5) 益生菌产生的肠道微生物及其代谢产物可以驱动免疫细胞应答,进而通过体循环运输调节局部或全身免疫系统[38],最终改善帕金森患者的认知功能与运动功能。人体免疫网络复杂,益生菌在各通路中的调节作用有待继续探究,通过改造工程菌使其能够实现在某一通路的特定调控作用,则有望为帕金森患者得以高效、安全地治疗提供可行方案。
4 结语肠道菌群在食物消化、免疫增强和防止有害病原体在胃肠道定殖方面发挥重要作用。各种观察和动物研究表明,肠道菌群通过影响α-突触核蛋白积聚及机体代谢影响帕金森病程,肠道菌群的失调可能增加炎症细胞因子和细菌代谢物,从而改变肠道和血脑屏障的通透性并引起神经炎症,最终成为帕金森病的诱因。而益生菌可以通过维持肠道生态稳定、促进神经递质合成等多种途径来达到预防、治疗帕金森病的效果。本文从帕金森病和肠道菌群的关系入手,阐述了益生菌治疗帕金森病的应用现状以及可能的机制,认为益生菌在治疗帕金森病方面具有独特优势。但目前研究所用的益生菌在治疗帕金森病过程中存在菌株种类单一、机制不明确、毒副作用不清、靶向性低和稳定性低等缺点,期望利用合成生物学等方法构建工程益生菌,调节帕金森病患者的肠道微生态平衡,以期减少帕金森病治疗过程中的毒副作用或进行特异性治疗,同时也为其他神经系统疾病的治疗提供新思路。
| [1] | BIGHAM M, MOHAMMADIPOUR A, HOSSEINI M, MALVANDI AM, EBRAHIMZADEH-BIDESKAN A. Neuroprotective effects of garlic extract on dopaminergic neurons of substantia nigra in a rat model of Parkinson's disease: motor and non-motor outcomes[J]. Metabolic Brain Disease, 2021, 36(5): 927-937 DOI:10.1007/s11011-021-00705-8. |
| [2] |
崔艳如, 庞日朝, 岑秋宇, 魏娟芳, 张安仁. 益生菌缓解帕金森病相关症状的作用及机制研究进展[J]. 食品工业科技, 2023, 44(9): 475-481.
CUI YR, PANG RZ, CEN QY, WEI JF, ZHANG AR. Research progress on the effect and mechanism of probiotics in relieving symptoms related to Parkinson's disease[J]. Food Industry Science and Technology, 2023, 44(9): 475-481 (in Chinese). |
| [3] | UNGER MM, SPIEGEL J, DILLMANN KU, GRUNDMANN D, PHILIPPEIT H, BÜRMANN J, FAßBENDER K, SCHWIERTZ A, SCHÄFER KH. Short chain fatty acids and gut microbiota differ between patients with Parkinson's disease and age-matched controls[J]. Parkinsonism & Related Disorders, 2016, 32: 66-72. |
| [4] | GUO MM, YANG CR, LI BW, CHENG SX, GUO QL, MING D, ZHENG B. Bionic dormant body of timed wake-up for bacteriotherapy in vivo[J]. ACS Nano, 2022, 16(1): 823-836 DOI:10.1021/acsnano.1c08377. |
| [5] | HILL C, GUARNER F, REID G, GIBSON GR, MERENSTEIN DJ, POT B, MORELLI L, CANANI RB, FLINT HJ, SALMINEN S, CALDER PC, ELLEN SANDERS M. The international scientific association for probiotics and prebiotics consensus statement on the scope and appropriate use of the term probiotic[J]. Nature Reviews Gastroenterology & Hepatology, 2014, 11(8): 506-514. |
| [6] | BORSOM EM, LEE K, COPE EK. Do the bugs in your gut eat your memories? Relationship between gut microbiota and Alzheimer's disease[J]. Brain Sciences, 2020, 10(11): 814 DOI:10.3390/brainsci10110814. |
| [7] | LUBOMSKI M, TAN AH, LIM SY, HOLMES AJ, DAVIS RL, SUE CM. Parkinson's disease and the gastrointestinal microbiome[J]. Journal of Neurology, 2020, 267(9): 2507-2523 DOI:10.1007/s00415-019-09320-1. |
| [8] | WASSER CI, MERCIECA EC, KONG G, HANNAN AJ, MCKEOWN SJ, GLIKMANN-JOHNSTONY, STOUT JC. Gut dysbiosis in Huntington's disease: associations among gut microbiota, cognitive performance and clinical outcomes[J]. Brain Communications, 2020, 2(2): fcaa110 DOI:10.1093/braincomms/fcaa110. |
| [9] | CAPUCO A, URITS I, HASOON J, CHUN R, GERALD B, WANG JK, KASSEM H, NGO AL, ABD-ELSAYED A, SIMOPOULOS T, KAYE AD, VISWANATH O. Current perspectives on gut microbiome dysbiosis and depression[J]. Advances in Therapy, 2020, 37(4): 1328-1346 DOI:10.1007/s12325-020-01272-7. |
| [10] | NEUFELD KM, KANG N, BIENENSTOCK J, FOSTER JA. Reduced anxiety-like behavior and central neurochemical change in germ-free mice[J]. Neurogastroenterology & Motility, 2011, 23(3): 255-e119. |
| [11] | BOEHME M, GUZZETTA KE, BASTIAANSSEN TFS, van de WOUW M, MOLONEY GM, GUAL-GRAU A, SPICHAK S, OLAVARRÍA-RAMÍREZ L, FITZGERALD P, MORILLAS E, RITZ NL, JAGGAR M, COWAN CSM, CRISPIE F, DONOSO F, HALITZKI E, NETO MC, SICHETTI M, GOLUBEVA AV, FITZGERALD RS, et al. Microbiota from young mice counteracts selective age-associated behavioral deficits[J]. Nature Aging, 2021, 1(8): 666-676 DOI:10.1038/s43587-021-00093-9. |
| [12] | BRAAK H, de VOS RAI, BOHL J, del TREDICI K. Gastric alpha-synuclein immunoreactive inclusions in Meissner's and Auerbach's plexuses in cases staged for Parkinson's disease-related brain pathology[J]. Neuroscience Letters, 2006, 396(1): 67-72 DOI:10.1016/j.neulet.2005.11.012. |
| [13] | GOYA ME, XUE F, SAMPEDRO-TORRES-QUEVEDO C, ARNAOUTELI S, RIQUELME-DOMINGUEZ L, ROMANOWSKI A, BRYDON J, BALL KL, STANLEY-WALL NR, DOITSIDOU M. Probiotic Bacillus subtilis protects against α-synuclein aggregation in C. elegans[J]. Cell Reports, 2020, 30(2): 367-380.e7 DOI:10.1016/j.celrep.2019.12.078. |
| [14] | CHALLIS C, HORI A, SAMPSON TR, YOO BB, CHALLIS RC, HAMILTON AM, MAZMANIAN SK, VOLPICELLI-DALEY LA, GRADINARU V. Gut-seeded α-synuclein fibrils promote gut dysfunction and brain pathology specifically in aged mice[J]. Nature Neuroscience, 2020, 23(3): 327-336 DOI:10.1038/s41593-020-0589-7. |
| [15] | ZHANG G, YANG G, LIU J. Phloretin attenuates behavior deficits and neuroinflammatory response in MPTP induced Parkinson's disease in mice[J]. Life Sciences, 2019, 232: 116600 DOI:10.1016/j.lfs.2019.116600. |
| [16] | SERRA D, ALMEIDA LM, DINIS TCP. Dietary polyphenols: a novel strategy to modulate microbiota-gut-brain axis[J]. Trends in Food Science & Technology, 2018, 78: 224-233. |
| [17] | KESHAVARZIAN A, GREEN SJ, ENGEN PA, VOIGT RM, NAQIB A, FORSYTH CB, MUTLU E, SHANNON KM. Colonic bacterial composition in Parkinson's disease[J]. Movement Disorders, 2015, 30(10): 1351-1360 DOI:10.1002/mds.26307. |
| [18] | BARICHELLA M, PACCHETTI C, BOLLIRI C, CASSANI E, IORIO L, PUSANI C, PINELLI G, PRIVITERA G, CESARI I, FAIERMAN SA, CACCIALANZA R, PEZZOLI G, CEREDA E. Probiotics and prebiotic fiber for constipation associated with Parkinson's disease[J]. Neurology, 2016, 87(12): 1274-1280 DOI:10.1212/WNL.0000000000003127. |
| [19] | TAMTAJI OR, TAGHIZADEH M, DANESHVAR KAKHAKI R, KOUCHAKI E, BAHMANI F, BORZABADI S, ORYAN S, MAFI A, ASEMI Z. Clinical and metabolic response to probiotic administration in people with Parkinson's disease: a randomized, double-blind, placebo-controlled trial[J]. Clinical Nutrition (Edinburgh, Scotland), 2019, 38(3): 1031-1035 DOI:10.1016/j.clnu.2018.05.018. |
| [20] | XIE C, PRASAD AA. Probiotics treatment improves hippocampal dependent cognition in a rodent model of Parkinson's disease[J]. Microorganisms, 2020, 8(11): 1661 DOI:10.3390/microorganisms8111661. |
| [21] | TAN AH, LIM SY, CHONG KK, A MANAP MAA, HOR JW, LIM JL, LOW SC, CHONG CW, MAHADEVA S, LANG AE. Probiotics for constipation in Parkinson's disease[J]. Neurology, 2021, 96(5): e772. |
| [22] | TSAO SP, NURRAHMA BA, KUMAR R, WU CH, YEH TH, CHIU CC, LEE YP, LIAO YC, HUANG CH, YEH YT, HUANG HY. Probiotic enhancement of antioxidant capacity and alterations of gut microbiota composition in 6-hydroxydopamin-induced Parkinson's disease rats[J]. Antioxidants, 2021, 10(11): 1823 DOI:10.3390/antiox10111823. |
| [23] | SUN HR, ZHAO FY, LIU YY, MA T, JIN H, QUAN KY, LENG B, ZHAO JW, YUAN XL, LI ZG, LI F, KWOK LY, ZHANG SK, SUN ZH, ZHANG JB, ZHANG HP. Probiotics synergized with conventional regimen in managing Parkinson's disease[J]. Npj Parkinson's Disease, 2022, 8: 62 DOI:10.1038/s41531-022-00327-6. |
| [24] | WANG LF, LIAO Y, YANG RB, ZHU ZF, ZHANG LC, WU ZD, SUN X. An engineered probiotic secreting Sj16 ameliorates colitis via Ruminococcaceae/butyrate/retinoic acid axis[J]. Bioengineering & Translational Medicine, 2021, 6(3): e10219. |
| [25] | CHOUDHURY A, ORTIZ P, KEARNEY CM. In vitro inhibition of H. pylori in a preferential manner using bioengineered L. lactis releasing guided antimicrobial peptides[Z]. Cold Spring Harbor: Cold Spring Harbor Laboratory Press, 2021. |
| [26] | KOH E, HWANG IY, LEE HL, de SOTTO R, LEE JWJ, LEE YS, MARCH JC, CHANG MW. Engineering probiotics to inhibit Clostridioides difficile infection by dynamic regulation of intestinal metabolism[J]. Nature Communications, 2022, 13: 3834 DOI:10.1038/s41467-022-31334-z. |
| [27] | DURRER KE, ALLEN MS, HUNT von HERBING I. Genetically engineered probiotic for the treatment of phenylketonuria (PKU); assessment of a novel treatment in vitro and in the PAHenu2 mouse model of PKU[J]. PLoS One, 2017, 12(5): e0176286 DOI:10.1371/journal.pone.0176286. |
| [28] | KURTZ CB, MILLET YA, PUURUNEN MK, PERREAULT M, CHARBONNEAU MR, ISABELLA VM, KOTULA JW, ANTIPOV E, DAGON Y, DENNEY WS, WAGNER DA, WEST KA, DEGAR AJ, BRENNAN AM, MILLER PF. An engineered E. coli Nissle improves hyperammonemia and survival in mice and shows dose-dependent exposure in healthy humans[J]. Science Translational Medicine, 2019, 11(475): eaau7975 DOI:10.1126/scitranslmed.aau7975. |
| [29] | WU H, WEI J, ZHAO XM, LIU Y, CHEN ZH, WEI KH, LU JC, CHEN WJ, JIANG MX, LI SJ, CHEN TT. Neuroprotective effects of an engineered Escherichia coli Nissle 1917 on Parkinson's disease in mice by delivering GLP-1 and modulating gut microbiota[J]. Bioengineering & Translational Medicine, 2022: e10351. |
| [30] | PADHI P, BACKES NJ, ABDALLA A, PHILLIPS G, KANTHASAMY AG. Recombinant microbial cell used in composition for treating Parkinson's disease, depression, anxiety, comprises heterologous 4-hydroxyphenylacetate 3-monooxygenase, FAD reductase nucleotide sequence stably integrated in genome of cell: US2022031771-A1[P]. 2022-02-03. |
| [31] | ZHOU X, GUO QL, GUO MM, LI BW, PENG WC, WANG DP, MING D, ZHENG B. Nanoarmour-shielded single-cell factory for bacteriotherapy of Parkinson's disease[J]. Journal of Controlled Release: Official Journal of the Controlled Release Society, 2021, 338: 742-753 DOI:10.1016/j.jconrel.2021.09.009. |
| [32] | GEORGESCU D, ELENA ANCUSA O, GEORGESCU LA, IONITA I, REISZ D. Nonmotor gastrointestinal disorders in older patients with Parkinson's disease: is there hope?[J]. Clinical Interventions in Aging, 2016, 11: 1601-1608 DOI:10.2147/CIA.S106284. |
| [33] | MAGISTRELLI L, AMORUSO A, MOGNA L, GRAZIANO T, CANTELLO R, PANE M, COMI C. Probiotics may have beneficial effects in Parkinson's disease: in vitro evidence[J]. Frontiers in Immunology, 2019, 10: 969 DOI:10.3389/fimmu.2019.00969. |
| [34] | WANG Y, TONG Q, MA SR, ZHAO ZX, PAN LB, CONG L, HAN P, PENG R, YU H, LIN Y, GAO TL, SHOU JW, LI XY, ZHANG XF, ZHANG ZW, FU J, WEN BY, YU JB, CAO XT, JIANG JD. Oral berberine improves brain dopa/dopamine levels to ameliorate Parkinson's disease by regulating gut microbiota[J]. Signal Transduction and Targeted Therapy, 2021, 6: 77 DOI:10.1038/s41392-020-00456-5. |
| [35] | LIAO JF, CHENG YF, YOU ST, KUO WC, HUANG CW, CHIOU JJ, HSU CC, HSIEH-LI HM, WANG S, TSAI YC. Lactobacillus plantarum PS128 alleviates neurodegenerative progression in 1-methyl-4-phenyl-1, 2, 3, 6-tetrahydropyridine-induced mouse models of Parkinson's disease[J]. Brain, Behavior, and Immunity, 2020, 90: 26-46 DOI:10.1016/j.bbi.2020.07.036. |
| [36] | SRIVASTAV S, NEUPANE S, BHURTEL S, KATILA N, MAHARJAN S, CHOI H, HONG JT, CHOI DY. Probiotics mixture increases butyrate, and subsequently rescues the nigral dopaminergic neurons from MPTP and rotenone-induced neurotoxicity[J]. The Journal of Nutritional Biochemistry, 2019, 69: 73-86 DOI:10.1016/j.jnutbio.2019.03.021. |
| [37] |
于洁, 李琪, 赵飞燕. 肠道菌群成为帕金森病治疗的新靶点[J]. 食品工业科技, 2022, 43(21): 1-8.
YU J, LI Q, ZHAO FY. Intestinal flora: a new target for the treatment of Parkinson's disease[J]. Science and Technology of Food Industry, 2022, 43(21): 1-8 (in Chinese). |
| [38] | LI Z, LU G, LI Z, WU B, LUO EL, QIU XM, GUO JW, XIA ZY, ZHENG CY, SU QZ, ZENG Y, CHAN WY, SU XW, CAI QD, XU YJ, CHEN YJ, WANG MB, POON WS, LUO XD. Altered Actinobacteria and Firmicutes phylum associated epitopes in patients with Parkinson's disease[J]. Frontiers in Immunology, 2021, 12: 632482 DOI:10.3389/fimmu.2021.632482. |
 2023, Vol. 63
2023, Vol. 63