
中国科学院微生物研究所,中国微生物学会
文章信息
- 潘琪琪, 王涓, 汪智, 肖铠姗, 吴清平. 2024
- PAN Qiqi, WANG Juan, WANG Zhi, XIAO Kaishan, WU Qingping.
- 外膜囊泡的物质传递及细菌保护作用研究进展
- Research progress in material delivery and bacterial protection of outer membrane vesicles
- 微生物学报, 64(2): 364-377
- Acta Microbiologica Sinica, 64(2): 364-377
-
文章历史
- 收稿日期:2023-07-18
- 网络出版日期:2023-10-13
2. 华南农业大学食品学院, 广东 广州 510642
2. College of Food Science, South China Agricultural University, Guangzhou 510642, Guangdong, China
细菌在生长繁殖过程中会面临连续不断变化的或恶劣的环境。细菌如何应对环境中的不利影响,是它们能否生存的关键。几乎所有的革兰氏阴性细菌都会产生一种具有磷脂双分子层的球状纳米结构(直径10–250 nm),称为外膜囊泡(outer membrane vesicles, OMVs)[1-5]。OMVs外层含有脂多糖、外膜蛋白受体等,内层由脂蛋白和肽聚糖交联而成[6-7],其包含外膜蛋白和脂质,以及位于腔内或结合于外表面的可溶性物质[8-9]。细菌能在多种环境下产生OMVs,例如浮游培养、淡水和盐水、生物被膜、真核细胞内和哺乳动物宿主内[1, 10-13]。研究发现细菌通过OMVs来应对恶劣环境这是一种自我保护机制[14]。OMVs除了能辅助细菌的自我保护,还参与多种生理过程,如促进细菌间的通讯、帮助细菌分泌物质、获取营养等[15-16]。
自青霉素发现以来,多种抗生素被发现、利用和大量生产,解决了许多人类感染性疾病。与此同时,病原细菌的耐药性也逐渐提升,甚至还出现了多重耐药菌和超级细菌,使抗生素治疗效果降低,给相关疾病的治疗带来了巨大障碍[17]。细菌的耐药机制一直都是研究的热点。已有团队成功提取了OMVs[18],以用于细菌耐药机制研究。多项研究结果认为,OMVs的产生是造成细菌耐药的原因之一,强调了OMVs在抗生素环境下对细菌的存活以及耐药性获得的重要作用[19-20]。目前,研究者对于OMVs的物质传递功能还未全面地了解,关于在抗生素环境及其他逆境下,OMVs对细菌保护作用的相关报道也并不多,因此本文将对OMVs具有的多种物质传递与保护功能以及细菌OMVs在治疗疾病方面的应用潜力进行综述,以期对未来的研究提供参考与帮助。
1 细菌OMVs及其来源面对纷繁复杂的生存环境,微生物经过漫长的演变,进化出了能协调环境与菌体相互作用的工具,其中包括产生的OMVs[14]。过去的20多年里,已经有大量的有力证据证实了OMVs的重要性。OMVs就像是细胞膜的延伸,拓宽了细菌与外界相互作用的边界,它包裹了多种不同功能的物质,如周质空间相关的蛋白质、脂多糖、核酸和细胞毒素等。OMVs不仅传递这些包裹的物质到宿主的特定部位发生作用[6, 18],还在一定程度上保护了内容物,实现长距离运输(图 1)。由于OMVs天生具备的包裹和传递功能,使其在病原菌感染和致病方面具有推波助澜的作用。特别是对于一些没有毒力分泌系统的菌种[17]来说,OMVs是实现其致病性的强有力工具之一。
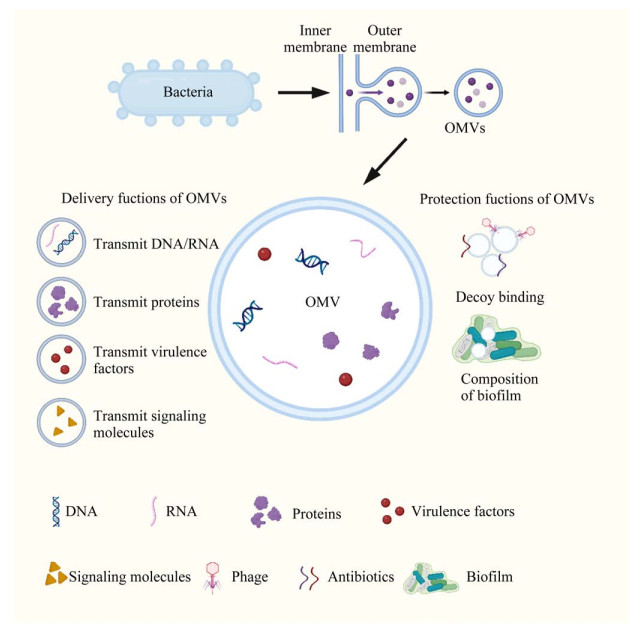
|
| 图 1 细菌OMVs的物质传递与保护功能 Figure 1 The substances delivery and protection functions of bacterial OMVs. OMVs secreted by bacteria transmit various substances, such as DNA, RNA, proteins, virulence factors, signaling molecules, etc. OMVs can also serve as bait to bind antibiotics, bacteriophages, and participate in the formation of biofilms. |
OMVs的产生被认为是细菌应激反应的结果,是一个有规律和选择性的过程[9]。目前,已有一些关于外膜囊泡形成方式的理论,包括外膜蛋白减少、局部包膜成分的积累等[14, 21]。细菌外膜与内层的脂蛋白、肽聚糖三者交联,当脂蛋白-肽聚糖解联时,细菌外膜会向外凸起出芽,形成OMVs。在鲍曼不动杆菌中,OmpA蛋白的减少可能引起脂蛋白-肽聚糖交联减少[22];在OMVs形成过程中,一些周质酶的产生使总体交联程度降低,但目前还没发现这种周质酶[21]。Schwechheimer等[23]提出,由于肽聚糖片段、错误折叠的蛋白质等在交联较少的细胞膜处聚集,使细胞产生应激反应而生成OMVs将这些物质包裹送出细胞。局部积累的物质可能影响细胞膜的电荷、改变膜的流动性,促使膜曲率发生改变而向外膨胀出芽形成OMVs[14]。温度、脂肪酸种类、脂多糖类型和抗生素胁迫等也会影响OMVs的产生和产量[24-26]。一些脂多糖亚型可以在OMVs中富集,并直接或间接影响OMVs的产量和成分。Haurat等[27]关于OMVs形成方式的研究结果表明,A型脂多糖的突变会导致牙龈卟啉单胞菌OMVs产量降低,且掺入OMVs的外膜蛋白数量增加。
2 OMVs作为细菌的运输工具 2.1 OMVs运输耐药基因在环境中,同种或不同种的细菌之间往往通过基因的水平转移来获得相关抗生素耐药性[28]。细菌间遗传物质的交换不仅仅局限于接合、转化和转导,OMVs也参与了细菌物种之间遗传物质的转移。许多革兰氏阴性菌OMVs中都包含DNA。在鲍曼不动杆菌中[29],OMVs可以携带质粒pMMA2或pMMCU3,该质粒上带有碳青霉烯类抗生素耐药基因blaOXA-24,从而通过OMVs将其转移给其他鲍曼不动杆菌菌株,使得敏感菌株获得青霉素类和头孢类抗生素的耐药性。另一研究[30]通过免疫金标记跟踪带有β-内酰胺类抗生素耐药基因的质粒,也确定了OMVs在基因水平转移方面的贡献。以上结果揭示了一种新的基因传播方式。
除了在种内传递,OMVs还具有在种间传播和扩散耐药基因的能力。鲍曼不动杆菌的OMVs携带含有blaNDM-1基因的质粒[30],该OMVs除了能将基因传递给其他鲍曼不动杆菌,还能传递给大肠杆菌,同时OMVs还具有较高的转化效率。该现象揭示了OMVs水平传递耐药性的能力,但并没有证实该基因隔代是否还存在。近年,肺炎克雷伯菌OMVs也被首次证明具有水平传递基因的功能[31],该OMVs能够将含有耐药基因的高拷贝质粒传递给大肠杆菌、肠道沙门氏菌、铜绿假单胞菌和洋葱伯克霍尔德菌,阐明肺炎克雷伯菌OMVs作为抗生素耐药基因传播载体的关键作用,有助于微生物群落中抗生素耐药的发展。
2.2 OMVs运输毒力基因OMVs作为细菌的运输工具可以递送毒力基因。OMVs参与群体感应,通过选择性杀死或促进其他细菌的生长,使细菌能够建立定殖生态位,并将毒力因子传递给宿主细胞,从而调节宿主免疫反应[13, 32]。OMVs在传递毒力基因方面的重要性已被广泛认可。Yaron等[33]证实,大肠杆菌O157:H7释放到培养基中的OMVs含有毒力基因。此OMVs介导了毒力基因的转移,并且该基因随后在受体肠道细菌中表达。该OMVs传递的毒力基因还可在大肠杆菌和其他肠道细菌之间转移,电子显微镜观察发现OMVs中除了含有噬菌体相关基因外,还有质粒和染色体DNA片段[33]。
2.3 OMVs运输毒素OMVs是一种传递细胞毒素的方式。细胞致死性扩张毒素(cytolethal distending toxin, CDT)是弯曲杆菌属最具特征性的细胞毒素,也是最先被发现的能通过OMVs递送的毒素。Lindmark等[34]发现空肠弯曲杆菌OMVs能够释放CDT,对培养的细胞造成致死性扩张效应。幽门螺杆菌分泌的OMVs与VacA毒素相关[35],能使胃上皮细胞出现显著空泡现象。此外,霍乱弧菌可以通过OMVs保护并运输霍乱毒素到肠上皮细胞从而影响肠道健康[36]。
2.4 OMVs运输RNA众所周知,细胞内小RNA (small RNAs, sRNAs)在许多细菌物种[37-38]中具有调节功能,调节细胞膜结构、代谢、细菌通讯、群体感应、生物被膜形成和毒力[39-40]。研究表明,sRNAs可以借助OMVs传递[41-42],从而在一定程度上影响细菌和环境之间的相互作用。Koeppen等[43]表征了铜绿假单胞菌OMVs中差异包装的sRNAs,显示OMVs-sRNAs能向人类气道细胞转移。同时该团队选择了一种在OMVs中含量丰富的tRNA (即sRNA52320)进行进一步研究,发现sRNA52320减弱了OMVs诱导的小鼠肺KC细胞因子分泌和中性粒细胞浸润,证明OMVs传递的sRNA52320可以调节人的气道上皮细胞和小鼠肺的免疫反应[43]。这是OMVs携带sRNA进行跨物种调控的第一个例子。其他研究也进一步说明了OMVs传递RNA的功能。导致牙周疾病的病原菌聚集放线菌(Aggregatibacter actinomycetemcomitans, Aa)分泌的OMVs中包含细胞外RNA (extracellular RNA, exRNA)[44],该exRNA通过OMVs被转移到宿主细胞,研究者认为该exRNA可整合到内源性RNA诱导沉默复合物中。Aa-OMVs和exRNA不仅能影响局部免疫,还可以穿过血脑屏障,增加小鼠大脑中TNF-α的表达,OMVs-exRNA转移到大脑可以导致阿尔茨海默病等神经炎症性疾病。包含RNA的OMVs可能参与了宿主基因的调控机制。
2.5 OMVs运输信号分子细菌以群体的形式存在,它们会通过一些低分子量的胞外信号分子实现细胞间的通讯以调节群体行为,这一过程被称为群体感应[45-46]。一些群体感应信号分子因其疏水性,难以经过外界水环境与受体结合,而OMVs的存在使得这类信号分子可以扩散,促进群体感应发生。珊瑚弧菌AK1[47]可以分泌带有N-酰基高丝氨酸内酯信号分子的OMVs,该OMVs对弧菌适应环境具有重要作用。此外,海洋弧菌OMVs也能包裹信号分子CAI-1使其在该弧菌之间运输[48]。铜绿假单胞菌中具有一种重要的群体感应信号分子,即喹诺酮假单胞菌信号(pseudomonas quinolone signal, PQS),该信号分子不仅与细胞的毒力控制相关,也是一种OMVs自诱导因子,诱导OMVs的产生[49-50],包含PQS的OMVs能参与铜绿假单胞菌群体间的铁摄取[51]。OMVs为信号分子提供了稳定且具有保护作用的运输环境,直到它们与靶受体结合。
2.6 OMVs运输的其他物质OMVs能够运输多种物质,除上述物质以外,OMVs还能运输吸引补体的物质。鼠伤寒沙门氏菌分泌富含PagC的OMVs[52],该OMVs吸引补体分子与之结合,并募集补体抑制因子H使补体失活,从而使细菌可以逃避宿主补体系统的伤害。此外,OMVs可运输硫酸酯酶及抗原[13],以硫酸酯酶依赖性方式穿透肠道黏液屏障,将抗原传递给宿主细胞导致肠道炎症发生。革兰氏阴性菌能释放携带胞质肽聚糖的OMVs,激活NOD信号通路[53],参与维持肠道微生物群平衡。可见,OMVs的运输功能使细菌产物传递到细菌无法抵达的位置,从而影响多种生理反应过程。
3 OMVs在抗生素环境下对细菌的保护方式 3.1 OMVs产量增加抗生素会刺激细菌增加OMVs的分泌量,介导对细菌的保护作用。Manning等[54]用较高浓度多黏菌素B和黏菌素(一类抗菌肽)处理大肠杆菌,收集经过处理和未经过处理的细菌培养液上清,对OMVs的产量进行定量,发现在多黏菌素B和黏菌素处理下,OMVs产量显著增加,是未经处理组的10倍。Li等[55]的研究也发现在黏菌素压力下,大肠杆菌OMVs产量显著增加,但相关机制尚不清楚。Chiu等[24]证明用亚抑制浓度的头孢他啶和亚胺培南处理可以使碳青霉烯类耐药鲍曼不动杆菌的OMVs释放量增加。抗生素胁迫能诱导细菌应激反应,刺激OMVs的产生导致OMVs产量增加,由OMVs携带的释放到环境中的抗生素水解酶、抗生素“诱饵”总量随之增加,从而提高细菌在抗生素胁迫下的存活率。细菌也可能是以OMVs作为一种短期、及时的工具,中和环境压力,让细菌有足够的时间发挥其他耐药方式,如抗生素外排、靶点修饰等[56-57]。
3.2 OMVs包含抗生素水解酶OMVs由蛋白质、脂类、脂多糖等组成,其中携带有酶类、遗传物质和其他与毒力相关的因子[58]。已有多项研究结果证明[2, 60-62],OMVs中含有抗生素水解酶——β-内酰胺酶。β-内酰胺酶能够水解β-内酰胺类抗生素,是革兰氏阴性菌中常见的抗生素抗性蛋白[59],在不同细菌中由于编码基因不同,该酶作用的抗生素也有一定差异。
OMVs能够将抗生素水解酶由细菌本身传递到其他细菌菌群中。Kim等[2]的研究揭示了大肠杆菌产生的OMVs中包含多种能够水解β-内酰胺类抗生素的蛋白,使β-内酰胺类敏感大肠杆菌免受β-内酰胺类抗生素的生长抑制。可见,在细菌防御中OMVs起着重要作用,有助于细菌在抗生素条件下的生存。
此外,携带抗生素水解酶的OMVs不仅能保护细菌本身,还能在不同其他菌种环境中发挥作用,使细菌群落形成对特定抗生素的共同防御。Schaar等[60]提取出卡他莫拉菌的OMVs,通过SDS-PAGE、流式细胞仪及透射电子显微镜分析,确定阿莫西林抗性菌株OMVs中含有β-内酰胺酶;发现该OMVs能保护敏感型卡他莫拉菌在阿莫西林下生长,提高其他种属细菌如不可分型流感嗜血杆菌和肺炎链球菌在阿莫西林下的存活率。3年后,该团队的另一项研究成果进一步说明,在抗生素条件下,OMVs对化脓性链球菌具有保护作用[61]。流感嗜血杆菌OMVs能保护化脓性链球菌,且保护作用强于卡他莫拉菌产生的OMVs,揭示了抗生素治疗扁桃体炎时失败情况增加的原因。Bielaszewska等[62]的研究也揭示了在β-内酰胺类抗生素治疗时,OMVs是一种被低估的导致治疗失败的机制。可见,携带抗生素水解酶的OMVs在一定程度上有助于细菌群落间的相互作用,帮助共同防御抗生素,保护细菌群体在抗生素下继续存活。这些发现能为应对全球抗生素耐药性扩散提供新的解决思路和应对方法。
3.3 OMVs作为抗生素的“诱饵”细菌利用OMVs应对抗生素胁迫的另一方式为以OMVs作为“诱饵”,结合抗生素为敏感细菌提供保护。Kulkarni等[3]使用大肠杆菌的OMVs处理了3种革兰氏阴性细菌:大肠杆菌MG1655、绿脓杆菌NCTC 6751和一种耐辐射不动杆菌MMC5,发现在抗菌肽蜂毒素和黏菌素的处理下,OMVs能保护这些细菌免受以上抗生素的伤害。关于该保护作用的可能机制是,OMVs螯合黏菌素后,OMVs表面某种蛋白酶降解黏菌素使其失去活性。通过蛋白质分析发现,该OMVs中还含有其他蛋白酶和肽酶。OMVs能保护细菌群落免受膜活性抗生素的影响,但似乎不能保护细菌免受其他作用机制的抗生素(如链霉素、环丙沙星等核糖体、DNA螺旋酶作用机制的抗生素)伤害[3]。Manning等[54]的研究也证明OMVs通过螯合抗菌肽,促进细菌防御。此外,黏菌素敏感的大肠杆菌OMVs含有更多未被修饰的脂质A[55],能结合更多黏菌素,导致黏菌素耐药性的出现,该研究指出OMVs作为“诱饵”促进黏菌素耐药性出现的可能机制。
生物被膜中的OMVs也能充当“诱饵”,结合抗生素。在疾病临床治疗中,由于生物被膜结构在一定程度上使得抗生素无法渗透杀死其中的细菌,且生物被膜中的细菌往往处于休眠状态,而大部分抗生素治疗方法是针对代谢活跃的细菌[63],所以一些慢性细菌感染性疾病的治疗面临挑战,如慢性尿道炎[64]。在组成生物被膜的多种基质中,OMVs是易被忽视,但又起着无可替代功能的组分之一。OMVs除了能结合抗生素,还能中和能破坏生物被膜的杀菌物质。Schooling等[65]发现OMVs是铜绿假单胞菌生物被膜中普遍存在的成分,其有助于细菌群落的发展和适应。该研究结果表明,浮游态和生物被膜中OMVs的数量、质量、大小和颜色不同,且生物被膜中产生的OMVs能结合外源庆大霉素。Park等[66]对铜绿假单胞菌培养物上清和生物被膜中的OMVs进行蛋白质组学分析发现,OMVs中含有能够结合抗生素的药物结合蛋白,且生物被膜的OMVs中药物结合蛋白的含量高于上清,该结果暗示了铜绿假单胞菌OMVs与耐药性关联的可能性,且这种OMVs相关的耐药机制已存在于细菌生物被膜中。通过以上的现有研究结果可见,在抗生素胁迫下,细菌OMVs似乎充当了一种动态防御机制,在不同细菌中呈现不一样的防御方式。除了以上方式,OMVs还可能通过包裹外界抗生素的方式,使抗生素远离细菌,限制抗生素接触目标细菌,但目前尚未有相关研究证明这一保护方式[2, 20, 67]。
4 OMVs在其他逆境环境下对细菌的保护方式除了抗生素,其他抗菌物质如氯己定,也被作为防控细菌生长的方式之一。氯己定是一种表面活性剂,具有相当强的广谱抑菌、杀菌作用,对多种细菌有抑制效果,是牙周治疗中常用的一种辅助抗菌药物。牙龈卟啉单胞菌是一种主要的口腔细菌,其生物被膜[68]会产生具有活性的OMVs,OMVs脱离细胞后结合氯己定,从而保护生物被膜。此外,牙龈卟啉单胞菌OMVs还有助于使分散的不同菌种形成聚集体,包括牙密螺旋体、砂真杆菌[69],从而影响牙周菌斑的细菌组成,促进和增强了牙龈下的生物被膜。可见,生物被膜中的OMVs优先结合会破坏生物被膜和细胞的杀菌物质,增大细菌存活的概率,保护生物被膜内的细菌。但Ma等[70]发现,小肠结肠炎耶尔森氏菌OMVs会在一定程度上抑制生物被膜形成的初始阶段,但不影响细菌本身的生长,同时还证明该OMVs能抑制肠炎沙门氏菌和金黄色葡萄球菌生物被膜的形成,该结果与前面所述OMVs对细菌的保护作用相悖,同时说明OMVs对细菌的保护作用可能具有菌种差异性。
霍乱弧菌分泌的OMVs被证明可以抵御烈性噬菌体ICP1、ICP2和ICP3的感染[71],该OMVs可以通过剂量依赖及受体依赖的方式作为诱饵参与噬菌体防御(图 2)。Stephan等[72]分析了沙门氏菌特异性O-抗原噬菌体P22与OMVs的相互作用,发现OMVs可以作为保护细菌免受噬菌体攻击的天然诱饵,在体外有效地触发噬菌体DNA释放,减少噬菌体颗粒的数量。荧光光谱分析表明,噬菌体P22与OMVs相互作用后,将其DNA释放到囊泡腔内(图 2)。由于OMVs可能在基因转移中起作用,因此细菌分泌的OMVs可能转移噬菌体DNA进而也避免了噬菌体基因进入细菌细胞。这些现象说明OMVs是细菌抵抗噬菌体的方式之一,提示利用噬菌体预防或治疗细菌感染时,应将OMVs的产生和作用作为一种可能影响噬菌体治疗结果的因素加以考虑。
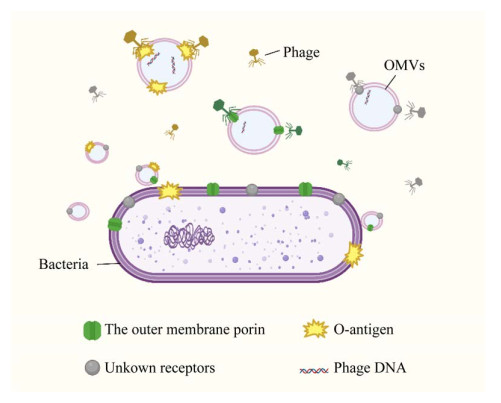
|
| 图 2 噬菌体与OMVs Figure 2 Phages inject DNA into OMVs. There are phage-specific receptors on OMVs, such as porin, O-antigen and some unknown receptors. After binding to specific receptors on the OMVs, the phage releases DNA into the vesicle lumen. |
5 细菌OMVs在治疗方面的应用潜力
抗生素耐药性是目前世界上最紧迫的公共卫生威胁之一,仅在我国,每年就有数万人死于金黄色葡萄球菌等常见细菌的耐药性菌株感染[73]。然而,用于治疗的抗生素难以在患处高浓度聚集[74],需要多次给药才能达到杀菌效果,这就会增加抗生素的全身性扩散,也提高了细菌耐药性出现的可能性。治疗方法的发展离不开对药物输送方法的改善和提升,寻找一种高效且靶向特异性强的抗生素传递方法(给药方式)是目前的研究热点之一。由于OMVs是由细菌分泌的,其成分与结构与细胞外膜高度相似,与细胞膜具有较高的融合效率[21],而且能通过表面的配体将效应分子准确地递送到作用位点[45, 75],所以在递送药物方面,OMVs具有巨大潜力。
Huang等[76]利用OMVs的特征,以及细菌通过细胞膜上的外排泵和OMVs将抗生素排出体外的机制,建立了用OMVs负载抗生素的方法。研发出的口服“抗生素-囊泡”不仅具有很好的生物相容性,还比游离抗生素效率高,能有效杀死肠毒性大肠杆菌。OMVs在降低细菌感染方面也具有很大的潜力。Schulz等[77]提取出非致病性黏细菌Cbv34的OMVs处理大肠杆菌,发现该OMVs能通过膜融合与大肠杆菌相互作用,抑制效果不亚于庆大霉素。结合液相质谱与质谱分析OMVs,得知其中含有一种名为囊泡菌胺的抑菌物质,这是一种革兰氏阳性和阴性细菌的拓扑异构酶抑制剂,可抑制细菌IIa型拓扑异构酶[78-79]。上述研究结果为基于OMVs的新型抑菌化合物或药物递送系统的开发奠定了坚实基础,使OMVs在与抗生素联合治疗方面的应用前景更为广阔。
利用OMVs的特点,现在已经制备出了可作为抗细菌感染的OMVs疫苗。OMVs作为疫苗有两点限制,一是其结构不稳定,二是其尺寸范围大,所以单独利用OMVs合成疫苗是不理想的。在细菌感染时,OMVs呈现出一定的免疫功能,于是研究者通过尺寸可控的牛血清蛋白纳米颗粒强化OMVs的结构[80],获得了结构稳定均匀的牛血清白蛋白-OMVs疫苗。经过该疫苗免疫后,小鼠在碳青霉烯类耐药性的肺炎克雷伯氏菌感染后存活率显著地提高。可见,结构优化后的OMVs在作为抗细菌感染的疫苗方面表现出优异的效果。目前,一种来自脑膜炎球菌的OMVs疫苗[81]在临床试验中被证明是具有免疫原性且安全的,并已得到了临床批准。
OMVs除了用作抗细菌感染的疫苗,还可诱导干扰素γ,在实验小鼠中抑制肿瘤生长[82]。另外,Wang等[83]的研究证明肠道微生物群的OMVs通过调节肠道稳态缓解结肠炎,强调细菌OMVs在肠道生态中的重要性。在免疫治疗方面,工程细菌OMVs被作为微生物纳米复合材料包封溶瘤腺病毒[84],该OMVs已被用于自噬级联增强免疫疗法的开发,在小鼠癌症模型中能够促进抗肿瘤免疫应答反应。可见,细菌OMVs在疾病治疗与干预方面具有巨大的应用潜力。
若想更广泛地实现细菌OMVs从实验室到临床的转化,研究者们仍面临着许多挑战[85],例如需要设计减毒菌株用于OMVs生产;开发成本低、产量高的细菌OMVs提取技术;提高细菌OMVs的药物承载量;有效地使细菌OMVs更准确地富集在疾病部位;全面了解细菌OMVs介导免疫的具体机制等等。
6 总结与展望综上所述,OMVs能够通过多种途径,如增加OMVs产量、结合或灭活抗生素、促进生物被膜形成和防御噬菌体,从而保护细菌,提高细菌的存活率。OMVs还能作为细菌传播耐药性、传递毒力基因、毒素和RNA的工具,是实现种间和界间交流的不可缺少的方式之一。
在过去的几年里,OMVs研究领域已经取得了许多进展,使对OMVs的作用及应用有了更加全面的认识。许多原本不涉及OMVs的领域如肠道、口腔、免疫,也开始将OMVs作为重点研究对象,例如Bittel的团队初步实现了OMVs在细菌-宿主之间转移的可视化[86],利用OMVs的抗原特性研发的多肿瘤抗原呈递平台也已初步建立[87-88],多领域的成就弥补了以往研究的不足。但还是有些问题仍待解决,例如:细菌中何种信号或途径调节OMVs的产生?OMVs具体通过何种机制实现细菌内容物的运输?以OMVs为基础的疫苗或抗生素是否稳定且无害?未来随着OMVs研究的愈发深入,有望利用其破解愈发严重的抗生素耐药性及疾病治疗难题。
| [1] | BEVERIDGE TJ. Structures of Gram-negative cell walls and their derived membrane vesicles[J]. Journal of Bacteriology, 1999, 181(16): 4725-4733 DOI:10.1128/JB.181.16.4725-4733.1999. |
| [2] | KIM SW, BIN PARK S, IM SP, LEE JS, JUNG JW, GONG TW, LAZARTE JMS, KIM J, SEO JS, KIM JH, SONG JW, JUNG HS, KIM GJ, LEE YJ, LIM SK, JUNG TS. Outer membrane vesicles from β-lactam-resistant Escherichia coli enable the survival of β-lactam-susceptible E. coli in the presence of β-lactam antibiotics[J]. Scientific Reports, 2018, 8: 5402 DOI:10.1038/s41598-018-23656-0. |
| [3] | KULKARNI HM, NAGARAJ R, JAGANNADHAM MV. Protective role of E. coli outer membrane vesicles against antibiotics[J]. Microbiological Research, 2015, 181: 1-7 DOI:10.1016/j.micres.2015.07.008. |
| [4] | TURNER KL, CAHILL BK, DILELLO SK, GUTEL D, BRUNSON DN, ALBERTÍ S, ELLIS TN. Porin loss impacts the host inflammatory response to outer membrane vesicles of Klebsiella pneumoniae[J]. Antimicrobial Agents and Chemotherapy, 2015, 60(3): 1360-1369. |
| [5] | WITWER KW, GOBERDHAN DC, O'DRISCOLL L, THÉRY C, WELSH JA, BLENKIRON C, BUZÁS EI, Di VIZIO D, ERDBRÜGGER U, FALCÓN-PÉREZ JM, FU QL, HILL AF, LENASSI M, LÖTVALL J, NIEUWLAND R, OCHIYA T, ROME S, SAHOO S, ZHENG L. Updating MISEV: evolving the minimal requirements for studies of extracellular vesicles[J]. Journal of Extracellular Vesicles, 2021, 10(14): e12182 DOI:10.1002/jev2.12182. |
| [6] | CECIL JD, SIRISAENGTAKSIN N, O'BRIEN-SIMPSON NM, KRACHLER AM. Outer membrane vesicle-host cell interactions[J]. Microbiology Spectrum, 2019, 7(1) DOI:10.1128/microbiolspec.PSIB-10.1128/microbiolspec.0001-2018. |
| [7] | VEITH PD, CHEN YY, GORASIA DG, CHEN DN, GLEW MD, O'BRIEN-SIMPSON NM, CECIL JD, HOLDEN JA, REYNOLDS EC. Porphyromonas gingivalis outer membrane vesicles exclusively contain outer membrane and periplasmic proteins and carry a cargo enriched with virulence factors[J]. Journal of Proteome Research, 2014, 13(5): 2420-2432 DOI:10.1021/pr401227e. |
| [8] | ELLIS TN, KUEHN MJ. Virulence and immunomodulatory roles of bacterial outer membrane vesicles[J]. Microbiology and Molecular Biology Reviews: MMBR, 2010, 74(1): 81-94 DOI:10.1128/MMBR.00031-09. |
| [9] | KULP A, KUEHN MJ. Biological functions and biogenesis of secreted bacterial outer membrane vesicles[J]. Annual Review of Microbiology, 2010, 64: 163-184 DOI:10.1146/annurev.micro.091208.073413. |
| [10] | BEVERIDGE TJ, MAKIN SA, KADURUGAMUWA JL, LI ZS. Interactions between biofilms and the environment[J]. FEMS Microbiology Reviews, 1997, 20(3/4): 291-303. |
| [11] | BILLER SJ, SCHUBOTZ F, ROGGENSACK SE, THOMPSON AW, SUMMONS RE, CHISHOLM SW. Bacterial vesicles in marine ecosystems[J]. Science, 2014, 343(6167): 183-186 DOI:10.1126/science.1243457. |
| [12] | HELLMAN J, LOISELLE PM, ZANZOT EM, ALLAIRE JE, TEHAN MM, BOYLE LA, KURNICK JT, SHAW WARREN H. Release of Gram-negative outer-membrane proteins into human serum and septic rat blood and their interactions with iminunoglobulin in antiserum to Eschevichia coli J5[J]. The Journal of Infectious Diseases, 2000, 181(3): 1034-1043 DOI:10.1086/315302. |
| [13] | HICKEY CA, KUHN KA, DONERMEYER DL, PORTER NT, JIN CS, CAMERON EA, JUNG H, KAIKO GE, WEGORZEWSKA M, MALVIN NP, GLOWACKI RWP, HANSSON GC, ALLEN PM, MARTENS EC, STAPPENBECK TS. Colitogenic Bacteroides thetaiotaomicron antigens access host immune cells in a sulfatase-dependent manner via outer membrane vesicles[J]. Cell Host & Microbe, 2015, 17(5): 672-680. |
| [14] | KULKARNI HM, SWAMY CVB, JAGANNADHAM MV. Molecular characterization and functional analysis of outer membrane vesicles from the Antarctic bacterium Pseudomonas syringae suggest a possible response to environmental conditions[J]. Journal of Proteome Research, 2014, 13(3): 1345-1358 DOI:10.1021/pr4009223. |
| [15] | KIM SW, LEE JS, BIN PARK S, LEE AR, JUNG JW, CHUN JH, LAZARTE JMS, KIM J, SEO JS, KIM JH, SONG JW, HA MW, THOMPSON KD, LEE CR, JUNG M, JUNG TS. The importance of porins and β-lactamase in outer membrane vesicles on the hydrolysis of β-lactam antibiotics[J]. International Journal of Molecular Sciences, 2020, 21(8): 2822 DOI:10.3390/ijms21082822. |
| [16] | KULKARNI HM, JAGANNADHAM MV. Biogenesis and multifaceted roles of outer membrane vesicles from Gram-negative bacteria[J]. Microbiology (Reading, England), 2014, 160(Pt 10): 2109-2121. |
| [17] | ELMI A, WATSON E, SANDU P, GUNDOGDU O, MILLS DC, INGLIS NF, MANSON E, IMRIE L, BAJAJ-ELLIOTT M, WREN BW, SMITH DGE, DORRELL N. Campylobacter jejuni outer membrane vesicles play an important role in bacterial interactions with human intestinal epithelial cells[J]. Infection and Immunity, 2012, 80(12): 4089-4098 DOI:10.1128/IAI.00161-12. |
| [18] |
聂翔, 王涓, 吴清平, 张菊梅, 马国祥, 汪智, 唐胜君, 潘琪琪, 张伟培, 肖铠姗. 一种新的空肠弯曲菌外膜囊泡提取方法的建立[J]. 现代食品科技, 2021, 37(12): 265-271.
NIE X, WANG J, WU QP, ZHANG JM, MA GX, WANG Z, TANG SJ, PAN QQ, ZHANG WP, XIAO KS. A new method for extracting outer membrane vesicles of Campylobacter jejuni[J]. Modern Food Science & Technology, 2021, 37(12): 265-271 (in Chinese). |
| [19] | DELL'ANNUNZIATA F, FOLLIERO V, GIUGLIANO R, de FILIPPIS A, SANTARCANGELO C, IZZO V, DAGLIA M, GALDIERO M, ARCIOLA CR, FRANCI G. Gene transfer potential of outer membrane vesicles of Gram-negative bacteria[J]. International Journal of Molecular Sciences, 2021, 22(11): 5985 DOI:10.3390/ijms22115985. |
| [20] | KIM JY, SUH JW, KANG JS, KIM SB, YOON YK, SOHN JW. Gram-negative bacteria's outer membrane vesicles[J]. Infection & Chemotherapy, 2023, 55(1): 1. |
| [21] | SCHWECHHEIMER C, KUEHN MJ. Outer-membrane vesicles from Gram-negative bacteria: biogenesis and functions[J]. Nature Reviews Microbiology, 2015, 13(10): 605-619 DOI:10.1038/nrmicro3525. |
| [22] | MOON DC, CHOI CH, LEE JH, CHOI CW, KIM HY, PARK JS, KIM SI, LEE JC. Acinetobacter baumannii outer membrane protein a modulates the biogenesis of outer membrane vesicles[J]. The Journal of Microbiology, 2012, 50(1): 155-160 DOI:10.1007/s12275-012-1589-4. |
| [23] | SCHWECHHEIMER C, KULP A, KUEHN MJ. Modulation of bacterial outer membrane vesicle production by envelope structure and content[J]. BMC Microbiology, 2014, 14: 324 DOI:10.1186/s12866-014-0324-1. |
| [24] | CHIU CH, LEE YT, LIN YC, KUO SC, YANG YS, WANG YC, LIU YH, LIN JC, CHANG FY, CHEN TL. Bacterial membrane vesicles from Acinetobacter baumannii induced by ceftazidime are more virulent than those induced by imipenem[J]. Virulence, 2020, 11(1): 145-158 DOI:10.1080/21505594.2020.1726593. |
| [25] | CHOWDHURY C, JAGANNADHAM MV. Virulence factors are released in association with outer membrane vesicles of Pseudomonas syringae pv. tomato T1 during normal growth[J]. Biochimica et Biophysica Acta (BBA)-Proteins and Proteomics, 2013, 1834(1): 231-239 DOI:10.1016/j.bbapap.2012.09.015. |
| [26] | MACDONALD IA, KUEHN MJ. Stress-induced outer membrane vesicle production by Pseudomonas aeruginosa[J]. Journal of Bacteriology, 2013, 195(13): 2971-2981 DOI:10.1128/JB.02267-12. |
| [27] | HAURAT MF, ADUSE-OPOKU J, RANGARAJAN M, DOROBANTU L, GRAY MR, CURTIS MA, FELDMAN MF. Selective sorting of cargo proteins into bacterial membrane vesicles[J]. The Journal of Biological Chemistry, 2011, 286(2): 1269-1276 DOI:10.1074/jbc.M110.185744. |
| [28] | MERINO M, ACOSTA J, POZA M, SANZ F, BECEIRO A, CHAVES F, BOU G. OXA-24 carbapenemase gene flanked by XerC/XerD-like recombination sites in different plasmids from different Acinetobacter species isolated during a nosocomial outbreak[J]. Antimicrobial Agents and Chemotherapy, 2010, 54(6): 2724-2727 DOI:10.1128/AAC.01674-09. |
| [29] | RUMBO C, FERNÁNDEZ-MOREIRA E, MERINO M, POZA M, MENDEZ JA, SOARES NC, MOSQUERA A, CHAVES F, BOU G. Horizontal transfer of the OXA-24 carbapenemase gene via outer membrane vesicles: a new mechanism of dissemination of carbapenem resistance genes in Acinetobacter baumannii[J]. Antimicrobial Agents and Chemotherapy, 2011, 55(7): 3084-3090 DOI:10.1128/AAC.00929-10. |
| [30] | FULSUNDAR S, HARMS K, FLATEN GE, JOHNSEN PJ, CHOPADE BA, NIELSEN KM. Gene transfer potential of outer membrane vesicles of Acinetobacter baylyi and effects of stress on vesiculation[J]. Applied and Environmental Microbiology, 2014, 80(11): 3469-3483 DOI:10.1128/AEM.04248-13. |
| [31] | DELL'ANNUNZIATA F, DELL'AVERSANA C, DOTI N, DONADIO G, dal PIAZ F, IZZO V, de FILIPPIS A, GALDIERO M, ALTUCCI L, BOCCIA G, GALDIERO M, FOLLIERO V, FRANCI G. Outer membrane vesicles derived from Klebsiella pneumoniae are a driving force for horizontal gene transfer[J]. International Journal of Molecular Sciences, 2021, 22(16): 8732 DOI:10.3390/ijms22168732. |
| [32] | BRYANT WA, STENTZ R, Le GALL G, STERNBERG MJE, CARDING SR, WILHELM T. In silico analysis of the small molecule content of outer membrane vesicles produced by Bacteroides thetaiotaomicron indicates an extensive metabolic link between microbe and host[J]. Frontiers in Microbiology, 2017, 8: 2440 DOI:10.3389/fmicb.2017.02440. |
| [33] | YARON S, KOLLING GL, SIMON L, MATTHEWS KR. Vesicle-mediated transfer of virulence genes from Escherichia coli O157: H7 to other enteric bacteria[J]. Applied and Environmental Microbiology, 2000, 66(10): 4414-4420 DOI:10.1128/AEM.66.10.4414-4420.2000. |
| [34] | LINDMARK B, ROMPIKUNTAL PK, VAITKEVICIUS K, SONG TY, MIZUNOE Y, UHLIN BE, GUERRY P, WAI SN. Outer membrane vesicle-mediated release of cytolethal distending toxin (CDT) from Campylobacter jejuni[J]. BMC Microbiology, 2009, 9(1): 1-10 DOI:10.1186/1471-2180-9-1. |
| [35] | RICCI V, CHIOZZI V, NECCHI V, OLDANI A, ROMANO M, SOLCIA E, VENTURA U. Free-soluble and outer membrane vesicle-associated VacA from Helicobacter pylori: two forms of release, a different activity[J]. Biochemical and Biophysical Research Communications, 2005, 337(1): 173-178 DOI:10.1016/j.bbrc.2005.09.035. |
| [36] | ZINGL FG, THAPA HB, SCHARF M, KOHL P, MÜLLER AM, SCHILD S. Outer membrane vesicles of Vibrio cholerae protect and deliver active cholera toxin to host cells via porin-dependent uptake[J]. mBio, 2021, 12(3): e0053421 DOI:10.1128/mBio.00534-21. |
| [37] | DAUROS-SINGORENKO P, BLENKIRON C, PHILLIPS A, SWIFT S. The functional RNA cargo of bacterial membrane vesicles[J]. FEMS Microbiology Letters, 2018, 365(5): fny023. |
| [38] | STORZ G, VOGEL J, WASSARMAN KM. Regulation by small RNAs in bacteria: expanding frontiers[J]. Molecular Cell, 2011, 43(6): 880-891 DOI:10.1016/j.molcel.2011.08.022. |
| [39] | CHOI JW, KWON TY, HONG SH, LEE HJ. Correction to: isolation and characterization of a microRNA-size secretable small RNA in Streptococcus sanguinis[J]. Cell Biochemistry and Biophysics, 2018, 76(3): 441 DOI:10.1007/s12013-018-0841-x. |
| [40] | DÖTSCH A, ECKWEILER D, SCHNIEDERJANS M, ZIMMERMANN A, JENSEN V, SCHARFE M, GEFFERS R, HÄUSSLER S. The Pseudomonas aeruginosa transcriptome in planktonic cultures and static biofilms using RNA sequencing[J]. PLoS One, 2012, 7(2): e31092 DOI:10.1371/journal.pone.0031092. |
| [41] | CHOI JW, UM JH, CHO JH, LEE HJ. Tiny RNAs and their voyage via extracellular vesicles: secretion of bacterial small RNA and eukaryotic microRNA[J]. Experimental Biology and Medicine, 2017, 242(15): 1475-1481 DOI:10.1177/1535370217723166. |
| [42] | YOON YJ, KIM OY, GHO YS. Extracellular vesicles as emerging intercellular communicasomes[J]. BMB Reports, 2014, 47(10): 531-539 DOI:10.5483/BMBRep.2014.47.10.164. |
| [43] | KOEPPEN K, HAMPTON TH, JAREK M, SCHARFE M, GERBER SA, MIELCARZ DW, DEMERS EG, DOLBEN EL, HAMMOND JH, HOGAN DA, STANTON BA. A novel mechanism of host-pathogen interaction through sRNA in bacterial outer membrane vesicles[J]. PLoS Pathogens, 2016, 12(6): e1005672 DOI:10.1371/journal.ppat.1005672. |
| [44] | HAN EC, CHOI SY, LEE Y, PARK JW, HONG SH, LEE HJ. Extracellular RNAs in periodontopathogenic outer membrane vesicles promote TNF-α production in human macrophages and cross the blood-brain barrier in mice[J]. FASEB Journal: Official Publication of the Federation of American Societies for Experimental Biology, 2019, 33(12): 13412-13422 DOI:10.1096/fj.201901575R. |
| [45] | MASHBURN LM, WHITELEY M. Membrane vesicles traffic signals and facilitate group activities in a prokaryote[J]. Nature, 2005, 437(7057): 422-425 DOI:10.1038/nature03925. |
| [46] | ZENG XY, ZOU YM, ZHENG J, QIU SY, LIU LL, WEI CY. Quorum sensing-mediated microbial interactions: mechanisms, applications, challenges and perspectives[J]. Microbiological Research, 2023, 273: 127414 DOI:10.1016/j.micres.2023.127414. |
| [47] | LI J, AZAM F, ZHANG S. Outer membrane vesicles containing signalling molecules and active hydrolytic enzymes released by a coral pathogen Vibrio shilonii AK1[J]. Environmental Microbiology, 2016, 18(11): 3850-3866 DOI:10.1111/1462-2920.13344. |
| [48] | BRAMEYER S, PLENER L, MÜLLER A, KLINGL A, WANNER G, JUNG K. Outer membrane vesicles facilitate trafficking of the hydrophobic signaling molecule CAI-1 between Vibrio harveyi cells[J]. Journal of Bacteriology, 2018, 200(15): e00740-17. |
| [49] | COOKE AC, FLOREZ C, DUNSHEE EB, LIEBER AD, TERRY ML, LIGHT CJ, SCHERTZER JW. Pseudomonas quinolone signal-induced outer membrane vesicles enhance biofilm dispersion in Pseudomonas aeruginosa[J]. mSphere, 2020, 5(6): e01109-e01120. |
| [50] | FLOREZ C, RAAB JE, COOKE AC, SCHERTZER JW. Membrane distribution of the Pseudomonas quinolone signal modulates outer membrane vesicle production in Pseudomonas aeruginosa[J]. mBio, 2017, 8(4): e01034-e01017. |
| [51] | LIN JS, ZHANG WP, CHENG JL, YANG X, ZHU KX, WANG Y, WEI GH, QIAN PY, LUO ZQ, SHEN XH. A Pseudomonas T6SS effector recruits PQS-containing outer membrane vesicles for iron acquisition[J]. Nature Communications, 2017, 8: 14888 DOI:10.1038/ncomms14888. |
| [52] | DEHINWAL R, COOLEY D, RAKOV AV, ALUGUPALLI AS, HARMON J, CUNRATH O, VALLABHAJOSYULA P, BUMANN D, SCHIFFERLI DM. Increased production of outer membrane vesicles by Salmonella interferes with complement-mediated innate immune attack[J]. mBio, 2021, 12(3): e0086921 DOI:10.1128/mBio.00869-21. |
| [53] | CAÑAS MA, FÁBREGA MJ, GIMÉNEZ R, BADIA J, BALDOMÀ L. Outer membrane vesicles from probiotic and commensal Escherichia coli activate NOD1-mediated immune responses in intestinal epithelial cells[J]. Frontiers in Microbiology, 2018, 9: 498 DOI:10.3389/fmicb.2018.00498. |
| [54] | MANNING AJ, KUEHN MJ. Contribution of bacterial outer membrane vesicles to innate bacterial defense[J]. BMC Microbiology, 2011, 11: 258 DOI:10.1186/1471-2180-11-258. |
| [55] | LI X, SUN L, LI CR, YANG XY, WANG XK, HU XX, NIE TY, ZHANG YW, YOU XF. The attenuated protective effect of outer membrane vesicles produced by a mcr-1 positive strain on colistin sensitive Escherichia coli[J]. Frontiers in Cellular and Infection Microbiology, 2021, 11: 701625 DOI:10.3389/fcimb.2021.701625. |
| [56] | BOTTERY MJ, PITCHFORD JW, FRIMAN VP. Ecology and evolution of antimicrobial resistance in bacterial communities[J]. The ISME Journal, 2021, 15(4): 939-948 DOI:10.1038/s41396-020-00832-7. |
| [57] | ZHANG XY, ZHOU Q, TANG MJ, PU JH, ZHANG J, LU JX, ZHANG YZ, GAO YS. Aminoglycoside resistance and possible mechanisms in Campylobacter spp. isolated from chicken and swine in Jiangsu, China[J]. Frontiers in Microbiology, 2021, 12: 716185 DOI:10.3389/fmicb.2021.716185. |
| [58] | MASHBURN-WARREN LM, WHITELEY M. Special delivery: vesicle trafficking in prokaryotes[J]. Molecular Microbiology, 2006, 61(4): 839-846 DOI:10.1111/j.1365-2958.2006.05272.x. |
| [59] | DRAWZ SM, BONOMO RA. Three decades of beta-lactamase inhibitors[J]. Clinical Microbiology Reviews, 2010, 23(1): 160-201 DOI:10.1128/CMR.00037-09. |
| [60] | SCHAAR V, NORDSTRÖM T, MÖRGELIN M, RIESBECK K. Moraxella catarrhalis outer membrane vesicles carry β-lactamase and promote survival of Streptococcus pneumoniae and Haemophilus influenzae by inactivating amoxicillin[J]. Antimicrobial Agents and Chemotherapy, 2011, 55(8): 3845-3853 DOI:10.1128/AAC.01772-10. |
| [61] | SCHAAR V, UDDBÄCK I, NORDSTRÖM T, RIESBECK K. Group A streptococci are protected from amoxicillin-mediated killing by vesicles containing β-lactamase derived from Haemophilus influenzae[J]. Journal of Antimicrobial Chemotherapy, 2014, 69(1): 117-120 DOI:10.1093/jac/dkt307. |
| [62] | BIELASZEWSKA M, DANIEL O, NYČ O, MELLMANN A. In vivo secretion of β-lactamase-carrying outer membrane vesicles as a mechanism of β-lactam therapy failure[J]. Membranes, 2021, 11(11): 806 DOI:10.3390/membranes11110806. |
| [63] | LEWIS K. Multidrug tolerance of biofilms and persister cells[M]// Current Topics in Microbiology and Immunology. Berlin, Heidelberg: Springer Berlin Heidelberg, 2008: 107-131. |
| [64] | WOOD TK, KNABEL SJ, KWAN BW. Bacterial persister cell formation and dormancy[J]. Applied and Environmental Microbiology, 2013, 79(23): 7116-7121 DOI:10.1128/AEM.02636-13. |
| [65] | SCHOOLING SR, BEVERIDGE TJ. Membrane vesicles: an overlooked component of the matrices of biofilms[J]. Journal of Bacteriology, 2006, 188(16): 5945-5957 DOI:10.1128/JB.00257-06. |
| [66] | PARK AJ, SURETTE MD, KHURSIGARA CM. Antimicrobial targets localize to the extracellular vesicle-associated proteome of Pseudomonas aeruginosa grown in a biofilm[J]. Frontiers in Microbiology, 2014, 5: 464. |
| [67] | MacNAIR CR, TAN MW. The role of bacterial membrane vesicles in antibiotic resistance[J]. Annals of the New York Academy of Sciences, 2023, 1519(1): 63-73 DOI:10.1111/nyas.14932. |
| [68] | GRENIER D, BERTRAND J, MAYRAND D. Porphyromonas gingivalis outer membrane vesicles promote bacterial resistance to chlorhexidine[J]. Oral Microbiology and Immunology, 1995, 10(5): 319-320 DOI:10.1111/j.1399-302X.1995.tb00161.x. |
| [69] | GRENIER D. Porphyromonas gingivalis outer membrane vesicles mediate coaggregation and piggybacking of Treponema denticola and Lachnoanaerobaculum saburreum[J]. International Journal of Dentistry, 2013, 2013: 305476. |
| [70] | MA GX, DING Y, WU QP, ZHANG JM, LIU M, WANG Z, WANG ZM, WU S, YANG XJ, LI Y, WEI XH, WANG J. Yersinia enterocolitica-derived outer membrane vesicles inhibit initial stage of biofilm formation[J]. Microorganisms, 2022, 10(12): 2357 DOI:10.3390/microorganisms10122357. |
| [71] | REYES-ROBLES T, DILLARD RS, CAIRNS LS, SILVA-VALENZUELA CA, HOUSMAN M, ALI A, WRIGHT ER, CAMILLI A. Vibrio cholerae outer membrane vesicles inhibit bacteriophage infection[J]. Journal of Bacteriology, 2018, 200(15): e00792-17. |
| [72] | STEPHAN MS, BROEKER NK, SARAGLIADIS A, ROOS N, LINKE D, BARBIRZ S. In vitro analysis of O-antigen-specific bacteriophage P22 inactivation by Salmonella outer membrane vesicles[J]. Frontiers in Microbiology, 2020, 11: 510638 DOI:10.3389/fmicb.2020.510638. |
| [73] |
姬海燕, 白雪, 王红霞, 姜佳琦, 窦学梅, 王毅. 2018–2021年某综合性医院住院患者多重耐药菌医院感染现况调查[J]. 预防医学论坛, 2023, 29(2): 109-113.
JI HY, BAI X, WANG HX, JIANG JQ, DOU XM, WANG Y. Survey on status of nosocomial infection with multidrug-resistant organisms among hospitalized patients in a comprehensive hospital from 2018 to 2021[J]. Preventive Medicine Tribune, 2023, 29(2): 109-113 (in Chinese). |
| [74] | JOUKHADAR C, FROSSARD M, MAYER BX, BRUNNER M, KLEIN N, SIOSTRZONEK P, EICHLER HG, MÜLLER M. Impaired target site penetration of beta-lactams may account for therapeutic failure in patients with septic shock[J]. Critical Care Medicine, 2001, 29(2): 385-391 DOI:10.1097/00003246-200102000-00030. |
| [75] | ZINGL FG, LEITNER DR, THAPA HB, SCHILD S. Outer membrane vesicles as versatile tools for therapeutic approaches[J]. microLife, 2021, 2: uqab006 DOI:10.1093/femsml/uqab006. |
| [76] | HUANG WW, ZHANG QS, LI WR, YUAN MC, ZHOU JX, HUA LQ, CHEN YJ, YE C, MA YB. Development of novel nanoantibiotics using an outer membrane vesicle-based drug efflux mechanism[J]. Journal of Controlled Release: Official Journal of the Controlled Release Society, 2020, 317: 1-22 DOI:10.1016/j.jconrel.2019.11.017. |
| [77] | SCHULZ E, GOES A, GARCIA R, PANTER F, KOCH M, MÜLLER R, FUHRMANN K, FUHRMANN G. Biocompatible bacteria-derived vesicles show inherent antimicrobial activity[J]. Journal of Controlled Release, 2018, 290: 46-55 DOI:10.1016/j.jconrel.2018.09.030. |
| [78] | BAUMANN S, HERRMANN J, RAJU R, STEINMETZ H, MOHR KI, HÜTTEL S, HARMROLFS K, STADLER M, MÜLLER R. Cystobactamids: myxobacterial topoisomerase inhibitors exhibiting potent antibacterial activity[J]. Angewandte Chemie (International Ed in English), 2014, 53(52): 14605-14609 DOI:10.1002/anie.201409964. |
| [79] | HÜTTEL S, TESTOLIN G, HERRMANN J, PLANKE T, GILLE F, MORENO M, STADLER M, BRÖNSTRUP M, KIRSCHNING A, MÜLLER R. Discovery and total synthesis of natural cystobactamid derivatives with superior activity against Gram-negative pathogens[J]. Angewandte Chemie International Edition, 2017, 56(41): 12760-12764 DOI:10.1002/anie.201705913. |
| [80] | WU GX, JI HY, GUO XY, LI YY, REN TB, DONG HQ, LIU JX, LIU YQ, SHI XY, HE B. Nanoparticle reinforced bacterial outer-membrane vesicles effectively prevent fatal infection of carbapenem-resistant Klebsiella pneumoniae[J]. Nanomedicine: Nanotechnology, Biology, and Medicine, 2020, 24: 102148 DOI:10.1016/j.nano.2019.102148. |
| [81] | BAI XL, FINDLOW J, BORROW R. Recombinant protein meningococcal serogroup B vaccine combined with outer membrane vesicles[J]. Expert Opinion on Biological Therapy, 2011, 11(7): 969-985 DOI:10.1517/14712598.2011.585965. |
| [82] | KIM OY, PARK HT, DINH NTH, CHOI SJ, LEE J, KIM JH, LEE SW, GHO YS. Bacterial outer membrane vesicles suppress tumor by interferon-γ-mediated antitumor response[J]. Nature Communications, 2017, 8: 626 DOI:10.1038/s41467-017-00729-8. |
| [83] | WANG XY, LIN SS, WANG L, CAO ZP, ZHANG MM, ZHANG YF, LIU R, LIU JY. Versatility of bacterial outer membrane vesicles in regulating intestinal homeostasis[J]. Science Advances, 2023, 9(11): eade5079 DOI:10.1126/sciadv.ade5079. |
| [84] | BAN WY, SUN MC, HUANG HW, HUANG WX, PAN SW, LIU PF, LI BW, CHENG ZG, HE ZG, LIU FN, SUN J. Engineered bacterial outer membrane vesicles encapsulating oncolytic adenoviruses enhance the efficacy of cancer virotherapy by augmenting tumor cell autophagy[J]. Nature Communications, 2023, 14: 2933 DOI:10.1038/s41467-023-38679-z. |
| [85] | WEN MH, WANG JY, OU ZH, NIE GJ, CHEN Y, LI M, WU ZW, XIONG SD, ZHOU HW, YANG ZF, LONG G, SU JC, LIU H, JING YY, WEN ZK, FU YX, ZHOU TL, XIE H, GUAN WD, SUN X, et al. Bacterial extracellular vesicles: a position paper by the microbial vesicles task force of the Chinese society for extracellular vesicles[J]. Interdisciplinary Medicine, 2023, 1(3): 1-33. |
| [86] | BITTEL M, REICHERT P, SARFATI I, DRESSEL A, LEIKAM S, UDERHARDT S, STOLZER I, PHU TA, NG M, VU NK, TENZER S, DISTLER U, WIRTZ S, ROTHHAMMER V, NEURATH MF, RAFFAI RL, GÜNTHER C, MOMMA S. Visualizing transfer of microbial biomolecules by outer membrane vesicles in microbe-host-communication in vivo[J]. Journal of Extracellular Vesicles, 2021, 10(12): e12159 DOI:10.1002/jev2.12159. |
| [87] | CHENG KM, ZHAO RF, LI Y, QI YQ, WANG YZ, ZHANG YL, QIN H, QIN YT, CHEN L, LI C, LIANG J, LI YJ, XU JQ, HAN XX, ANDERSON GJ, SHI J, REN L, ZHAO X, NIE GJ. Bioengineered bacteria-derived outer membrane vesicles as a versatile antigen display platform for tumor vaccination via plug-and-display technology[J]. Nature Communications, 2021, 12: 2041 DOI:10.1038/s41467-021-22308-8. |
| [88] | LI Q, ZHOU GD, FEI X, TIAN YC, WANG SF, SHI HY. Engineered bacterial outer membrane vesicles with lipidated heterologous antigen as an adjuvant-free vaccine platform for Streptococcus suis[J]. Applied and Environmental Microbiology, 2023, 89(3): e0204722 DOI:10.1128/aem.02047-22. |
 2024, Vol. 64
2024, Vol. 64




