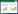中国科学院微生物研究所,中国微生物学会
文章信息
- 吴娴, 毕海洋, 武永淑, 李向臣, 张亚南. 2024
- WU Xian, BI Haiyang, WU Yongshu, LI Xiangchen, ZHANG Yanan.
- 江山乌猪肠道黏膜菌群组成及其功能的性别差异
- Differences of the composition and functions of intestinal mucosal microbiota between male and female Jiangshan Black pigs
- 微生物学报, 64(4): 1249-1262
- Acta Microbiologica Sinica, 64(4): 1249-1262
-
文章历史
- 收稿日期:2023-11-06
- 网络出版日期:2024-01-18
动物肠道内栖息着数量庞大且复杂的微生物菌群,这些菌群可直接或间接参与调控宿主营养代谢、炎症免疫和神经信号传递等各项生理功能,从而维护机体的健康和生长发育[1]。肠道菌群的组成和结构受到多种因素的影响,如日粮成分[2-3]、环境[4]和遗传[5]等。近年来,宿主性别被认为在塑造肠道菌群过程中也扮演了重要角色[6-7]。一项针对人类的研究显示,男性和女性肠道菌群的组成存在显著差异,并且女性肠道菌群的多样性更高[8]。在小鼠模型上的研究也发现了相似的结果[9]。研究表明,猪粪样菌群存在明显的性别偏向性[10]。其中,公猪具有更高丰度的韦荣氏球菌(Veillonellaceae)、罗斯氏菌(Roseburia)和埃希氏菌(Escherichia),母猪具有更高丰度的密螺旋体(Treponema)和拟杆菌(Bacteroides)[10]。另外,性别介导的肠道菌群差异与多种疾病的发生发展有直接的相互作用[11]。在对代谢综合征患者的肠道菌群研究中发现,性别引起的肠道菌群不同导致了男性和女性发病率的差异[12]。
肠道在纵向上可分为小肠和大肠(主要指单胃动物),横向又可分为肠道管腔和肠道黏膜等不同营养生态位点[13]。近年来,大量研究表明定殖在不同营养生态位点的肠道菌群在功能组成上存在显著差异,且广泛参与了宿主消化吸收和抗炎免疫等生理过程[14-15]。体外研究表明,猪小肠黏膜菌群具有合成氨基酸的能力[16]。此外,肠道黏膜菌群能够通过刺激黏液层产生抗菌化合物[17]、与病原体竞争空间和营养物质等改善肠屏障功能[18],并且通过与肠道免疫细胞上的模式识别受体直接作用,从而对宿主免疫系统发挥更关键的作用[19],维护肠道健康。由此可见,肠道黏膜菌群组成和功能与宿主的多种生理功能密切相关。然而,尽管性别是塑造肠道菌群组成的因素之一,目前大多数研究主要关注性别对肠腔菌群组成及功能的影响,而对肠道黏膜菌群的影响还不清楚。
江山乌猪是我国优良的地方畜禽品种资源,拥有丰富的遗传基因并具有优异的种质特性。该品种具有耐粗饲、母性强、育成率高,以及屠宰率高、适应性强和抗病力强等优点。目前对江山乌猪肠道黏膜菌群的组成及其功能的研究报道还相对较少。本研究通过16S rRNA基因高通量测序技术,探究不同性别江山乌猪肠道黏膜菌群组成及功能的差异性,明晰性别差异对江山乌猪肠黏膜菌群的影响,以期加深对我国地方畜禽品种肠道微生物资源的了解和挖掘。
1 材料与方法本试验操作严格遵从实验动物相关伦理准则,并通过浙江农林大学实验动物伦理委员会审核批准(伦理编号为:ZAFUAC2023045)。
1.1 饲养管理本试验选取16头体重相近[(15.0±1.03) kg]且健康的90日龄江山乌猪,按照性别分为雄性组(male组)和雌性组(female组),每组8个重复,每个重复1头猪。本研究选用的江山乌猪均来自同批猪种,单栏饲养。试验期间使用同种商品化日粮进行饲喂,日粮配方组成如下:玉米64.00%,豆粕23.00%,麦麸9.35%,大豆油0.60%,赖氨酸0.18%,苏氨酸0.01%,磷酸氢钙0.69%,石粉0.87%,食盐0.30%,预混料1.00%,该预混料为每公斤日粮提供维生素A 10 800 IU、维生素D3 4 000 IU、维生素E 40 IU、维生素K3 4 mg、维生素B1 6 mg、维生素B2 12 mg、维生素B6 6 mg、维生素B12 0.05 mg、生物素0.2 mg、叶酸2 mg、烟酸50 mg、d-泛酸25 mg、铁100 mg、铜150 mg、锰40 mg、锌100 mg、碘0.5 mg、硒0.3 mg。营养水平计算如下:消化能(MJ/kg) 13.55%,粗蛋白16.80%,中性洗涤纤维11.98%,酸性洗涤纤维4.16%。自由采食和饮水。试验期为16周,饲养至200日龄左右出栏,进行屠宰。
1.2 样品采集所有猪只屠宰前禁食12 h。屠宰后,打开腹腔,分离肠道,分别在回肠和结肠两端结扎,并剪取不同肠段中间位置长约5 cm的组织样品,使用手术剪纵向剖开肠段,去除肠道食糜并用灭菌PBS清洗残留食糜,平铺肠段后,用无菌载玻片轻轻刮取肠道黏膜层,装入灭菌冻存管后,立即放入液氮,保存备用。
1.3 DNA提取及PCR扩增按照E.Z.N.A. Bacterial DNA Kit (D3350) (Omega Bio-Tek公司)说明书提取肠道黏膜微生物组总DNA。以抽提的DNA为模板,针对细菌16S rRNA基因的V3−V4区进行PCR扩增,其中上游引物:341F (5′-CCTAYGGGRBGCA SCAG-3′);下游引物:806R (5′-GGACTACNNGG GTATCTAAT-3′)。PCR扩增体系(20 μL):5×FastPfu Buffer 4 μL,2.5 mmol/L dNTPs 2 μL,上、下游引物(5 μmol/L)各0.8 μL,FastPfu Polymerase 0.4 μL,DNA模板1 μL,ddH2O 11 μL。PCR扩增程序:95 ℃预变性2 min;95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s,共25个循环;72 ℃终延伸5 min。将扩增产物进行2%琼脂糖凝胶电泳检测其片段大小,并使用AxyPrep DNA凝胶回收试剂盒(Axygen Biosciences公司)切胶回收PCR产物。通过QuantiFluorTM-ST蓝色荧光定量系统(Promega公司)对纯化后的PCR产物进行检测,将样品根据检测值按比例进行混合。由上海凌恩生物科技有限公司利用Illumina测序平台进行测序。
1.4 生物信息学分析使用DADA2算法[20],将测序得到的原始序列进行降噪、合并、去嵌合体和去重复等处理。将所得丰度最高的序列通过RDP分类器进行分类,并对照SILVA (SSU132) 16S rRNA基因数据库,使用70%的置信度阈值对每个扩增子序列变体(amplicon sequence variants, ASVs)的特征序列进行物种注释分析[21]。其中,利用Mothur (v1.30)软件计算完成菌群稀释曲线,α多样性指数(Chao1指数和Shannon指数)以及基于Bray-Curtis距离计算得到的主坐标分析(principal coordinate analysis, PCoA)。利用线性判别式(linear discriminant analysis, LDA)分析两组间ASVs水平的差异菌。其中,LDA score > 2表示两组间差异显著。
基于16S rRNA基因高通量测序数据,利用PICRUSt软件对菌群进行功能预测。将预测功能结果通过京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes, KEGG)数据库进行通路分类。
1.5 数据统计分析使用SPSS 20.0软件对数据进行统计分析。微生物多样性(Chao1指数和Shannon指数)利用独立样本t检验分析两组间的差异,数据表示为平均值±标准误。P < 0.05表示差异显著。16S rRNA基因高通量测序获得微生物数据(包括门、属以及ASV水平细菌的相对丰度),利用Mann-Whitney U检验方法统计两组间的差异,数据表示为平均值±标准误,P < 0.05表示差异显著。利用GraphPad Prism 9.0对数据进行作图。
2 结果与分析16S rRNA基因测序数据经过质控后,共计得到827 498条有效序列,平均每个样本有效序列为25 859条。所有样本的稀释曲线随测序深度增加且逐渐趋于平缓稳定(图 1A),表明测序深度足够反映江山乌猪肠道菌群的多样性信息,满足下一步的分析要求。
|
| 图 1 性别对江山乌猪不同肠段黏膜菌群多样性的影响 Figure 1 Effects of sex on the diversity of microbiota in different intestinal segmental mucosa of Jiangshan Black pigs. A:稀释曲线. B:Chao1指数. C:Shannon指数. D−G:不同肠段和不同性别肠黏膜菌群的主坐标分析. *:P < 0.05 A: Rarefaction curve. B: Chao1 index. C: Shannon index. D−G: PCoA analysis of the microbiota in the intestinal mucosa of different intestinal segments and different sexes. *: P < 0.05. |
2.1 性别对江山乌猪肠黏膜微生物多样性的差异影响
α多样性分析发现,在回肠黏膜中,雄性乌猪微生物的Chao1指数和Shannon指数均显著高于雌性乌猪(P < 0.05,图 1B和1C);在结肠黏膜中,两组之间的Chao1指数和Shannon指数均无显著差异(P > 0.05,图 1B和1C)。通过PCoA进一步分析黏膜微生物结构发现,不同肠段黏膜微生物显著分开,明显聚成两簇(P=0.001,图 1D);另外,不同性别乌猪黏膜微生物也显著分开(P=0.001,图 1E);进一步分析不同肠段性别间黏膜微生物的结构发现,在回肠和结肠中,两组之间样本均表现出明显的分开(P=0.002,图 1F;P=0.001,图 1G)。以上结果表明,性别因素对江山乌猪肠黏膜微生物多样性及其结构具有显著影响。
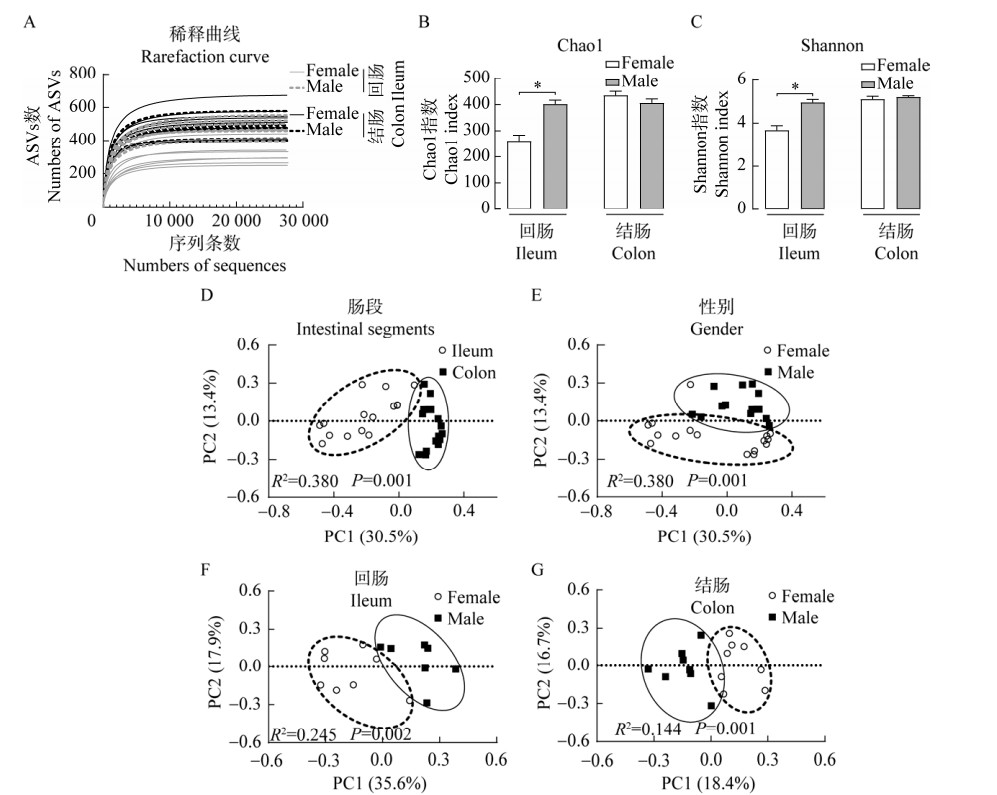
2.2 性别对江山乌猪肠黏膜微生物组成的差异影响进一步分析不同肠段黏膜微生物组成发现,在门水平上,黏膜微生物主要由厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、变形菌门(Proteobacteria)、螺旋体门(Spirochaetes)和弯曲菌门(Campylobacterota)组成(图 2A)。其中,Firmicutes和Proteobacteria是回肠黏膜中的优势菌门(图 2A),Firmicutes和Bacteroidetes是结肠黏膜中的优势菌门(图 2A)。此外,不论是雌性还是雄性组,Firmicutes在各肠段中相对丰度均最高。差异菌门结果显示(图 2B),回肠黏膜中,雌性组Proteobacteria相对丰度显著高于雄性(P < 0.05,图 2B),而雌性组中Bacteroidetes的相对丰度显著低于雄性组(P < 0.05,图 2B);在结肠黏膜中,纤维杆菌门(Fibrobacteres)和Spirochaetes在雌性组的相对丰度显著高于雄性组(P < 0.05,图 2B)。
|
| 图 2 在门水平上不同性别江山乌猪肠黏膜菌群组成及其差异菌 Figure 2 The composition of the intestinal mucosa microbiota of different sexes of Jiangshan Black pigs and the significant changed bacteria at the phylum level. A:回肠和结肠黏膜菌群组成. B:回肠和结肠黏膜差异菌. *:P < 0.05 A: The ileal and colonic mucosa microbial composition. B: The significant changed bacteria in the mucosa of ileum and colon. *: P < 0.05. |
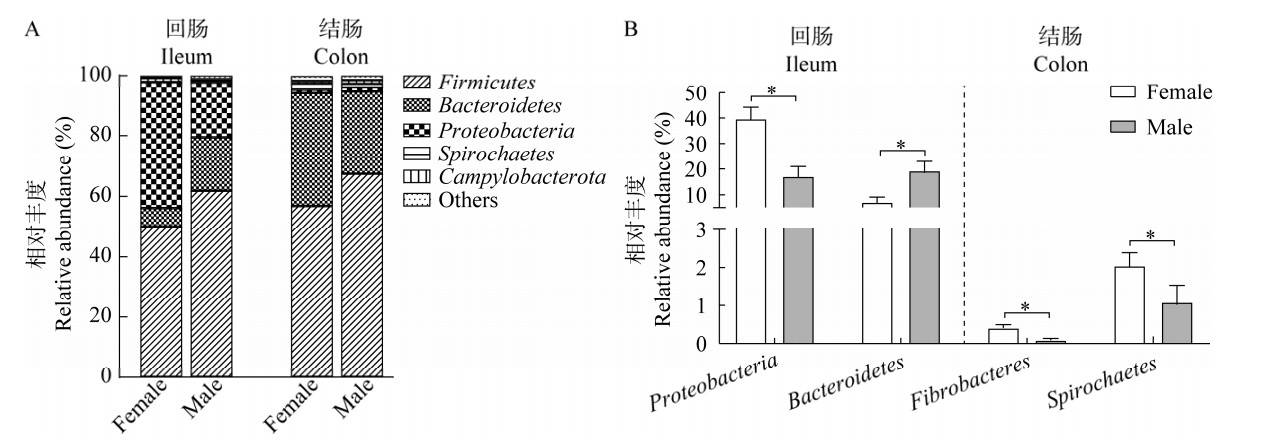
在属水平上,回肠黏膜菌属主要由沙雷氏菌属(Serratia)、乳杆菌属(Lactobacillus)、Oscillospiraceae UCG-005、埃希氏志贺菌属(Escherichia_Shigella)等组成(图 3A),其中,Serratia在雌雄性两组中均占据优势地位;结肠黏膜菌属主要由Lactobacillus和Oscillospiraceae UCG-005等组成(图 3C)。属水平菌群差异分析显示,在回肠黏膜中,Serratia和Escherichia_Shigella在雌性组中的相对丰度显著高于雄性(P < 0.05,图 3B);雄性组中Oscillospiraceae UCG-005、拟普雷沃氏菌属(Alloprevotella)、布劳特氏菌属(Blautia)和Prevotellaceae_NK3B31_group相对丰度显著高于雌性(P < 0.05,图 3B);在结肠黏膜中,雌性组中unclassified_Muribaculaceae、Rikenellaceae_ RC9_gut_group和Prevotellaceae UCG-003相对丰度显著高于雄性组(P < 0.05,图 3D);而Oscillospiraceae UCG-005、Lachnospiraceae_ NK4A136_group和unclassified_Lachnospiraceae在雄性组中相对丰度更高(P < 0.05,图 3D)。
|
| 图 3 在属水平上不同性别江山乌猪肠黏膜菌群组成及其差异菌 Figure 3 The composition of the intestinal mucosa microbiota of different sexes of Jiangshan Black pigs and the significant changed bacteria at the genus level. A:回肠黏膜菌群组成. B:回肠黏膜差异菌. C:结肠黏膜菌群组成. D:结肠黏膜差异菌. *:P < 0.05 A: The ileal mucosa microbial composition. B: The significant changed bacteria in the mucosa of ileum. C: The colonic mucosa microbial composition. D: The significant changed bacteria in the mucosa of colon. *: P < 0.05. |
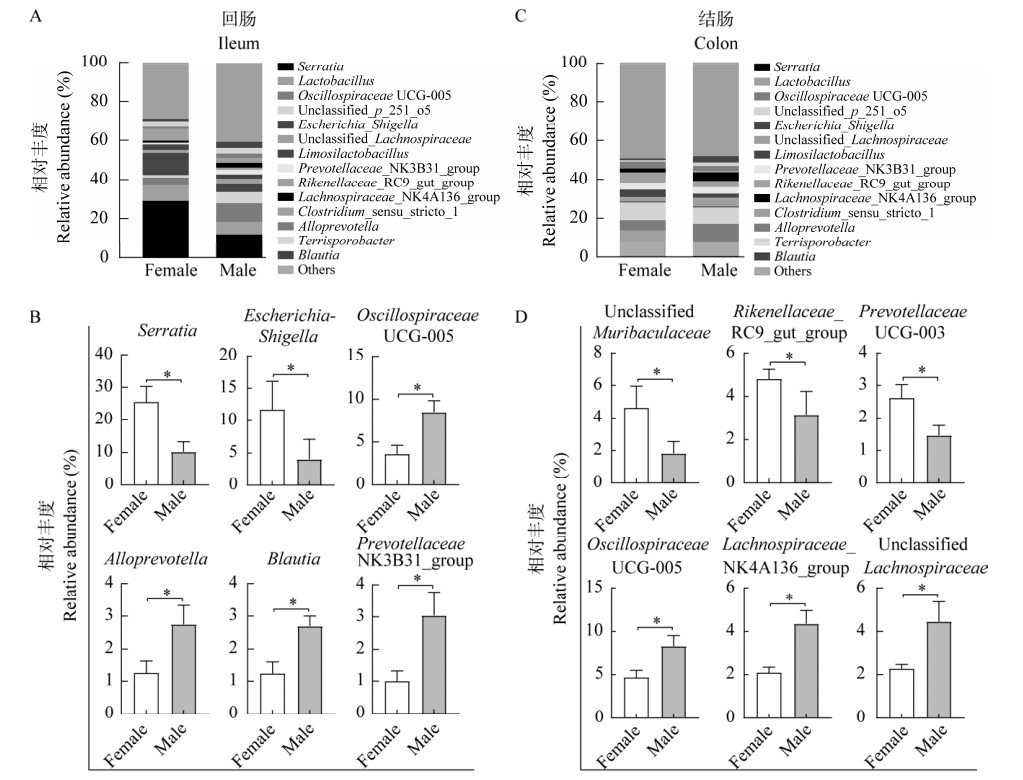
在ASV水平上,对不同性别江山乌猪的不同肠段黏膜菌群进行线性判别分析(linear discriminant analysis, LDA),以LDA score > 2为筛选标准。雌性组和雄性组在回肠和结肠黏膜中的差异ASVs分别有14个和15个(图 4)。在回肠黏膜中,雄性乌猪主要富集了ASV27 (Paraprevotella clara)、ASV28 (Clostridium jeddahitimonense)、ASV25 (Eubacterium coprostanoligenes)、ASV10 (Phascolarctobacterium succinatutens)、ASV15 (Blautia brookingsii)、ASV12 (Parabacteroides distasonis)、ASV14 (Vescimonas coprocola)、ASV22 (Papillibacter cinnamivorans)和ASV5 (Parabacteroides distasonis);雌性乌猪主要富集了ASV17 (Clostridium jeddahitimonense)、ASV11 (Serratia liquefaciens)、ASV7 (Romboutsia timonensis)、ASV3 (Escherichia coli)、ASV1 (Serratia liquefaciens) (图 4A)。在结肠黏膜中,雄性组中ASV66 (Sporobacter termitidis)、ASV50 (Enterocloster lavalensis)、ASV72 (Christensenella timonensis)、ASV25 (Eubacterium coprostanoligenes)、ASV77 (Waltera intestinalis)、ASV14 (Vescimonas coprocola)、ASV6 (Terrisporobacter petrolearius)、ASV15 (Blautia brookingsii)、ASV173 (Acetanaerobacterium elongatum)和ASV170 (Porphyromonas pogonae)相对丰度更高;雌性乌猪中ASV232 (Prevotellamassilia timonensis)、ASV188 (Intestinimonas timonensis)、ASV110 (Prevotellamassilia timonensis)、ASV82 (Parapedobacter soli)和ASV13 (Limosilactobacillus urinaemulieris)的相对丰度更高(图 4B)。

|
| 图 4 在ASV水平上,不同性别江山乌猪肠黏膜微生物的差异菌 Figure 4 The significant changed bacteria in the intestinal mucosa of different sexes of Jiangshan Black pigs at the ASV level. A:LDA分析回肠黏膜中差异显著的ASVs. B:LDA分析结肠黏膜中差异显著的ASVs. A: The significantly changed ASVs based on LDA analysis in the ileal mucosa. B: The significantly changed ASVs based on LDA analysis in the colonic mucosa. |
2.3 性别对江山乌猪肠黏膜微生物功能的差异影响
为了揭示不同性别江山乌猪不同肠段黏膜微生物中菌群功能的差异性,通过PICRUSt对肠道黏膜微生物进行功能预测。如图 5所示,基于KEGG数据库对3级分类水平上微生物功能代谢途径的相对丰度进行偏最小二乘判别式回归分析(partial least squares discriminant analysis, PLS-DA),以肠段作为处理因素,结肠和回肠黏膜样本显著分开(图 5A);另外,以性别作为处理因素时,雄性组和雌性组样本也明显分开(图 5B)。以上结果表明,江山乌猪肠道黏膜微生物功能的差异性受肠道位置以及性别的影响。以性别作为处理因素,分别对回肠和结肠黏膜微生物代谢功能途径进行PLS-DA分析发现,在回肠(图 5C)和结肠(图 5D)中,雄性组和雌性组的样本均明显分开并聚集成两簇,表明性别差异对回肠和结肠黏膜微生物代谢功能具有显著影响。
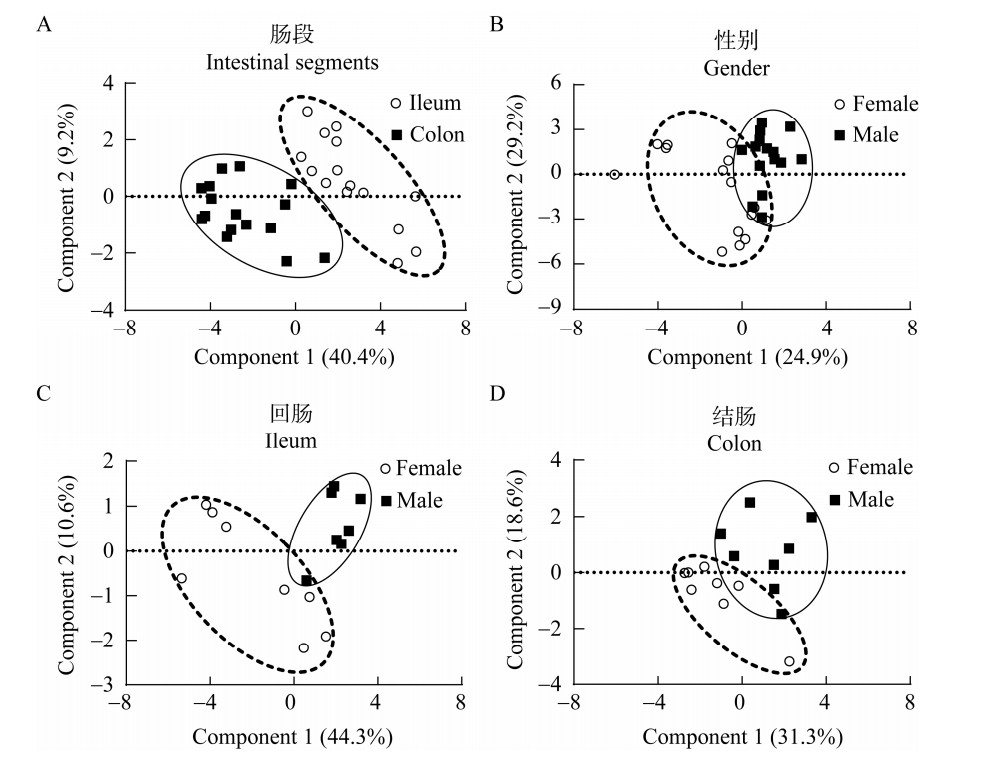
|
| 图 5 偏最小二乘判别式回归分析江山乌猪肠黏膜微生物功能 Figure 5 PLS-DA analysis of intestinal mucosal microbial function of Jiangshan Black pigs. A:不同肠段. B:不同性别. C:回肠. D:结肠. A: The different intestinal segments. B: The different gender. C: Ileum. D: Colon. |
基于KEGG数据库对2级分类水平上的微生物功能代谢途径(相对丰度大于1%)进行分析,主要筛选出20条功能代谢途径。在回肠黏膜菌群中,雄性组中碳水化合物代谢(carbohydrate metabolism)、氨基酸代谢(amino acid metabolism)和能量代谢(energy metabolism)等代谢途径的相对丰度显著高于雌性组(P < 0.05);在结肠黏膜菌群中,膜转运(membrane transport)、脂质代谢(lipid metabolism)和信号转导(signal transduction)等代谢途径在雄性组中相对丰度更高(P < 0.05,图 6A)。
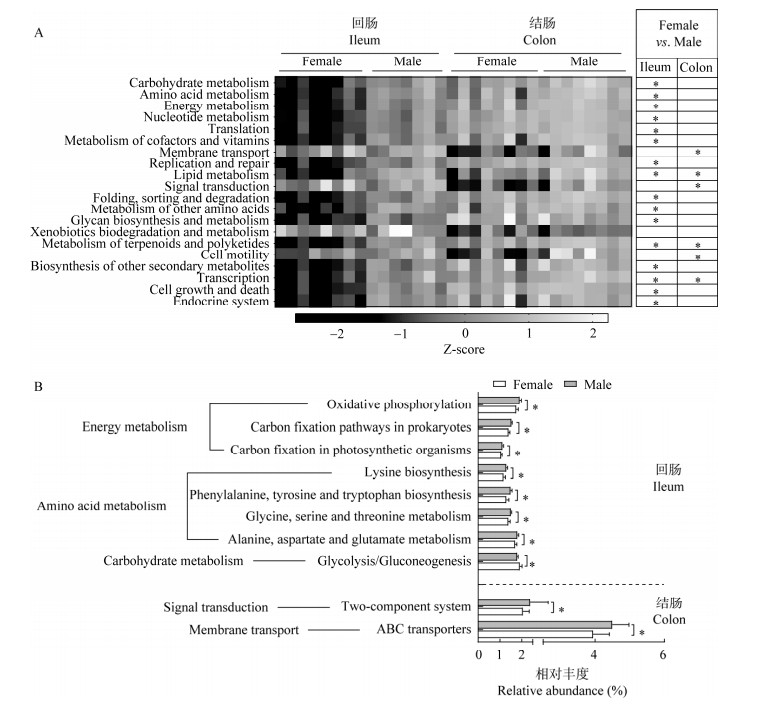
|
| 图 6 不同性别江山乌猪肠黏膜微生物功能预测 Figure 6 Microbial functional prediction of intestinal mucosa of Jiangshan Black pigs in different sexes. A:微生物功能预测代谢通路热图. B:微生物功能代谢差异途径. *:P < 0.05 A: The heatmap of metabolic pathways in microbial functional prediction. B: The significant changed bacterial metabolic pathways. *: P < 0.05. |
进一步在3级分类水平上,对不同肠段黏膜微生物功能代谢途径进行差异分析,结果显示,在回肠黏膜菌群中,主要在碳水化合物代谢(carbohydrate metabolism)、氨基酸代谢(amino acid metabolism)及能量代谢(energy metabolism)方面存在性别间的差异。其中,氨基酸代谢相关的赖氨酸的生物合成(lysine biosynthesis),苯丙氨酸、酪氨酸和色氨酸的生物合成(phenylalanine, tyrosine and tryptophan biosynthesis),甘氨酸、丝氨酸和苏氨酸的代谢(glycine, serine and threonine metabolism),丙氨酸、天门冬氨酸和谷氨酸代谢(alanine, aspartate and glutamate metabolism),以及能量代谢相关的氧化磷酸化(oxidative phosphorylation)、原核生物中的碳固定途径(carbon fixation pathways in prokaryotes)、光合生物中的碳固定(carbon fixation in photosynthetic organisms)等功能途径在雄性组中的相对丰度显著高于雌性组(P < 0.05,图 6B)。而碳水化合物代谢中的糖酵解/糖原异生(glycolysis/gluconeogenesis)途径在雌性组中相对丰度更高(P < 0.05,图 6B)。结肠黏膜菌群中,不同性别黏膜微生物差异功能代谢途径主要集中在膜转运(membrane transport)和信号转导(signal transduction)两方面。其中,膜转运中的ABC转运蛋白(ABC transporters)通路以及信号转导相关的双组分系统(two-component system, TCS)途径在雄性组的相对丰度明显高于雌性组(P < 0.05,图 6B)。
3 讨论与结论肠黏膜菌群作为肠道菌群的重要组成部分,在维持肠道稳态以及宿主机体健康方面发挥重要作用[22]。性别被认为是塑造肠道菌群的因素之一。研究表明,雌雄间肠道微生物群的组成、结构及功能均有显著差异[23]。本研究结果显示,江山乌猪肠黏膜微生物在物种丰度多样性及功能方面均存在性别间的差异,且存在肠段特异性。在微生物功能方面,性别差异对肠道黏膜菌群功能途径,如氨基酸代谢、能量代谢、膜转运等途径存在显著影响。总之,这些结果进一步明晰了性别差异对江山乌猪肠道黏膜菌群的影响。
肠道菌群多样性是评价肠道菌群结构的重要指标之一。本研究结果显示,雄性江山乌猪回肠黏膜菌群多样性更高,且不同性别间肠道黏膜菌群的结构明显不同。这些结果表明性别因素对江山乌猪肠黏膜微生物群落结构产生差异影响。在对华南野猪肠道微生物多样性研究中发现,不同肠段微生物群多样性表现出略微的性别差异[24]。回肠中雌性华南野猪的菌群丰富度和多样性略高于雄性,而结肠中的表现则与回肠相反[24],这与我们的研究结果基本一致。这种差异可能与性激素差异有关。性激素(如孕激素和睾酮)是雌性和雄性哺乳动物之间差异的主要决定因素[7]。研究发现去势导致的雄激素缺乏改变了小鼠肠道菌群结构组成[25],说明性激素可能参与哺乳动物肠道菌群的调节。
在微生物组成方面,不同肠段雌雄性江山乌猪黏膜微生物有显著差异。从整体上看,Firmicutes是江山乌猪肠道黏膜的优势菌门。Petry等[26]在对猪回肠黏膜样本的检测中发现最丰富的菌门分别为Firmicutes (63.97%)、Proteobacteria (10.05%)、Bacteroidetes (7.99%),与本研究结果相似。Firmicutes富含与膜转运相关基因[27],并且与碳水化合物和氨基酸代谢相关[28],这与后续菌群功能预测结果一致。研究发现,Firmicutes丰度升高在抵抗肠道炎症和改善肠屏障等方面具有重要作用[29]。因此,江山乌猪具有耐粗饲、抗病力强等优势可能与肠道中富含Firmicutes相关。我们发现在雄性江山乌猪回肠黏膜中Oscillospiraceae UCG-005、Prevotellaceae_NK3B31_group、Alloprevotella和Blautia的丰度均显著高于雌性猪,这些菌主要属于Firmicutes和Bacteroidetes,参与肠道中多种代谢活动并与短链脂肪酸的产生相关,在改善肠道炎症和维持肠道屏障健康方面发挥作用。一项研究表明,颤螺菌属(Oscillospira)产生丁酸盐和丙酸盐并增加杯状细胞和黏液的产生,从而保持肠上皮的完整性[30]。Blautia主要产生乙酸等,小鼠口服韦氏布劳特氏菌(Blautia wexlerae)改变了机体脂质代谢的能力,发挥抗炎作用并且降低了高脂肪饮食引起的肥胖和糖尿病[31]。在结肠黏膜中,雄性江山乌猪具有更高丰度的Oscillospiraceae UCG-005、Lachnospiraceae_NK4A136_group和unclassified_ Lachnospiraceae。研究表明,毛螺菌科(Lachnospiraceae)可表达多种糖苷水解酶,在降解日粮纤维多糖中发挥重要作用[32]。这一结果可能暗示雄性江山乌猪大肠黏膜菌群在利用植物纤维方面具有一定的优势。另外,与雄性组相比,雌性组中Serratia和Escherichia_Shigella在回肠黏膜中富集,而它们均属于Proteobacteria。大量研究表明Proteobacteria中包含多种致病菌,如大肠杆菌、埃希氏菌、沙门氏菌等,其丰度异常升高会导致肠道稳态失调引发炎症反应[33]。这可能是导致雌性江山乌猪患肠道炎症几率增加的原因。肠道中的Proteobacteria大多数为兼性厌氧菌。研究发现,肠腔中缺乏促进兼性厌氧菌进行有氧呼吸的电子呼吸受体,并且氧气含量的升高会促进兼性厌氧菌有氧呼吸进程,引起Proteobacteria丰度升高[34]。因此,雌性江山乌猪回肠黏膜中Proteobacteria丰度高可能与肠道黏膜上富含电子呼吸受体有关[35]。本研究发现Serratia是江山乌猪回肠黏膜中特有的优势菌属,而在其他地方品种猪中鲜有报道[36]。近期一项研究发现,Serratia具有天然抗疟活性,能够裂解疟原虫[37]。然而,Serratia在江山乌猪肠黏膜中的功能还有待进一步探究。这为挖掘我国地方品种猪肠道微生物资源提供了一定的线索。
在微生物功能方面,回肠黏膜中,两组之间主要在氨基酸代谢、碳水化合物代谢和能量代谢等功能途径存在差异。其中,雄性组显著富集了赖氨酸的生物合成、苯丙氨酸、酪氨酸和色氨酸的生物合成以及甘氨酸、丝氨酸和苏氨酸的代谢等功能途径。赖氨酸作为猪的第一限制性氨基酸,其含量增加有助于猪生长性能的提高[38];苯丙氨酸、酪氨酸和色氨酸等芳香族氨基酸被认为是调节宿主生理活动的重要信号分子,在促进猪生长发育及提高免疫等方面发挥作用[39]。总之,这些结果提示雄性乌猪回肠黏膜菌群具有更强的氨基酸合成和代谢的能力,可能促进了雄性乌猪对日粮蛋白质的消化吸收并改善肠道健康。结肠黏膜中,菌群差异功能途径主要集中在细菌的膜转运和信号转导等方面。进一步的结果显示,雄性组菌群主要富集了ABC转运蛋白和信号转导相关的双组分系统等功能途径。ABC转运蛋白是从原核生物到人类所有现存门中转运系统超家族的成员,参与机体多种生理过程,如营养物质摄取,转运甾醇、脂质、多种代谢物,信号转导以及病毒防御等[40]。双组分系统是存在于细菌中的一种重要信号感受器,能够使细菌快速感知并适应环境刺激[41]。这一结果暗示了相比于雌性乌猪,雄性乌猪结肠黏膜菌群可能在利用结肠营养素方面具有更强的能力;另外,其具有较强的抵抗外界环境扰动的能力,使其结构更加稳定,有利于维持肠黏膜菌群稳态。
综上,性别因素在塑造江山乌猪肠道黏膜菌群组成及其功能方面也发挥了一定的作用。其中,在回肠黏膜中,雄性乌猪具有更高的菌群多样性和高丰度的产酸菌,并富集了碳氮代谢相关代谢功能途径;在结肠黏膜中,雄性乌猪具有更高丰度的纤维降解菌,并富集了膜转运和信号转导等功能途径。这些结果揭示了不同性别江山乌猪肠道黏膜菌群的差异特征,为挖掘我国地方畜禽品种肠道微生物资源提供了一定的参考。
| [1] | ADAK A, KHAN MR. An insight into gut microbiota and its functionalities[J]. Cellular and Molecular Life Sciences, 2019, 76(3): 473-493 DOI:10.1007/s00018-018-2943-4. |
| [2] | WANG JW, QIN CF, HE T, QIU K, SUN WJ, ZHANG X, JIAO N, ZHU WY, YIN JD. Alfalfa-containing diets alter luminal microbiota structure and short chain fatty acid sensing in the caecal mucosa of pigs[J]. Journal of Animal Science and Biotechnology, 2018, 9: 11 DOI:10.1186/s40104-017-0216-y. |
| [3] | BISANZ JE, UPADHYAY V, TURNBAUGH JA, LY K, TURNBAUGH PJ. Meta-analysis reveals reproducible gut microbiome alterations in response to a high-fat diet[J]. Cell Host & Microbe, 2019, 26(2): 265-272.e4. |
| [4] | IANIRO G, TILG H, GASBARRINI A. Antibiotics as deep modulators of gut microbiota: between good and evil[J]. Gut, 2016, 65(11): 1906-1915 DOI:10.1136/gutjnl-2016-312297. |
| [5] | KOVACS A, BEN-JACOB N, TAYEM H, HALPERIN E, IRAQI FA, GOPHNA U. Genotype is a stronger determinant than sex of the mouse gut microbiota[J]. Microbial Ecology, 2011, 61(2): 423-428 DOI:10.1007/s00248-010-9787-2. |
| [6] | VALERI F, ENDRES K. How biological sex of the host shapes its gut microbiota[J]. Frontiers in Neuroendocrinology, 2021, 61: 100912 DOI:10.1016/j.yfrne.2021.100912. |
| [7] | YOON K, KIM N. Roles of sex hormones and gender in the gut microbiota[J]. Journal of Neurogastroenterology and Motility, 2021, 27(3): 314-325 DOI:10.5056/jnm20208. |
| [8] | SINHA T, VICH VILA A, GARMAEVA S, JANKIPERSADSING SA, IMHANN F, COLLIJ V, BONDER MJ, JIANG XF, GURRY T, ALM EJ, D'AMATO M, WEERSMA RK, SCHERJON S, WIJMENGA C, FU JY, KURILSHIKOV A, ZHERNAKOVA A. Analysis of 1135 gut metagenomes identifies sex-specific resistome profiles[J]. Gut Microbes, 2019, 10(3): 358-366 DOI:10.1080/19490976.2018.1528822. |
| [9] | ELDERMAN M, HUGENHOLTZ F, BELZER C, BOEKSCHOTEN M, van BEEK A, de HAAN B, SAVELKOUL H, de VOS P, FAAS M. Sex and strain dependent differences in mucosal immunology and microbiota composition in mice[J]. Biology of Sex Differences, 2018, 9(1): 26 DOI:10.1186/s13293-018-0186-6. |
| [10] | HE MZ, GAO J, WU JY, ZHOU YY, FU H, KE SL, YANG H, CHEN CY, HUANG LS. Host gender and androgen levels regulate gut bacterial taxa in pigs leading to sex-biased serum metabolite profiles[J]. Frontiers in Microbiology, 2019, 10: 1359 DOI:10.3389/fmicb.2019.01359. |
| [11] | MAFFEI S, FORINI F, CANALE P, NICOLINI G, GUIDUCCI L. Gut microbiota and sex hormones: crosstalking players in cardiometabolic and cardiovascular disease[J]. International Journal of Molecular Sciences, 2022, 23(13): 7154 DOI:10.3390/ijms23137154. |
| [12] | SANTOS-MARCOS JA, HARO C, VEGA-ROJAS A, ALCALA-DIAZ JF, MOLINA-ABRIL H, LEON-ACUÑA A, LOPEZ-MORENO J, LANDA BB, TENA-SEMPERE M, PEREZ-MARTINEZ P, LOPEZ-MIRANDA J, PEREZ-JIMENEZ F, CAMARGO A. Sex differences in the gut microbiota as potential determinants of gender predisposition to disease[J]. Molecular Nutrition & Food Research, 2019, 63(7): e1800870. |
| [13] | DONALDSON GP, LEE SM, MAZMANIAN SK. Gut biogeography of the bacterial microbiota[J]. Nature Reviews Microbiology, 2016, 14: 20-32 DOI:10.1038/nrmicro3552. |
| [14] | ADHIKARI B, KIM SW, KWON YM. Characterization of microbiota associated with digesta and mucosa in different regions of gastrointestinal tract of nursery pigs[J]. International Journal of Molecular Sciences, 2019, 20(7): 1630 DOI:10.3390/ijms20071630. |
| [15] | AWAD WA, MANN E, DZIECIOL M, HESS C, SCHMITZ-ESSER S, WAGNER M, HESS M. Age-related differences in the luminal and mucosa-associated gut microbiome of broiler chickens and shifts associated with Campylobacter jejuni infection[J]. Frontiers in Cellular and Infection Microbiology, 2016, 6: 154. |
| [16] |
YANG YX. Influence of gastrointestinal microbiota on amino acids metabolism in swine and rat[D]. Nanjing: Doctoral Dissertation of Nanjing Agricultural University, 2016 (in Chinese). 杨宇翔. 消化道微生物对猪和大鼠氨基酸代谢的影响[D]. 南京: 南京农业大学博士学位论文, 2016. |
| [17] | ARIKE L, SEIMAN A, van der POST S, RODRIGUEZ PIÑEIRO AM, ERMUND A, SCHÜTTE A, BÄCKHED F, JOHANSSON MEV, HANSSON GC. Protein turnover in epithelial cells and mucus along the gastrointestinal tract is coordinated by the spatial location and microbiota[J]. Cell Reports, 2020, 30(4): 1077-1087.e3 DOI:10.1016/j.celrep.2019.12.068. |
| [18] | SCHROEDER BO, BIRCHENOUGH GMH, PRADHAN M, NYSTRÖM EEL, HENRICSSON M, HANSSON GC, BÄCKHED F. Obesity-associated microbiota contributes to mucus layer defects in genetically obese mice[J]. Journal of Biological Chemistry, 2020, 295(46): 15712-15726 DOI:10.1074/jbc.RA120.015771. |
| [19] | PICKARD JM, ZENG MY, CARUSO R, NÚÑEZ G. Gut microbiota: role in pathogen colonization, immune responses, and inflammatory disease[J]. Immunological Reviews, 2017, 279(1): 70-89 DOI:10.1111/imr.12567. |
| [20] | CALLAHAN BJ, McMURDIE PJ, ROSEN MJ, HAN AW, JOHNSON AJA, HOLMES SP. DADA2: high-resolution sample inference from Illumina amplicon data[J]. Nature Methods, 2016, 13: 581-583 DOI:10.1038/nmeth.3869. |
| [21] | AMATO KR, YEOMAN CJ, KENT A, RIGHINI N, CARBONERO F, ESTRADA A, GASKINS HR, STUMPF RM, YILDIRIM S, TORRALBA M, GILLIS M, WILSON BA, NELSON KE, WHITE BA, LEIGH SR. Habitat degradation impacts black howler monkey (Alouatta pigra) gastrointestinal microbiomes[J]. The ISME Journal, 2013, 7(7): 1344-1353 DOI:10.1038/ismej.2013.16. |
| [22] | MERGA Y, CAMPBELL BJ, RHODES JM. Mucosal barrier, bacteria and inflammatory bowel disease: possibilities for therapy[J]. Digestive Diseases, 2014, 32(4): 475-483 DOI:10.1159/000358156. |
| [23] | KOLIADA A, MOSEIKO V, ROMANENKO M, LUSHCHAK O, KRYZHANOVSKA N, GURYANOV V, VAISERMAN A. Sex differences in the phylum‐level human gut microbiota composition[J]. BMC Microbiology, 2021, 21(1): 131 DOI:10.1186/s12866-021-02198-y. |
| [24] |
YANG XW. A preliminary study on feeding habits and intestinal microbial diversity of sus scrofa chirodontus in Guizhou Province, china[D]. Guiyang: Master's Thesis of Guizhou University, 2021 (in Chinese). 杨雄威. 华南野猪(Sus scrofa chirodontus)的食性和肠道微生物多样性初步研究[D]. 贵阳: 贵州大学硕士学位论文, 2021. |
| [25] | HARADA N, HANAOKA R, HANADA K, IZAWA T, INUI H, YAMAJI R. Hypogonadism alters cecal and fecal microbiota in male mice[J]. Gut Microbes, 2016, 7(6): 533-539 DOI:10.1080/19490976.2016.1239680. |
| [26] | PETRY AL, PATIENCE JF, KOESTER LR, HUNTLEY NF, BEDFORD MR, SCHMITZ-ESSER S. Xylanase modulates the microbiota of ileal mucosa and digesta of pigs fed corn-based arabinoxylans likely through both a stimbiotic and prebiotic mechanism[J]. PLoS One, 2021, 16(1): e0246144 DOI:10.1371/journal.pone.0246144. |
| [27] | LI WX, ZHANG YP, MAO W, WANG CS, YIN SX. Functional potential differences between Firmicutes and Proteobacteria in response to manure amendment in a reclaimed soil[J]. Canadian Journal of Microbiology, 2020, 66(12): 689-697 DOI:10.1139/cjm-2020-0143. |
| [28] | TANES C, BITTINGER K, GAO Y, FRIEDMAN ES, NESSEL L, PALADHI UR, CHAU L, PANFEN E, FISCHBACH MA, BRAUN J, XAVIER RJ, CLISH CB, LI HZ, BUSHMAN FD, LEWIS JD, WU GD. Role of dietary fiber in the recovery of the human gut microbiome and its metabolome[J]. Cell Host & Microbe, 2021, 29(3): 394-407.e5. |
| [29] | KAUR A, CHEN TT, GREEN SJ, MUTLU E, MARTIN BR, RUMPAGAPORN P, PATTERSON JA, KESHAVARZIAN A, HAMAKER BR. Physical inaccessibility of a resistant starch shifts mouse gut microbiota to butyrogenic Firmicutes[J]. Molecular Nutrition & Food Research, 2019, 63(7): e1801012. |
| [30] | KONIKOFF T, GOPHNA U. Oscillospira: a central, enigmatic component of the human gut microbiota[J]. Trends in Microbiology, 2016, 24(7): 523-524 DOI:10.1016/j.tim.2016.02.015. |
| [31] | HOSOMI K, SAITO M, PARK J, MURAKAMI H, SHIBATA N, ANDO M, NAGATAKE T, KONISHI K, OHNO H, TANISAWA K, MOHSEN A, CHEN YA, KAWASHIMA H, NATSUME-KITATANI Y, OKA Y, SHIMIZU H, FURUTA M, TOJIMA Y, SAWANE K, SAIKA A, et al. Oral administration of Blautia wexlerae ameliorates obesity and type 2 diabetes via metabolic remodeling of the gut microbiota[J]. Nature Communications, 2022, 13: 4477 DOI:10.1038/s41467-022-32015-7. |
| [32] | BIDDLE A, STEWART L, BLANCHARD J, LESCHINE S. Untangling the genetic basis of fibrolytic specialization by Lachnospiraceae and Ruminococcaceae in diverse gut communities[J]. Diversity, 2013, 5(3): 627-640 DOI:10.3390/d5030627. |
| [33] | LI SS, GUO JD, LIU RM, ZHANG FZ, WEN SA, LIU Y, REN WC, ZHANG XX, SHANG YY, GAO MQ, LU J, PANG Y. Predominance of Escherichia-Shigella in gut microbiome and its potential correlation with elevated level of plasma tumor necrosis factor alpha in patients with tuberculous meningitis[J]. Microbiology Spectrum, 2022, 10(6): e0192622 DOI:10.1128/spectrum.01926-22. |
| [34] |
郭仕辉, 余永涛, 万佳宏, 毛彦妮, 张浩东, 张津慎, 田新岳, 赵清梅. 变形菌门与哺乳动物结肠肠道菌群失调相关研究进展[J]. 中国微生态学杂志, 2022, 34(4): 479-484.
GUO SH, YU YT, WAN JH, MAO YN, ZHANG HD, ZHANG JS, TIAN XY, ZHAO QM. Progress in research on the relationship between Proteobacteria and the imbalance of mammalian colonic intestinal flora[J]. Chinese Journal of Microecology, 2022, 34(4): 479-484 (in Chinese). |
| [35] | ZHANG CG, LIU HF, SUN L, WANG Y, CHEN XD, DU J, SJÖLING Å, YAO JH, WU SR. An overview of host-derived molecules that interact with gut microbiota[J]. iMeta, 2023, 2(2): e88 DOI:10.1002/imt2.88. |
| [36] |
石宝明, 鲍嘉欣, 赵轩. 中国地方猪种肠道微生物功能发掘与利用的研究进展[J]. 动物营养学报, 2022, 34(10): 6281-6290.
SHI BM, BAO JX, ZHAO X. Research progress on exploitation and utilization of intestinal microbial function in Chinese native pigs[J]. Chinese Journal of Animal Nutrition, 2022, 34(10): 6281-6290 (in Chinese). |
| [37] | GAO H, BAI L, JIANG YM, HUANG W, WANG LL, LI SG, ZHU GD, WANG DQ, HUANG ZH, LI XS, CAO J, JIANG LB, JACOBS-LORENA M, ZHAN S, WANG SB. A natural symbiotic bacterium drives mosquito refractoriness to Plasmodium infection via secretion of an antimalarial lipase[J]. Nature Microbiology, 2021, 6: 806-817 DOI:10.1038/s41564-021-00899-8. |
| [38] | APPLE JK, MAXWELL CV, BROWN DC, FRIESEN KG, MUSSER RE, JOHNSON ZB, ARMSTRONG TA. Effects of dietary lysine and energy density on performance and carcass characteristics of finishing pigs fed ractopamine[J]. Journal of Animal Science, 2004, 82(11): 3277-3287 DOI:10.2527/2004.82113277x. |
| [39] | GAO J, XU K, LIU HN, LIU G, BAI MM, PENG C, LI TJ, YIN YL. Impact of the gut microbiota on intestinal immunity mediated by tryptophan metabolism[J]. Frontiers in Cellular and Infection Microbiology, 2018, 8: 13 DOI:10.3389/fcimb.2018.00013. |
| [40] | BEIS K. Structural basis for the mechanism of ABC transporters[J]. Biochemical Society Transactions, 2015, 43(5): 889-893 DOI:10.1042/BST20150047. |
| [41] | PASQUA M, COLUCCIA M, EGUCHI Y, OKAJIMA T, GROSSI M, PROSSEDA G, UTSUMI R, COLONNA B. Roles of two-component signal transduction systems in Shigella virulence[J]. Biomolecules, 2022, 12(9): 1321 DOI:10.3390/biom12091321. |
 2024, Vol. 64
2024, Vol. 64