中国科学院微生物研究所、中国微生物学会主办
文章信息
- 李芳, 毛成琼, 辛俊勃, 施秦, 吴璇
- Li Fang, Mao Chengqiong, Xin Junbo, Shi Qin, Wu Xuan
- 光免疫治疗的抗肿瘤研究进展
- Advances of using photoimmunotherapy for anticancer treatment
- 生物工程学报, 2021, 37(9): 3088-3100
- Chinese Journal of Biotechnology, 2021, 37(9): 3088-3100
- 10.13345/j.cjb.200687
-
文章历史
- Received: October 26, 2020
- Accepted: January 14, 2021
- Published: January 25, 2021
2. 维克森林大学 医学院肿瘤生物学部,美国 温斯顿塞勒姆 27157
2. Department of Cancer Biology, Wake Forest University School of Medicine, Winston Salem 27157, USA
手术治疗、放疗与化疗是当前肿瘤治疗最常用的3种手段,但是它们均会对包括免疫细胞在内的正常细胞造成实质性的伤害[1]。免疫治疗是肿瘤治疗的新手段,通过杀死调节性T细胞(Regulatory T cell,Treg) 或髓源性抑制细胞(Myeloid derived suppressor cell,MDSC) 等免疫抑制细胞、使用T细胞活化细胞因子(如白介素2 (Interleukin-2,IL-2) 或IL-15) 或免疫检查点阻断剂(Immune-checkpoint blockade,ICB) (如抗细胞毒性T淋巴细胞相关蛋白4 (Cytotoxic T-lymphocyte-associated protein 4,CTLA-4) 或抗程序性死亡受体-1 (Programmed cell death-1,PD-1)/程序性死亡受体-配体1 (Programmed cell death ligand-1,PD-L1) 抗体) 等选择性地控制肿瘤生长[1]。临床数据显示,该疗法仅对部分患者有效,且存在严重的副作用,如非特异性地激活免疫系统会造成正常组织的自身免疫损伤。因此,寻求既能够靶向杀死肿瘤细胞,也能够激活组织特异性免疫反应的新策略是临床肿瘤研究的热点。
光免疫治疗(Photoimmunotherapy,PIT) 通过静脉注射靶向肿瘤表面抗原的单克隆抗体(Monoclonal antibody,mAb) 与光吸收剂IRDye 700DX (IR700) 的结合物(Antibody-photoabsorber conjugate,APC),继而在肿瘤部位进行局部近红外(Near infrared,NIR) 光照射而选择性地诱导肿瘤细胞的快速死亡,从而实现高度靶向的肿瘤治疗与最小的正常组织损伤。IR700为水溶性光学染料,从APC分离的游离IR700可直接从尿液排泄,生物安全性好。第一个PIT的人体研究将靶向表皮生长因子受体(Epidermal growth factor receptor,EGFR) 的cetuximab-IR700用于治疗不可手术的头颈癌,该制剂于2018年被美国食品药品监督管理局(U.S. Food and Drug Administration,FDA) 批准进入全球Ⅲ期临床研究快速通道。
与其他传统疗法不同,PIT不仅不会削弱宿主抗肿瘤免疫反应,反而能激活特异性抗肿瘤免疫应答。它引起肿瘤细胞的免疫原性死亡(Immunogenic cell death,ICD),继而迅速释放肿瘤特异性抗原与膜损伤危险信号,从而吸引树突状细胞(Dendritic cell,DC) 迁徙至肿瘤部位并诱导其提呈肿瘤特异性抗原,激活肿瘤特异的T细胞致其增殖并介导肿瘤细胞死亡。因此,PIT可以克服传统抗体疗法存在的不均匀或不充分递送等问题[1]。另外,PIT不受治疗频次的限制,重复多次PIT也是解决抗体疗法不足的有效策略[1]。鉴于PIT在肿瘤临床治疗上的独特优势与巨大潜力,本文将从其免疫激活机制、超级高渗透长滞留(Superenhanced permeability and retention,SUPR) 效应、新进展与联合治疗等方面进行综述,为其临床研究与应用提供依据。
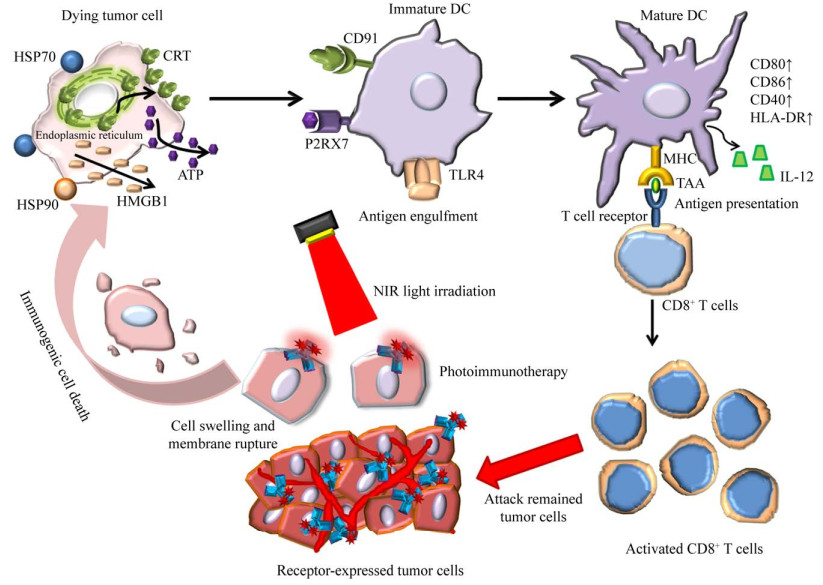
1 免疫激活机制ICD是一种能够激活针对死细胞相关抗原的适应性免疫应答的细胞死亡形式,而PIT是一种诱导并利用ICD激活抗肿瘤免疫反应的疗法[2]。PIT引起靶肿瘤细胞迅速溶胀并出现细胞膜破裂便是ICD的特征,其诱导的抗肿瘤宿主免疫反应机制如图 1所示[1-2]。ICD依赖于特定损伤相关分子模式(Damage-associated molecular patterns,DAMPs) 的细胞表面表达和/或释放。这些DAMPs包括钙网蛋白(Calreticulin,CRT)、热休克蛋白(Heat shock protein,HSP) 70和HSP90、三磷酸腺苷(Adenosine triphosphate,ATP) 和高迁移率族蛋白1 (High mobility group box 1,HMGB1)[3-4]。暴露于垂死细胞表面的CRT、HSP70与HSP90协同ATP与HMGB1[3-4]的细胞外释放向宿主免疫系统提供免疫原性信号,这些信号在建立抗肿瘤免疫力和免疫记忆中发挥着重要作用[5-6]。
|
| 图 1 PIT诱导的免疫原性死亡增强宿主抗肿瘤免疫反应的生物学机制[1] Fig. 1 Biological mechanism of PIT induced immunogenic cell death (ICD) that results in enhancement of antitumor host immunity. ICD caused by PIT results in immediate activation of damage-associated molecular patterns (DAMPs) including heat shock proteins (HSP) 70 and 90, calreticulin (CRT), adenosine triphosphate (ATP) and high mobility group box 1 (HMGB1), which lead to rapid maturation of immature dendritic cells (DCs). After DCs present tumor associated antigens (TAAs) to CD8+ T cells, newly primed CD8+ T cells proliferate and react to more cancer antigens. As a consequence, the anticancer host immunity is profoundly strengthened[1]. |
| |
ICD过程中最重要的一个标志就是CRT从内质网转位到细胞膜外侧,细胞膜表面的CRT与固有免疫细胞表面的CD91受体结合,可增强免疫系统对其的免疫响应。光疗能够促进HSP在肿瘤细胞表面的表达[7-8],如HSP70就是免疫系统的内源性危险信号,先天性或适应性免疫细胞可通过识别肿瘤细胞表面表达的HSP70而将其破坏。细胞外HSP70可以促进抗原提呈细胞的成熟,并形成HSP-肽复合物从而促进DC中HSP偶联肽抗原的交叉提呈,进一步触发抗原特异性的辅助T细胞与细胞毒T细胞的活化与分化[8-9]。HMGB1是晚期ICD的标志物,从胞内释放的HMGB1能够被表达模式识别受体如Toll样受体4 (Toll like receptor 4,TLR4) 等的免疫细胞识别,从而启动免疫反应。细胞外ATP是真核生物用来检测细胞损伤的危险信号[10],ICD过程中释放的ATP与靶细胞上嘌呤能受体P2RX7[11]结合通过炎症小体激活而产生免疫刺激作用。Ogawa等[2]测定了A431细胞表面ICD生物学标志物的表达,流式数据显示,PIT后垂死细胞表面CRT、HSP70与HSP90的表达增加。与此同时,细胞外HMGB1和ATP的浓度测定结果证实了PIT可引起HMGB1和ATP从肿瘤细胞的快速释放。
PIT引发ICD导致垂死肿瘤细胞迅速释放肿瘤特异性抗原(如DAMPs),这些抗原能够被抗原提呈细胞特别是DC捕获,从而促进了肿瘤细胞微环境中未成熟DC的成熟。而DC的成熟状态决定了其吞噬、处理、提呈来自垂死细胞的抗原已成功诱导抗肿瘤免疫的能力[12]。Ogawa等[2]将未成熟DC与PIT杀死的肿瘤细胞共孵育,发现DC成熟标志物CD80、CD86和人类白细胞抗原(Human leukocyte antigen-DR,HLA-DR) 在DC表面的表达较未成熟DC显著提高,表明PIT杀死的肿瘤细胞能够引起DC的成熟。不仅如此,与未成熟DC相比,同PIT杀死的肿瘤细胞共孵育的DC的共刺激受体CD40的表达与IL-12的分泌也显著增加,其中IL-12是DC成熟和诱导Th1反应的指标[13]。随后,成熟DC将肿瘤相关抗原(Tumor-associated antigen,TAA) 提呈给CD8+ T细胞,CD8+ T细胞通过识别TAA继而攻击残存的肿瘤细胞(图 1)。实施肿瘤细胞靶向的PIT后,与PIT之前的CD8+ T细胞相比,新引发的CD8+ T细胞能与更多的肿瘤抗原反应,并在肿瘤床增殖[14]。得益于CD8+ T细胞的激活和增殖,抗肿瘤免疫反应在PIT后得到了极大的增强。
与常规肿瘤免疫治疗主要通过激活肿瘤床和身体其他部位已存在的CD8+ T细胞不同,PIT是通过局部增强宿主免疫反应,故而,不会产生类似于自身免疫性疾病的副作用[1]。此外,使用靶向Treg或MDSC的APC还能够选择性地清除肿瘤床中的免疫抑制细胞,从而进一步增强宿主的免疫反应。Santo等[15]研究发现,靶向CD25的PIT能够特异性地清除Treg细胞,从而导致肿瘤浸润CD8+ T细胞和自然杀伤(Natural killer,NK) 细胞的快速活化。
2 SUPR效应由于肿瘤新生血管的形态与功能异常,即内皮细胞排列不紧密、缺乏平滑肌层、血管紧张素Ⅱ受体功能受损等,且肿瘤内部淋巴引流不足,大分子药物、纳米颗粒等一旦进入便会被滞留在肿瘤部位,该现象被称为高渗透长滞留(Enhanced permeability and retention,EPR) 效应。借助EPR效应,脂质体、纳米粒等靶向纳米载体有望将更多的药物传递至肿瘤。但是,文献数据显示纳米制剂经系统给药后仅有约0.7%的药物到达实体瘤[16]。传统的EPR效应虽然能够增加纳米药物向肿瘤的递送,但与达到肿瘤治疗效果还相差甚远。
静脉注射APC后,抗体结合物能够最大程度地与血管周围空间中的肿瘤细胞结合,暴露于NIR光下即可对这些细胞产生毒性作用,导致血管周围细胞突然坏死和血管完整性丧失。血管因组织间质液压降低而扩张,这使得其通透性急剧增加,从而导致纳米颗粒迅速向血管周围间隙渗透,最终沉积于整个肿瘤床,该现象就是SUPR效应[17] (图 2)。通过荧光标记纳米颗粒成像的方法可以观察到该现象。Hanaoka等[18]用IRDye800CW (IR800) 标记白蛋白结合型紫杉醇(Nanoparticle albumin-bound paclitaxel,nab-paclitaxel,Abraxane),PIT后给予IR800-nab-paclitaxel能够观察到其在荷瘤鼠经PIT治疗的肿瘤内迅速蓄积,且该蓄积作用使得肿瘤在静脉注射后的60 min内清晰可见。Mao等[19]的研究中也观察到类似现象,以双侧荷KB-8-511/3T3混合瘤裸鼠为模型,给予靶向P-糖蛋白(P-glycoprotein,Pgp) 的抗Pgp单克隆抗体-IR700结合物后光照右侧肿瘤,继而注射盐酸阿霉素脂质体注射液(Doxorubicin HCl liposome injection,Doxil)。注射Doxil后24 h的荧光成像照片显示,与未光照肿瘤相比,Doxil在光照侧肿瘤的摄取明显增多,该结果与离体组织荧光成像以及肿瘤细胞流式分析的数据一致。

|
| 图 2 PIT介导的SUPR效应的机制 Fig. 2 Mechanism of PIT-mediated superenhanced permeability and retention (SUPR) effect. PIT induces an immediate necrosis of the perivascular cancer cells and loss of vessel integrity. After that the vessel dilates due to the reduced tissue interstitial pressure. Thus, the PIT-induced SUPR effect results in markedly enhanced permeability and leakage from vessels. |
| |
为了确定PIT后何时注射纳米药物具有最佳的SUPR效应,Sano等[17]以双侧荷A431瘤裸鼠为模型,静脉注射panitumumab-IR700 (Pan-IR700) 1 d后仅对右侧肿瘤进行光照处理。光照后分别于1 h、6 h与24 h注射Pan-IR800,并观察其在肿瘤的分布。结果显示,PIT后1 h注射的Pan-IR800在光照侧肿瘤的分布最多,以光剂量50 J/cm2照射肿瘤,背景校正后Pan-IR800在光照侧肿瘤的摄取比对照肿瘤高21.5倍。而PIT后24 h再注射Pan-IR800未见渗透性的增加,这可能是因为血管周围肿瘤组织修复而恢复了肿瘤间质液压所致。因此,使肿瘤内达到最大Pan-IR800浓度的最佳给药时间是PIT后立即给药,而且在PIT后的6 h内均可观察到摄取的增加,但之后至24 h渗漏性逐渐下降。
EPR效应只能适度增加纳米制剂的肿瘤传递,而PIT介导的SUPR效应能够引起纳米材料在治疗肿瘤的分布比对照肿瘤高达24倍的增加[17]。另外,PIT引起的SUPR效应对纳米材料的性质无特殊要求。它不仅能促进非靶向纳米粒如PEG化的Qdot800 (粒径约50 nm)、超顺磁氧化铁纳米粒(粒径约200 nm)、超小顺磁氧化铁造影剂(平均粒径20 nm)、钆标记的聚乙二胺树状聚合物(平均粒径10 nm) 等在肿瘤的传递[17],还能促进其他抗体或者APC向肿瘤床的递送[20-22]。荷瘤小鼠模型显示,单次给予APC后多次光照能够显著抑制肿瘤生长[18],这是由于初次的光照引发了SUPR效应,致使存在于血液中的APC能够进入PIT前难以到达的更大的肿瘤区域以及深层肿瘤组织,且分布也更加均匀[22-23]。
3 新进展 3.1 使用抗体替代物 3.1.1 抗原结合片段(Antigen binding fragment,Fab) 类抗体与完整抗体相比,Fab片段的分子量更低、尺寸更小,没有可结晶片段(Crystallizable fragment,Fc) 介导的细胞毒性,具有更强的肿瘤穿透力与更均匀的肿瘤分布。靶向CD25的PIT可诱导肿瘤相关Treg的空间选择性清除,Okada等[24]比较了抗体片段anti-CD25-F(ab′)2与完整抗体anti-CD25-IgG用于PIT的疗效。当偶联等量的IR700分子时,虽然两者在体外杀灭靶细胞的效果相当,但是在单侧荷瘤模型中F(ab′)2-PIT组的生存期更长,这是由于完整抗体的半衰期过长,体内剩余的anti-CD25-IgG-IR700阻断了IL-2与激活的效应细胞上IL-2受体的结合,而IL-2信号能够促进新激活的T细胞和效应细胞的增殖与存活。在双侧荷瘤模型中,仅一侧肿瘤给予光照,F(ab′)2-PIT组两侧肿瘤的抑制效果均显著优于IgG-PIT组,未光照肿瘤的生长受抑制是新激活的T细胞转移过来并对其进行攻击所致[24]。Mao等[25]评价了靶向Pgp的anti-Pgp Fab-IR700 (Fab-IR700) 对化学抗性肿瘤的作用,同样观察到重组抗体片段制成的结合物Fab-IR700优于全抗体结合物anti-Pgp monoclonal antibody-IR700 (Pab-IR700),表现在组织穿透性能更佳、肿瘤内浓度达到峰值的时间更短、快速的肿瘤吸收和全身清除使结合物注射后可以在更短的时间间隔内进行光照,有利于临床转化。Bao等[26]的研究也有相似的发现,抗CD276的抗体片段与IR700的结合物(IRD-αCD276/Fab) 能够靶向表达CD276的肿瘤。
3.1.2 单链抗体单链抗体(Single chain antibody fragment,scFv) 由抗体重链可变区和轻链可变区通过15–20个氨基酸的短肽连接而成,具有分子量小、穿透力强、抗原性弱等特点,且较好地保留了对抗原的亲和活性。Wei等[27]将靶向糖蛋白A33抗原(Glycoprotein A33 antigen,GPA33) 的单链抗体(A33scFv) 与IR700结合用于大肠癌的治疗。在荷LS174T瘤小鼠中,A33scFv-IR700选择性地富集在GPA33阳性的肿瘤中,且与非PIT组相比,单次注射A33scFv-IR700并光照即可产生优良的治疗效果。
3.1.3 亲和体(Affibody)亲和体的功能和抗体类似,但具有分子量小、亲和力高、半衰期短、组织渗透性好、体内清除快、理化性能稳定等特点。人类表皮生长因子受体2 (Human epidermal growth factor receptor 2,HER2) affibody-IR700介导的PIT在体外能够选择性地破坏HER2过表达的乳腺癌细胞,而不会破坏HER2低表达的细胞[28]。过表达HER2的乳腺癌患者的脑转移率为36.2%,由于亲和体分子极小,affibody-IR700有可能透过血脑屏障从而使得PIT有潜力用于脑癌或脑转移的治疗。EGFR特异性亲和体ZEGFR: 03115被用于胶质母细胞瘤(Glioblastoma,GBM) 的治疗[29]。ZEGFR: 03115-IR700在体外诱导了U87-MGvⅢ细胞的死亡与肿瘤球的解体,在体内能够有效地靶向至脑中EGFR阳性的GBM细胞,且能够抑制皮下荷U87-MGvⅢ瘤小鼠的肿瘤生长[29]。不仅如此,抗EGFR affibody-IR700还被用于早期淋巴结转移的治疗[30]。由于亲和体与IR700均已用于临床,所以该体系很有可能实现临床转化。
3.1.4 单域抗体美洲驼单结构域抗体(Single-domain antibody,VHH),又称为纳米抗体或单域抗体。与常规抗体及基因工程抗体相比,它具有分子量小、易表达、可溶性好、稳定性强、免疫原性弱、穿透性好等优点。单域抗体-IR700结合物(VHH[PS]) 诱导了表达EGFR的肿瘤细胞与通过外科手术从高度浆液性卵巢癌的患者腹水中获得的表达EGFR的细胞的死亡。虽然1个VHH仅连接1个IR700分子,但是,VHH[PS]具有很高的选择性和特异性,在非常低的浓度就能通过坏死诱导有效的细胞杀伤[31]。
3.2 使用其他光吸收剂IR700因其优良的性质成为PIT最常用的光吸收剂。近年来,一些其他的光吸收剂也引起了研究者的注意。吲哚氰绿(Indocyanine green,ICG)是心血管系统疾病临床诊断中常用的一种造影剂。抗组织因子(Tissue factor,TF) 抗体1849-ICG能够特异性地与TF高表达的BxPC-3细胞结合,经NIR光照后能够诱导肿瘤细胞的快速死亡,并显著抑制体内肿瘤的生长[32]。Darwish等[33]还将PEG化酞菁星型聚合物与骨髓瘤选择性抗体相连用于PIT,也显示了良好的光毒性。
3.3 作用于新靶点除了以肿瘤细胞表面的抗原为靶点外,PIT还可以作用于其他靶点以达到肿瘤治疗的目的。Nishimura等[34]将抗血管内皮生长因子受体2 (Vascular endothelial growth factor receptor 2,VEGFR-2) 的抗体DC101与IR700结合制备了DC101-IR700,该APC靶向肿瘤血管,在NCI-N87异种移植肿瘤中发挥了比trastuzumab-IR700 (Tra-IR700) 更强的抗肿瘤作用,并伴有肿瘤微血管密度降低和肿瘤新脉管系统破坏。由于作用机制不同于常规的PIT,DC101-IR700介导的PIT后未观察到SUPR效应,但抗VEGFR-2抗体可以与所有血管内皮结合,通过控制NIR光照部位可限制正常组织毒性,因此,针对肿瘤新脉管系统的PIT可以应用于包括胃癌在内的大多数实体瘤,有望实现临床转化。成纤维细胞活化蛋白(Fibroblast activation protein,FAP) 在活化成纤维细胞CAFTECM表面过度表达,Watanabe等[35]还将PIT用于靶向肿瘤微环境的癌症相关成纤维细胞(Cancer-associated fibroblast,CAF)。与CAF共培养可加快TE细胞在体内的生长速度,但FAP-IR700介导的PIT显著抑制了共培养模型中TE细胞的生长,使其达到了仅相当于癌细胞生长速度的水平。
3.4 新策略常规的PIT仅针对一个TAA,固定的抗原特异性严重限制了其功效和适用性。实体瘤通常由可能来自肿瘤干细胞的异种细胞群组成,且TAA的表达方式和肿瘤微环境的组成通常会随着肿瘤的恶性进展以及放化疗过程而动态变化。为了将PIT有效地应用于多种癌症类型和适应TAA表达的变化,就需要合成大量针对各种TAA的抗体,但是,这显然不现实。Shirasu等[36]利用IR700偶联的亲和素(IRDye700DX-conjugated NeutrAvidin,AvIR) 与各种生物素化抗体(Biotinylated antibody,BioAb) 构建了一种靶向肿瘤的通用策略(图 3)。先用一种或多种BioAb标记靶细胞,继而加入AvIR,利用亲和素与生物素的高亲和性和特异性将IR700连接到细胞表面,再用NIR光照射而杀死靶细胞。虽然IR700并非直接与抗体相连,但是这不影响PIT的功效。AvIR介导的PIT的光毒性具有高度抗原特异性,选用不同的BioAb可分别实现杀死肿瘤细胞、肿瘤干细胞、CAF、肿瘤血管内皮细胞等。该策略不仅可以同时靶向多种肿瘤细胞,而且可以靶向多种肿瘤支持和/或免疫抑制细胞,并能够对肿瘤及其微环境进行整合和有效的控制,从而克服了肿瘤的异质性。

|
| 图 3 AvIR介导的PIT的示意图[36] Fig. 3 Schematic diagram of AvIR-mediated PIT. Target cells including tumor cells and/or tumor-supporting cells are pre-marked with single or multiple BioAbs which are specific to cell surface antigen(s). Due to the extremely high affinity and specificity between avidin and biotin, AvIR exclusively binds to the BioAbs. Subsequently, application of NIR light irradiation causes phototoxicity to the target cells[36]. |
| |
虽然PIT能够诱导靶肿瘤细胞的ICD,并激发宿主免疫反应,但由于适应性免疫抵抗使其在同基因肿瘤小鼠模型中大都未能引起持久的抗肿瘤反应[14]。另外,肿瘤内异质性、PIT的条件不完备(如肿瘤表面受体表达低、APC的剂量不足、NIR光的强度不够) 等,往往会导致抗肿瘤效果不佳或肿瘤复发[37]。在这些情况下,化疗、免疫治疗等的介入将有助于改善PIT的治疗效果。
4.1 PIT联合PITPIT的疗效与肿瘤细胞表面受体的表达水平相关[38],单一APC介导的PIT仅靶向一个肿瘤受体,当该受体表达水平较低时PIT的效果往往也不好。而肿瘤内异质性(特别是肿瘤细胞表面受体表达的异质性) 还会导致靶向疗法的失败[39]。突变率高的肿瘤,其异质性也高。以突变率第三高的膀胱癌为例,因其亚型不同而具有不同的细胞表面蛋白富集[40],基底型膀胱癌高表达EGFR,而管腔型膀胱癌高表达HER2[41]。肿瘤组织样本检测发现,某些肿瘤中往往同时存在两种或多种过表达的受体,如在一项原发性膀胱癌研究中,57%的膀胱癌样本共表达EGFR和HER2[42]。同时以靶向EGFR与HER2的抗体Fab片段为靶头修饰纳米粒构建的双重靶向纳米粒能够克服受体的异质性[39]。Siddiqui等[41]将靶向EGFR的Pan-IR700与靶向HER2的Tra-IR700联合应用于细胞表面靶标中等表达的膀胱癌,与单一PIT相比,联合PIT组的肿瘤异种移植物显示出明显的生长迟缓。因此,联合PIT是一种治疗表面受体低/中度表达肿瘤的有前途的方法。
APC的均匀分布既是IR700在整个肿瘤中均匀分布的保障,也是PIT发挥理想疗效的前提。但是,当mAb对其受体具有高亲和力和/或肿瘤细胞表达高水平的靶受体时,mAb会在血管周围空间内饱和而无法深入到肿瘤中,该现象称为“结合位点屏障”。通过添加具有较低亲和力或较低受体表达的第二个mAb,可以实现抗体的更均匀分布。Nakajima等[43]以EGFRHigh/CD25Low的ATAC4细胞为模型,联合应用靶向EGFR的Pan-IR700与靶向CD25的basiliximab-IR700 (Bas-IR700) 进行PIT。与单独使用Pan-IR700或Bas-IR700相比,联合疗法提高了mAb与肿瘤细胞结合的同质性,使得APC的微分布更均一,且可显著抑制荷ATAC4瘤小鼠的肿瘤生长并延长其生存期。
肿瘤的增殖、迁移、进展等还与其所处的微环境密切相关,在肿瘤组织能识别肿瘤细胞的T细胞、NK细胞数量较多,但其细胞毒作用被临近的免疫抑制细胞所抑制[15],如Treg细胞通过引起免疫抑制[44]而在肿瘤免疫逃逸[45]与生长中发挥重要作用。通过同时注射两种或多种不同的APC,继而暴露于NIR光,PIT可以同时靶向两种或多种细胞[46],从而提高抗肿瘤效果。CD44是公认的肿瘤干细胞标志物,在多种肿瘤的细胞膜均有表达[47]。Maruoka等[46]将靶向CD44与CD25的PIT联合应用于同基因小鼠模型,荷瘤小鼠的生存期较各单一疗法更长。靶向CD25的PIT能够通过清除肿瘤微环境中的Treg细胞而增强其他靶向肿瘤的PIT的效果,这将是延长已治疗肿瘤免疫应答获得更优疗效的有效策略。但是,由于CD25在机体免疫中的特殊作用,还需考虑这样两个问题[24]:(1) 可能会出现Fc片段介导的抗体依赖性细胞毒性、补体依赖性细胞毒性和抗体依赖性细胞介导的吞噬作用,导致抗体靶向的CD25+ Treg细胞的清除;(2) 抗CD25的APC可能会阻断效应T细胞上的IL-2受体。Okada等[24]的PIT研究中使用不含Fc片段的抗CD25-F(ab’)2,既克服了Fc片段介导的细胞毒性,又因其半衰期更短而大大降低了阻断IL-2受体的机会。
另外,有研究表明,用针对同一受体不同表位的抗体(如曲妥珠单抗和帕妥珠单抗[48]) 进行联合信号阻滞可提高肿瘤反应并逆转对单一药物的抗性[49-50]。Ito等[51]将靶向HER2的Tra-IR700与pertuzumab-IR700 (Per-IR700) 联用,因作用于HER2的不同表位,两者不仅不会发生竞争作用,其联用的体内外抗肿瘤效果还优于任何单一PIT。鉴于肿瘤受体表达的高度多样性与分子异质性,联合应用靶向多个表面受体或同一受体不同表位的PIT能够诱导更有效的跨不同肿瘤或肿瘤亚型的细胞毒作用。
4.2 PIT联合化疗肿瘤(尤其是由表型和功能上异质的恶性细胞组成的实体瘤) 的异质性会干扰肿瘤治疗(特别是包括PIT在内的靶向分子疗法) 的有效性,最终导致肿瘤复发[52]。Ito等[52]将靶向HER2的PIT与5-氟尿嘧啶联合用于胃癌的治疗。与单一PIT相比,联合治疗在体内外抗HER2表达胃癌的效果均得到了增强,在体内产生了更强的肿瘤生长抑制作用,且其诱导肿瘤细胞死亡的机制包括PIT引起的坏死性膜损伤、5-氟尿嘧啶与曲妥珠单抗引起的细胞凋亡。
脂质体、纳米粒等药物载体能够提高化疗药物向肿瘤的传递,FDA批准的抗肿瘤纳米制剂有Doxil、Abraxane等。将PIT与市售抗肿瘤纳米制剂联用,不仅可以借助PIT诱导的SUPR效应提高纳米制剂的肿瘤递送而增强抗肿瘤效果,还能够为其临床应用与转化提供依据。Sano等[53]以EGFR阳性的A431细胞与EGFR阴性的Balb3T3/deRed细胞构建了混合肿瘤模型,在靶向EGFR的PIT后1 h注射柔红霉素脂质体(DaunoXome,DX),DX在PIT处理肿瘤的蓄积增加了5倍。与DX或PIT单独治疗相比,PIT与DX联合治疗组小鼠的肿瘤体积显著缩小、生存期显著延长。在另一项研究中,Glypican-3 (GPC3) 为靶点的PIT与Abraxane联用在肝细胞癌治疗上显现出优良的效果,IR700-anti-GPC3 antibody (IR700-YP7) 介导的PIT显著增加了Abraxane向肿瘤床的渗漏。与Abraxane治疗组相比,联合治疗组小鼠的肿瘤抑制和存活率均显著提高[18]。Mao等[19]开发了靶向Pgp的PIT,并将其与Doxil联合用于多药耐药(Multidrug resistance,MDR) 肿瘤的治疗,以荷MDR肿瘤细胞和基质细胞的混合肿瘤小鼠为模型,PIT特异性地杀灭MDR肿瘤细胞,并通过削弱Pgp介导的外排功能和增强肿瘤渗透性提高了Doxil对MDR肿瘤细胞和基质细胞的作用。
此外,与蛋白结合的低分子量抗肿瘤药物系统、抗体-药物结合物、光活化药物释放系统等也能与PIT联用。Nagaya等[54]将Pan-IR700介导的PIT与NIR释放的CyEt-Pan-Duo (Cyanine-Caged Duocarmycin conjugated panitumumab) 联用,体内研究数据显示,在NIR光照射后立即注射CyEt-Pan-Duo会导致高肿瘤积累和高肿瘤背景比,联合治疗的效果优于单独使用PIT或NIR释放疗法。
4.3 PIT联合免疫治疗ICB是临床研究最成熟、应用最广泛的肿瘤免疫治疗手段,国内外上市的肿瘤免疫类抗体包括CTLA-4和PD-1/PD-L1阻断剂。一项研究将靶向CD276的PIT与PD-1/PD-L1 ICB联用[26]。单独使用PD-L1 ICB治疗或IRD-αCD276/Fab PIT只能部分抑制4T1肿瘤的生长,而联合治疗能够明显增强肿瘤生长延迟效应并导致肿瘤尺寸显著小于单一治疗组。不仅如此,与单一疗法相比,联合治疗通过募集肿瘤浸润CD8+ T细胞而显著抑制继发性肿瘤生长并阻止其向肺的转移[26]。
Nagaya等[14]将靶向CD44的PIT与PD-1 ICB联合应用,通过逆转适应性免疫抵抗,PD-1 ICB在多种癌症模型中均明显增强了PIT诱导的抗肿瘤免疫能力。联合治疗还可以显著增强荷MC38或LLC瘤小鼠的肿瘤生长抑制作用,并延长其生存期。在双侧荷MC38-luc瘤小鼠模型中,虽然PIT仅处理单侧肿瘤,但联合治疗组双侧肿瘤的生物发光同时降低,且组织学分析发现双侧肿瘤存在相似的坏死与微出血以及白细胞浸润的增加。在荷多个MC38-luc瘤小鼠模型中,以PIT处理1个肿瘤,联合疗法足以诱导全身性免疫而清除其他PIT未处理的肿瘤。不仅如此,对联合治疗完全应答的小鼠还具有免疫记忆,能够抵抗MC38-luc细胞的攻击而使其不再形成肿瘤。但是,在MOC1模型上联合治疗较单一疗法并无明显优势。仍以这3种肿瘤为模型,Maruoka等[55]开展了一项类似的研究。与单独使用CTLA-4阻断剂或靶向CD44的PIT相比,在MOC1肿瘤中,联合治疗可显著延长小鼠生存期并提高完全缓解率(44%),而靶向CD44的PIT和PD-1阻断剂联用时,荷MOC1瘤小鼠的完全缓解率仅为8%。在MC38-luc肿瘤模型中,虽然PIT联合CTLA-4阻断剂较单一疗法显著延长了小鼠的生存期,但肿瘤完全缓解率低于PIT联合PD-1阻断剂。另外,CTLA-4阻断剂在LL/2肿瘤模型上几乎没有作用。与PIT相比,CTLA-4阻断剂的加入未能显著延长小鼠的生存期[55]。而在靶向CD44的PIT后给予IL-15,可通过增强抗肿瘤宿主免疫反应而进一步抑制肿瘤生长[56]。与单一疗法相比,联合治疗在这3个肿瘤模型上均具有显著的抑制肿瘤生长和延长小鼠生存期的作用。不同类型肿瘤的T细胞分布不同,每种肿瘤的个体微环境有所区别,因此,与PIT联合使用的最有效的免疫检查点靶标也会因基于细胞系的肿瘤类型而异。
5 总结与展望PIT能够特异性地减少肿瘤细胞数量,并增强宿主免疫反应,较传统肿瘤疗法有明显优势。它与化疗等肿瘤治疗手段联合应用时,可以产生较任何单一疗法更优的效果,尤其是与免疫激活疗法联用时,不但可以治疗局部肿瘤,还能够减少或消除全身转移、防止复发并产生免疫记忆。随着研究的逐渐深入及其在肿瘤联合治疗中的不断成熟,肿瘤靶向的PIT有巨大的潜力替代化疗等成为广泛应用的一线肿瘤疗法。
| [1] |
Kobayashi H, Choyke PL. Near-infrared photoimmunotherapy of cancer. Acc Chem Res, 2019, 52(8): 2332-2339. DOI:10.1021/acs.accounts.9b00273
|
| [2] |
Ogawa M, Tomita Y, Nakamura Y, et al. Immunogenic cancer cell death selectively induced by near infrared photoimmunotherapy initiates host tumor immunity. Oncotarget, 2017, 8(6): 10425-10436. DOI:10.18632/oncotarget.14425
|
| [3] |
Ye T, Jiang K, Wei LW, et al. Oncolytic Newcastle disease virus induces autophagy-dependent immunogenic cell death in lung cancer cells. Am J Cancer Res, 2018, 8(8): 1514-1527.
|
| [4] |
You SY, Rui W, Chen ST, et al. Process of immunogenic cell death caused by disulfiram as the anti-colorectal cancer candidate. Biochem Biophys Res Commun, 2019, 513(4): 891-897. DOI:10.1016/j.bbrc.2019.03.192
|
| [5] |
Galluzzi L, Vitale I, Warren S, et al. Consensus guidelines for the definition, detection and interpretation of immunogenic cell death. J Immunother Cancer, 2020, 8(1): e000337. DOI:10.1136/jitc-2019-000337
|
| [6] |
Zhou JY, Wang GY, Chen YZ, et al. Immunogenic cell death in cancer therapy: present and emerging inducers. J Cell Mol Med, 2019, 23(8): 4854-4865. DOI:10.1111/jcmm.14356
|
| [7] |
Li Y, Li XS, Zhou FF, et al. Nanotechnology-based photoimmunological therapies for cancer. Cancer Lett, 2019, 442: 429-438. DOI:10.1016/j.canlet.2018.10.044
|
| [8] |
Song S, Zhou FF, Chen WR, et al. PDT-induced HSP70 externalization up-regulates NO production via TLR2 signal pathway in macrophages. FEBS Lett, 2013, 587(2): 128-135. DOI:10.1016/j.febslet.2012.11.026
|
| [9] |
Ciupitu AMT, Petersson M, O'Donnell CL, et al. Immunization with a lymphocytic choriomeningitis virus peptide mixed with heat shock protein 70 results in protective antiviral immunity and specific cytotoxic T lymphocytes. J Exp Med, 1998, 187(5): 685-691. DOI:10.1084/jem.187.5.685
|
| [10] |
Heil M, Land WG. Danger signals-damaged-self recognition across the tree of life. Front Plant Sci, 2014, 5: 578.
|
| [11] |
Tappe KA, Budida R, Stankov MV, et al. Immunogenic cell death of dendritic cells following modified vaccinia virus Ankara infection enhances CD8+ T cell proliferation. Eur J Immunol, 2018, 48(12): 2042-2054. DOI:10.1002/eji.201847632
|
| [12] |
Kroemer G, Galluzzi L, Kepp O, et al. Immunogenic cell death in cancer therapy. Annu Rev Immunol, 2013, 31: 51-72. DOI:10.1146/annurev-immunol-032712-100008
|
| [13] |
Jafari S, Lavasanifar A, Hejazi MS, et al. STAT3 inhibitory stattic enhances immunogenic cell death induced by chemotherapy in cancer cells. Daru, 2020, 28(1): 159-169. DOI:10.1007/s40199-020-00326-z
|
| [14] |
Nagaya T, Friedman J, Maruoka Y, et al. Host immunity following near-infrared photoimmunotherapy is enhanced with PD-1 checkpoint blockade to eradicate established antigenic tumors. Cancer Immunol Res, 2019, 7(3): 401-413. DOI:10.1158/2326-6066.CIR-18-0546
|
| [15] |
Sato K, Sato N, Xu BY, et al. Spatially selective depletion of tumor-associated regulatory T cells with near-infrared photoimmunotherapy. Sci Transl Med, 2016, 8(352): 352ra110. DOI:10.1126/scitranslmed.aaf6843
|
| [16] |
Torrice M. Does Nanomedicine have a delivery problem?. ACS Cent Sci, 2016, 2(7): 434-437. DOI:10.1021/acscentsci.6b00190
|
| [17] |
Sano K, Nakajima T, Choyke PL, et al. Markedly enhanced permeability and retention effects induced by photo-immunotherapy of tumors. ACS Nano, 2013, 7(1): 717-724. DOI:10.1021/nn305011p
|
| [18] |
Hanaoka H, Nakajima T, Sato K, et al. Photoimmunotherapy of hepatocellular carcinoma-targeting glypican-3 combined with nanosized albumin-bound paclitaxel. Nanomedicine (Lond), 2015, 10(7): 1139-1147. DOI:10.2217/nnm.14.194
|
| [19] |
Mao CQ, Li F, Zhao Y, et al. P-glycoprotein-targeted photodynamic therapy boosts cancer nanomedicine by priming tumor microenvironment. Theranostics, 2018, 8(22): 6274-6290. DOI:10.7150/thno.29580
|
| [20] |
Liang CP, Nakajima T, Watanabe R, et al. Real-time monitoring of hemodynamic changes in tumor vessels during photoimmunotherapy using optical coherence tomography. J Biomed Opt, 2014, 19(9): 098004. DOI:10.1117/1.JBO.19.9.098004
|
| [21] |
Tang QG, Nagaya T, Liu Y, et al. Real-time monitoring of microdistribution of antibody-photon absorber conjugates during photoimmunotherapy in vivo. J Control Release, 2017, 260: 154-163. DOI:10.1016/j.jconrel.2017.06.004
|
| [22] |
Tang QG, Nagaya T, Liu Y, et al. 3D mesoscopic fluorescence tomography for imaging micro-distribution of antibody-photon absorber conjugates during near infrared photoimmunotherapy in vivo. J Control Release, 2018, 279: 171-180. DOI:10.1016/j.jconrel.2018.04.027
|
| [23] |
Nagaya T, Nakamura Y, Sato K, et al. Improved micro-distribution of antibody-photon absorber conjugates after initial near infrared photoimmunotherapy (NIR-PIT). J Control Release, 2016, 232: 1-8. DOI:10.1016/j.jconrel.2016.04.003
|
| [24] |
Okada R, Maruoka Y, Furusawa A, et al. The effect of antibody fragments on CD25 targeted regulatory T cell near-infrared photoimmunotherapy. Bioconjug Chem, 2019, 30(10): 2624-2633. DOI:10.1021/acs.bioconjchem.9b00547
|
| [25] |
Mao CQ, Qu P, Miley MJ, et al. P-glycoprotein targeted photodynamic therapy of chemoresistant tumors using recombinant Fab fragment conjugates. Biomater Sci, 2018, 6(11): 3063-3074. DOI:10.1039/C8BM00844B
|
| [26] |
Bao R, Wang YP, Lai JH, et al. Enhancing anti-PD-1/PD-L1 immune checkpoint inhibitory cancer therapy by CD276-targeted photodynamic ablation of tumor cells and tumor vasculature. Mol Pharm, 2019, 16(1): 339-348. DOI:10.1021/acs.molpharmaceut.8b00997
|
| [27] |
Wei DF, Tao Z, Shi QX, et al. Selective photokilling of colorectal tumors by near-infrared photoimmunotherapy with a GPA33-targeted single-chain antibody variable fragment conjugate. Mol Pharm, 2020, 17(7): 2508-2517. DOI:10.1021/acs.molpharmaceut.0c00210
|
| [28] |
Yamaguchi H, Pantarat N, Suzuki T, et al. Near-infrared photoimmunotherapy using a small protein mimetic for HER2-overexpressing breast cancer. Int J Mol Sci, 2019, 20(23): 5835. DOI:10.3390/ijms20235835
|
| [29] |
Burley TA, Mączyńska J, Shah A, et al. Near-infrared photoimmunotherapy targeting EGFR-shedding new light on glioblastoma treatment. Int J Cancer, 2018, 142(11): 2363-2374. DOI:10.1002/ijc.31246
|
| [30] |
Tsuchimochi M, Yamaguchi H, Hayama K, et al. Imaging of metastatic cancer cells in sentinel lymph nodes using affibody probes and possibility of a theranostic approach. Int J Mol Sci, 2019, 20(2): 427. DOI:10.3390/ijms20020427
|
| [31] |
Van Lith SAM, Van Den Brand D, Wallbrecher R, et al. The effect of subcellular localization on the efficiency of EGFR-targeted VHH photosensitizer conjugates. Eur J Pharm Biopharm, 2018, 124: 63-72. DOI:10.1016/j.ejpb.2017.12.009
|
| [32] |
Aung W, Tsuji AB, Sugyo A, et al. Near-infrared photoimmunotherapy of pancreatic cancer using an indocyanine green-labeled anti-tissue factor antibody. World J Gastroenterol, 2018, 24(48): 5491-5504. DOI:10.3748/wjg.v24.i48.5491
|
| [33] |
Darwish WM, Bayoumi NA, El-Shershaby HM, et al. Targeted photoimmunotherapy based on photosensitizer-antibody conjugates for multiple myeloma treatment. J Photochem Photobiol B, 2020, 203: 111777. DOI:10.1016/j.jphotobiol.2020.111777
|
| [34] |
Nishimura T, Mitsunaga M, Ito K, et al. Cancer neovasculature-targeted near-infrared photoimmunotherapy (NIR-PIT) for gastric cancer: different mechanisms of phototoxicity compared to cell membrane-targeted NIR-PIT. Gastric Cancer, 2020, 23(1): 82-94. DOI:10.1007/s10120-019-00988-y
|
| [35] |
Watanabe S, Noma K, Ohara T, et al. Photoimmunotherapy for cancer-associated fibroblasts targeting fibroblast activation protein in human esophageal squamous cell carcinoma. Cancer Biol Ther, 2019, 20(9): 1234-1248. DOI:10.1080/15384047.2019.1617566
|
| [36] |
Shirasu N, Shibaguchi H, Yamada H, et al. Highly versatile cancer photoimmunotherapy using photosensitizer-conjugated avidin and biotin-conjugated targeting antibodies. Cancer Cell Int, 2019, 19: 299. DOI:10.1186/s12935-019-1034-4
|
| [37] |
Mitsunaga M, Nakajima T, Sano K, et al. Immediate in vivo target-specific cancer cell death after near infrared photoimmunotherapy. BMC Cancer, 2012, 12: 345. DOI:10.1186/1471-2407-12-345
|
| [38] |
Peng W, De Bruijn HS, Farrell E, et al. Epidermal growth factor receptor (EGFR) density may not be the only determinant for the efficacy of EGFR-targeted photoimmunotherapy in human head and neck cancer cell lines. Lasers Surg Med, 2018, 50(5): 513-522. DOI:10.1002/lsm.22930
|
| [39] |
Houdaihed L, Evans JC, Allen C. Dual-targeted delivery of nanoparticles encapsulating paclitaxel and everolimus: a novel strategy to overcome breast cancer receptor heterogeneity. Pharm Res, 2020, 37(3): 39. DOI:10.1007/s11095-019-2684-6
|
| [40] |
Dadhania V, Zhang M, Zhang L, et al. Meta-analysis of the luminal and basal subtypes of bladder cancer and the identification of signature immunohistochemical markers for clinical use. E Bio Medicine, 2016, 12: 105-117.
|
| [41] |
Siddiqui MR, Railkar R, Sanford T, et al. Targeting epidermal growth factor receptor (EGFR) and human epidermal growth factor receptor 2 (HER2) expressing bladder cancer using combination photoimmunotherapy (PIT). Sci Rep, 2019, 9: 2084. DOI:10.1038/s41598-019-38575-x
|
| [42] |
Carlsson J, Wester K, De La Torre M, et al. EGFR-expression in primary urinary bladder cancer and corresponding metastases and the relation to HER2-expression. On the possibility to target these receptors with radionuclides. Radiol Oncol, 2015, 49(1): 50-58. DOI:10.2478/raon-2014-0015
|
| [43] |
Nakajima T, Sano K, Choyke PL, et al. Improving the efficacy of photoimmunotherapy (PIT) using a cocktail of antibody conjugates in a multiple antigen tumor model. Theranostics, 2013, 3(6): 357-365. DOI:10.7150/thno.5908
|
| [44] |
Krantz D, Mints M, Winerdal M, et al. IL-16 processing in sentinel node regulatory T cells is a factor in bladder cancer immunity. Scand J Immunol, 2020, 92(6): e12926.
|
| [45] |
Son J, Cho JW, Park HJ, et al. Tumor-infiltrating regulatory T-cell accumulation in the tumor microenvironment is mediated by IL33/ST2 signaling. Cancer Immunol Res, 2020, 8(11): 1393-1406.
|
| [46] |
Maruoka Y, Furusawa A, Okada R, et al. Combined CD44- and CD25-targeted near-infrared photoimmunotherapy selectively kills cancer and regulatory T cells in syngeneic mouse cancer models. Cancer Immunol Res, 2020, 8(3): 345-355. DOI:10.1158/2326-6066.CIR-19-0517
|
| [47] |
Nagaya T, Nakamura Y, Okuyama S, et al. Syngeneic mouse models of oral cancer are effectively targeted by anti-CD44-based NIR-PIT. Mol Cancer Res, 2017, 15(12): 1667-1677. DOI:10.1158/1541-7786.MCR-17-0333
|
| [48] |
Deng XH, Zheng XX, Yang HM, et al. Comparative analysis of evolutionarily conserved motifs of epidermal growth factor receptor 2 (HER2) predicts novel potential therapeutic epitopes. PLoS ONE, 2014, 9(9): e106448. DOI:10.1371/journal.pone.0106448
|
| [49] |
Nami B, Maadi H, Wang ZX. The effects of pertuzumab and its combination with trastuzumab on HER2 homodimerization and phosphorylation. Cancers (Basel), 2019, 11(3): 375. DOI:10.3390/cancers11030375
|
| [50] |
Shu MJ, Yan HB, Xu CY, et al. A novel anti-HER2 antibody GB235 reverses trastuzumab resistance in HER2-expressing tumor cells in vitro and in vivo. Sci Rep, 2020, 10: 2986. DOI:10.1038/s41598-020-59818-2
|
| [51] |
Ito K, Mitsunaga M, Nishimura T, et al. Combination photoimmunotherapy with monoclonal antibodies recognizing different epitopes of human epidermal growth factor receptor 2: an assessment of phototherapeutic effect based on fluorescence molecular imaging. Oncotarget, 2016, 7(12): 14143-14152. DOI:10.18632/oncotarget.7490
|
| [52] |
Ito K, Mitsunaga M, Arihiro S, et al. Molecular targeted photoimmunotherapy for HER2-positive human gastric cancer in combination with chemotherapy results in improved treatment outcomes through different cytotoxic mechanisms. BMC Cancer, 2016, 16: 37. DOI:10.1186/s12885-016-2072-0
|
| [53] |
Sano K, Nakajima T, Choyke PL, et al. The effect of photoimmunotherapy followed by liposomal daunorubicin in a mixed tumor model: a demonstration of the super-enhanced permeability and retention effect after photoimmunotherapy. Mol Cancer Ther, 2014, 13(2): 426-432. DOI:10.1158/1535-7163.MCT-13-0633
|
| [54] |
Nagaya T, Gorka AP, Nani RR, et al. Molecularly targeted cancer combination therapy with near-infrared photoimmunotherapy and near-infrared photorelease with duocarmycin-antibody conjugate. Mol Cancer Ther, 2018, 17(3): 661-670. DOI:10.1158/1535-7163.MCT-17-0851
|
| [55] |
Maruoka Y, Furusawa A, Okada R, et al. Near-infrared photoimmunotherapy combined with CTLA4 checkpoint blockade in syngeneic mouse cancer models. Vaccines (Basel), 2020, 8(3): 528. DOI:10.3390/vaccines8030528
|
| [56] |
Maruoka Y, Furusawa A, Okada R, et al. Interleukin-15 after near-infrared photoimmunotherapy (NIR-PIT) enhances T cell response against syngeneic mouse tumors. Cancers (Basel), 2020, 12(9): 2575. DOI:10.3390/cancers12092575
|
 2021, Vol. 37
2021, Vol. 37