扩展功能
文章信息
- 王秋玲, 徐倩倩, 张婷婷, 赵文钧, 陈玉秋, 齐甜铭, 马得莹
- WANG Qiu-Ling, XU Qian-Qian, ZHANG Ting-Ting, ZHAO Wen-Jun, CHEN Yu-Qiu, QI Tian-Ming, MA De-Ying
- 重组鹅β-防御素12蛋白的原核表达及生物学特性
- Recombinant expression and biological characteristics of goose β-defensin 12
- 微生物学通报, 2016, 43(9): 1973-1979
- Microbiology China, 2016, 43(9): 1973-1979
- DOI: 10.13344/j.microbiol.china.150885
-
文章历史
- 收稿日期: 2015-11-09
- 接受日期: 1016-03-03
- 优先数字出版日期(www.cnki.net): 2016-03-18
目前,由于抗生素在养殖业中的不当使用导致细菌耐药性的产生,严重威胁人畜的健康,并制约养殖业的发展。因此,寻求无污染、无残留、无毒副作用的新型抗菌制剂代替饲用抗生素,已成为畜牧业迫切要解决的首要问题。抗菌肽作为一种新型的生物活性肽,由于其广泛的杀菌作用而成为最具希望代替抗生素的新型抗菌制剂。
禽β-防御素(avian β-defensin,AvBD)是一类广泛存在于家禽体中的内源性抗菌肽[1],主要分子特征为含有位置保守的6个半胱氨酸残基构成的 3对二硫键,多由4个外显子和3个内含子构成。大量研究表明,禽β-防御素具有广谱的抗菌活性,能有效地杀灭细菌、真菌、螺旋体和囊膜病毒等[2, 3],在禽先天性免疫及获得性免疫中均发挥重要作用。然而,天然禽β-防御素分子量小,在机体内含量很少,分离提纯困难,天然产量有限。因此,基因工程方法是获得禽β-防御素的有效途径之一[4-6]。
在已发现的11种鹅β-防御素(AvBD1-7,AvBD9-10,AvBD12,AvBD16)中,AvBD12编码区大小为198 bp,编码65个氨基酸残基。在前期研究中,本课题组已采用GST基因融合表达系统,表达了鹅AvBD1、AvBD3、AvBD5、AvBD6和AvBD10的重组蛋白,均获得了理想的表达效果。但是,由于GST标签分子质量与禽β-防御素相比较大,对其活性有一定影响,所以本试验采用His融合表达系统表达鹅AvBD12重组蛋白。并在体外测定鹅AvBD12重组蛋白的生物学特性,期望能为进一步探讨禽β-防御素在鹅防御系统中发挥的作用及其在水禽饲养中的推广应用提供参考。
1 材料与方法 1.1 材料1.1.1 菌株及质粒:重组质粒pMD18-T-goose AvBD12由本实验室保存[7];pMD18-T-Simple Vector购自TaKaRa公司;表达载体pProEX-HTa、表达菌株Escherichia coli Rosetta、枯草芽孢杆菌Bacillus subtilis (ATCC 9193)、金黄色葡萄球菌Staphyloccocus aureus (ATCC 29213)、四联球菌Micrococcus tetragenus (ATCC 2835)、鸡白痢沙门氏菌Salmonella pullorum (C79-11-S11)、大肠杆菌Escherichia coli (BL21)均由实验室保存。
1.1.2 主要试剂和仪器:ExTaq DNA聚合酶、限制性内切酶EcoR i、Xho i、T4 DNA连接酶、Marker和异丙基硫代-β-D-半乳糖苷(IPTG)购自宝生物工程(大连)有限公司;凝胶回收试剂盒购自美国OMEGA公司;蛋白纯化复性试剂盒购自Novagen公司;所使用的试剂均为分析纯。
生物安全柜,美国Forma Scientific公司;超低温 冰箱(ULTB86-3型),美国REVCD公司;水浴锅(DK-8D型),上海-恒科技有限公司;直流电泳仪(DYY-6C型),北京市六一仪器厂;紫外凝胶成像仪(Bio imaging system),Gene Genius;超声波 破碎仪(CV18),南京新辰 生物科技有限公司;低温台式高速离心机(J2-21M型),Beckman公司;紫外分光光度计,瑞典Pharmacia公司。
1.2 方法1.2.1 原核表达重组质粒的构建、重组蛋白的表达及纯化:在本实验室前期研究基础上,根据表达载体pProEX-HTa与pMD18-T-AvBD12酶切位点设计一对鹅AvBD12特异性表达引物P1/P2,将EcoR I、Xho I两个酶切位点分别加入到基因的上游引物P1和下游引物P2的5′端。P1:5′-GAATTCATGGAC AGCTGTAACCACG-3′;P2:5′-CTCGAGTCAGGTC TTGGTGGGAGTTG-3′。以重组质粒pMD18-T- AvBD12为模板,用表达引物进行PCR扩增。PCR反应体系:ExTaqTM DNA聚合酶(2x) 12.5 μL,模板(约200 mg/L) 0.5 μL,上下游引物(10 μmol/L)各 1 μL,用灭菌双蒸水补足25 μL。扩增条件:94 ℃ 5 min;94 ℃ 30 s,58 ℃ 30 s,72 ℃ 30 s,25个循环;72 ℃ 10 min。
将扩增产物用EcoR I和Xho I双酶切后克隆到原核表达载体pProEX-HTa上,构建重组表达质粒pProEX-AvBD12,经上述PCR扩增体系及反应条件进行质粒PCR和双酶切鉴定,酶切体系如下:重组表达质粒3 μL,EcoR I和Xho I各0.5 μL,10×H Buffer 1 μL,补加去离子水至总体积10 μL,37 ℃水浴2 h进行双酶切鉴定。阳性质粒由北京六合华大基因科技股份有限公司测序。
将鉴定为阳性的菌液活化后,取50 μL按1:100接种于5 mL含有Amp+的LB液体培养基 中[6],37 ℃、250 r/min振荡培养2-2.5 h至OD600值达到0.6-0.8时,无菌条件下取1 mL细菌培养物作为诱导前对照,并在剩余菌液中加入 浓度为 100 mmol/L IPTG使其终浓度达到0.6 mmol/L,继续振摇培养,分别在诱导2、4和6 h后各留取 1 mL菌样。将不同时间段收集的菌样于4 ℃、 5 000 r/min离心5 min,收获细菌沉淀。在沉淀中加入1/10菌液体积的1×SDS凝胶上样缓冲液,煮沸5 min,冰浴2 min。将加入缓冲液处理过的样品进行Tricine-SDS-PAGE电泳。电泳结束后,经考马斯亮蓝染色,甲醇-冰乙酸脱色液脱色观察结果。用薄层扫描仪确定蛋白质的表达量。按照Novagen公司的蛋白纯化复性试剂盒说明书进行包涵体的纯化、复性和透析,并用分光光度计测定重组蛋白的浓度。留取1 mL超声波破碎离心的上清液和少量沉淀,将沉淀用100 μL PBS (pH 7.4)重新悬起。将诱导前对照菌样、诱导后菌样、上清液、沉淀样和纯化后的蛋白进行Tricine-SDS- PAGE电泳分析。
1.2.2 鹅AvBD12重组蛋白抗菌活性测定:采用菌落计数法测定鹅AvBD12重组蛋白的抗菌活性。将纯化后的鹅AvBD12重组蛋白装在1.5 mL EP管中,用pH 7.4的无菌PBS稀释,使其终浓度分别为50、100、250和500 mg/L总体积为250 μL的蛋白。将1.1.1所述各株细菌培养至对数生长期,然后用相应的培养基稀释细菌至2×106 CFU/ml,分别取每株细菌培养物10 μL至EP管中,同时用PBS代替重组蛋白作为阴性对照,每组设置3个重复。37 ℃振荡孵育4 h后,每个稀释度各取 100 μL接种于相应的LB固体培养基上,37 ℃培养过夜后,观察并记录每个培养基上的单菌落量。取相同稀释度的3个培养基菌落平均值作为该稀释度样品的菌落数量。根据接种量和稀释倍数计算每管原液中的细菌数量,并用Excel 2003处理数据,应用GraphPad Prism 5绘制细菌存活率和重组蛋白浓度关系。
细菌的存活率(%)=存活细菌数/阴性对照存活细菌数×100。
1.2.3 不同盐离子浓度对鹅AvBD12重组蛋白抗菌活性的影响:选取大肠杆菌(G-)和四联球菌(G+)为检测菌,调整PBS中氯化钠浓度,使其浓度分别为0、50、100、150 mmol/L。然后将鹅重组蛋白在无菌的1.5 mL EP管中用上述含不同氯化钠浓度的缓冲液稀释至终浓度为250 mg/L总体积为 250 μL的蛋白,同时设相应浓度的NaCl缓冲液为阴性对照, 分别向每管加入细菌培养物10 μL,37 ℃振荡孵育4 h,方法同1.2.2。
1.2.4 鹅AvBD12重组蛋白对鸡红细胞的溶血活性测定:用无菌PBS (pH 7.4)将新鲜鸡血红细胞稀释至2%-3%,用PBS稀释重组蛋白,使其终浓度分别为100、250、500 mg/L。取20 μL蛋白分别加入无菌离心管中,同时设PBS作为阴性对照,0.2% Triton 100作为阳性对照,分别向每管加入180 μL稀释的红细胞。每组设3个重复,37 ℃孵育1 h,1 000 r/min离心10 min后取上清,用微量紫外分光光度计测OD560值。每个样品做3个平行测定,取平均值。
溶血指数(%)=(OD蛋白-ODPBS)/(ODTriton-ODPBS)× 100。
1.2.5 统计分析:试验所得数据均采用SAS 6.0软件进行方差分析。
2 结果与分析 2.1 重组表达质粒pProEX-goose AvBD12的鉴定电泳结果表明,酶切产物大小与质粒PCR扩增得到条带大小一致(147 bp),如图 1所示。测序表明重组质粒成功插入到原核表达载体pProEX-HTa的目的位点。

|
| 图 1 重组质粒pProEX-goose-AvBD12的双酶切及PCR产物的鉴定 Figure 1 Identification of pProEX-goose-AvBD12 recombinant plasmid digested and PCR product 注:F:质粒pProEX HTa-AvBD12双酶切产物;E:质粒pProEX HTa-AvBD12的PCR产物;M:100 bp Ladder DNA marker. Note: F: Product of plasmid pProEX HTa-AvBD12 restriction enzyme digestion; E: Plasmid pProEX HTa-AvBD12 PCR product; M: 100 bp Ladder DNA marker. |
|
|
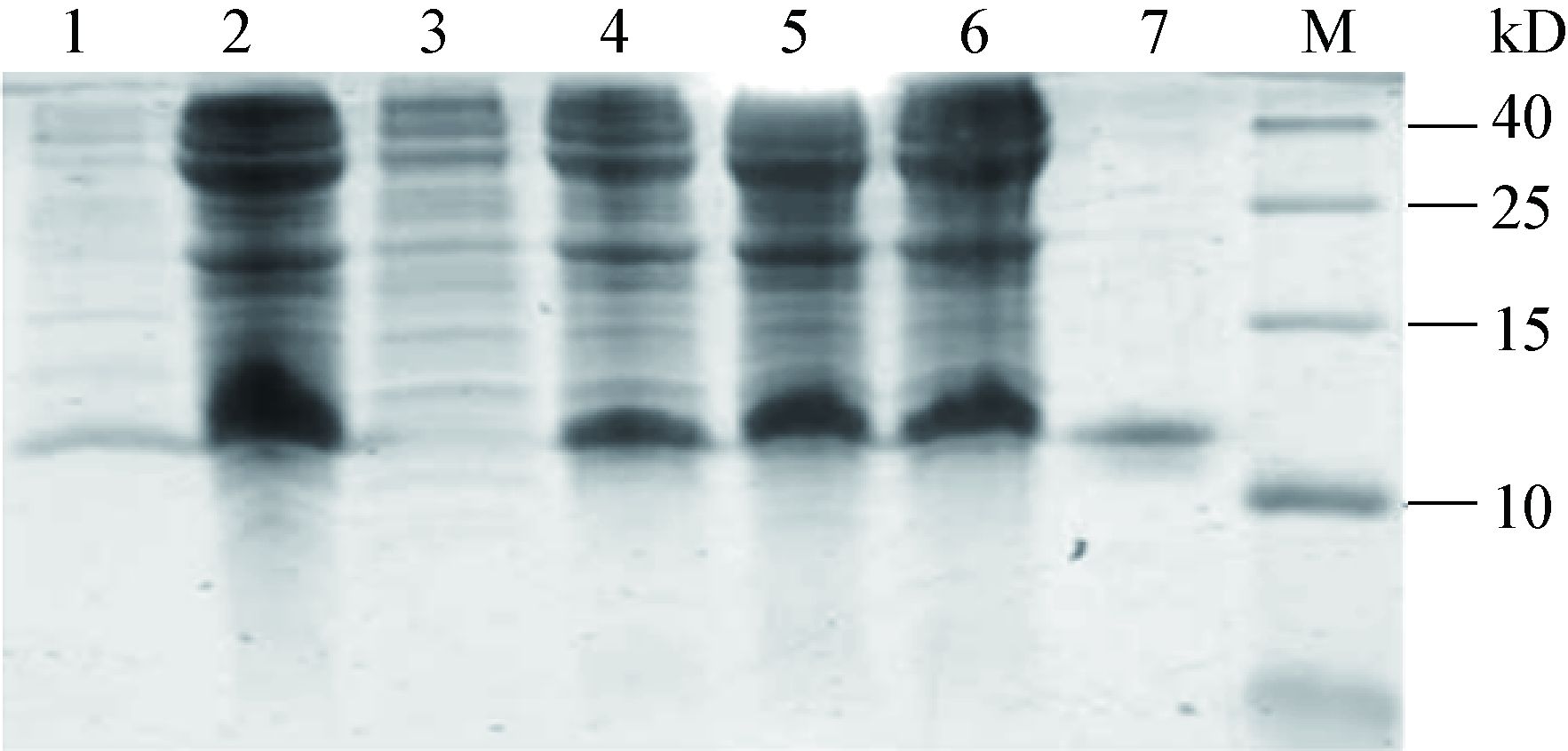
通过Tricine-SDS-PAGE电泳结果显示,诱导后与诱导前相比,有一条明显的表达蛋白条带约12 kD,表达的融合蛋白约占总菌体蛋白的35%。诱导2、4、6 h后可见,6 h的表达量最大。采用Novagen试剂盒对鹅AvBD12重组蛋白进行纯化复性,发现表达的蛋白大部分在包涵体中。对纯化后的蛋白进行Tricine-SDS-PAGE电泳,可见约 12 kD蛋白带,与预期蛋白大小相符(图 2)。纯化后的蛋白浓度为1 500 mg/L。
|
| 图 2 鹅AvBD12重组蛋白的表达与纯化 Figure 2 Expression and purification of recombinant goose AvBD12 protein 注:1:上清;2:包涵体;3:无诱导;4-6:IPTG诱导2、4、6 h后融合蛋白表达;7:纯化蛋白;M:蛋白质Marker. Note: 1: Supertant; 2: Inclusion body; 3: Total protein of Rosseta containing goose AvBD12 without IPTG induction; 4-6: Total protein of Rosseta containing goose AvBD12 on 2,4,6 h,after induction with IPTG; 7: Purified protein; M: Protein marker. |
|
|
试验采用菌落计数法在体外测定鹅AvBD12重组蛋白的抗菌活性。结果表明,鹅AvBD12重组蛋白在浓度50-500 mg/L范围内对大肠杆菌、鸡白痢沙门氏菌、四联球菌、枯草芽孢杆菌及金黄色葡萄球菌均具有抑制作用,且随着蛋白浓度的增加抗菌活性增强。其中,鹅AvBD12重组蛋白对大肠杆菌和四联球菌抗菌活性较强,对枯草芽孢杆菌、金黄色葡萄球菌和鸡白痢沙门氏菌抗菌活性相对较弱(图 3)。

|
| 图 3 鹅AvBD12重组蛋白的抗菌活性 Figure 3 Antimicrobial activity of recombinant goose AvBD12 protein 注:A:大肠杆菌;B:鸡白痢沙门氏菌;C:四联球菌;D:枯草芽孢杆菌;E:金黄色葡萄球菌. Note: A: E. coli; B: S. pullorum; C: M. tetragenus; D: B. subtilis; E: S. aureus. |
|
|
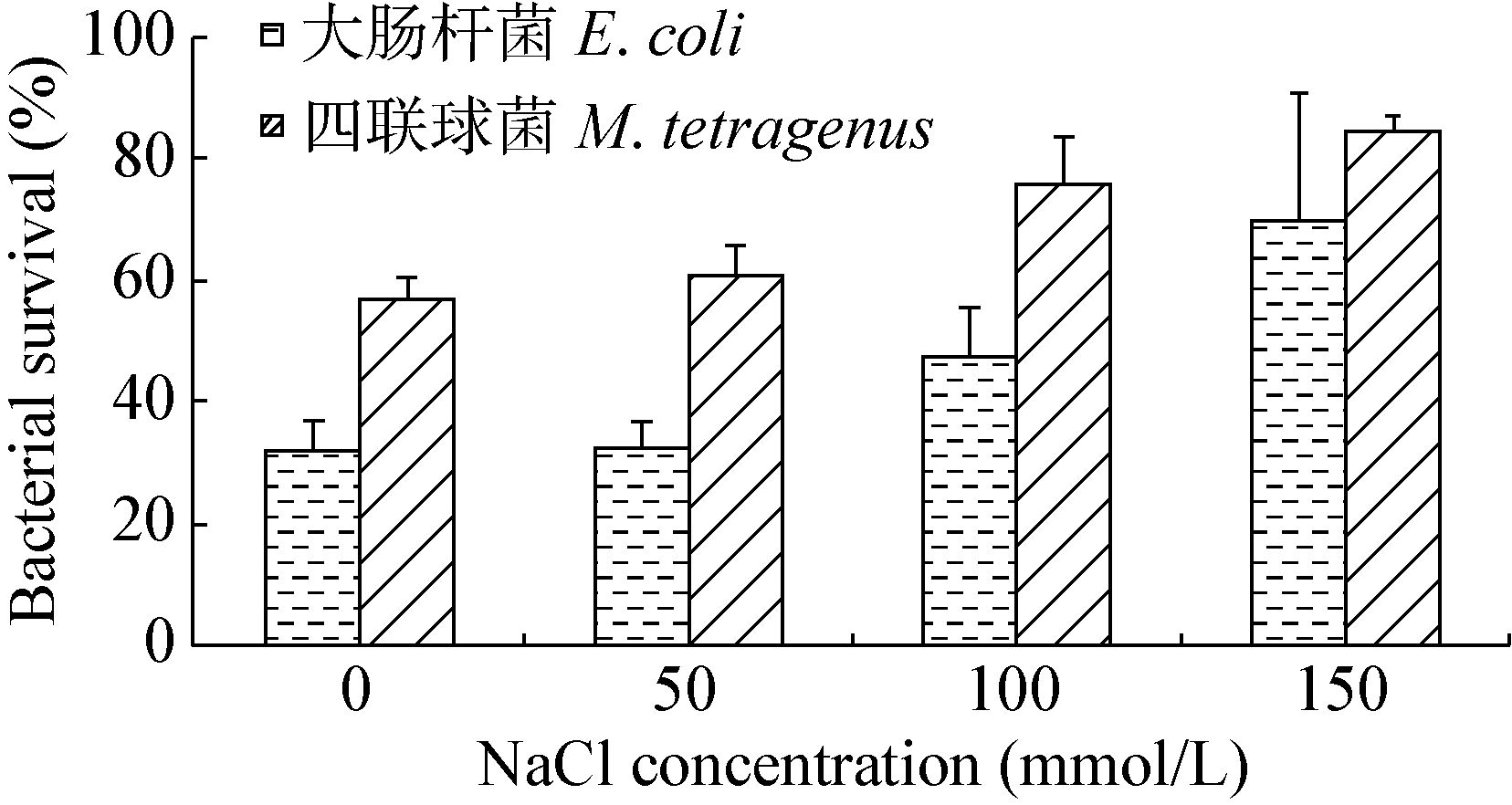
如图 4所示,无论是以革兰氏阳性菌(四链球菌)还是革兰氏阴性菌(大肠杆菌)为检测菌,当鹅AvBD12重组蛋白在浓度为250 mg/L时,随着盐离子浓度的升高细菌存活率上升,即抗菌活性下降,并且,当NaCl浓度达到150 mmol/L时,抗菌活性显著下降(P<0.01)。
|
| 图 4 NaCl浓度对鹅AvBD12重组蛋白抗菌活性的影响 Figure 4 Effect of different NaCl concentration on the antimicrobial activity of recombinant goose AvBD12 protein |
|
|
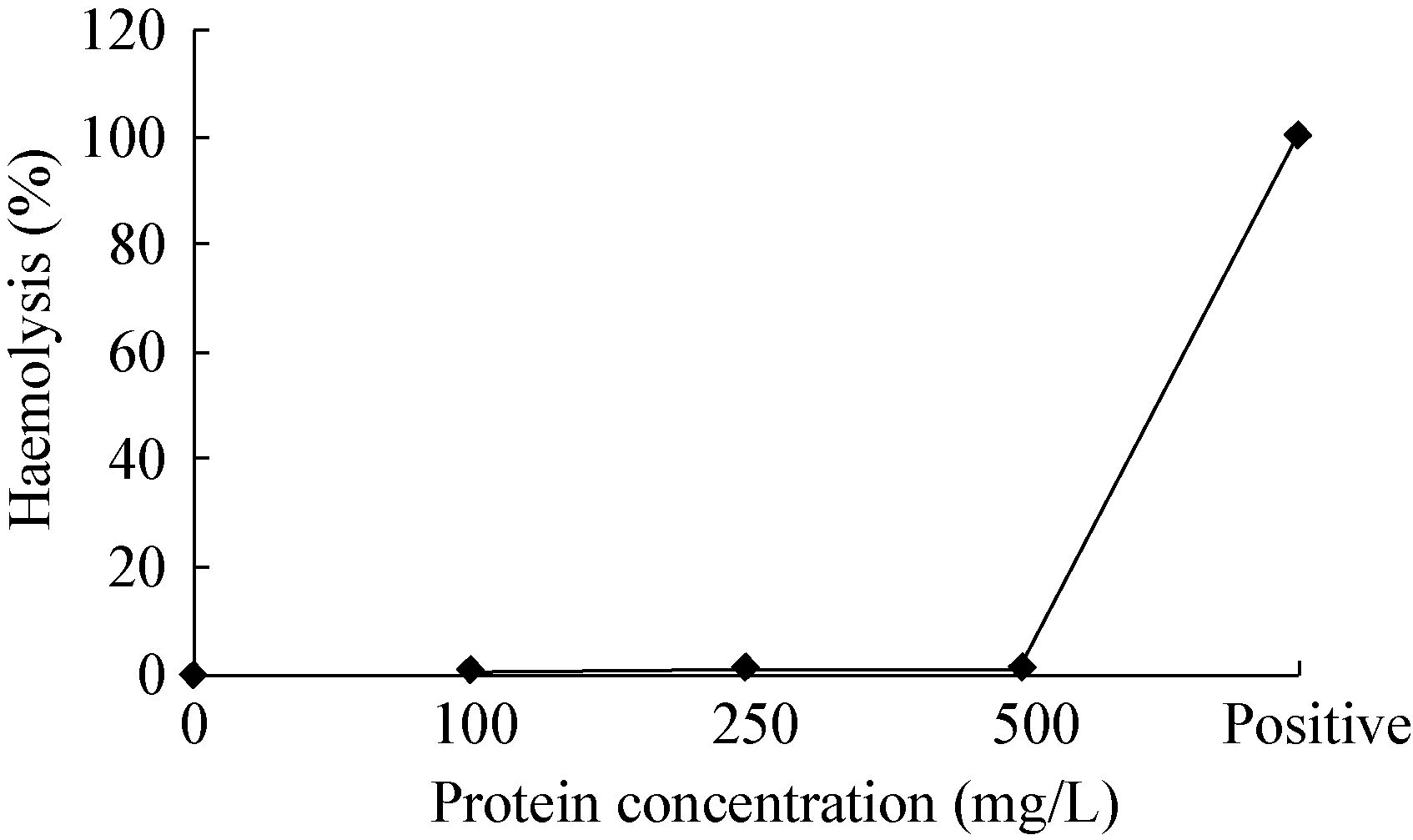
如图 5所示,不同浓度(100、250、500 mg/L)的鹅AvBD12重组蛋白对鸡红细胞的溶血活性极低,与PBS阴性对照相比,差异不显著(P>0.05)。试验表明鹅AvBD12重组蛋白对鸡红细胞无溶血活性。
|
| 图 5 鹅AvBD12重组蛋白的溶血活性 Figure 5 Hemolysis activity of recombinant goose AvBD12 protein |
|
|
由于禽类缺少超氧化物离子和髓过氧化物酶,禽类更多依赖于防御因子,包括溶菌酶、阳离子蛋白质和抗菌肽。在对抗病原体时,β-防御素一直被认为在先天免疫过程中起着重要作用[8]。
为了研究防御素的生物活性,纯化或者激活一定数量的蛋白质是必要的。到目前为止,蛋白表达主要有真核表达系统和原核表达系统,原核表达系统中GST融合表达与His融合表达是目前常用的表达系统,现在已经有很多防御素通过GST融合表达系统大量表达,并且获得了良好效 果[4-6, 9-12]。但是由于GST的分子量相对于防御素过大,对其活性有一定影响。所以本试验采用His融合表达系统表达鹅AvBD12重组蛋白。通过Tricine-SDS-PAGE电泳分析表明,表达的蛋白大部分以不溶的、无活性的包涵体形式存在。包涵体是大量表达的重组蛋白形成的致密颗粒,能保护目的蛋白不受蛋白酶降解,且不影响宿主菌生长,便于产物的分离[13],所以包涵体对于提高重组蛋白的产量和稳定性非常重要。由于目的蛋白形成包涵体后不具有生物活性,所以,我们用Novagen公司的Protein Refolding Kit试剂盒对包涵体进行溶解和复性,最后得到具有活性的重组蛋白。
经抗菌活性测定,该重组蛋白在50-500 mg/L范围内对所测定的5种细菌均具有抑菌作用,且随着蛋白浓度的增加抗菌活性增强,本研究结果与前人有关其他禽类AvBDs的报道一致[14-16],表明禽β-防御素具有广谱抗菌活性。另外,我们前期研究表明[4],用GST标签融合表达的重组鸭AvBD12蛋白对金黄色葡萄球菌和鸡白痢沙门氏菌的抑制作用与本研究结果相似,但对大肠杆菌的抗菌活性明显低于本研究中His标签融合表达的鹅AvBD12重组蛋 白。这说明用His融合表达系统表达AvBDs重组蛋白更有利于其抗菌作用的发挥。
在高浓度的盐离子(150 mmol/L)条件下,鹅AvBD12重组蛋白无论对革兰氏阳性菌(四链球菌)还是革兰氏阴性菌(大肠杆菌)的抗菌活性都显著降低,表明高浓度盐离子能够显著抑制鹅AvBD12重组蛋白的抗菌活性。本结果与前人相关报道一 致[4-6]。这可能是因为高浓度离子破坏细菌外膜的阴离子和抗菌肽正电荷的相互作用而影响防御素的抗菌活性[17]。为了进一步了解鹅AvBD12重组蛋白对细胞的毒性,我们选用鸡红细胞作为研究对象,探讨该重组蛋白的溶血活性。结果发现,鹅AvBD12重组蛋白对鸡红细胞的溶血活性极低。这与前人有关其他禽源AvBDs的结果一致[9, 11, 18-21]。上述结果初步表明,AvBDs对机体细胞不具有危害。此外,我们前期研究发现,AvBDs对环境温度及酸碱度有较强的耐受性,即使在-20-100 ℃或pH 3.0-12.0条件下处理30 min仍具有抗菌活 性[9, 22]。上述结果显示,AvBDs重组蛋白具有耐受饲料加工过程的高温处理和适应畜禽消化道内环境pH的特性。这些研究结果揭示,AvBDs重组蛋白具有作为抗生素替代品应用于养殖业的潜质。
4 结论本研究应用原核表达载体pProEX-HTa表达了鹅AvBD12蛋白,该重组蛋白分子质量约为12 kD。该重组蛋白对所测定的5种细菌均有抑制作用;高盐离子浓度显著降低其抑菌活性。此外,鹅AvBD12重组蛋白对鸡血红细胞的溶血活性极低。
| [1] | Lehrer RI, Ganz T. Antimicrobial peptides in mammalian and insect host defence[J]. Current Opinion in Immunology , 1999, 11 (1) : 23–27. DOI:10.1016/S0952-7915(99)80005-3 |
| [2] | Brune K, Leffell MS, Spitznagel JK. Microbicidal activity of peroxidaseless chicken heterophile leukocytes[J]. Infection and Immunity , 1972, 5 (3) : 283–287. |
| [3] | Donovan KL, Topley N. What are renal defensins defending?[J]. Nephron Experimental Nephrology , 2004, 93 (4) : 125–128. |
| [4] | Ma DY, Lin LJ, Zhang KX, et al. Three novel Anas platyrhynchos avian β-defensins,upregulated by duck hepatitis virus,with antibacterial and antiviral activities[J]. Molecular Immunology , 2011, 49 (1/2) : 84–96. |
| [5] | Ma DY, Lin LJ, Zhang KX, et al. Discovery and characterization of Coturnix chinensis avian β-defensin 10,with broad antibacterial activity[J]. Journal of Peptide Science , 2012, 18 (4) : 224–232. DOI:10.1002/psc.v18.4 |
| [6] | Ma DY, Zhou CY, Zhang MY, et al. Functional analysis and induction of four novel goose (Anser cygnoides) avian β-defensins in response to Salmonella enteritidis infection[J]. Comparative Immunology,Microbiology and Infectious Diseases , 2012, 35 (2) : 197–207. DOI:10.1016/j.cimid.2012.01.006 |
| [7] | Xu QQ. Molecular mechanism of roles of NDV infection on immune function of goose[D]. Harbin: Master’s Thesis of Northeast Agricultural University,2015 (in Chinese) 徐倩倩. 鹅源新城疫病毒感染对鹅免疫功能作用的分子机 制[D]. 哈尔滨: 东北农业大学硕士学位论文,2015 |
| [8] | Harmon BG. Avian heterophils in inflammation and disease resistance[J]. Poultry Science , 1998, 77 (7) : 972–977. DOI:10.1093/ps/77.7.972 |
| [9] | Ma DY, Wang RQ, Liao WY, et al. Identification and characterization of a novel antibacterial peptide,avian β-defensin 2 from ducks[J]. The Journal of Microbiology , 2009, 47 (5) : 610–618. DOI:10.1007/s12275-009-0068-z |
| [10] | Ma DY, Liao WY, Wang RQ, et al. Two novel duck antibacterial peptides,avian beta-defensins 9 and 10,with antimicrobial activity[J]. Journal of Microbiology and Biotechnology , 2009, 19 (11) : 1447–1455. |
| [11] | Wang RQ, Ma DY, Lin LJ, et al. Identification and characterization of an avian β-defensin orthologue,avian β-defensin 9,from quails[J]. Applied Microbiology and Biotechnology , 2010, 87 (4) : 1395–1405. DOI:10.1007/s00253-010-2591-6 |
| [12] | Ma DY, Liu SW, Han ZX, et al. Expression and characterization of recombinant gallinacin-9 and gallinacin-8 in Escherichia coli[J]. Protein Expression and Purification , 2008, 58 (2) : 284–291. DOI:10.1016/j.pep.2007.11.017 |
| [13] | Ishitsuka Y, Pham DS, Waring AJ, et al. Insertion selectivity of antimicrobial peptide protegrin-1 into lipid monolayers: effect of head group electrostatics and tail group packing[J]. Biochimica et Biophysica Acta (BBA)-Biomembranes , 2006, 1758 (9) : 1450–1460. DOI:10.1016/j.bbamem.2006.08.001 |
| [14] | Xin SN, Zhang KX, Zhang MY, et al. Cloning and antimicrobial activity of pigeon avian β-defensin 5[J]. Chinese Journal of Biotechnology , 2012, 28 (11) : 1294–1305. (in chinese) 辛胜男, 张可心, 张名岳, 等. 鸽β-防御素5基因克隆及其抗菌活性[J]. 生物工程学报 , 2012, 28 (11) : 1294–1305. |
| [15] | Li YY, Xu Y, Zhang TT, et al. Cloning and bioactivity determination of pigeon avian beta-defensin 1[J]. Microbiology China , 2014, 41 (4) : 636–645. (in chinese) 李妍妍, 徐杨, 张婷婷, 等. 鸽β-防御素1基因的克隆及其生物学作用鉴定[J]. 微生物学通报 , 2014, 41 (4) : 636–645. |
| [16] | Soman SS, Arathy DS, Sreekumar E. Discovery of Anas platyrhynchos avian β-defensin 2 (Apl_AvBD2) with antibacterial and chemotactic functions[J]. Molecular Immunology , 2009, 46 (10) : 2029–2038. DOI:10.1016/j.molimm.2009.03.003 |
| [17] | Veldhuizen EJA, Rijnders M, Claassen EA, et al. Porcine β-defensin 2 displays broad antimicrobial activity against pathogenic intestinal bacteria[J]. Molecular Immunology , 2008, 45 (2) : 386–394. DOI:10.1016/j.molimm.2007.06.001 |
| [18] | Martin E, Ganz T, Lehrer RI. Defensins and other endogenous peptide antibiotics of vertebrates[J]. Journal of Leukocyte Biology , 1995, 58 (2) : 128–136. |
| [19] | Thouzeau C, Maho YL, Froget G, et al. Spheniscins,Avian β-defensins in preserved stomach contents of the king penguin,Aptenodytes patagonicus[J]. Journal of Biological Chemistry , 2003, 278 (51) : 51053–51058. DOI:10.1074/jbc.M306839200 |
| [20] | Ma DY, Zhang KX, Zhang MY, et al. Identification,expression and activity analyses of five novel duck beta-defensins[J]. PLoS One , 2012, 7 (10) : e47743. DOI:10.1371/journal.pone.0047743 |
| [21] | Ma DY, Zhang MY, Zhang KX, et al. Identification of three novel avian beta-defensins from goose and their significance in the pathogenesis of Salmonella[J]. Molecular Immunology , 2013, 56 (4) : 521–529. DOI:10.1016/j.molimm.2013.05.227 |
| [22] | Zhang MY, Zhou CY, Han ZX, et al. Isolation,identification and bioactivity characterization of goose avian β-defensin 3[J]. Chinese Journal of Biotechnology , 2011, 27 (12) : 1711–1721. (in chinese) 张名岳, 周财源, 韩宗玺, 等. 鹅β-防御素3基因的分离、鉴定及其表达产物的生物学特性[J]. 生物工程学报 , 2011, 27 (12) : 1711–1721. |
 2016, Vol. 43
2016, Vol. 43




