
中国科学院微生物研究所,中国微生物学会
文章信息
- 蒲占湑, 朱莉, 杜丹超, 胡秀荣, 鹿连明, 黄振东. 2023
- PU Zhanxu, ZHU Li, DU Danchao, HU Xiurong, LU Lianming, HUANG Zhendong.
- 基于超高效液相色谱-串联质谱技术的柑橘黑点病菌(Diaporthe citri)发育关联代谢物分析
- Development-associated metabolites of Diaporthe citri: a metabolomics analysis based on UPLC-MS/MS
- 微生物学报, 63(6): 2472-2487
- Acta Microbiologica Sinica, 63(6): 2472-2487
-
文章历史
- 收稿日期:2022-10-03
- 网络出版日期:2023-01-05
柑橘黑点病也称砂皮病,病原为柑橘间座壳菌(Diaporthe citri),受其危害会造成柑橘主干、枝条流胶枯死,枝条、果实和叶片出现黑色或红褐色突起的小点或斑块。黑点病在美国[1]、日本[2],以及我国的台湾[3]、浙江[4]、江西[5]等柑橘产区普遍发生。近年来柑橘果实黑点病的发生日益加重,严重影响果实外观品质,仅江西抚州自2000年以来因黑点病发生蔓延,受害蜜橘面积超过3.0×104 hm2,橘农减少收入超过4 500万元。黑点病的发生流行已成为柑橘高品质发展的重要制约因素。
黑点病的侵染来源是枯枝和腐烂枝条中产生的子囊孢子和分生孢子。枝条受感染后从枯死到产生分生孢子器一般需要1.5–4个月,分生孢子器持续产生分生孢子的时期可以保持至少90 d[6],一般自柑橘抽梢到果实膨大期都会遭受侵染危害[1, 6-7]。因D. citri生活史长、侵染时期长,田间有效防治柑橘黑点病的药剂少[1, 8-9],防治用药次数多[10],导致生产中防治难度大。因此,进一步完善黑点病防控策略是目前柑橘产业中的重大需求。
近年来,代谢组学在植物病原真菌中的研究越来越受到人们的重视和关注,并逐步应用于病原真菌的研究[11-13],主要侧重于病原菌代谢组分析平台的建立[14-15]、病原菌生物学[16-17]、病害的诊断[18]、植物与病原菌互作[19-20]及病原菌代谢产物开发等方面的研究。尤其是病原菌发育过程中代谢物的研究表明,D-葡萄糖、9(Z)-十八碳烯酸、9,12-十八碳二烯酸、α-海藻糖[16]、海藻糖[17]、13S-HPODE[21]和1-辛烯-3-醇[22]等物质具有病原菌发育的生物标记作用。因此,通过代谢组分析病原菌生长发育过程中代谢物的变化,挖掘病原菌发育过程中标记物、关键代谢物有助于揭示病原菌发育机制,为后续干扰性药剂的开发,实现病害有效防控提供了新的突破口。
目前柑橘黑点病菌生长发育过程中代谢物的变化尚未见报道,为了挖掘D. citri在发育过程中的关键代谢物,本研究采用超高效液相色谱-串联质谱(ultra performance liquid chromatography/tandem mass spectrometry, UPLC-MS/MS)代谢组学分析D. citri在离体条件下,菌丝生长期(T1)、分生孢子器形成期(T2)和分生孢子器产孢期(T3) 3个时期代谢物变化,比较不同发育时期代谢物差异,寻找不同发育阶段的生物标记物,探究代谢物与D. citri发育的关系,以期为黑点病的防控提供新思路。
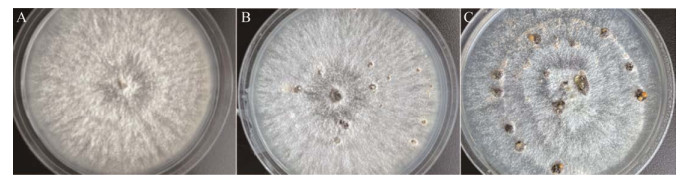
1 材料与方法 1.1 试验菌株试验菌株从位于浙江省台州市黄岩区头陀镇鱼山坪的浙江省柑橘研究所实验果园中采集的枯枝分离获得,经单孢纯化、形态学观察和rDNA ITS区序列分析鉴定为柑橘间座壳菌(Diaporthe citri),编号为LHOH。D. citri接种于PDA平皿上(马铃薯200 g,葡萄糖20 g,琼脂15 g,超纯水1 000 mL),28黑暗静置培养,分别在菌丝生长期(10 d, T1)、分生孢子器形成期(20 d, T2)和分生孢子器产孢期(30 d, T3) (图 1)用无菌接种针小心挑取菌丝、分生孢子器及分生孢子,3个时期各设3个生物学重复。每个时期样品取样后迅速用液氮冷冻后转入–80超低温冰箱储存备用。
|
| 图 1 柑橘间座壳菌的不同发育阶段 Figure 1 The developmental stages of Diaporthe citri. A: Mycelium growth stage (10 d, T1). B: Conidia formation stage (20 d, T2). C: Sporulation stage of conidia (30 d, T3). |
1.2 主要试剂及仪器
葡萄糖、琼脂购自生工生物工程(上海)股份有限公司;甲醇、乙腈购自Merck公司,色谱纯;甲酸购自Aladdin公司,色谱纯。冻干机(Scientz-100F),宁波新芝生物科技股份有限公司产品;研磨仪(MM400 Retsch)购自莱驰;超高效液相色谱(SCIEX ExionLC AD)和串联质谱(Appleid Biosystems 6500 QTRAP)。
1.3 样品提取样品委托武汉迈特维尔代谢生物技术有限公司进行代谢物检测数据分析。样品从–80超低温冰箱取出,置于冻干机(Scientz-100F)冻干,准确称取(20±1) mg于离心管中,用球磨仪(30 Hz, 20 s)研磨,在4条件下,3 000 r/min离心30 s将样品离心至管底,弃上清,加入400 μL 70%甲醇水内标提取液,1 500 r/min振荡5 min,离心管放入液氮冷冻5 min、干冰上解冻5 min、涡旋2 min,重复放入液氮、解冻、涡旋3次,于4条件下,12 000 r/min离心10 min,取上清后放入–20冰箱静置30 min。在4条件下,12 000 r/min离心3 min,取上清200 μL用于UPLC-MS/MS分析。质控样本(quality control, QC)由样品的提取物混合制备而成,仪器分析过程中用于监测分析样本在相同处理方法下的重复性和分析过程的重复性。
1.4 色谱质谱采集条件代谢组分析采用LC-QTRAP-MS/MS系统进行。分析条件如下:
采用亲水性UPLC色谱柱(Waters ACQUITY UPLC HSS T3 C18 1.8 µm, 2.1 mm×100 mm);流动相为超纯水(含0.1%甲酸) (A),乙腈(含0.1%甲酸) (B);优化的色谱柱梯度洗脱,0 min水/乙腈(95:5, 体积比),11.0 min为水/乙腈(10:90, 体积比),保持1 min,12.1 min调整为水/乙腈(95:5, 体积比),并保持110 s。流速0.35 mL/min,柱温40,进样量2 μL。在三重四极杆线性离子阱质谱仪(Q TRAP)上获得的LIT和三重四极杆(QQQ)扫描,QTRAPLC-MS/MS系统中电子喷雾电离(ESI)设置为正(ESI+)和负(ESI–) 2种模式,MS离子喷雾电压为5 500 V (正离子模式),–4 500 V (负离子模式),离子源气体(ion source gas, GSⅠ) 50 psi,气体(GSⅡ) 50 psi,幕气(CUR) 25 psi,源温度为500,碰撞诱导电离(CAD)为高,Analyst 1.6.3软件(Sciex)处理数据。
1.5 数据分析采用MultiaQuant (Sciex)软件进行色谱峰的积分和校正、信号强度提取,Analyst 1.6.3 (Sciex)进行质谱数据的处理,基于武汉迈特维尔代谢生物技术有限公司的自建数据库MWDB (Metware database)和公共数据库MHK数据库进行代谢物的定性分析,三重四级杆质谱的多反应监测模式(multiple reaction monitoring, MRM)进行代谢物定量分析。采用R软件(www.r-project.org/)进行主成分分析(principal component analysis, PCA)和正交偏最小二乘判别分析(orthogonal partial least squares discriminant analysis, OPLS-DA),并对OPLS-DA模型进行验证。利用建立的OPLS-DA模型获得的VIP (variable importancein projection)值,结合单变量分析的P-value值和差异倍数(fold change)值进行差异代谢物的筛选。
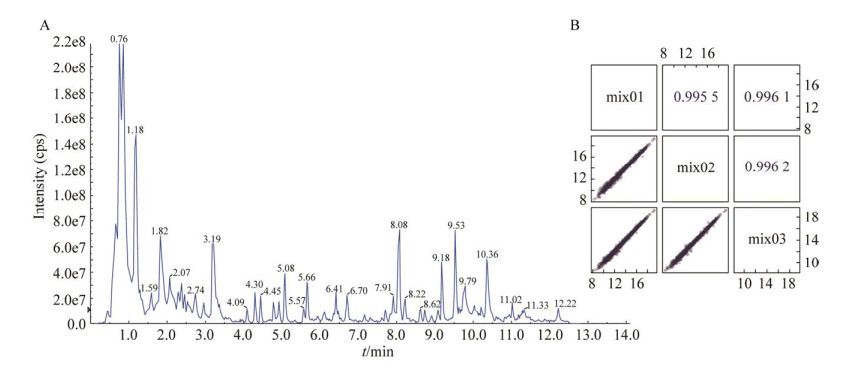
2 结果与分析 2.1 Diaporthe citri样品的质量控制(quality control, QC)分析通过对不同质控QC样本质谱检测分析的总离子流图(total ionscurrent, TIC)分析(图 2A)和QC样本皮尔逊相关性分析(图 2B),D. citri不同发育阶段的代谢物检测总离子流的曲线重叠性好,QC样本皮尔逊相关性高,信号稳定性好,说明检测得到的数据稳定、可靠。
|
| 图 2 样品的质量控制分析 Figure 2 The quality analysis of samples. A: The detection of TIC overlap map (positive ion) by QC sample mass spectrometry. B: The Pearson correlation diagram for QC samples. |
2.2 D. citri发育过程中代谢谱变化及多元统计分析
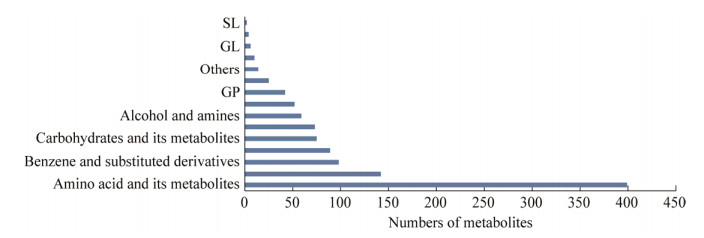
根据培养皿上的形态学特征显示菌丝生长期(10 d, T1)、分生孢子器形成期(20 d, T2)和分生孢子器产孢期(30 d, T3) 3个时间采样,利用UPLC-MS/MS方法,D. citri发育的3个阶段共鉴定出1 090种代谢物(图 3)。其中氨基酸及其代谢物399种,约占总代谢物的36.60%;有机酸及其衍生物142种,约占总代谢物的13.03%;苯及其衍生物98种,约占总代谢物的8.99%;核苷酸及其代谢物89种,约占总代谢物的8.16%;碳水化合物及其代谢物75种,约占总代谢物的6.88%;其余73种脂肪酰类,59种醇、胺类,10种醛、酮、酯类,42种甘油磷脂类,25种辅酶和维生素,6种甘油脂类,4种色胺、胆碱、色素类,2种鞘脂类和14种其他代谢物。
|
| 图 3 代谢物分类和数量 Figure 3 The number and classifications of total metabolites. SL: Sphingolipid; GL: Glycerolipid; GP: Glycerophospholipids. |
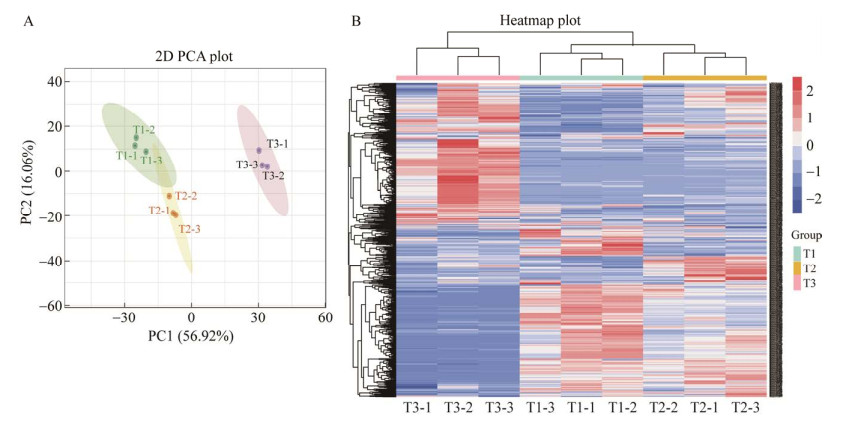
通过对1 090种代谢物进行主成分分析(PCA),结果显示(图 4A),D. citri在菌丝生长期(T1)和分生孢子器形成期(T2)的代谢产物有聚合也有分离,分生孢子器产孢期(T3)代谢产物分别与T1和T2的代谢产物呈现分离趋势,表明D. citri不同发育时期样品间代谢物存在显著差异,样本的总体聚类图也直观地反映了D. citri不同发育阶段样品间代谢物存在显著差异(图 4B)。为了进一步分析差异的代谢物,对不同发育阶段的代谢物进行分组比较,3个比较组为:T1 vs. T2、T2 vs. T3、T1 vs. T3,建立正交偏最小二乘法(OPLS-DA)模型(表 1),获得模型的参数R2、Q2。模型参数R2、Q2数值高,其中Q2均大于0.9,模型能准确描述每个样本数据的真实情况,建立的模型是稳定可靠的。通过PCA分析和建立OPLS-DA模型分析,说明不同发育时期的3个比较组的代谢物存在显著的差异,获得的差异代谢产物具有统计意义。
|
| 图 4 不同发育阶段代谢物的主成分分析(A)和聚类分析(B) Figure 4 The principal component analysis (A) and cluster analysis (B) of metabolites at different developmental stages. A: PCA plot of the samples. B: Heatmap plot of the samples. |
| Group | R2X | R2Y | Q2 |
| T1 vs. T2 | 0.895 | 1 | 0.976 |
| T2 vs. T3 | 0.948 | 1 | 0.999 |
| T1 vs. T3 | 0.957 | 1 | 0.995 |
| R2X and R2Y values represent the explanation rate of the established model to X and Y matrix, respectively; Q2: Predictive ability of the model. | |||
2.3 Diaporthe citri发育过程中的差异代谢物筛选及分析
通过对代谢物进行单变量和多元统计分析,获得OPLS-DA模型的VIP值和单因素分析的差异倍数值(fold change),采取将fold change、OPLS-DA模型的VIP值结合的方法筛选差异代谢物。在筛选条件(VIP≥1,fold change≥2和fold change≤0.5)下,T1 vs. T2比较组共筛选出265种显著差异代谢物,其中71种代谢物在分生孢子形成期呈下调趋势,194种代谢物在分生孢子形成期呈上调趋势(图 5)。T2 vs. T3比较组共筛选出456种显著差异代谢物,其中358种代谢物在分生孢子器产孢过程中呈下调趋势,198种代谢物在分生孢子器产孢过程中呈上调趋势(图 5)。在T1 vs. T3比较组共筛选出580种显著差异代谢物,其中331种代谢物呈下调趋势,249种代谢物呈上调趋势,说明黑点病发育过程中代谢物显著变化。
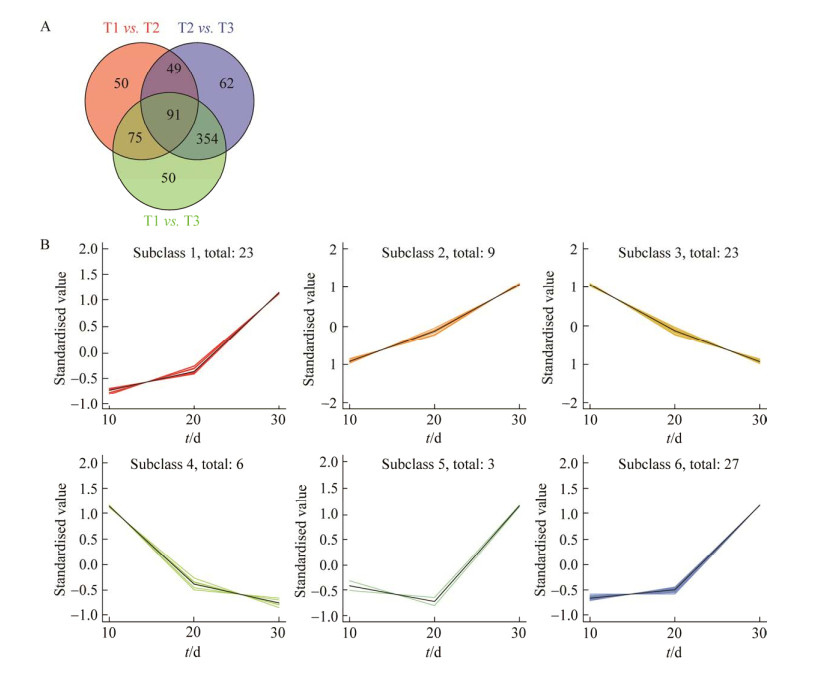
|
| 图 5 差异代谢物韦恩图及K聚类分析 Figure 5 The Venn diagram and K clustering analysis of differential metabolites. A: The Venn diagram of the differential metabolites. B: The K means of differential metabolites during the different developmental stages of Diaporthe citri. |
为了进一步明确各个发育阶段中的关键差异代谢物质,首先绘制T1 vs. T2、T2 vs. T3、T1 vs. T3比较组的韦恩图(图 5A),分析3组中共享的显著差异代谢物。结果显示,3个组中共享91个显著差异代谢物(表 2),其中氨基酸类27个、苯及相关代谢物12个、醇/胺类2个、甘油磷脂类4个、核苷酸类4个、碳水化合物7个、有机酸类21个、脂肪酸14个。其次,对D. citri不同发育阶段共享的91个差异代谢物质进行K聚类分析(图 5B),59个共享代谢物在病原菌生长发育的3个过程持续上调,29个共享代谢物在病原菌生长发育的3个过程持续下调。91个共享显著差异代谢物中,66.67%氨基酸及其代谢物逐渐下降,而L-酵母氨酸、N-乙酰基亮氨酸、N-乙酰基甘氨酸、N-3-苯基丙酰基甘氨酸等不断积累;许多苯及其衍生物类代谢物在菌丝阶段(T1)未检出,随着菌丝的发育代谢物不断合成和积累,2-苯基乙酰胺、AM-1172等在分生孢子器形成期开始大量积累直到产孢;大多数醇、胺类代谢物在菌丝生长发育过程中不断消耗,巨大戟醇自分生孢子器形成期开始大量积累直到产孢。90.47%的有机酸类代谢物在分生孢子器形成期(T2)和分生孢子器产孢过程中大量积累,丙酮酸、4-甲基-2-氧代戊酸、8-甲氧基炔脲酸酯、间甲苯乙酸、5-氨基水杨酸代谢物在菌丝阶段(T1)未检出,在分生孢子器形成期开始大量积累。85.71%的脂肪酸类代谢物在菌丝生长发育过程中不断积累,皮诺敛酸和γ-亚麻酸不断消耗。因此,有机酸、甘油酯类、脂肪酸和氨基酸等代谢物在D. citri形态发育中起着至关重要的作用。
| Index | Molecular formula | Metabolite name | Compound type | log2 FC | Subclass | ||
| T1/T2 | T2/T3 | T1/T3 | |||||
| MEDN0049 | C11H20N2O6 | L-saccharopine | Amino acid | 1.54 | 1.30 | 2.84 | 2 |
| MEDN0056 | C8H15NO3 | N-acetyl-L-leucine | 1.31 | 1.87 | 3.18 | 1 | |
| MEDN0460 | C9H23N3O | N8-acetylspermidine | –1.02 | –2.06 | –3.08 | 3 | |
| MEDN1934 | C10H19N3O4 | Val-Gln | ‒1.15 | ‒2.98 | ‒4.13 | 3 | |
| MEDN1936 | C9H15N3O4 | Asn-Pro | ‒2.97 | ‒1.55 | ‒4.52 | 4 | |
| MEDN1937 | C5H9NO5 | 4-hydroxy-L-glutamic acid | 1.10 | 2.28 | 3.38 | 6 | |
| MEDN2117 | C9H16N2O5 | Hyp-Thr | ‒1.01 | ‒2.34 | ‒3.35 | 3 | |
| MEDP0037 | C13H16N2O5 | Asp-Phe | ‒1.04 | ‒1.51 | ‒2.56 | 3 | |
| MEDP0297 | C5H11NO2 | 5-aminovaleric acid | 1.73 | 2.18 | 3.91 | 1 | |
| MEDP0318 | C10H12N2O3 | L-kynurenine | ‒1.43 | ‒2.26 | ‒3.69 | 3 | |
| MEDP0373 | C4H7NO3 | N-acetylglycine | 3.51 | 1.06 | 4.56 | 2 | |
| MEDP0637 | C14H18N2O3 | Phe-Pro | ‒1.28 | ‒2.43 | ‒3.71 | 3 | |
| MEDP0664 | C10H13NO3 | L-tyrosine methyl ester | ‒1.89 | ‒2.27 | ‒4.16 | 4 | |
| MEDP1177 | C5H11NO2 | N-methyl-α-aminoisobutyric acid | 6.47 | 3.09 | 9.57 | 6 | |
| MEDP1307 | C10H13NO2 | (2S, 3S)-3-methylphenylalanine | ‒2.33 | ‒1.33 | ‒3.66 | 4 | |
| MEDP1653 | C10H16N2O7 | Glu-Glu | 1.32 | 2.16 | 3.49 | 1 | |
| MEDP1680 | C16H31N3O5 | Thr-Leu-Ile | ‒1.19 | ‒2.13 | ‒3.32 | 3 | |
| MEDP1681 | C14H27N3O4 | Leu-Gly-Leu | ‒1.17 | ‒3.46 | ‒4.62 | 3 | |
| MEDP1851 | C13H16N2O6 | Asp-Tyr | ‒1.24 | ‒1.68 | ‒2.92 | 3 | |
| MEDP2031 | C10H13NO3 | Alpha-methyl-m-tyrosine | ‒1.30 | ‒1.81 | ‒3.10 | 3 | |
| MEDP2037 | C11H13NO3 | 2-((3-oxo-3-phenylpropyl) amino) acetic acid | 2.19 | 2.39 | 4.58 | 1 | |
| MEDP2321 | C11H21N5O3 | Pro-Arg | ‒1.03 | ‒2.64 | ‒3.67 | 3 | |
| MEDP2335 | C6H12N2O4 | Gly-Thr | ‒1.05 | ‒4.09 | ‒5.14 | 3 | |
| MEDP2446 | C10H14N2O2 | Cyclo (Pro-Pro) | 2.61 | 1.81 | 4.41 | 1 | |
| MEDP2459 | C12H26N4O3 | Lys-Lys | ‒1.44 | ‒13.30 | ‒14.8 | 3 | |
| MEDP2538 | C9H11NO3 | 3-hydroxy-L-phenylalanine | ‒1.12 | ‒2.07 | ‒3.19 | 3 | |
| MEDP2552 | C8H16N2O5 | Thr-Thr | ‒1.01 | ‒3.58 | ‒4.60 | 3 | |
| MEDN0410 | C7H6O2 | 4-hydroxybenzaldehyde | Benzene and substituted derivatives | 2.24 | 1.08 | 3.32 | 2 |
| MEDN1878 | C14H18O4 | Trolox | 11.72 | 3.30 | 15.02 | 6 | |
| MEDP0101 | C9H8O3 | P-coumaric acid | ‒1.20 | ‒4.66 | ‒5.86 | 3 | |
| MEDP0507 | C9H8O3 | 2-hydroxycinnamic acid | ‒1.27 | ‒4.54 | ‒5.81 | 3 | |
| MEDP0556 | C10H8O3 | Herniarin | ‒2.40 | ‒11.20 | ‒13.6 | 4 | |
| MEDP0654 | C8H9NO | 2-phenylacetamide | 13.79 | 2.74 | 16.53 | 1 | |
| MEDP1807 | C10H12O2 | Thymoquinone | 2.06 | 1.03 | 3.09 | 2 | |
| MEDP2137 | C11H16O | 5-phenyl-1-pentanol | ‒1.27 | 4.29 | 3.02 | 5 | |
| MEDP2184 | C8H10O3 | 2,3-dimethoxyphenol | 2.39 | 1.14 | 3.54 | 2 | |
| MEDP2243 | C27H39NO2 | AM-1172 | 10.93 | 2.08 | 13.01 | 1 | |
| MEDP2615 | C11H12O3 | 3-4-(4-hydroxy-3-methoxyphenyl) but-3-en-2-one | 1.79 | 2.25 | 4.04 | 1 | |
| MEDP2620 | C11H10O2 | 1,4-dihydroxy-2-methylnaphthalene | 1.42 | 2.07 | 3.49 | 1 | |
| MEDN1799 | C20H28O5 | Ingenol | Alcohol and amines | 14.74 | 2.66 | 17.39 | 1 |
| MEDP1002 | C7H15NO2 | Acetylcholine | ‒1.08 | 2.98 | 1.90 | 5 | |
| MEDN1273 | C25H46NO7P | LPE (0:0/20:3) LPE (0:0/20:3) |
GP | 9.48 | 3.61 | 13.09 | 6 |
| MEDN1274 | C25H46NO7P | LPE (20:3/0:0) LPE (20:3/0:0) |
9.48 | 3.61 | 13.09 | 6 | |
| MEDP1686 | C20H42NO7P | LPE (15:0/0:0) LPE (15:0/0:0) |
2.15 | 3.26 | 5.41 | 6 | |
| MEDP1875 | C22H44NO7P | LPE (17:1/0:0) LPE (17:1/0:0) |
1.60 | 2.83 | 4.43 | 6 | |
| MEDN0452 | C9H14N3O7P | 2′-deoxycytidine-5′-monophosphate | Nucleotide | 1.72 | 1.13 | 2.85 | 2 |
| MEDN1675 | C5H11O7P | 2-deoxyribose 5′-phosphate | 1.52 | 2.63 | 4.15 | 6 | |
| MEDP0177 | C5H6N2O2 | Thymine | 1.73 | 1.99 | 3.72 | 1 | |
| MEDP0378 | C14H17N5O8 | N6-succinyl adenosine | 1.48 | 1.93 | 3.42 | 1 | |
| MEDN0211 | C5H12O5 | D-arabitol | Carbohydrates | ‒1.07 | ‒5.29 | ‒6.35 | 3 |
| MEDN0502 | C5H11O7P | 2-deoxyribose 1-phosphate | 1.52 | 2.63 | 4.15 | 6 | |
| MEDN0832 | C6H14NO8P | D-glucosamine 6-phosphate | 1.00 | 3.43 | 4.44 | 6 | |
| MEDN1018 | C5H12O5 | Ribitol | ‒1.07 | ‒5.29 | ‒6.35 | 3 | |
| MEDN1540 | C7H14O8 | Gluceptate | 2.12 | 2.82 | 4.95 | 6 | |
| MEDN2057 | C36H62O31 | Maltohexaose | ‒1.44 | ‒5.12 | ‒6.55 | 3 | |
| MEDP2343 | C30H52O26 | D-maltopentaose | ‒1.19 | ‒2.44 | ‒3.63 | 3 | |
| MEDP2359 | C14H25NO11 | N-acetyl-D-lactosamine | Organic acid | ‒1.32 | ‒1.43 | ‒2.75 | 4 |
| MEDN0201 | C4H6O4 | Succinic acid | 1.40 | 2.37 | 3.77 | 6 | |
| MEDN0204 | C3H4O3 | Pyruvic acid | 11.24 | 1.24 | 12.48 | 2 | |
| MEDN0280 | C2H7NO3S | 2-aminoethanesulfonic acid | 2.23 | 2.10 | 4.33 | 1 | |
| MEDN0284 | C6H12O3 | 2-hydroxyisocaproic acid | 2.02 | 3.49 | 5.52 | 6 | |
| MEDN0335 | C4H6O4 | Methylmalonic acid | 1.40 | 2.37 | 3.77 | 6 | |
| MEDN0432 | C6H12O3 | 5-hydroxyhexanoic acid | 2.02 | 3.49 | 5.52 | 6 | |
| MEDN0593 | C4H6O5 | D-malic acid | 1.75 | 1.97 | 3.72 | 1 | |
| MEDN1155 | C6H10O3 | 4-methyl-2-oxovaleric acid | 12.16 | 4.95 | 17.12 | 6 | |
| MEDN1197 | C11H9NO4 | 8-methoxyalkynurate | 11.87 | 2.76 | 14.63 | 1 | |
| MEDN1328 | C6H12O3 | (S)-leucic acid | 2.02 | 3.49 | 5.52 | 6 | |
| MEDN1499 | C6H12O3 | 2-hydroxyhexanoic acid | 2.02 | 3.49 | 5.52 | 6 | |
| MEDN1590 | C6H8O6 | Tricarballylic acid | 1.99 | 2.29 | 4.29 | 1 | |
| MEDN1721 | C9H10O2 | M-toluene acetic acid | 12.44 | 3.34 | 15.79 | 6 | |
| MEDN1874 | C4H10N2O3 | L-canaline | ‒1.12 | ‒4.08 | ‒5.19 | 3 | |
| MEDN2063 | C6H14O12P2 | 1,6-di-o-phosphono-D-fructose | 1.19 | 3.47 | 4.66 | 6 | |
| MEDP0296 | C5H11N3O2 | 4-guanidinobutyric acid | ‒1.32 | 2.79 | 1.48 | 5 | |
| MEDP0313 | C3H7N3O2 | Guanidineacetic acid | 1.76 | 2.01 | 3.77 | 1 | |
| MEDP0528 | C7H7NO3 | 5-aminosalicylic acid | 12.60 | 9.49 | 22.07 | 6 | |
| MEDP0689 | C8H15NO2 | Tranexamic acid | 1.77 | 2.59 | 4.36 | 6 | |
| MEDP1495 | C9H10O3 | 3-methoxyphenylacetic acid | 1.86 | 1.31 | 3.17 | 2 | |
| MEDN0788 | C20H30O5 | LXA5 | FA | 13.01 | 1.81 | 14.82 | 1 |
| MEDN1428 | C20H30O4 | 20-COOH-AA | 3.06 | 1.90 | 4.96 | 1 | |
| MEDN1840 | C18H30O2 | Pinolenic acid | ‒1.57 | ‒14.20 | ‒15.80 | 3 | |
| MEDP0429 | C18H30O2 | FFA (18:3) | ‒1.81 | ‒2.13 | ‒3.94 | 4 | |
| MEDP0510 | C9H17NO4 | Carnitine C2:0 | 1.89 | 1.04 | 2.93 | 2 | |
| MEDP0530 | C20H28O3 | 15-deoxy-δ-12,14-PGJ2 | 2.58 | 1.83 | 4.41 | 1 | |
| MEDP0577 | C11H21NO4 | Carnitine isoC4:0 | 1.83 | 2.11 | 3.94 | 1 | |
| MEDP0618 | C12H23NO4 | Carnitine-2-methyl-C4 | 1.40 | 2.77 | 4.17 | 6 | |
| MEDP1084 | C19H37NO4 | Carnitine C12:0 | 14.61 | 3.27 | 17.88 | 6 | |
| MEDP1440 | C12H23NO4 | Carnitine C5:0 | 1.40 | 2.77 | 4.17 | 6 | |
| MEDP1442 | C11H21NO4 | Carnitine C4:0 | 1.83 | 2.11 | 3.94 | 1 | |
| MEDP1459 | C20H28O3 | Epoxy-eicosapentaenoic-acid | 11.81 | 2.81 | 14.62 | 6 | |
| MEDP1460 | C20H28O3 | Hydroxyeicosapentaenoic-acid | 13.19 | 1.85 | 15.04 | 1 | |
| MEDP1665 | C10H19NO4 | Carnitine C3:0 | 1.73 | 2.63 | 4.36 | 6 | |
2.4 差异代谢物KEGG分析
利用KEGG数据库对差异代谢物进行注释和通路富集分析,进一步探索D. citri生长发育过程中的代谢物的代谢途径变化与生长发育的关系。比较组T1 vs. T2、T2 vs. T3、T1 vs. T3中差异显著且被KEGG数据库注释到的代谢物分别为132个、203个和214个;被注释的代谢物在不同比较组中分别进行代谢通路的富集分析,取显著富集的前20条通路绘制富集图(图 6)。3个比较组中磷酸戊糖途径(ko00030)、葡萄糖醛酸酯互变途径(ko00040)、生物合成(ko00130)、嘧啶代谢(ko00240)、丙氨酸、天冬氨酸和谷氨酸代谢(ko00250)、苯丙氨酸代谢(ko00360)、花生四烯酸代谢(ko00590)、亚油酸代谢(ko00591)和不饱和脂肪酸生物合成(ko01040)等通路显著富集。
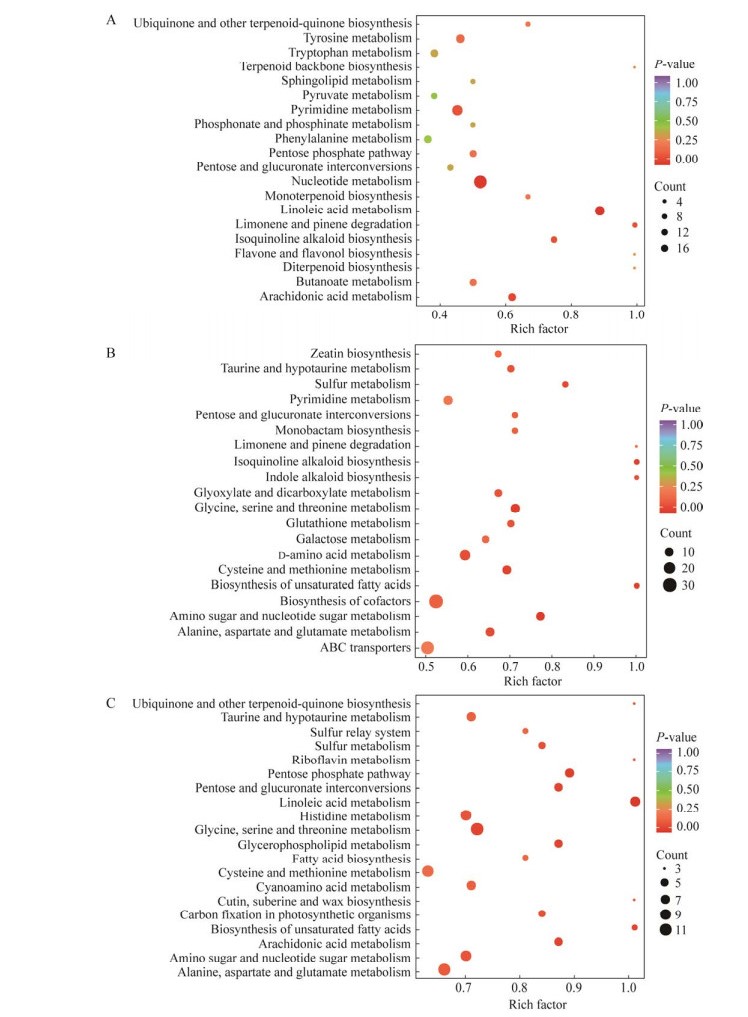
|
| 图 6 差异代谢物KEGG富集图 Figure 6 Top 20 KEGG enrichment map of different metabolites. A–C: T1 vs. T2, T2 vs. T3, and T1 vs. T3 groups. |
D. citri在菌丝生长期(T1)至分生孢子器形成期(T2)和整个生长发育期T1‒T3差异代谢物在亚油酸代谢(ko00591)通路上显著富集(P < 0.01, 表 3)。亚油酸代谢(ko00591)通路被注释到的差异代谢物有8个,其中13-过氧化羟基-9Z, 11E-十八碳二烯酸[(±)13-HpODE]、(9S, 10E, 12Z)-9-羟基十八碳-10,12-二烯酸[9(S)-HODE]、9-氧代-10E, 12Z-十八碳二烯酸(9-oxoODE)、13-氧代-9Z, 11E-十八碳二烯酸(13-oxoODE)、9-过氧化羟基-9Z, 11E-十八碳二烯酸[(±)9-HpODE]、9,12,13-三羟基-十八碳单烯酸[9(S), 12(S), 13(S)-TriHOME]和(±)9,10-二羟基-12Z-十八碳烯酸(9,10-DiHOME)在生长发育过程中显著积累,γ-亚麻酸不断消耗(图 7)。代谢途径图显示,在ko00591(KEGG数据库)通路中γ-亚麻酸转化为dihomo-γ-linolenate→arachidonic,通过花生四烯酸代谢(ko00590)转化为脂氧素B4 (LXB4)、15-酮基-前列腺素F2a (15-keto prostaglandin F2α)、20-羧基-白三烯B4 (20-carboxy LTB4)和15-脱氧-δ12,14-前列腺素J2 (15-deoxy-δ-12,14-PGJ2)。因此,筛选出的参与亚油酸代谢(ko00591)和花生四烯酸代谢(ko00590) (图 8)的差异代谢物可能与D. citri产孢机制密切相关,作为产孢调控的代谢物研究潜力巨大。
| Group | KEGG pathway | Ko-ID | P value | Metabolite |
| TI vs. T2 | Linoleicacid metabolism | ko00591 | 4.39×10–4 | C04717+C14767+C14766+C14765+C14827+C06426+C14833+C14828 |
| Nucleotide metabolism | ko01232 | 8.93×10–3 | C00526+C00299+C00106+C00239+C05512+C00360+C00881+C01762+C00178+C00380+C00262+C00214+C00559+C00294+C00387+C00385 | |
| T1 vs. T3 | Linoleic acid metabolism | ko00591 | 2.62×10–3 | C14833+C14767+C06426+C04717+C14765+C01595+C14766+C14827 |
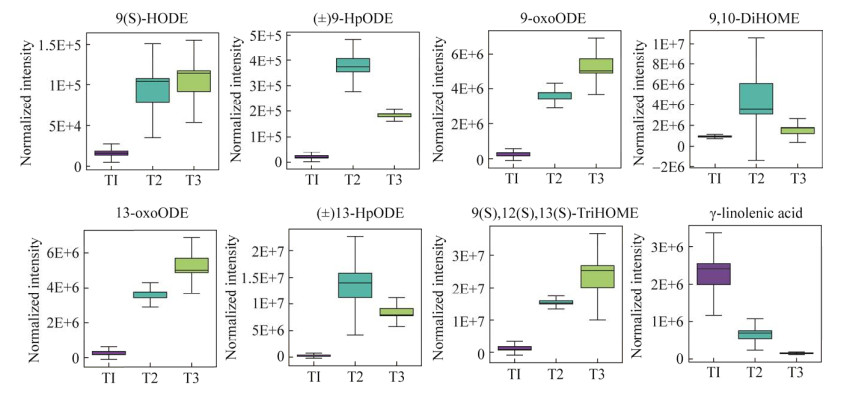
|
| 图 7 ko00591通路富集的代谢物水平变化箱线图 Figure 7 Box plot of changes in metabolite levels enriched by the ko00591 pathway. |
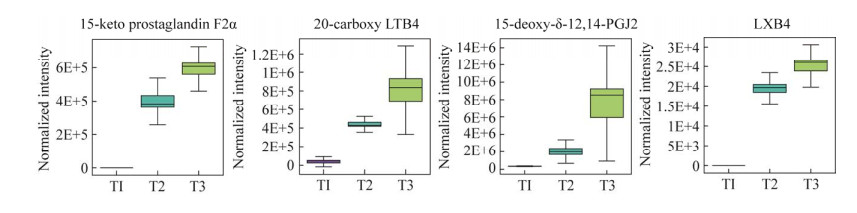
|
| 图 8 ko00590通路富集的差异代谢物水平变化箱线图 Figure 8 Box plot of changes in metabolite levels enriched by the ko00590 pathway. |
3 讨论与结论
通过UPLC-MS/MS分析D. citri共鉴定出1 090种代谢物,T1 vs. T2、T2 vs. T3、T1 vs. T3比较组分别筛选出265、456和580个显著差异代谢物,鉴定出的重要差异代谢物主要包括糖类、脂肪酸、苯及其衍生物、氨基酸和有机酸等(图 3),说明基于UPLC-MS/MS、GC-MS和HPLC-MS等分析技术平台的代谢组学方法可以分析与真菌形态变化相关的复杂代谢物变化[23-26]。
本研究显示D. citri在菌丝生长、分生孢子器形成和分生孢子器产孢的生长发育过程中与代谢物的变化密切相关(图 1,表 1),与冠突散囊菌(Eurotium cristatum)[24]、白色念珠菌(Candida albicans)[25]形态变化与代谢物谱、代谢物网络的变化有关的研究结果相一致。基于OPLS-DA模型、单因素分析和Kmeans聚类分析明确了8类代谢物(氨基酸类、苯及相关代谢物、醇/胺类、甘油磷脂类、核苷酸类、碳水化合物、有机酸类、脂肪酸类)在D. citri生长发育过程中的变化特征(图 5,表 2),其中,大多数氨基酸类代谢物在D. citri发育过程逐渐消耗,包括L-色氨酸-L-酪氨酸、苯丙氨酸-丙氨酸-亮氨酸、L-精氨酸-L-丝氨酸等,氨基酸类代谢物的大量下降可能为形成分生孢子器提供了养分,已有研究表明氨基酸可能是构成所有真菌的主要营养来源[27],虽然D. citri发育过程中氨基酸不断消耗,然而,少数的氨基酸如L-酵母氨酸、N-乙酰基亮氨酸、N-乙酰基甘氨酸、N-3-苯基丙酰基甘氨酸等在产孢阶段积累,其代谢的相关机理有待于进一步研究。早期研究已经确定了冠突散囊菌(E. cristatum)[24]、白色念珠菌(C. albicans)[25]在形态变化和性发育过程中的关联代谢物主要是氨基酸、脂肪酸和有机酸盐等,并且不同物种间代谢物对形态变化和性发育调节作用存在显著的差异。尽管D. citri发育过程中代谢物变化未见报道,我们初步推测筛选出显著差异的有机酸、甘油酯类、脂肪酸和氨基酸等代谢物对D. citri发育过程起重要的调节作用,单个代谢产物的功能[28-29]有待于进一步研究。
由多不饱和脂肪酸(polyunsaturated fatty acids, PUFA)产生的氧脂素(oxylipin)广泛存在于各种生物中,是植物、动物和真菌之间的一种常见的交流物质,氧脂素类代谢物在真菌中的功能涉及调节生长、分化、致病性、有性生殖和无性生殖[30-32]。据报道,1-辛烯-3-醇可调控蘑菇轮枝霉褐斑病(Lecanicillium fungicola)分生孢子的形成和萌发[22],8-HPODE对曲霉(Aspergillus fumigatus)产孢有影响[33],光照条件下18-HODE促进粗糙脉孢菌(Neurospora crassa)分生孢子的形成、18-HOTrE抑制分生孢子的形成[34]。我们发现亚油酸消耗(表 2),注释到亚油酸代谢(ko00591)的13-HpODE、9(S)-HODE、9-oxoODE、13-oxoODE、9-HpODE、9(S), 12(S), 13(S)TriHOME和9,10-DiHOME,并在D. citri分生孢子器形成过程中显著积累,这表明这些代谢物参与了D. citri无性生殖的过程。前人研究表明花生四烯酸(arachidonic acid, AA)生物合成是决定葱枯萎病菌(Stemphylium eturmiunum)性发育的关键因素[35],沉默单酰基甘油脂肪酶(magl)基因能显著减少S. eturmiunum合成AA,5 μmol/L花生四烯酸处理后光照条件下N. crassa无性孢子减少了45%[36],本研究中γ-亚麻酸的消耗是通过ko00591转化为dihomo-γ-linolenate→ arachidonic,arachidonic是通过花生四烯酸代谢(ko00590)途径转化为15-酮基-前列腺素F2a、脂氧素B4、20-羧基-白三烯B4和15-脱氧-δ12,14-前列腺素J2的前体,20-羧基花生四烯酸(20-carboxyl arachidonic acid)在D. citri发育过程中不断积累(表 2),代谢物脂氧素B4和15-酮基-前列腺素F2a在菌丝生长期(T1)未检出,到分生孢子器形成期(T2)开始大量积累,可能是菌丝生长期积累量较少,随着性发育过程中20-羧基花生四烯酸的增加而积累。因此,推测亚油酸及其代谢产物[linolenic acid、13-HpODE、9(S)-HODE、9-oxoODE、13-oxoODE、9-HpODE、9(S), 12(S), 13(S)-TriHOME、9,10-DiHOME、γ-linolenic acid]和20-羧基花生四烯酸及其代谢物(20-COOH-AA、LXB4、15-keto prostaglandin F2α、20-carboxy LTB4、15-deoxy-δ-12,14-PGJ2)可能与D. citri产孢机制有关。研究发现的这些氧化脂类差异代谢物为其产孢机制、调控等的研究提供了重要的依据。
本研究基于UPLC-MS/MS研究了D. citri生长发育、无性生殖过程中代谢物变化,并对差异代谢物进行了KEGG功能注释和通路富集分析,发现菌丝生长至分生孢子器产孢过程中差异代谢物显著富集于花生四烯酸代谢、亚油酸代谢和不饱和脂肪酸生物合成等多条代谢途径,氧化脂类代谢物(亚油酸及代谢物和花生四烯酸及代谢物)是D. citri产孢的关键代谢物。由于真菌代谢物质谱数据库不健全、尚有大量的真菌代谢产物有待鉴定,影响了试验结果的进一步精准分析。
| [1] | TIMMER LW, ZITKO SE, ALBRIGO LG. Split applications of copper fungicides improve control of melanose on grapefruit in Florida. Plant Disease, 1998, 82: 983-986. DOI:10.1094/PDIS.1998.82.9.983 |
| [2] | YUTAKA A, YASUO H, TOMOMASA M. Studies on citrus melanose and citrus stem-end rot by Diaporthecitri Wolf. Japanese Journal of Phytopathology, 1986, 52: 39-46. |
| [3] |
CAI ZG, ZHUANG ZY. Citrus melanose and its control. Horticulture of Chinese, 1985, 31(3): 132-140.
(in Chinese) 蔡竹固, 庄再扬. 柑橘黑点病及其防治. 中国园艺, 1985, 31(3): 132-140. |
| [4] |
JIANG LY, XU FS, HUANG ZD, HUANG F, CHEN GQ, LI HY. Occurrence and control of citrus melanose caused by Diaporthe citri. Acta Agriculturae Zhejiangensis, 2012(4): 647-653.
(in Chinese) 姜丽英, 徐法三, 黄振东, 黄峰, 陈国庆, 李红叶. 柑橘黑点病的发病规律和防治. 浙江农业学报, 2012(4): 647-653. |
| [5] |
ZENG BL, ZENG ZF, ZHU XY, PENG MQ, LI YJ, WU DZ, CAI BL. Occurrence regularity and comprehensive control measures of Nanfeng orange fruit black spot disease. Zhejiang Ganju, 2010(2): 24-26.
(in Chinese) 曾炳隆, 曾知富, 朱晓云, 彭明强, 李跃进, 吴德志, 蔡柏龄. 南丰蜜橘果实黑点病发生规律与综合防治措施. 浙江柑橘, 2010(2): 24-26. |
| [6] | MONDAL SN, AGOSTINI JP, ZHANG L, TIMMER LW. Factors affecting pycnidium production of Diaporthe citri on detached Citrus twigs. Plant Disease, 2004, 88(4): 379-382. DOI:10.1094/PDIS.2004.88.4.379 |
| [7] |
CAI ZG, ZUANG ZY. Disease incidence of citrus melanose in Taiwan, China. Horticulture of Chinese, 1989, 35(4): 239-246.
(in Chinese) 蔡竹固, 庄再扬. 柑橘黑点病之田间发病消长. 中国园艺, 1989, 35(4): 239-246. |
| [8] |
HUANG ZD, PU ZX, HU XR, ZHANG XY, CHEN GQ, LI HY. Control effect of different chemical combinations on citrus black spot disease. Zhejiang Ganju, 2011, 28(2): 23-24.
(in Chinese) 黄振东, 蒲占湑, 胡秀荣, 张小亚, 陈国庆, 李红叶. 不同药剂组合对柑橘黑点病的防治效果. 浙江柑橘, 2011, 28(2): 23-24. DOI:10.3969/j.issn.1009-0584.2011.02.009 |
| [9] |
LIU X, WANG MS, MEI XF, JIANG LY, HAN GX, LI HY. Sensitivity evaluation of Diaporthe citri populations to mancozeb and screening of alternative fungicides for citrus melanose control. Journal of Plant Protection, 2018, 45(2): 373-381.
(in Chinese) 刘欣, 王明爽, 梅秀凤, 姜丽英, 韩国兴, 李红叶. 柑橘黑点病菌种群对代森锰锌的敏感性评价及其替代药剂的筛选. 植物保护学报, 2018, 45(2): 373-381. |
| [10] |
HUANG XB, LIANG KH, HUANG ZD. Study on the suitable time and medication method of controlling citrus black spot disease. Zhejiang Ganju, 2010, 27(2): 26-29.
(in Chinese) 黄茜斌, 梁克宏, 黄振东. 柑橘果实黑点病防治适期及用药方法研究. 浙江柑橘, 2010, 27(2): 26-29. DOI:10.3969/j.issn.1009-0584.2010.02.010 |
| [11] |
ZHANG FZ, LIU XH, ZHANG CL, LIN FC. Progresses of metabolomics in plants response to plant pathogenic fungi. Chinese Journal of Cell Biology, 2016, 38(4): 434-440.
(in Chinese) 张凡忠, 刘小红, 章初龙, 林福呈. 植物响应病原真菌的代谢组学研究进展. 中国细胞生物学学报, 2016, 38(4): 434-440. |
| [12] |
LIU PF, HU ZH, DAI T, LIANG L, LIU XL. Metabolomics-a robust bioanalytical approach for phytopathology. Acta Phytopathologica Sinica, 2018, 48(4): 433-444.
(in Chinese) 刘鹏飞, 胡志宏, 代探, 梁莉, 刘西莉. 代谢组学-植物病理学研究有力的生物分析工具. 植物病理学报, 2018, 48(4): 433-444. |
| [13] |
LIU HY, CHEN LL, GAO JT. Metabolomics and its use in fungal metabolic analyses: a review. Mycosystema, 2019, 38(12): 2078-2086.
(in Chinese) 刘宏有, 陈柳龙, 高江涛. 代谢组及其在真菌研究中的应用. 菌物学报, 2019, 38(12): 2078-2086. |
| [14] |
XU TR, LIU XY, XU GW. Advances of analytical methods for liquid chromatography-mass spectrometry-based metabolomics. Journal of Instrumental Analysis, 2020, 39(1): 10-18.
(in Chinese) 徐天润, 刘心昱, 许国旺. 基于液相色谱-质谱联用技术的代谢组学分析方法研究进展. 分析测试学报, 2020, 39(1): 10-18. |
| [15] |
ZHAO XY, ZHANG QQ, YANG ZY, LIU MY, ZHAO JL, ZHANG JY, CAO ZY, LIU N, DONG JG. Optimization of metabolomics analysis method of Setosphaeria turcica based on LC-MS. Journal of Maize Sciences, 2021, 29(5): 166-171.
(in Chinese) 赵逍遥, 张倩倩, 杨子怡, 刘美玉, 赵佳丽, 张金玥, 曹志艳, 刘宁, 董金皋. 基于液质联用的玉米大斑病菌代谢组的方法优化. 玉米科学, 2021, 29(5): 166-171. |
| [16] | ALIFERIS KA, JABAJI S. 1H NMR and GC-MS metabolic fingerprinting of developmental stages of Rhizoctonia solani sclerotia. Metabolomics, 2010, 6: 96-108. |
| [17] | LOWE R, LORD M, RYBAK K, TRENGOVE RD, OLIVER RP, SOLOMON PS. Trehalose biosynthesis is involved in sporulation of Stagonos poranodorum. Fungal Genetics and Biology, 2009, 46(5): 381-389. |
| [18] | CEVALLOS-CEVALLOS JM, GARCÍA-TORRES R, ETXEBERRIA E, REYES-de-CORCUERA JI. GC-MS analysis of headspace and liquid extracts for metabolomic differentiation of citrus Huanglongbing and zinc deficiency in leaves of 'Valencia' sweet orange from commercial groves. Phytochemical Analysis, 2011, 22(3): 236-246. |
| [19] | AGUDELO-ROMERO P, ERBAN A, REGO C, CARBONELL-BEJERANO P, NASCIMENTO T, SOUSA L, MARTÍNEZ-ZAPATER JM, KOPKA J, FORTES AM. Transcriptome and metabolome reprogramming in Vitis vinifera cv. Trincadeira berries upon infection with Botrytis cinerea. Journal of Experimental Botany, 2015, 66(7): 1769-1785. |
| [20] | CHEN F, MA R, CHEN XL. Advances of metabolomics in fungal pathogen-plant interactions. Metabolites, 2019, 9: 169. |
| [21] | AFFELDT KJ, BRODHAGEN M, KELLER NP. Aspergillus oxylipin signaling and quorum sensing pathways depend on G protein-coupled receptors. Toxins (Basel), 2012, 4: 695-717. |
| [22] | BERENDSEN RL, KALKHOVE SI, LUGONES LG, BAARS JJ, WÖSTEN HA, BAKKER PA. Effects of the mushroom-volatile 1-octen-3-ol on dry bubble disease. Applied Microbiology and Biotechnology, 2013, 97: 5535-5543. |
| [23] | LIU HX, ZHAO XS, GUO MX, LIU H, ZHENG ZM. Growth and metabolism of Beauveria bassiana spores and mycelia. BioMed Central Microbiology, 2015, 15: 267. |
| [24] | REN CG, TAN YM, REN XX, LIU YX, LIU ZY. Metabolomics reveals changes in metabolite concentrations and correlations during sexual development of Eurotium cristatum (synonym: Aspergillus cristatus). Mycosphere, 2017, 8(10): 1626-1639. |
| [25] | HAN TL, CANNON RD, VILLAS-BOAS SG. Metabolome analysis during the morphological transition of Candida albicans. Metabolomics, 2012, 8: 1204-1217. |
| [26] | FEOFILOVA EP, IVASHECHKIN AA, ALEKHIN AI, SERGEEVA YE. Fungal spores: dormancy, germination, chemical composition, and role in biotechnology (review). Applied Biochemistry and Microbiology, 2012, 48(1): 5-17. |
| [27] | GOURNAS C, PRÉVOST M, KRAMMER EM, ANDRÉ B. Function and regulation of fungal amino acid transporters: insights from predicted structure[M]// RAMOS J, SYCHROVA H, KSCHISCHO M. Chapter 4. Advances in Experimental Medicine and Biology, Yeast Membrane Transport (volume 892). Switzerland: Springer International Publishing, 2016: 69-106. |
| [28] |
GENG QR, YANG FY, WANG YH, CHE YW, YANG KL. Research advance in functional and synthetic regulation of secondary metabolites of filamentous fungi. Mycosystema, 2020, 39(3): 539-547.
(in Chinese) 耿青如, 杨飞洋, 王雨荷, 车雨微, 杨坤龙. 丝状真菌次级代谢产物的功能与合成调控研究进展. 菌物学报, 2020, 39(3): 539-547. |
| [29] |
FENG YY, XU XR, ZOU X. Calcineurin signaling cascade regulates fungal growth, metabolism, virulence and stress resistance. Acta Microbiologica Sinica, 2021, 61(12): 3844-3855.
(in Chinese) 冯莹莹, 徐兴然, 邹祥. 钙调磷酸酶信号调控真菌生长代谢、毒力及抗逆性能. 微生物学报, 2021, 61(12): 3844-3855. |
| [30] | BECCACCIOLI M, PUCCI N, SALUSTRI M, SCORTICHINI M, ZACCARIA M, MOMENI B, LORETI S, REVERBERI M, SCALA V. Fungal and bacterial oxylipins are signals for intra- and inter-cellular communication within plant disease. Frontiers in Plant Science, 2022, 13: 823233. |
| [31] | GESSLER NN, FILIPPOVICH SY, BACHURINA GP, BACHURINA EA, KHARCHENKO NV, GROZA TA, BELOZERSKAYA. Oxylipins and oxylipin synthesis pathways in fungi. Applied Biochemistry and Microbiology, 2017, 53(6): 628-639. |
| [32] | FISCHER GJ, KELLER NP. Production of cross-kingdom oxylipins by pathogenic fungi: an update on their role in development and pathogenicity. Journal of Microbiology, 2016, 54(3): 254-264. |
| [33] | JERNERÉN F, OLIW EH. The fatty acid 8,11-diol synthase of Aspergillus fumigatus is inhibited by imidazole derivatives and unrelated to PpoB. Lipids, 2012, 47: 707-717. |
| [34] | FILIPPOVICH SY, BACHURINA GP, GESSLER NN, GOLOVANOV AB, MAKAROVA AM, GROZA NV, BELOZERSKAYA TA. Influence of oxygenated derivatives of linoleic and linolenic acids on the formation of conidia and protoperithecia in wild-type and photoreceptor complex mutants of Neurospora crassa. Applied Biochemistry and Microbiology, 2015, 51(6): 655-659. DOI:10.1134/S0003683815060058 |
| [35] | ZHAO YX, WANG Q, WANG S, LIU X, YU JH, ZHENG W, ZHANG X. Disturbance in biosynthesis of arachidonic acid impairs the sexual development of the onion blight pathogen Stemphylium eturmiunum. Current Genetics, 2019, 65: 759-771. |
| [36] | FILIPPOVICH SY, GESSLER NN, BACHURINA GP, KHARCHENKO EA, IVANOV IV, SIROTENKO TI, GOLOVANOV AB, BELOZERSKAYA TA, GROZA NV. Effect of 20-hydroxy-(5Z, 8Z, 11Z, 14Z)-eicosatetraenoicand arachidonic acids on differentiation of Neurospora crassa. Applied Biochemistry and Microbiology, 2018, 54(3): 309-315. |
 2023, Vol. 63
2023, Vol. 63




